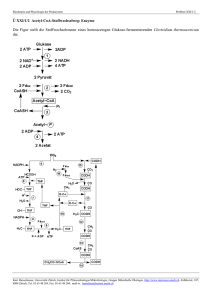
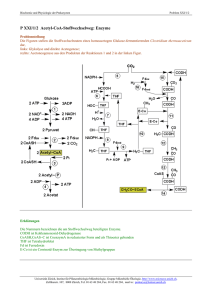
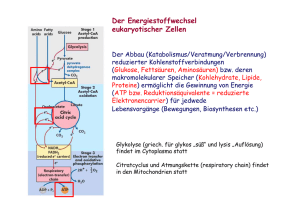
Protein-Acetylierung
Werbung

DEUTSCHES KREBSFORSCHUNGSZENTRUM Stiftung des öffentlichen Rechts in der Helmholtz-Gemeinschaft Protein-Acetylierung Martina Schnölzer Zentrale Proteinanalytik [email protected] Protein-Acetylierung Protein-Acetylierung • Acetylierung von Histonen vor mehr als 30 Jahren erstmals beschrieben • Acetylierung wird zunehmend für andere Faktoren beschrieben: Chromatin-assoziierte Proteine, Transkriptionsfaktoren, transkriptionelle Aktivatoren und Coaktivatoren, Importin, Tubulin etc. • Mehr als 20 Proteine mit Acetytransferase-Aktivität sind bis heute bekannt. Gegliedert in 6 Acetyltransferase-Familien Vertreter: pCAF, p300, TIF etc. Protein-Acetylierung Acetyltransferasen (Acetylasen) übertragen Acetylgruppen von Acetyl-Coenzym A (AcCoA) auf die α-Aminogruppe der N-terminalen Aminosäure eines Proteins: N-Acetyltransferasen (NATs), irreversibel ε-Aminogruppe von Lysinen : Histon-Acetyltransferasen (HATs) oder Faktor-Acetyltransferasen (FATs), reversibel, Abspaltung der Acetylgruppe wird durch Deacetylasen katalysiert Acetylierung von Lysinresten – NH – CH – CO – – NH – CH – CO – CH2 CH2 CH2 Acetyl Coenzym A (AcCoA) CH2 CH2 NH2 CH2 CH2 Acetyltransferase CH2 NH C=O CH3 MALDI-MS eines acetylierten Histon-Peptids + 1 Acetyl 1369 ∆ 42 Da [M+H]+ 1327 1330 1340 1350 1360 1370 m/z Acetyl-Lysin: keine metastabile Fragmentierung Metastabile Fragmentierung Metastabile Fragmentierung Phosphorylierte Peptide (S und T): Abspaltung von Phosphorsäure Met(O)-haltige Peptide: Abspaltung von Methansulfensäure ESI-MS eines acetylierten Histon-Peptids + 1 Acetyl 1369 [M+H]+ 1327 ∆ 42 Da m 1 3 0 0 1 4 0 0 ESI-MS eines acetylierten Histon-Peptids [M+3H+Acetyl]3+ 457.25 ∆ 14 Da [M+3H]3+ 443.25 [M+2H+Acetyl]2+ 685.37 ∆ 21 Da [M+2H]2+ 664.37 Instrumentierung ESI-MS: QTof-Ultima (Micromass) MALDI-MS: Reflex II (Bruker) Acetylierung: Analyse-Strategien Protein in vivo acetyliert Rekombinantes oder synthetisches Protein Synthetisches Peptid in vitro Acetylierung Proteolytischer Verdau Acetyliertes Peptid / acetylierte Peptide Acetylierung: Analyse-Strategien Protein in vivo acetyliert Rekombinantes oder synthetisches Protein Synthetisches Peptid in vitro Acetylierung Proteolytischer Verdau Acetyliertes Peptid / acetylierte Peptide Acetylierung: Analyse-Strategien Acetyliertes Peptid / acetylierte Peptide MALDI-PSD ESI-MS/MS Proteolytischer Verdau und MS-Analyse EdmanSequenzierung PeptidMutationsanalyse Identifizierung der Acetylierungsstellen HIV-1 Tat: Transaktivator der Transcription • kleines hochkonserviertes Protein, von 2 Exons im HIV-Genom kodiert • essentiell für die transkriptionelle Elongation 1 72 Exon 1 Exon 2 101 1 11 21 31 41 51 61 71 81 91 101 MEPVDPRLEP WKHPGSQPKT ACTNCYCKKC CFHCQVCFIT KALGISYGRK KRRQRRRPPQ GSQTHQVSLS KQPTSQSRGD PTGPKESKKK VERETETDPF D I 1-21 Sauer 1 II 22-31 Cys-reich (CRR) III IV V 38-48 49-59 60-72 Core Arg-reich Gln-reich (ARM) Transaktivierende Region 48 VI 73-101 C-terminal RNA bindende Region 101 HIV-1 Tat wird enzymatisch acetyliert Einbau von [1-14C]-markiertem AcCoA, Autoradiografie Tat AcCoA Enzym Tat + + + + - + - + + + + + + - + - + + m m y y z z n n E F eE 0 e A n 30 n C h p oh P o Tat-Acetylierung Tat (1-101) besitzt 10 Lysinreste K12 K28 K29 I II 1-21 22-31 Sauer Cys-reich (CRR) K41 K50 K51 III IV V 38-48 49-59 60-72 Core Arg-reich Gln-reich (ARM) K85 K88 K89 K90 VI 73-101 C-terminal Tat-Acetylierung Sechs Peptide überspannen die Tat-Sequenz K12 K28 K29 1-21 22-35 K41 K50 K51 K85 K88 K89 K90 59-81 35-48 45-58 82-101 Die Peptide wurden chemisch synthetisiert und in vitro mit AcCoA und Acetyltransferase acetyliert Tat-Acetylierung K12 K28 K29 22-35 K41 K50 K51 K85 K88 K89 K90 45-58 45-53 d p ti d i t ep Pe P H4 H3 + PCAF + AcCoA Acetylierung des ARM-Peptids 45-53 KKRR53 45ISYGR 1164 + 1 Acetyl 1206 1248 ∆ 42 Da + AcCoA + p300 +Na +Na + AcCoA - p300 1170 1190 1210 1230 1250 m/z Acetylierung: Analyse-Strategien Acetyliertes Peptid / acetylierte Peptide x MALDI-PSD ESI-MS/MS Proteolytischer Verdau und MS-Analyse EdmanSequenzierung PeptidMutationsanalyse Identifizierung der Acetylierungsstellen Lys-C Verdau in silico m/z 893 m/z 1024 m/z 723 m/z 1194 Lys-C Verdau von 45ISYGRacKKRRQRRRP58 Kontrollpeptid: chemisch acetyliert 45ISYGRacKK51 893 800 900 52RRQRRRP58 1024 1000 1100 m/z Lys-C Verdau von in vitro acetyliertem ARM Peptid 45ISYGRKK51 851 52RRQRRRP58 45ISYGRK50 45ISYGRKK51 723 + 1 Acetyl 893 1194 1024 + AcCoA + p300 51KRRQRRRP58 1152 + AcCoA - p300 chemisch acetyliert 800 900 1000 1100 m/z Lys-C Verdau von synthetischem Tat (1-72) 1MEPVDPRLEP WKHPGSQPKT … CFHCQVCFIT KALGISYGRK KRRQRRRPP … KQ72 42ALGISYGRK50 965 42ALGISYGRKK51 1093 42ALGISYGRKK51 + 1 Acetyl 1135 1 oxMEPVDPRLEPWK12 1513 1MEPVDPRLEPWK12 1497 + AcCoA + Enzym + AcCoA - Enzym Acetylierung: Analyse-Strategien Acetyliertes Peptid / acetylierte Peptide x MALDI-PSD ESI-MS/MS Proteolytischer Verdau und MS-Analyse EdmanSequenzierung PeptidMutationsanalyse Identifizierung der Acetylierungsstellen Edman-Sequenzierung des acetylierten ARM-Peptids 45ISYGRKKRR53 45ISYGRKKRR53 + AcCoA, - Enzym + AcCoA, + Enzym R R K acK K R K R Edman-Sequenzierung des acetylierten ARM-Peptids 45ISYGRKKRR53 45ISYGRKKRR53 + AcCoA, - Enzym + AcCoA, + Enzym R R K acK K R K R Tat-Acetylierung K12 K28 K29 22-35 K41 K50 K51 K85 K88 K89 K90 45-58 d p ti d i t ep Pe P H4 H3 + PCAF + AcCoA Acetylierung des CRR-Peptids 22-35 22CTNCYCKKCCFHCQ35 + 1 Acetyl + 2 Acetyl 1725 1767 1683 + AcCoA + pCAF + 3 Acetyl 1809 + AcCoA + p300 + AcCoA - Enzym 1710 1760 1810 1860 m/z Acetylierung: Analyse-Strategien Acetyliertes Peptid / acetylierte Peptide x MALDI-PSD ESI-MS/MS x Proteolytischer Verdau und MS-Analyse x EdmanSequenzierung PeptidMutationsanalyse Identifizierung der Acetylierungsstellen 22CTNCYCKKCCFHCQ35 1569 22CTNCYCAACCFHCQ35 + 2 Acetyl + 1 Acetyl 1653 1611 +Na +Na + 3 Acetyl 1695 + AcCoA + pCAF + AcCoA - pCAF 1600 1650 1700 1750 m/z Acetylierung des geschützten CRR-Peptids 22 acmCTNacmCYacmCKKacmCacmCFHacmCQ35 2109 + AcCoA + pCAF +Na +AcCoA +p300 +AcCoA -Enzym 2140 2190 2240 2290 m/z Cystein wird nichtenzymatisch acetyliert 2523 + 1 Acetyl 2565 2607 LHKSMGRTWQFDYNPEACVIK + AcCoA 2420 + 1 Acetyl 2662 XVIK LHKSMGRTWQFDYNPEAC + AcCoA Cystein wird nichtenzymatisch acetyliert 2523 + 1 Acetyl 2565 2607 LHKSMGRTWQFDYNPEACVIK + AcCoA 2420 + 1 Acetyl 2662 XVIK LHKSMGRTWQFDYNPEAC + AcCoA 2450 2500 2550 m/z Cystein-Acetylierung Tat Core Peptid: 35QVCFITKALGISYG48 1499 + 1 Acetyl 1541 1583 + AcCoA + pCAF +Na +Na + AcCoA - PCAF 1500 1520 1540 1560 1580 m/z Instrumentierung NanoMate: Autosampler und Ionenquelle Dank an Jörg Niebel (Fa Advion) und J. Peter-Katalinic (Münster) Instrumentierung ESI Chip: Array mit 100 identischen Nanoelectrospray-Nozzles Cystein-Acetylierung: ESI-MS/MS Tat Core Peptid: 36V C F I T K A L G I S Y G R K50 y5 y6 y7 I G y8 L y9 A y10 K y11 T y12 I y13 F y14 C - AcCoA I 800 G L A 1000 K T 1200 I 1400 F acC mass y14 + AcCoA Cystein-Acetylierung: ESI-MS/MS Tat Core Peptid: 36V C F I T K A L G I S Y G R K50 y5 y6 y7 I G y8 L y9 A y10 K y11 T y12 I y13 F y14 C - AcCoA I G L A K T I F acC y14 + AcCoA 800 1000 1200 1400 mass N - versus S - Acetylierung O Acetyl-Lysin H3C – C – NH – (CH2)4 – CH – NH ~ O ~ C O Acetyl-CoA H3C – C – S – CH2 – CH2 – NH ~ O H3C – C – S – CH2 – CH – NH ~ C ~ Acetyl-Cystein O Cystein-Acetylierung ... histone acetylation proceeds through an acetyl-cysteine enzyme intermediate ... Zusammenfassung Lysinreste können sequenzabhängig in Gegenwart von AcetylCoA und Acetyltransferasen enzymatisch acetyliert werden Cysteinreste werden nichtenzymatisch unabbängig von der umgebenden Sequenz acetyliert Dank an die Gruppe ... besonders an Wilma Wilma Dormeyer Die biochemische Analyse der Protein-Acetylierung am Beispiel des HIV-1 Tat Proteins Dissertation Heidelberg/Bochum 2004