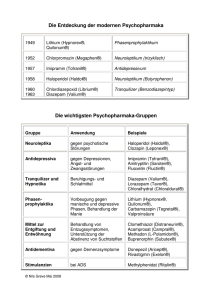
vo-schabschneider_psychopharmakologie_wien_ws
Werbung
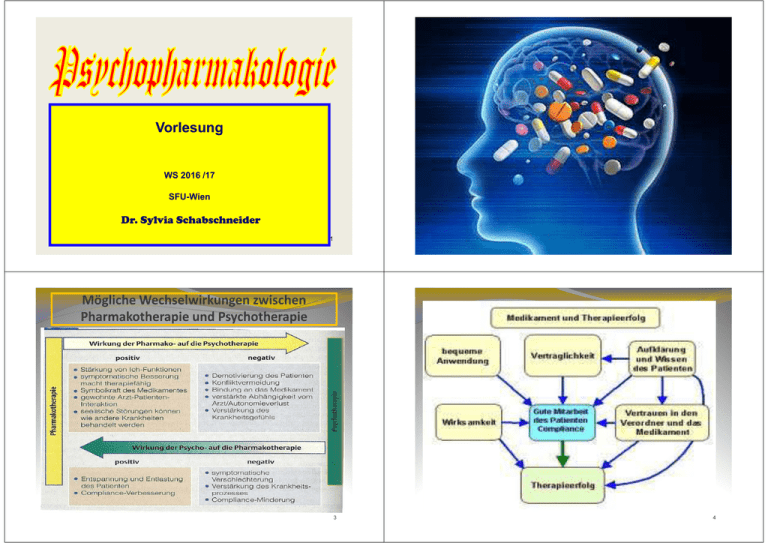
Vorlesung WS 2016 /17 SFU-Wien Dr. Sylvia Schabschneider 1 Mögliche Wechselwirkungen zwischen Pharmakotherapie und Psychotherapie 3 4 Psychopharmaka werden nur dann verordnet, wenn eine gezielte Indikation besteht (Erkrankung). Zuerst sorgfältige Untersuchung und Diagnosesteilung (zugrunde liegende Ursachen). Medikamentöse Vorbehandlungen eruieren, Suchtanamnese abklären. Adäquate Wahl des Psychopharmakons nach Wirkprofil unter Berücksichtigung möglicher Interaktionen und Nebenwirkungen sowie Kontraindikationen. 6 • Dosierung in der Regel einschleichend und individuell. Keine Verschreibung größerer Mengen während der Akuterkrankung. Dosisanpassung bei älteren Patienten. • Bei Tranquilizern und Hypnotika Dosierung möglichst niedrig, aber ausreichend; frühestmögliche, langsame Dosisreduktion mit Übergang auf diskontinuierliche Gabe (Bedarfsmedikation). • Exakte Aufklärung und Information des Patienten über Wirkungen und mögliche Nebenwirkungen sowie Wechselwirkungen mit anderen Medikamenten, insbesondere mit Alkohol (möglichst meiden). 7 • Längerfristige Kombination mehrerer Psychopharmaka möglichst vermeiden. • Persönliche Verordnung mit Verlaufskontrollen (Dosisanpassung). Aufbau einer tragfähigen Arzt-Patient-Beziehung (Compliance). • Gesamtbehandlungsplan erstellen, der auch andere Therapieformen umfasst (ärztliches Gespräch, Psychotherapie, physikalische Maßnahmen) 8 Begriffserklärungen Psychopharmakologie Begriffseinführung Anfang des 20. Jh. durch den amerikanischen Pharmakologen Macht. Als Begründer der Psychopharmakologie gilt Kraepelin. Die damit einhergehenden Forschungsarbeiten bereiteten den Weg von der Droge zum Arzneimittel mit wissenschaftlich begründetem Wirkungsspektrum. • Bei Langzeitmedikation Kooperation mit Facharzt (Indikationsstellung, Dosierung, Behandlungsdauer). Gesonderte Aufklärung über mögliche Nebenwirkungen bei Langzeitmedikation (z. B. Spätdyskinesien durch Neuroleptika). Psychopharmaka …sind alle Medikamente, die zur Behandlung von psychischen Erkrankungen verwendet werden. Für die meisten psychiatrischen Krankheiten wurden die ersten modernen, bahnbrechenden Pharmaka in einem Zeitraum von weniger als 10 Jahren zwischen 1949 und 1957 entdeckt: Lithium (1949), wirksam als Antimanikum (Cade) Chlorpromazin (1952), wirksam als Antipsychotikum (Delay / Deniker) Meprobamat (1954), wirksam als Anxiolytikum (Berger) Imipramin (1957), wirksam als Antidepressivum (Kuhn) „Behandlungspass" für Lithium und Depotneuroleptika führen. Beendigung der Behandlung grundsätzlich durch langsam ausschleichende Dosisreduktion. Psychotrope Substanzen …sind alle Substanzen (Drogen), die eine Wirkung auf die Psyche entfalten – z.B. Alkohol, LSD etc. Alkohol 9 Hinweis zur Namensgebung von Medikamenten • Generische Namen, syn. Freiname (generic name - dt. allgemeingültige Bezeichnung) oder INN (International Nonproprietary Name) sind auf der ganzen Welt gleich. Internationaler Freiname • WHO Wirkstoff Datenbank • Wurde im Jahr 1953 gestartet • Derzeit etwa 7.000 Stoffe Als Internationaler Freiname (INN, Abkürzung vom engl. International Nonproprietary Name), Generischer Name (engl. Generic Name) oder DCI (von lat. denominatio communis internationalis) wird der von der WHO vergebene, gemeinfreie Name für einen Arzneimittelwirkstoff bezeichnet. Ältestes Psychopharmakon – seit circa 2000 Jahren bekannt, dosisabhängige Wirkung 10 Unter Freinamen versteht man die rechtlich nicht geschützten Namen von Arzneimittelwirkstoffen (chemische Bezeichnung). Warenname, der nicht für einen einzelnen Hersteller oder Verteiler geschützt ist. Sie dienen als chemische Kurzbezeichnung zur einfachen Benennung der meist kompliziert zusammengesetzten Verbindungen. Freinamen sind besonders für Arznei- und Schädlingsbekämpfungsmittel eingeführt. Die Freinamen oder generischen Namen erleichtern den länderübergreifenden Informationsfluss zwischen Ärzten und Apothekern. Nach Ablauf des Patentschutzes können andere Hersteller Nachahmerpräparate, so genannte Generika, unter diesem Namen, meist mit dem Zusatz des Herstellernamens, vertreiben. 11 12 ATC-Klassifikationssystem Internationaler Freiname Bei der Wahl des Namens hat der Entdecker der Substanz ein Vorschlagsrecht. Diesem Vorschlag wird in der Regel gefolgt. Dabei wird jedoch darauf geachtet, dass der Name nicht, auch nicht in Teilen, markenrechtlich geschützt ist, oder das Markenrecht anderer berührt wird. Weiter werden verschiedene Präfixe und Suffixe verwendet, um die Zugehörigkeit zu einer bestimmten Gruppe zu zeigen, entweder aus chemisch-struktureller Sicht oder auf Grund der Wirkungsweise. ATC: Akronym • Anatomy • Therapy • Chemie Das Anatomisch-therapeutischchemische Klassifikationssystem gilt für Substanzen, nicht für Handelspräparate. 13 ATC 14 ATC • Das Anatomisch-therapeutisch-chemische Klassifikationssystem, offiziell Anatomical Therapeutic Chemical / Defined Daily Dose Classification ist eine 1976 von der European Pharmaceutical Market Research Association (EPhMRA) entwickelte • 1990 dann vom Collaborating Centre for Drug Statistics der Weltgesundheitsorganisation adaptierte und offiziell herausgegebene internationale Klassifikation für Arzneistoffe. • Die Klassifikation enthält 5 Ebenen. Auf der ersten Ebene gibt es 14 Hauptgruppen, die sich nach dem Organ (zum Beispiel Herz) oder System (zum Beispiel Blutkreislauf) richten, auf die der Arzneistoff seine Hauptwirkung entfaltet. Die zweite und dritte Ebene sind Therapiegruppen beziehungsweise untergruppen; die vierte und fünfte Ebene sind nach der chemischen Struktur geordnet. 15 16 Defined Daily Dose Offiziell ATC/DDD Website: Wirkstoffen wird eine definierte Tagesdosis (DDD) zugeordnet. Die DDD ist die angenommene mittlere tägliche Erhaltungsdosis für die Hauptindikation eines Wirkstoffes bei Erwachsenen. http://whocc.no 17 18 Generika Markteintritt von Generika wird durch verschiedene Rechtsvorschriften beschränkt. Dazu zählt einerseits das Patentrecht, andererseits greift auch ein arzneimittelrechtlicher Unterlagenschutz für die Zulassungsunterlagen des Originalherstellers. Als Generikum (Plural Generika) bezeichnet man ein Arzneimittel, das eine wirkstoffgleiche Kopie eines bereits unter einem Markennamen auf dem Markt befindlichen Medikaments ist. Von diesem Originalpräparat kann sich das Generikum bzgl. enthaltener Hilfsstoffe u. Herstellungstechnologie unterscheiden. Generika werden zumeist unter dem internationalen Freinamen (INN) des Wirkstoffes mit dem Zusatz des Herstellernamens angeboten. Hingegen bieten sogenannte Markengenerika (branded generics) patentfreie Wirkstoffe unter einem neuen Handelsnamen an. In der Regel ist eine Markteinführung von Generika erst zehn bis 15 Jahre nach Erstzulassung des Referenzarzneimittels zulässig. Die Patentgesetze sehen eine Patentlaufzeit von 20 Jahren vor. Da Arzneimittel eine lange Entwicklungszeit haben und ein zeitraubendes Zulassungsverfahren durchlaufen müssen, wodurch die effektive Marktexklusivität deutlich verkürzt wird, wurden in der Europäischen Union, aber auch in anderen Ländern ergänzende Schutzzertifikate eingeführt. Nach der Verordnung Nr. 1768/92 kann einem Patentinhaber ein solches Zertifikat für fünf Jahre erteilt werden; die Dauer der Marktexklusivität ab der ersten Arzneimittelzulassung ist auf höchstens 15 Jahre beschränkt. Abweichend davon kann das Patent oder Schutzzertifikat um weitere sechs Monate verlängert werden, wenn das Arzneimittel für eine pädiatrische Indikation nach der Verordnung (EG) Nr. 1901/2006 zugelassen wird. 19 20 Handelsname Unabhängig vom Patentschutz sieht das Europäische Arzneimittelrecht vor, dass Generika erst zehn Jahre nach Zulassung des Originalpräparats in den Verkehr gebracht werden dürfen. Der Handelsname ist ein geschützter Markenname eines Arzneimittels. Geschützte Markennamen werden in der Regel mit einem ® gekennzeichnet. Der Handelsname und der Wirkstoff eines Medikamentes sind nicht dasselbe. Beispiel: Aspirin® ist der Handelsname eines bekannten Medikamentes. Der Wirkstoff darin ist Acetylsalicylsäure oder kurz ASS, der auch in sehr vielen weiteren Medikamenten mit anderen Handelsnamen enthalten ist. Wenn der Originalhersteller vorher eine Zulassung in weiteren Indikationen mit bedeutendem klinischen Nutzen im Vergleich zu den bestehenden Therapien erhält, wird dieser Unterlagenschutz auf höchstens 11 Jahre verlängert. Erst nach Ablauf dieser Frist darf der Generikahersteller auf die in den Zulassungsunterlagen für das Referenzarzneimittel dokumentierten Ergebnisse der vorklinischen und klinischen Versuche des Originalherstellers verweisen. Die Durchführung klinischer Studien durch Generikafirmen wird vom Patentschutz nicht berührt 21 22 Zulassung und Registrierung von Arzneimitteln • Deutschland: BfArM www.bfarm.de • Österreich: AGES PharmMed www.ages.at Grundlagen der Psychopharmakologie 23 24 25 26 27 28 Die ist das Ergebnis vieler komplexer chemischer Abläufe im menschlichen Körper. Der Zeitabschnitt von der Einnahme bis zur Wirkung wird in drei Phasen aufgeteilt. die pharmazeutische Phase die pharmakokinetische Phase die pharmakodynamische Phase 29 • Die pharmazeutische Phase umfasst den Zerfall und die Auflösung der festen Arzneimittel (Pillen, Zäpfchen ...). • Die pharmakokinetische Phase umfasst die Aufnahme (Resorption), Verteilung (Distribution), Metabolismus (d.h. Umwandlung der Substanz in eine inaktive, wasserlösliche Form durch die Leber) und Entsorgung (Elimination) über Harn oder Stuhl. • Die pharmakodynamische Phase beschreibt die Wechselwirkung zwischen dem Medikament und seiner Ankopplungsstelle (Rezeptor), an deren Ende die Wirkung steht. 31 30 Reaktionskette Pharm azeutische Phase Applikation Zerfall der Arzneiform Auflösung der Wirkstoffe Pharm akokinetische Phase (Verstoffwechselung) Ausscheidung (Urin-pH, Saluret ika Tran sporterprot ein e) Pharm akodynam ische Phase Klinische Wirksam keit Resorption (Magen pH, Ver weildau er, Komplexb ildung) Verteilung Biotransform ation (Eiweißb indung) (z.B. C yto chr om P450) Wirkort/Rezeptoren Pharm akologischer Effekt Toxische Wirkung 32 nach Mutschler et al, Arzneimittelwirkungen WVG Stuttgart 2001 An ein Medikament gestellte Erwartung hinsichtlich seiner Wirkung hängt nicht nur von dem Wirkstoff und seiner Interaktion mit dem Körper, also von seiner Pharmakodynamik, sondern vielmehr die Vorgänge der Aufnahme, Verteilung und Entsorgung eine wesentliche Rolle spielen. • Zur Resorption (Aufnahme)... • Medikamente, die in Form von Tropfen, Tabletten oder Kapseln eingenommen werden können, werden im Magen-Darm-Trakt aufgenommen. Ihre Wirkstoffe sind zur Verbesserung der Aufnahme an einen Trägerstoff gebunden. Dieser Trägerstoff (z.B. Laktose, Stärke, Zellulose, Maltodextrin) kann bei Präparaten, die von verschiedenen Herstellern stammen und den gleichen Wirkstoff enthalten, verschieden sein. Dies führt dazu, dass die Resorption logischerweise auch unterschiedlich sein kann. 33 • So muss es nicht nur ein subjektiver Eindruck sein, wenn man bemerkt, dass das Schmerzmittel Marke X anders wirkt, als das Schmerzmittel Marke Y, obwohl der gleiche Wirkstoff enthalten ist. 34 • Zur Verteilung... Im Blut haben Arzneien bestimmte Vorlieben, sich an Eiweiße zu binden, können mehr oder weniger gut die Blut-Hirn-Schranke überwinden, um im zentralen Nervensystem wirksam zu werden. So kann ein Trägerstoff für eine schnellere Aufnahme sorgen und damit auch für einen schnelleren Wirkungseintritt. • Zum Abbau... ► Ein zweiter wichtiger Aspekt ist mit der Resorption verbunden. Eingenommene Medikamente werden von Leber und Niere abgebaut. Der Abbauprozess braucht eine bestimmte Zeit. Ist diese Zeit kurz, wirkt auch die Tablette nur kurz. Nehmen Frau X und Frau Y die gleiche Tablette ein, bedeutet das nicht, dass beide die gleiche Menge an Wirkstoff aufnehmen. In diesem Zusammenhang wird von der Halbwertszeit t½ eines Medikaments gesprochen. Die Halbwertszeit ist die Zeit, in der die Plasmakonzentration eines Arzneistoffes auf die Hälfte des Ausgangswertes abgesunken ist, also verstoffwechselt und/oder ausgeschieden wurde. Je nach Medikament schwankt die Aufnahme im Magen-Darm-Trakt zwischen 10% und 90% der in der Tablette enthaltenen Wirkstoffmenge. Das bedeutet, dass die Höhe der Medikation verschiedener Patienten nur mit Einschränkungen vergleichbar ist. Eine wichtige Kontrollmöglichkeit der Resorption ist die Bestimmung der Wirkstoffmenge im Blut durch entsprechende Laboruntersuchungen. Bei älteren Menschen läuft dieser Vorgang langsamer, was bei der Medikation, vor allem bei der Dosierung bedacht werden muss. 35 36 Es gibt keine Wirkung nur an einem Ort alleine Applikationsformen: 1. Peroral Unterform: sublingual 2. parenteral: (a) intravenös (b) intramuskulär (c) subkutan 3. Inhalation 4. Nasal 5. Rektal 6. Vaginal 7. Transdermal 37 38 39 40 41 42 Benzodiazepine entfalten ihre Wirkung dadurch, dass sie im ZNS, aber auch im PNS die Wirkung des Neurotransmitters Gamma-Aminobuttersäure (GABA) verstärken. Sie binden an eine spezifische Komponente des GABA-A-Rezeptor und erleichtern dadurch die Bindung von GABA an seinen Rezeptor. Darüber hinaus erhöhen sie die Öffnungsfrequenz von Chloridkanäle, die mit dem GABA A-Rezeptor verbunden sind, und induzieren eine Hyperpolarisation der Zellmembran. Durch die verstärkte Wirkung von GABA kommt es zu einer gedämpften Aktivität bestimmter ZNS-Areale und einer zu verminderten Antwort auf emotionelle und psychische Reize. Als Hyperpolarisation bezeichnet man eine übermäßige Erhöhung (Spannung im Zellinneren wird negativer) des Membranpotentials einer Sinnes-, Nerven- oder Muskelzelle durch Aktivierung inhibitorischer Synapsen. Eine Nervenzelle weist in Ruhe ein negatives Membranpotential auf. Dieses kann durch verschiedene Einflüsse (hemmende Synapsen, Öffnen von Kaliumkanälen) noch weiter gesteigert werden. Eine Hyperpolarisation der Nervenzellmembran erfolgt nach jeder Depolarisation. Damit trägt die Hyperpolarisation entscheidend zur Refraktärzeit bei und schützt vor Übererregung. 43 44 45 46 47 48 49 50 51 52 53 54 55 56 Entstehungsgeschichte von Ritalin: Es begann alles damit, dass der Pharma-Chemiker L. Panizzon im Jahre 1944 rein zufällig Methylphenidat entdeckte, wovon seine Frau Rita naschte und die belebende Wirkung lobte, weswegen der Stoff dann auch "Ritalin" getauft wurde. Man hatte also nicht ein Medikament zur Therapie einer bereits existierenden Krankheit gesucht oder gefunden, sondern zufällig einen Wirkstoff (ein Amphetaminderivat), von dem man noch gar nicht recht wusste, wofür er zu gebrauchen sein könnte. K. Conners und L. Eisenberg gaben dann später einen verwandten Wirkstoff, Dexedrine, versuchsweise an zwei Schulklassen mit farbigen Unterschichtkindern in Baltimore, USA. Das ansonsten nervige und rüpelhafte Verhalten der Schüler "normalisierte" sich auffallend. Es war ein Mittel gefunden, das Verhalten der Kinder an Ghetto-Schulen chemisch zu beeinflussen. Man bemerke: Es lagen nicht irgendwelche medizinischen Diagnosen bei den Kindern zugrunde. Es waren einfach verhaltensschwierige Ghetto-Kids, deren Sozialverhalten chemisch angepasst werden sollte, anstatt an ihren chronisch traumatisierenden psychosozialen 57 Verhältnissen sozialpolitisch etwas zu verbessern. Die amerikanische Drogenbehörde DEA stuft (Methylphenidat) Ritalin® als ebenso gefährliche Droge ein wie Heroin und Kokain. Ritalin macht ebenso stark abhängig und kann sich mit seinen Nebenwirkungen mit Crack messen. Mittlerweile sind weltweit Millionen von Menschen – meist Kinder und Jugendliche – Ritalin süchtig. Dass das leistungssteigernde Amphetamin stark süchtig macht, wurde erst in einer Studie der letzten Jahre nachgewiesen, da Langzeitstudien über das Medikament bisher fehlten. Allein in den Jahren von 1991 bis 1999 verzwanzigfachten sich die Verschreibungen, um sich in den letzten Jahren nochmals zu verhundertfachen. Meistens erfolgen die Verschreibungen nach der Diagnose Aufmerksamkeits-Defizit-Syndrom (ADS). Doch Ritalin (Methylphenidat) kann ADS/ADHS nicht heilen, es dämpft nur die Symptome ab. Bereits 1986 veröffentlichte das International „Journal of the Addictions“ eine Studie über sämtliche wissenschaftliche Publikationen, die sich mit den Nebenwirkungen von Ritalin auseinandersetzten. Dazu gehören unter anderem: paranoide Psychosen und Wahnvorstellungen, hypomanische und manische Symptome, Halluzinationen , Angstzustände, Schlaflosigkeit, Suchtgefahr, psychische und physische Abhängigkeit, Myoklonien, Aggressivität. Wegen der Gefährlichkeit der Nebenwirkungen zählt die Behörde Ritalin sogar an dritter Stelle gleich hinter Heroin und Kokain auf und weist 59 darauf hin, dass sie wegen ihrer stimulierenden Wirkung zu einer Abhängigkeit führt. Wirkungsweise Methylphenidat hemmt die Funktion von Transportern für die Neurotransmitter Dopamin und Noradrenalin. Diese Transporter sitzen in der Zellmembran der präsynaptischen Nervenzelle und dienen einer schnellen Wiederaufnahme der Neurotransmitter aus dem synaptischen Spalt. Infolge der Wiederaufnahmehemmung (Reuptake-Inhibition) ist die Konzentration dieser Neurotransmitter erhöht und länger andauernd. Dies führt zu erhöhtem Signalaufkommen am Rezeptor und unter anderem zu einer Erhöhung des Sympathikotonus. In geringem Maße sorgt Methylphenidat für die Freisetzung von Katecholaminen, die große Erhöhung der Dopaminkonzentration wird aber in erster Linie durch Wiederaufnahmehemmung erreicht. Methylphenidat wirkt außerdem als Agonist am Serotonin-Rezeptor 5HT1A und 5-HT2B. https://www.youtube.com/watch?v=lFO2HLPyw-s 58 Die Vereinigung US-amerikanischer Kinderärzte hat die Richtlinien zur Abgabe von Methylphenidat an Kinder erweitert: Zukünftig dürfen Kinder ab vier Jahren mit dem Wirkstoff behandelt werden, womit die Grenze um zwei Jahre nach unten verschoben wurde. In der Leitlinie wird allerdings empfohlen, dass Kinder im Alter von vier bis fünf Jahren zuerst verhaltenstherapeutisch behandelt werden sollten. Zeigen sich dann keine signifikanten Verbesserungen, kann mit Methylphenidat behandelt werden. Wo aber keine verhaltenstherapeutische Betreuung verfügbar ist, kann auch sofort mit der Methylphenidat-Medikation begonnen werden. Grundschulkinder im Alter von 6 bis 11 Jahren können bereits wahlweise mit Ritalin und/oder verhaltenstherapeutisch behandelt werden, für 12- bis 18-Jährige wird in jeden Fall die Gabe von Methylphenidat vorgeschlagen, möglicherweise ergänzt durch therapeutische Maßnahmen. Hinzu kommt, dass gerade Kinder häufig nicht nur Ritalin erhalten, sondern zusätzlich noch Antidepressiva ( Prozac etc.). 60 Wirkungen von Ritalin®: Seit Juni 2006 ist in den USA als eine weitere Darreichungsform ein transdermales Pflaster (Daytrana von Shire Pharmaceuticals) zur Applikation von Methylphenidat über die Haut erhältlich. •stimmungsaufhellend und euphorisierend •vermittelt ein Gefühl erhöhter Energie •steigert die Aufmerksamkeit, Wachheitsgrad und Leistungsfähigkeit •senkt den Appetit •vertreibt Müdigkeit •Blutdruck und Puls steigen •die Pupillen erweitern sich •die Muskulatur wird stärker durchblutet •Sauerstoff- und Glucosekonzentration im Blut steigen an •Zum Teil können auch empathogene und halluzinogene Effekte auftreten. Das Pflaster wird täglich für bis zu neun Stunden getragen, wobei sich eine Wirkdauer von bis zu zwölf Stunden erreichen lässt. Wirkung und Nebenwirkungen von transdermal appliziertem Methylphenidat sind mit denen der Retardkapseln vergleichbar. 1996 deckte ein Fernsehreport auf, dass die größte amerikanische Non-ProfitOrganisation, die sich mit ADS auseinandersetzt und Informationskampagnen an Schulen, öffentlichen Veranstaltungen und in den Medien betreibt, vom RitalinHersteller Ciba-Geigy (heute Novartis) in Millionenhöhe gesponsert wird. 90 Prozent der gesamten Ritalin-Produktion werden in den USA abgesetzt. Wurden 1988 noch zwei Tonnen Tabletten verschrieben, so waren es 1997 bereits 14 Tonnen! 61 Bereits über sechs Millionen US-Schulkinder stehen unter dem Einfluss von Ritalin. Was sind Psychopharmaka? In einer Langzeitstudie von Gene-Jack Wang et al. (2013) zeigte bei erwachsenen ADHS-Patienten die Langzeiteinnahme des Stimulans Ritalin im Belohnungszentrum eine Zunahme jenes Eiweißes (Dopamin-Transporter), das durch das Medikament eigentlich gehemmt werden sollte, was darauf hindeutet, dass mit der Zeit eine Toleranz gegen die Droge entsteht, wodurch das Absetzen von Ritalin die Symptomatik verstärken würde. Nach dem Ende der einjährigen Einnahme hatte bei den Betroffenen die DATVerfügbarkeit in manchen Hirnarealen des Belohnungszentrums (Putamen, Caudate, ventrales Striatum) um bis zu 24 Prozent zugenommen. Man vermutet, dass die Zunahme eine Reaktion der Zelle auf die gestiegene Konzentration des Botenstoffs im synaptischen Spalt darstellt 62 Definition von Psychopharmaka Kritik am Begriff Psychopharmakon: er impliziert eine direkte Wirkung auf die Psyche Psychopharmaka sind Substanzen, die auf Gehirnfunktionen einwirken und so seelische Abläufe beeinflussen. Wörtlich aus dem griechischen übersetzt sind sie Heilmittel (Pharmakon) für die Seele (Psyche). Unter Psychopharmaka versteht man: Neuroleptika, Antidepressiva, Tranquilizer, Hypnotika, Phasenprophylaktika, Nootropika, Antidementiva 63 Jede Substanz, die in die Regulation zentralnervöser Funktionen eingreift und seelische Abläufe modifiziert (psychotroper Effekt) ist ein Psychopharmakon. Substanzen, für die nach kurzfristiger oder langfristiger Verabreichung in methodisch einwandfreien Untersuchungen an Tieren oder Menschen zweifelsfrei ein psychotroper Effekt nachgewiesen worden ist. Es muss außerdem gesichert sein, dass dieser psychotrope Effekt auf die Wirkung des Pharmakon selbst oder auf der Wirkung seiner Metaboliten auf Strukturen des Zentralnervernsystems beruht. 64 Wie funktionieren Psychopharmaka? • Durch Wiederaufnahme in die Nervenzelle oder Abbau durch ein Enzym wird der Neurotransmitter deaktiviert. Zu den, für die Psychopharmakologie zurzeit bedeutenden Transmittern zählen das Dopamin, Serotonin, Noradrenalin, Acetylcholin und Histamin. • Für die Erkrankungen aus dem schizophrenen Formenkreis ist in bestimmten Bereichen des Gehirns ein vermehrte Dopaminausschüttung bekannt, bei Depressionen, egal welcher Ursache sind verminderte Ausschüttungen von Serotonin und Noradrenalin bekannt. Grundlegende Wirkung eines Pharmakons Psychopharmaka interagieren mit zahlreichen Mechanismen innerhalb des ZNS, wie Neurotransmittersynthese, der Speicherung und Freisetzung von Neurotransmitter an den Synapsen, den Effekten abbauender Enzyme, den spezifischen prä- und postsynaptischen Rezeptoren, sowie den Transportproteinen. 65 66 67 68 Wichtigste Neurotransmitter • • • Erregende Neurotransmitter – Dopamin (Psychomotorik) • Dopaminmangel (z.B. Morbus Parkinson) Therapie: Eingriff ins extrapyramide System • Dopaminüberschuss (z.B. Schizophrenie) Therapie: Dopamin-Antagonisten (Neuroleptiker) blockieren Aufnahme von Dopamin – Noradrenalin (Aufmerksamkeit, Angst, Stimmung) • Noradrenalinmangel (z.B. Depression) Therapie: Down-regulation (Imipramin) blockieren Noradrenalin und herabsetzen der Empfindlichkeit der Rezeptoren – Serotonin (Schlaf, Stimmung, Schmerz, Angst, Impulskontrolle) • Serotoninmangel (z.B. Depression) Therapie: Selektive Serotonin Wiederaufnahmehemmer (SSRI) Rücktransport von Serotonin wird blockiert Hemmende Neurotransmitter – Aminosäuren (GABA, Glutaminsäure, Glycin) • z.B. GABA-Mangel generalisierte Angststörungen Therapie: Tranquilizer Hemmende und erregende Neurotransmitter - Acetylcholin (Gedächtnis, Lernen) • z.B: Acetylcholinmangel Alzheimer Neurotransmitter 69 Acetylcholin gehört nach γ-Aminobuttersäure (GABA) und Glycin zu den Neurotransmittern, die im Gehirn am häufigsten vorkommen. Noradrenalin ist ein Neurotransmitter und ein Hormon. Viele kognitive Prozesse sind an Acetylcholin als Botenstoff gebunden Einige kognitive Prozesse sind an Noradrenalin als Botenstoff gebunden So besteht beispielsweise bei der Alzheimer Erkrankung durch Absterben von hauptsächlich Acetylcholin produzierenden Nervenzellen ein Mangel an Acetylcholin. Im Locus coeruleus wird ein Großteil des Noradrenalins des ZNS produziert Benzodiazepine vermindern die Aktivität des Locus coeruleus und reduzieren damit den Transport von Noradrenalin zum Vorderhirn. Dopamin (DA) ist ein biogenes Amin aus der Gruppe der Katecholamine und ein wichtiger Neurotransmitter Die Wirkung hängt vom Dopamin-Rezeptortyp in der Postsynapse ab. Zur Zeit unterscheidet man fünf DopaminRezeptoren (D1–D5). Bindet Dopamin an D1 oder D5 wird die nachgeschaltete Zelle depolarisiert (ein exzitatorisches postsynaptisches Potential entsteht). Eine Bindung an die Rezeptoren D2–D4 bewirkt eine Hyperpolarisierung der Postsynapse (inhibitorisches postsynaptisches Potential). Serotonin ist ein Gewebshormon und Neurotransmitter. Befindet sich in den serotoninergen Nervenbahnen in den Raphe-Kernen. γ-Amino-Buttersäure (GABA) Stärkster und häufigster inhibitorischer Transmitter im ZNS Etwa 30-40% aller zerebralen Rezeptoren sind GABA-Rezeptoren GABA-Interaktion verbessert die Leitfähigkeit für Chloridionen Der verstärkte Cl-Influx hyperpolarisiert die postsynaptische Membran und somit die Hemmung der Glucagonsekretion Benzodiazepine (Tranquilizer) potenzieren diese Wirkung GABA: u.a. im Kortex, Hippocampus, Kleinhirn und den Basalganglien Synthese aus Glutamat (Aminosäure). Inaktivierung durch Reuptake (Neuronen und Glia) und enzymatischen Abbau Formel für die Berechnung der Interaktionen: n2-n/2 Beispiel: 6 verschiedene Medikamente= 36-6/2= 15 Interaktionen! Therapeutisches DrugMonitoring Therapeutisches DrugMonitoring 85 Therapeutisches DrugMonitoring 86 Therapeutisches DrugMonitoring 87 88 Geschichte und Grundlagen Psychopharmaka • Unter dem Paradigma, es handele sich bei bestimmten seelischen Erkrankungen um biologisch erklärbare Abläufe, wurde die Entwicklung der Psychopharmaka begonnen. Ihre Ursprünge der Psychopharmaka hatten jedoch wenig mit der Psychiatrie zu tun. • So stammte das erste Medikament zur Behandlung von psychotischen Symptomen aus einer Entwicklungsreihe von Heuschnupfenmitteln und Wurmkuren. Nur wegen des stark sedierenden Effektes wurde es versuchshalber in der Psychiatrie eingesetzt. Es war bei diesem Versuch ein Rückgang von akustischen Halluzinationen und eine beginnende Distanzierung von wahnhaftem Erleben bei vielen unter einer Schizophrenie leidenden Patienten feststellbar. • Die Substanz hieß Chlorpromazin und wurde in Deutschland viele Jahre unter dem Namen Megaphen verkauft. Mit der zunehmenden Zahl von entwickelten Psychopharmaka wurde eine Systematik zu ihrer Einordnung in krankheitsbezogene Untergruppen entworfen, die heute in ihren ursprünglich klaren Kategorien nicht mehr stimmig ist. Arzneimittelgruppen Neuroleptika Tranquillantien starke: wirken psychotischen Zuständen entgegen wirken gegen Unruhe bei Angstzuständen schwache: gegen Unruhe psychisch dämpfende Wirkung psychisch anregende Wirkung Antidepressiva Psychostimulantien wirken depressiven Stimmungen entgegen steigern den psychischen Antrieb und wirken Müdigkeit entgegen 89 90 Klassifikation neu Klassifikation Klassifikation nach Delay hat neue Aktualität erhalten, da sowohl WHO, als auch die europäische Arzneimittelbehörde (EMEA) die sog. ATC-Klassifikation (Anatomisch -Therapeutisch – Chemisch) für die Einteilung der Arzneimittelgruppen verwendet. Psychopharmaka finden sich in dieser Systematik unter den Psycholeptika und Psychoanaleptika 1957 von Delay vorgeschlagen Unterteilung nach der angestrebten therapeutischen Wirkung in 3 Gruppen: • Psycholeptika – mit vorwiegend dämpfender Wirkung auf die Psyche (Neuroleptika, Tranquilizer, Schlafmittel) • Psychoanaleptika – mit vorwiegend anregender Wirkung auf die Psyche (Antidepressiva, Psychostimulanzien) • Psychodysleptika – können psychotische Zustände künstlich hervorrufen (LSD, Pilzgifte) Psycholeptika: Antipsychotika Anxiolytika Hypnotika/Sedativa Psychoanaleptika: Antidepressiva Psychostimulanzien Antidementiva 91 92 Psychopharmaka Psychopharmaka Antidepressiva Neuroleptika Wirkstoffgruppe Schwache bis mittelstarke Neuroleptika Wirkstoffe Handelspräparate Promethazin Thioridazin Levomepromazin Clopenthixol Triflupromazin Atosil® Melleril® Neurocil® Ciatyl® Psyquil® Sehr starke Neuroleptika Perphenazin Haloperidol Flupentixol Benperidol Decentan® Haldol® Fluanxol® Glianimon® Depot-Präparate Clopenthixol-Decanoat Haloperidol-Decanoat Flupentixol-Decanoat Fluspirilen Ciatyl-Z Depot® Haldol Janssen D® Fluanxol Depot® Imap® Sulpirid Clozapin Risperidon Olanzapin Amisulpirid Dogmatil® Leponex® Risperdal® Zyprexa® Solian® Weitere Neuroleptika Halbwertszeiten 12 – 15 30 15 – 30 20 10 – 20 h h h h h 8 – 12 20 6 2–5 h h h h 19 21 17 7–8 d d d d 8 8 – 12 24 33 12 h h h h h 93 Benzodiazepine Handelspräparate Lormetazepam Noctamid®, Flurazepam Dalmadorm®, Staurodorm neu® Oxazepam Adumbran®, Praxiten® 12 – 15 h Bromazepam Lexotanil® 12 - 18 h Nitrazepam Imeson® Dikalium-chlorazepat Tranxilium® Lorazepam Tavor® Wirkstoffe Handelspräparate Tri-/tetracyclische Antidepressiva Amitriptylin Amitriptylinoxid Doxepin Mianserin Trimipramin Saroten® Equilibrin® Aponal®, Sinquan® Tolvin® Stangyl® Mittl. Tagesdos. [mg] 50 60 20 30 50 Desipramin Pertofran® 50 – 150 Imipramin Clomipramin Maprotilin Dibenzepin Tofranil® Anafranil® Aneural®, Ludiomil® Noveril® 50 – 150 50 – 150 75 – 150 120 – 360 Serotonin-ReuptakeHemmer Citalopram Fluoxetin Fluvoxamin Paroxetin Cipramil® Fluctin® Fevarin® Seroxat®, Tagonis® 20 – 60 20 100 – 200 20 – 40 Lithiumsalze Lithiumacetat Lithiumcarbonat Quilonum® Hypnorex® Individuell, je nach Serumspiegel MonoaminoxidaseHemmer Tranylcypromin Moclobemid Jatrosom® Aurorix® 10 – 20 300 – 600 Sonstige Antidepressiva Mirtazapin Viloxazin Venlafaxin Reboxetin Johanniskraut-Extrakt Remergil® Vivalan® Trevilor® Edronax® Jarsin®, Hyperforat® 15 – 45 150 – 500 150 – 375 8 – 12 100 – 900 – – – – – 150 150 150 90 150 94 Neuroleptika Psychopharmaka Wirkstoff Wirkstoffgruppe Im Rahmen ausgedehnter Forschungen französischer Pharmakologen nach 1945 auf dem Gebiet der Heuschnupfenmittel (Antihistaminika) und Wurmkuren (Antihelmetika) war eine Substanzgruppe, die PHENOTHIAZINE, weiterentwickelt worden. Die erste einsetzbare Substanz war das Promethazin, dass wegen seiner starken sedierenden Wirkung als Schlafmittel eingesetzt wurde und noch heute als Atosil® im Handel ist. Wenig später kam das Chlorpromazin zum Einsatz, das wesentlich stärker sedierende Eigenschaften aufwies. Es wurde von den französischen Psychiatern Delay und Deniker bei manischen und schizophrenen Patienten angewendet. Im Verlauf der Behandlung wurde ein nicht erwarteter Rückgang produktiv-psychotischer Symptome wie wahnhaftes Erleben oder akustische Trugwahrnehmungen beobachtet. 1955 Vorschlag des Begriffes "Neuroleptika" für ähnlich wirkende Substanzen 1958 Entdeckung der "Butyrophenone" mit Hauptvertreter "Haldol" durch Janssen Zahlreiche andere Substanzen sind bis heute entwickelt worden. Wirkdauer 8 - 10 h 7-8h 15 – 24 h 20 - 30 h 20 - 100 h 95 https://www.youtube.com/watch?v=9hlwGqy16j8 96 Chemische Merkmale Einteilung der Neuroleptika Neuroleptika 6 Gruppen Phenotiazine Thiordiazin (Melleril); Levomepromazin (Neurocil) Thioxanthene Chlorprothixen Butyrophenone Haloperidol, Benperidol Diphenylbutylpiperidine Fluspirilen (Imap), Pimozid Benzamide Sulpirid andere NL Clozapin, Risperidon v.a. dämpfend, erregungssenkend antipsychotisch, weniger sedierend auch auf Negativsymptomatik 97 Man spricht von hoch-, mittel-, und niederpotenten Neuroleptika. Typische und Atypische Neuroleptika Typische Neuroleptika Atypische Neuroleptika • Haloperidol (z. B. Haldol®) • Flupentixol (z. B. Fluanxol®) • Fluspirilen (z. B. Imap®, Fluspi®) • Levomepromazin (z. B. Neurocil®) • Chlorprothixen (z. B. Truxal®) • Sulpirid (z. B. Dogmatil®) • • • • • • • • Im Zusammenhang mit der antipsychotischen Wirkung wurden auch die ausgeprägten, unerwünschten Wirkungen der Präparate insbesondere auf die Motorik erkannt. Man nahm früher an, daß die Stärke der antipsychotischen Wirksamkeit mit der Stärke der zu beobachtenden Wirkungen auf die Motorik linear zusammenhänge. Erst als Anfang der siebziger Jahre das Neuroleptikum Leponex entdeckt wurde, das sich bei völligem Ausbleiben motorischer Nebenwirkungen als gut antipsychotisch wirksam erwies, mußte dieser Standpunkt relativiert werden. Entsprechend dem unerwarteten Verhalten wurde das Medikament als ATYPISCHES NEUROLEPTIKUM bezeichnet. Für die typischen Neuroleptika wurde eine Einteilung in drei Gruppen getroffen. 98 Clozapin (z. B. Leponex®) Olanzapin (z. B. Zyprexa®) Quetiapin (z. B. Seroquel®) Risperidon (z. B. Risperdal®) Paliperidon (z. B. Invega®) Amisulprid (z. B. Solian®) Ziprasidon (z. B. Zeldox®) Aripiprazol (z. B. Abilify®) Die hochpotenten NL sind stark antipsychotisch wirksam und haben starke Nebenwirkungen auf die Motorik, die niederpotenten NL wirken eher angstlösend und beruhigend, haben weniger Nebenwirkungen auf die Motorik, können aber zu Schwindel, niedrigen Blutdruck und epileptischen Anfällen führen. 99 100 • • • • • Hochpotente NL Fluphenazin (z.B. Dapotum® ) Flupentixol (z.B. Fluanxol®) Pinozid (z.B. Orap®) Haloperidol (z.B. Haldol®) Benperidol (z.B. Glianimon®) • • • • Mittelpotente NL Zuclopentixol (z.B. Ciatyl Z®) Sulpirid (z.B. Dogmatil®) Thioridazid (z.B. Melleril®) vom Markt genommen Perazin (z.B. Taxilan®) • • • • • Niederpotente NL Promethazin (z.B. Atosil®) Levomepromazin(z.B. Neurocil®, Nozinan®) Melperon (z.B. Eunerpan®, Buronil®) Chlorprothixen (z.B. Truxal®) Pipamperon (z.B. Dipiperon®) Depotneuroleptika • Haloperidol D®, Fluphenazin D®, Perphenacin D®, CiatylZ®, Flupentixol D®, Risperdal consta®, Cisordinol D®, Dapotum D®, Xeplion® • • • • • • • • • Atypische Neuroleptika Clozapin (z.B. Leponex®) besondere Behandlungsauflagen! Olanzapin (Zyprexa®) Risperidon (Risperdal®*) (*ab >4mg/Tag EPMS häufiger) Zotepin ( z.B. Nipolept®) Amisulprid (Solian®*) (*keine Wirkung auf Serotoninrezeptoren) Quetiapin (Seroquel®) Ziprasidon (Zeldox®) Aripiprazol (Abilify®) Paliperidon (Invega®) 101 102 Einteilung der Neuroleptika • Klinische Einteilung in "typische" und "atypische" Neuroleptika • Einteilung nach chemischer Struktur: – Trizyklische Neuroleptika: • Phenothiazine – Mit aliphatischer Seitenkette » stärker sedierend » deutliche vegetative NW. » Kaum EPS – Mit Piperidyl-Seitenkette – Mit Piperazinyl-Seitenkette » nur schwach sedierend » kaum vegetative NW » stärkere EPS – Thioxanthene – Chemisch ähnliche Substanzen • Butyrophenone und Diphenylbutylpiperidine • Dibenzoepine (z.B. Clozapin) • Benzamide(z.B. Amisulprid) • Chemisch neuartige Antipsychotika: – Olanzapin – Risperidon – Quetiapin – Ziprasidon – Typische N.: Plussymptomatik, EPS – Atypische N.: Plus- und Negativsymptomatik, keine oder geringe EPS • Einteilung "typischer" Neuroleptika nach antipsychotischer Wirkung ("neuroleptische Potenz" nach Haase) in schwach-, mittel- und hochpotent sowie Depot-Neuroleptika 103 104 Zum Beispiel: Chlorpromazin als Standardwirkstoff hat einen CPZi = 1 Neuroleptische Potenz Haloperidol CPZi = 50, Perphenazin CPZi = 10; dies heißt, das 1 mg Haloperidol eine neuroleptische Potenz vergleichbar mit 50 mg Chlorpromazin und Perphenazin 1 mg mit 10 mg Chlopromazin besitzen. Nach Einführung der Neuroleptika hatte man festgestellt, dass ein Medikament umso stärker antipsychotisch wirkte, je größer seine extrapyramidal-motorischen Nebenwirkungen waren. Je nach der Potenz werden klassische Neuroleptika in drei Klassen unterteilt: • Man führte daher den Begriff der neuroleptischen Potenz ein, der ein Maß für diese Nebenwirkungen ist. Erst mit der Einführung des Clozapin im Jahre 1971 kamen Medikamente auf den Markt, bei denen dieser Zusammenhang nicht besteht und die als atypische Neuroleptika bezeichnet werden. Die neuroleptische Potenz wird im Chlorpromazin-Index (CPZi) angegeben. niederpotente Neuroleptika (CPZi ≤ 1,0) Beispiele: Promethazin, Levomepromazin, Thioridazin, Promazin mittelpotente Neuroleptika (CPZi = 1,0-10,0) • Beispiele: Chlorpromazin, Perazin, Zuclopenthixol • hochpotente Neuroleptika (CPZi > 10,0) Beispiele: Perphenazin, Fluphenazin, Haloperidol, Die Zahlenangabe der Potenz eines Neuroleptikums sagt wenig über den Effekt der Substanz im Einzelfall (beim konkreten Patienten) aus, da individuell das Ansprechen auf eine Dosis sehr verschieden sein kann. CPZ-Äquivalent: 1 mg der Substanz entspricht x mg Chlorpromazin. 105 106 Wirkung der Neuroleptika: • Ähnlich wie bei den Antidepressiva ist auch bei den Neuroleptika der eigentliche Wirkmechanismus heute noch unbekannt!!! • Zentraler Transmitter ist das Dopamin (Es handle sich genauer um einen Dopaminüberschuss!) • Antipsychotische Wirkung sehr eng mit D2-Rezeptor korreliert! • Neuroleptika rufen eine Dopaminrezeptorblockade hervor: – Alle antipsychotisch wirksamen Neuroleptika blockieren sogenannte D2-artige Dopamin (DA)-Rezeptoren • D2-artige Rezeptoren sind die Rezeptoren D2,3,4, die zu einer Erhöhung der Konzentration von cAMP als intrazellulärem "second messenger" führen • D1-artige Rezeptoren sind die Rezeptoren D1/5, die zu einer 107 Erniedrigung der Konzentration von cAMP führen 108 Es gibt drei wichtige dopaminerge Neuronensysteme mit unterschiedlicher Verteilung der DA-Rezeptor-Subtypen im ZNS: • 1. nigrostriatales System: – verantwortlich für die Kontrolle der Motorik, damit auch für EPS! Pharmakokinetik • • • • in der Regel gute enterale Resorption schnelle Elimination (Akkumulation ist selten) Beziehung Dosis-Plasmakonzentration nicht einfach Phenotiazine und Thioxanthene im Blut an Plasmaproteine gebunden, HWZ ∅ 5-30 h; Inaktivierung in der Leber • Butyrophenone in viel geringeren Dosen wirksam, HWZ 12-36 h Wirkorte • 2. mesolimbisches System – vermutlich Hauptangriffsort der NL und verantwortlich für die antipsychotische Wirkung mesolimbisch-mesokortikales Gebiet (hier antipsychotische Wirkung; Lernen, Gedächtnis, affektive Störungen) • 3. tuberoinfundibuläres System tuberoinfundibuläres System (Beeinflussung der Hormonausschüttung der Hypophyse, v.a. Prolaktin durch NL ↑) – vermittelt die neuroendokrinologischen NW der NL nigrostriatales System (Kontrollmechanismen für Bewegungsabläufe; extrapyramidalmotorische NW) 109 – Einige NL blockieren zusätzlich 5-HT2(A, B, C)-, a1-, a2-, H1- und muskarinische Azetylcholin (mACH)-Rezeptoren (M1-5) – Einige NL binden auch an 5-HT6- (Clozapin, Olanzapin, Ziprasidon, Zotepin, aber auch Fluphenazin, Chlorpromazin, Chlorprotixen) und 5-HT7-Rezeptoren (Clozapin, Pimozid, Quetiapin, Risperidon, Ziprasidon, Zotepin) – Die Bedeutung eines zusätzlichen 5-HT2-Antagonismus für einen günstigeren Effekt auf Negativsymptome bleibt weiterhin umstritten!!! – Die Gründe für das Fehlen oder ein seltenes Auftreten von EPS bei atypischen NL sind unklar! (selektive D4- oder 5HT2A/C-Rezeptoren-Blockade?) 111 110 Wirkungsmechanismus Dopamin-Hyperaktivitätshypothese • → NL blockieren prä- und postsynaptische Dopaminrezeptoren (v.a. D2) und verdrängen Dopamin aus der Bindung an den Rezeptor ⇒ Unterdrückung der Wirkung → Dopa-Akkumulation im Gehirn (Erhöhung des Stoffwechselprodukts Homovanillinsäure im Liquor) weitere Hypothese: eher Transmitterdysbalance? • → Normalisierung mit Pharmaka, die auch andere Wirkeigenschaften besitzen (cholinerg, serotoninerg, GABAerg) • → im Striatum führt Blockade der Dopaminrezeptoren zu extrapyramidalmotorischen Störungen durch Dysbalance zwischen DA und Acetylcholin (Anticholinergika helfen) • → im Limbischen System wird die Wirkung der NL dagegen nicht durch Anticholinergika aufgehoben! • außerdem antihistaminisch, antiemetisch, antiadrenerg, anticholinerg, antiserotonerg → auch in Anästhesie, innerer Medizin und Dermatologie 112 Wirkungen von Neuroleptika Sedierung und psychomotorische Dämpfung; Kreislaufregulation, andere vegetative Folgen; manchmal hyperkinetisch-dystone Reaktionen (Frühdyskinesien) Welche Wirkungen haben Neuroleptika? Mehrphasenwirkung Gut zu beeinflussende psychotische Symptome: Halluzinationen (akustische, optische, haptische, olfaktorische, gustatorische) Denkstörungen (Denkzerfahrenheit, Ideenflucht, Gedankenabreißen) Wahnvorstellungen (paranoide Vorstellungen, Größenwahn) Störungen der Ich-Integrität (Gedankenausbreitung, Gedankeneingebung) Erregungszustände (Angst, Aggressivität) Beruhigende und Schlafanstoßende Wirkung anhaltende Antriebsminderung; Abnahme der vegetativen Begleiteffekte Distanzierung von psychotischen Erlebnissen; emotionale Ausgeglichenheit, zunehmende Krankheitseinsicht Weniger gut zu beeinflussende psychotische Symptome Antriebsminderung (Adynamie) Lustlosigkeit, Freudlosigkeit (Anhedonie) Innere Leere leichte Konzentrationsstörungen Bei Langzeitmedikation oder ambulanter Behandlung Langzeit NL als Tabletten oder Injektion 113 114 Wirkung und Einsatz der Neuroleptika • Schutz vor dem Wiederauftreten psychotischer Symtpome Innerhalb von 12 Monaten nach einer psychotischen Episode treten unter ausreichender neuroleptischer Therapie bei 15% der Patienten erneut psychotische Symptome auf. Ohne Medikation kommt es bei 75% zu Rückfällen. Innerhalb von 24 Monaten kommt es bei 40% der behandelten und bei 85% der unbehandelten Patienten zu Rückfällen. Depotneuroleptisch behandelte Patienten haben weniger Rückfälle. 115 Warum können Neuroleptika die Konzentration verbessern und verschlechtern? • Eine dieses Phänomen erklärende Theorie ist die Hypofrontalitätshypothese. • Demnach wurde bei psychotisch Erkrankten eine vermehrte Ausschüttung von Dopamin im mesolimbischen System festgestellt. Dieser Funktionsbereich des Gehirns vermittelt uns Gefühle wie Angst und Glück. • Im präfrontalen Kortex hingegen wurde eine verminderte Dopaminausschüttung registriert. In diesem Areal findet u.a. das kritische, bewusste Denken statt. Beide Bereiche sind miteinander durch Bahnen verbunden. • Bei starker mesolimbischer Erregung wird das reflektive kritische Denken gestört und behindert. Durch die Gabe der antidopaminerg wirkenden Antipsychotika wird die mesolimbische Erregung abgebaut; es kann deutlich klarer gedacht werden als in der akuten Psychose, jedoch bleibt die oben erwähnte Unterfunktion bestehen und wird durch eine zu hoch dosierte Neurolepsie verstärkt. • Die modernen Neuroleptika sind ein Vorteil für die Patienten, da sie ein anderes Spektrum der Dopaminrezeptoren ansprechen, die vorwiegend mesolimbisch zu finden sind. Damit wird die präfrontale Dopaminunterversorgung nicht weiter verstärkt. 116 Das auch als „positives Belohnungssystem“ bezeichnete mesolimbische System (Syn. mesencephal-limbisches System) ist entscheidend an der Entstehung der Emotion „Freude“ beteiligt. Aber auch zahlreiche Drogen wie Opioide, Alkohol oder Nikotin entfalten ihre Wirkungen durch Beeinflussung des mesolimbischen Systems, indem sie dort die Dopaminausschüttung direkt oder indirekt erhöhen. Ursachen der Suchtentwicklung, als extreme Form von Motivation, sind also auch im mesolimbischen System zu suchen. Dieses hat seinen Ursprung in der Area tegmentalis ventralis (auch: ventrale tegmentale Zone, VTZ) des Mittelhirns und ist Teil des limbischen Systems. Der Neurotransmitter des mesolimbischen Systems ist das Dopamin. 117 118 Unerwünschte Wirkungen Hoch- und mittelpotente NL Frühdyskinesien (Zungen-, Schlund-, Blickkrämpfe. Schiefhals) Parkinsonoid (kleinschrittiger Gang, starre Mimik, langsame Bewegungen, Schriftveränderungen, Schwierigkeiten beim Zähneputzen ...) Akathisie, Tasikinesie (Sitzunruhe, Bewegungsdrang, Zwang zum Laufen) Speichelfluss Malignes Neuroleptisches Syndrom (hohes Fieber, absolute Steifigkeit des ganzen Körpers, lebensgefährliches Syndrom in der Regel ist eine intensivmedizinische Behandlung erforderlich) Spätdyskinesien (Hyperkinesen, dauerhafte orale Dyskinesien) Niederpotente NL Blutdrucksenkung Schwindel Müdigkeit Appetitsteigerung Verstopfung Allgemeine unerwüschte Wirkungen Blutbildveränderungen (Rückgang der weißen Blutkörperchen) Sonnenemfindlichkeit (Photophobie bei Phenothiaziden) Leberveränderungen (Transaminasenerhöhung) sexuelle Dysfunktionen (Libidoverlust, Impotenz, etc.) Störungen der Regelblutungen (Dysmenorrhoe, Amenorrhoe) Milchfluß Herabsetzung der Krampfschwelle Gewichtszunahme 119 120 Behandlung der unerwünschten motorischen Wirkungen • Neuroleptisch induzierte Nebenwirkung, wie das Parkinsonoid, Frühdyskinesien und Speichelfluß lässt sich mit Einschränkungen durch ein Anticholinergikum wie Biperiden(Akineton) behandeln. Bei starken Zittern und Bewegungsunruhe hilft es kaum. • Bei Spätdyskinesien ist es unwirksam, kann die Beschwerden dort eher verstärken. 122 121 Wechselwirkungen • Zahlreiche zusätzliche Wirkungen in verschieden ausgeprägtem Maße: • u.a. mit Antihypertensiva (Abschwächung des Effekts, Kreislaufregulationsstörungen, Verstärkung des sedierenden Effekts); Alkohol, Benzodiazepine, Barbiturate, Hypnotika, Antidepressiva, Antiparkinsonmittel, Kontrazeptiva, ... Vergiftungen • • • • • – antihistaminerg – antiemetisch – antiadrenerg – anticholinerg vorübergehendes Delir bis tiefes Koma niedriger Blutdruck Tachykardie, Arrhythmie Atemdepression → Therapie ist schwierig (vorwiegend symptomatisch) Indikation • - antiserotonerg • • • • 123 • psychomotorische Erregtheit (→ initial stark dämpfende NL wie Levomepromazin, antispychotische Wirkung jedoch erst verzögert) akute psychotische Zustandsbilder (paranoid-halluzinatorisch) (→ Haloperidol oder Flupentixol; antipsychotische Wirkung schon in den ersten Tagen; aber auch extrapyramidale NW) chronisch verlaufende schizophrene Psychosen/Spätstadium nach langjähriger Schizophrenie Rezidivprophylaxe (→ langfristig wirkende NL oder Retardpräparate) Bewegungsstarre (→ z.B. Lorazepam (Tavor), eigentl. Benzodiazepin, gegen Stupor ohne extrapyramidalmotorische NW, (diese verschlechtern bei anderen Präparaten erst mal das Symptombild)) Negativsymptomatik (→ mit klassischen NL kaum; Clozapin als atypisches eher; 124 hat auch keine extrapyramidale NW, dafür aber Blutbildschädigung) Indikationen für den Einsatz von Neuroleptika: Kontraindikationen • • akute Intoxikationen mit zentral dämpfenden Pharmaka und Alkohol bei Patienten mit Leukopenie in der Anamnese keine trizyklischen NL Übersicht: • Neuroleptische Potenz • • • • • • Haase (1982) „Die Dosis, die gerade ausreicht, um zu einer extrapyramidalen Störung der Feinmotorik zu kommen" basiert auf der früheren Annahme, daß antipsychotische Wirkung an die extrapyramidalen NW gekoppelt ist (stimmt aber nicht) neuroleptische Potenz als Wert auf Skala bzgl. Standarddosis (Chlorpromazin hat Wert 1, alle anderen relativ dazu eingestuft) Je enger die Rezeptorbindung, desto größer die nl Potenz Zusammenhang neuroleptische Potenz-Sedation ist gegenläufig hochpotente NL v.a. bei psychotischen Zustandsbildern, niedrigpotente bei psychomotorischer Erregung (schlafanstoßend, initial dämpfend) – – – – – • psychomotorische Erregtheit affektive Spannung psychotische Sinnestäuschungen psychotisches Wahndenken katatone Verhaltensstörungen psychotische Ich-Störungen Schizophrene und schizoaffektive Psychosen Manien Erregungszustände jeglicher Art Verhaltensstörungen im Kindesalter Organische Psychosyndrome/Alterspsychosen Neurologisch: – Schmerzsyndrome (in Komb. Mit Antidepressiva) – Hyperkinetische Syndrome (Chorea Huntington(Veitstanz,autosomal-dominant vererbte, neuro-degenerative Erkrankung), Athetose (unwillkürliche, sich langsam abspielende, ausfahrende Bewegungen von Händen oder Füßen) Torsionsdystonie(vom eigenen Willen nicht beherrschbaren rotierenden Bewegungen vorwiegend im Rumpf- und Kopfbereich), Hemiballismus (plötzliche, unwillkürliche und heftige einseitige Schleuderbewegungen der Arme und Beine oder von Schulter- und Beckengürtel) Zielsymptome (1) (2) (3) (4) (5) (6) Psychiatrisch: • Anästhesie – Neuroleptanalgesie – Prämedikation – Postoperatives Erbrechen 125 • Sonstiges 126 – Symptomatisch bei Erbrechen oder Übelkeit Differentialindikationen: Nach Substanz: • ältere, typische NL wirken meist sehr gut auf "Positivsymptomatik", während atypische, neuere NL (zusätzlich) günstige Auswirkungen auf die "Negativsymptomatik" hat – das liegt vermutlich daran, dass die “typischen NL“ gleichmäßig an die D2Rezeptoren der limbischen und striatalen Nervenzellen binden und diese gleichermaßen blockieren. Durch Blockade der striatalen NZ kommt es zu EPMS. Die "atypischen" NL binden dagegen offenbar bevorzugt/selektiv an D2-Rezeptoren der limbischen Region, sodass die Gefahr der EPS verringert ist! – Das individuelle Wirkungsprofil der Neuroleptika, insbesondere auch die NW hängen davon ab, an welche Rezeptoren das Medikament mit welcher Intensität bindet • • • • • • D1-5, 5-HT, mACh a1 (noradrenerg) a2 (noradrenerg) H1 • für Amisulprid (Solian®) ist nachgewiesen, dass es auch bei reiner Negativsymptomatik wirkt • für Amisulprid (Solian®), Olanzapin (Zyprexa®) und Risperidon (Risperdal®) wurden antidepressive Eigenschaften im Rahmen der Schizophreniebehandlung beschrieben • für Amisulprid (Solian®) wurden antidepressive Wirkungen auch bei der Dysthymie beschrieben! • Atypische NL scheinen gegenüber typischen NL Vorteile bei der Behandlung der kognitiven Störungen der Schizophrenie zu haben • Vorteil der Atypika: Depotformen erhältlich 127 128 Nach Erkrankung: • • • • Manie mit psychotischen Symptomen (Vorübergehender Einsatz!) Psychotische Depression, z.B. wahnhafte Depression (vorübergehender Einsatz über mehrere Monate, anschließend langsames Absetzen unter Beibehalten des Antidepressivums) Nicht-psychotische Depression – Sulpirid (Dogmatil®) hat in einer Dosierung bis 300mg antidepressive Eigenschaften – Amisulprid (Solian®) hat niedrigdosiert bis 100mg tgl. eine antidepressive Wirkung – Erregungszustände im Rahmen einer Demenz (Cave: EPMS) – Schlafstörungen bei Demenz • Möglichst NL mit geringer anticholinerger Komponente verwenden (Pipamperon (Dipiperon®)) – M. Parkinson in Kombination mit einer paranoiden Psychosen • Clozapin , keine typischen Neuroleptika – Auf Depot-NL möglichst verzichten Neurologische Erkrankungen: – Gilles-de-la-Tourette-Syndrom und andere Tic-Störungen • Bei vokalen und motorischen Tics ist Pimozid (Orap®) 2-4mg wirksam, auch Fluphenazin (Dapotum®) 2-4mg tgl. – Chorea Huntington Andere organische Psychosen • NL sind wirksam gegen Bewegungsstörungen und Psychose – Alkoholhalluzinose – Dyskinesien unterschiedlicher Genese • Tiaprid, Antagonist an D2-artigen Rezeptoren, ist nur für diese Indikation zugelassen (Delpral®) 300-600mg tgl. (Höchstdosis 1200mg) • Demenz Persönlichkeitsstörungen • Evt. vorübergehend Haldol 5-10mg – Delir • Bei psychotischen Zustandsbildern oder starker psychomotorischer Erregung evt. Gabe eines NL, z.B. Haldol – Bei Borderline-Störungen und/oder schizotypischer Pers.-störung Hinweise auf Wirkung für • Flupentixol (Fluanxol®) • Haloperidol (Haldol®) • – Psychomotorische Erregung im Rahmen einer Intoxikation Angststörungen • Evt. vorübergehend Haldol – Es ist eine anxiolytische Wirkung von – Drogeninduzierte Psychose • Niedrig dosiertem Flupentixol (Fluanxol®) • Fluphenazin (Dapotum®) • Thioridazin (Melleril®) beschrieben • Vorübergehend Haldol – Aber: Antidepressiva, Benzodiazepine und Buspiron (Buspar®) sind wenn möglich immer 129 vorzuziehen wegen des immer bestehenden Risikos von EPMS und andere NW (Blutbildschäden) 130 Nebenwirkungen 1. Motorisch (extrapyramidal) ⇒ extrapyramidalmotorische NW v.a. bei hochpotenten, schwächer bei niedrigpotenten, gar nicht bei atypischen NL Empfohlene Behandlungsdauer: 2. Nervensystem ⇒ vegetative NW geringer bei Butyrophenonen • Nach erster Episode nach einigen Wochen Ausschleichversuch gerechtfertigt • Nach erstem Rezidiv Langzeitmedikation über mindestens ein Jahr • Bei drei oder mehr Rückfällen langjährige Neuroleptikatherapie 131 3. Innere Organe 4. Sinnesorgane 5. Psyche •Frühdyskinesien meist in der 1. Behandlungswoche Hyperkinesie der mimischen Muskulatur; Blick-, Zunge-, Schlundkrämpfe; Bewegungsstörungen der Extremitäten •Parkinsonoid erste 10 Tage, Rigor, Tremor, Akinesie, Rabbit-Syndrom, Anticholinergika dagegen •Akathisie, Tasikinesie Sitz- und Bewegungsunruhe, nach längerer Behandlung •Spätdyskinesien irreversible Folgen einer Langzeitbehandlung; Tics im Gesicht, Schaukelbewegungen, Bewegungsstörungen •Vegetativum α-sympatholytische und anticholinerge Wirkungen: Mundtrockenheit, Störung der Harnblasenfunktion, Obstipation, Ileus, Akkomodations-störungen, Kreislaufregulationsstörungen •ZNS zerebrale Krampfanfälle, Delir, selten malignes neuroleptisches Syndrom (Rigor, Stupor, Fieber,...) •Herz-Kreislauf Blutdruckregulation, EKG-Veränderungen, Arrhythmien, Thrombosen •Blutbild bei Phenotiazinen u.U. Leukopenie, Agranulozytose, ... •Leberfunktion Leberzellschädigung, Enzymanstieg •Hormonhaushalt Prolaktinfreisetzung, Libido-, Erektionsstörungen; Hemmung der Insulinsekretion •Auge Linsen- und Netzhauttrübung, •Haut allergische Veränderungen •Müdigkeit+Konzentrations -störungen 132 – Neuroleptika-induziertes Parkinson-Syndrom: Nebenwirkungen und Behandlungsmöglichkeiten: • • Rigor, Tremor, Akinese • Bildet sich nach frühestens 10 Tagen aus! • Sonderform Rabbit-Syndrom (hochfrequenter Lippentremor) E P M S (v. a. durch hochpotente NL und die Blockade der postsynaptischen Dopamin-D2-Rezeptoren) – Dyskinesien sind sehr gefürchtete Nebenwirkungen (unwillkürliche hyperkinetische Bewegungen, meist im Mundbereich, oft leichte Bewegungen an Fingern, Armen, Zehen oder Beinen) – Biperiden-Gabe – Akathisie (Unvermögen, ruhig zu sitzen, Trippelmotorik) • Erst nach Monaten der Behandlung • Zwingt zur Dosisreduktion oder zum Absetzen der Medikation • Merke: Biperiden hilft nicht!!! • Frühdyskinesien –10 - 30% bei Behandlungsbeginn –Blickkrämpfe –Zungen-Schlundkrämpfe –Hyperkinesen der mimischen Muskulatur –Bewegungsstörungen der Extremitäten » Biperiden-Gabe parenteral – Dystonien (kurz anhaltende oder auch fixierte abnorme Körperhaltungen, v.a. im Mundbereich, an den Augen, Hals und Rücken) – Sehr selten: malignes neuroleptisches Syndrom • Fieber, Stupor, Rigor • Wichtige DD: perniziöse Katatonie!!! • Cave: z.T. lebensbedrohliche Zustände • Spätdyskinesien –Meist irreversibel!!! (= nicht-umkehrbar) –Spätdyskinesien treten in bis zu 20% der Langzeitbehandelten Patienten mit klassischen N. auf, selten nach Langzeitbehandlung mit Atypika! –Gehäuft bei älteren und zerebral vorgeschädigten Patienten nach jahrelanger hochpotenter Neuroleptikabehandlung –Tics im Gesichtsbereich, Schaukelbewegungen des Körpers, verschiedenste Formen von Bewegungsstörungen, oft auch nur diskret, oft vom Patienten selber gar nicht bemerkt! –Ursache: Überempfindlichkeit der postsynaptischen Dopaminrezeptoren 133 Merke: Biperiden (Akineton) ist wirkungslos!!! Teilweise Besserung durch Tiaprid (Delpral®) oder Benzodiazepine EPMS – sofortiges Absetzen aller Neuroleptika – Dopamin-Agonisten-Gabe: » Dantrolen oder Lisurid • • • • • Gewichtszunahme unter Neuroleptikatherapie RR-Abfall Selten: Leukopenien, Leukozytosen, Lymphozytosen Sehr selten: Agranulozytose (Leponex®) Andere NW von Neuroleptika in Bezug zu deren Profil: – anticholinerg – antihistaminerg – antiadrenerg 134 EPMS Definition • Unter dem extrapyramidalmotorischem System versteht man alle ins Rückenmark ziehenden motorischen Bahnen, die nicht der Pyramidenbahn (ist beidseits an der Unterseite der Medulla oblongata als seichter Längswulst (Pyramis, Pyramide) sichtbar; für Feinmotorik und willkürliche Motorik zuständig) angehören. Aktivierung des extrapyramidalmotorischen Systems • Das extrapyramidalmotorische System wird zum einen über Kollateralen der Pyramidenbahn, zum anderen von prämotorischen und supplementärmotorischen Cortexarealen aktiviert. Zum extrapyramidalmotorischen System gehören… Tractus rubrospinalis Dieser Tractus wirkt vor allem aktivierend auf die Flexoren und hemmend auf die Extensoren. Er kann als einziges extrapyramidalmotorisches System an der Feinmotorik beteiligt sein. Tractus vestibulospinalis Er wirkt aktivierend auf die Motoneurone der Extensoren und hemmt die der Flexoren. Tractus reticulospinalis Medialer Reticulospinaltrakt Er wirkt ebenfalls aktivierend auf die Extensoren und hemmend auf die Flexoren. Lateraler Reticulospinaltrakt 135 Dieser Trakt aktiviert Flexoren und hemmt Extensoren. Funktion des extrapyramidalmotorischen Systems • Die Bahnen des extrapyramidalmotorischen Systems aktivieren vor allem die proximale Rumpf- und Extremitätenmuskulatur. Sie bewirken daher vor allem Massenbewegungen im Rumpf und den Extremitäten und sind daher Grundlage für die durch die Pyramidenbahn ausgelösten Bewegungen. • Jede differenzierte Bewegung in der Hand erfordert stets auch eine Bewegung des Oberarms, welche durch das extrapyramidalmotorische System erfolgt. 136 Kontraindikationen für die Verwendung von Neuroleptika: • Akute Intoxikationen mit zentral dämpfenden Substanzen und Alkohol • Ggf. Prostatahypertrophie und Pylorusstenose bei N. mit anticholinerger Wirkkomponentebei Leukopenien in der Anamnese keine Verabreichung von Clozapin oder trizyklischen N. Therapie der Schizophrenie: • Atypische NL sollten als Arzneimittel der ersten Wahl bei der Behandlung der Akutphase erwogen werden!!! (Dies führt wegen der besseren Verträglichkeit zur deutlichen Verbesserung der "Compliance") • Bei zusätzlicher psychomotorischer Erregung zusätzliche Gabe von Benzodiazepinen • Nur bei zusätzlichem aggressivem Verhalten "typische" NL + Benzodiazepine! – Zur Abwägung zwischen "atypischen" und "typischen" Neuroleptika: • Klassische Neuroleptika haben im Akutbereich nach wie vor ihre wichtige Bedeutung • Atypische Neuroleptika haben aber einen positiven Einfluss auf – Prognose • Soziale Integration und Lebensqualität, weswegen sie, wenn immer möglich vorzuziehen sind --> Compliance-Verbesserung 137 138 – Hochakute Psychose: • Statt der Kombination von hoch- und niederpotentem Neuroleptikum sollte, außer bei Suchtpatienten die Kombination eines hochpotenten N. mit einem Benzodiazepin wenn möglich vorgezogen werden. • Wechsel des Neuroleptikums erst nach vergeblicher Auftittrierung und Therapieversagen von 4 - 6 Wochen! • Bei Therapierefraktärität unbedingt Versuch mit Clozapin! • Therapie der unmittelbaren Akutsituationen: 139 • Hoch- oder mittelpotentes N., z.B. 5 - 10mg Haldol, ggf. kombiniert mit 100mg Nozinan, oder Clopixol (Zuclopenthixol) (Ciatyl-Z) 75 150mg als Akutphase i.m. oder oral 20-40mg • Merke: bei unklarem Erregungszustand und fraglicher Intoxikation immer Haldol nehmen! – Katatoner Stupor: • Neuroleptika und Benzodiazepine (Lorazepam) • Bei Therapieresistenz: frühzeitig EKT! – Perniziöse Katatonie: • Sofortiges Absetzen des Neurolepikums • Erhaltungsphase (mindestens 6 Monate empfohlen): – Erhaltungsdosierung – Spätestens jetzt Umstellungsversuch auf atypisches N.! – Bei wiederholten Rezidiven sollte die Erhaltungstherapie über mindestens 2 - 3 Jahre fortgesetzt werden. 140 Therapie der schizoaffektiven Störungen: • Langzeittherapie: – Besondere Beachtung des Risikos von Spätdyskinesien – Verwendung atypischer N. wenn möglich • bei schizomanischem Syndrom mit stark erregten Patienten ist der kombinierte Einstieg mit Lithium + NL besser wirksam als eine Monotherapie • Bei chronisch-produktiven Psychosen erfolgt eine symptomsuppressive Dauerbehandlung mit Neuroleptika • Die postpsychotische Depression ist in der Regel einer medikamentösen Therapie zugänglich: • bei schizodepressivem Syndrom ist eine Monotherapie mit NL der Kombinationsbehandlung mit einem Antidepressivum im Akutstadium vorzuziehen – Wenn möglich Reduktion der Neuroleptikadosis – Ggf. Gabe von Antidepressiva – Bei V. a. akinetische Depression im Rahmen eines Parkinsonoids Gabe von Biperiden (Akineton®) 141 Non-Responder (=kein Ansprechen auf Neuroleptikabehandlung): Abschwächende Wirkung auf Neuroleptika haben folgende Substanzen: • • • • • • • 142 Kaffee Schwarztee Manche Fruchtsäfte Milch Antacida Rauchen!!! (durch Enzyminduktion) Antikonvulsiva (Abnahme der HaldolPlasmakonzentration um 50% bei gleichzeitiger Gabe von Carbamazepin!!!) 143 • Anteil ca 30%!!! • Negative Prädiktoren: – Frühes Erstmanifestationsalter – Schleichender Erkrankungsbeginn – Gestörte prämorbide Persönlichkeit – Lange Dauer produktiv-psychotischer Symptomatik – Schlechtes Ansprechen auf Neuroleptika in der ersten Behandlungswoche 144 Antidepressiva • So wie bei der medikamentösen Behandlung der paranoidhalluzinatorischen Psychosen der Neurotransmitter Dopamin im Mittelpunkt steht, so sind es bei der Behandlung der Depressionen das Noradrenalin und das Serotonin, seltener Dopamin. • Im Gegensatz zur der Blockade der Neuroleptika an den Dopaminrezeptoren, ist bei den Antidepressiva gerade eine Vermehrung der Transmitter im synaptischen Spalt der gewünschte Effekt. • Das erste Antidepressivum war das Imipramin (Tofranil), das 1957 erstmals von dem Schweizer Psychiater Kuhn bei Patienten angewandt wurde, die an einer schweren Depression litten. Er konnte eine allmählich einsetzende Stimmungsaufhellung (thymoleptisch) und eine Antriebsteigerung (thymeretischen) beobachten. • Darunter befinden sich die noch heute gebräuchlichen Präparate trizykl. AD. wie Amitriptylin (Saroten®), Clomipramin (Anafranil®), Doxepin (Sinequan®). Später wurden Substanzen entwickelt, die vorwiegend das Noradrenalin beeinflussten Maprotilin (Ludiomil®)→Tetrazyklika Aus der Grundsubstanz Imipramin wurden durch geringe chemische Veränderungen zahlreiche Antidepressiva mit verschiedenen Wirkprofilen entwickelt. In den letzten Jahren sind zunehmend selektive Serotoninwiederaufnahmehemmer (SSRI), wie das Fluctine® (Fluoxetin) zum Einsatz gekommen. Neuere Entwicklungen haben wieder Einfluss auf Noradrenalin und Serotonin, jedoch mit einem anderen Nebenwirkungsspektrum, als die Antidepressiva der ersten Generation. Der diesen Substanzen zugehörige Effekt auf die Cholinrezeptoren erklärt die Nebenwirkungen. https://www.youtube.com/watch?v=zKsFQKtscVM 145 146 Was sind Antidepressiva? Antidepressiva sind wörtlich übersetzt gegen ("anti") Depressionen wirkende Medikamente. Die Ursache bestimmter Depressionen ist ein Mangel an bestimmten Botenstoffen des Hirnstoffwechsels. Antidepressiva vermehren die Menge dieser Botenstoffe. Sie sollen stimmungsaufhellend, angstlösend und beruhigend wirken. Bei Antriebsstörungen sollen sie ausgleichend aktivierend oder dämpfend wirken. ►Die stimmungsaufhellende Wirkung setzt in der Regel erst nach einigen Wochen ein. Deshalb ist es wichtig, Antidepressiva über einen genügend langen Zeitraum (mindestens vier Wochen) einzunehmen, bevor man wegen scheinbarer Wirkungslosigkeit ein anderes Präparat versucht oder die Therapie ganz beendet. Antidepressiva werden nach ihrer chemischen Struktur und ihrem Wirkungsmechanismus eingeteilt. Die beiden wichtigsten Gruppen sind die sogenannten trizyklischen Antidepressiva und die selektiven Serotonin-WiederaufnahmeHemmstoffe. Daneben gibt es noch mehrere andere Substanzgruppen. 147 148 Einteilung der Antidepressiva Machen Antidepressiva abhängig? • Klassische trizyklische AD Antidepressiva machen NICHT abhängig. Sie unterscheiden sich in ihrer chemischen Struktur und Wirkungsweise deutlich von suchterzeugenden Stoffen. Sie können also auch über einen langen Zeitraum eingenommen werden, ohne dass sich eine Sucht entwickelt! – Imipramin – Amitriptylin • Tetrazyklische AD – Mianserin – Maprotilin • und modifizierte trizyklische AD – Lofepramin • SSRI – – – – – Fluvoxamin Fluoxetin Paroxetin Citalopram Sertralin 149 150 • Noradrenalin-selektive Rückaufnahme-Inhibitoren (NARI) Antidepressiva • Reboxetin Einteilung • Serotonin-Noradrenalin-selektive AD (SNRI) • Milnacipran • Venlafaxin • trizyklische AD • tetrazyklische AD •Monoaminoxidasehemmer • MAO-Hemmer • Irreversibel (Tranylcypromin) • Reversibel (MAO-A, RIMA; z.B. Moclobemid) ältere AD • serotoninselektive AD • Serotoninrezeptor-Antagonist und RI (SARI) • Trazodon 3 Grundtypen nach dem klinisch-therapeutischen Wirkprofil bei den Tricycl. AD • Noradrenerges und spezifisch serotonerges AD (NaSSA) - Mirtazapin • Aminpräkursoren (L-Tryptophan) • Atypische AD (Sulpirid, Trimipramin) • Omega-3-Fettsäure Eicosapentaensäure (EPA) • Phytopharmaka (z.B. Johanniskraut) •Amitryptilintyp sedierend-dämpfend •Imipramintyp psychomotorisch stabilisierend/neutral •Desipramintyp psychomotorisch aktivierend, antriebssteigernd → Auswahl je nach Symptomatik 151 152 Serotonin-Wiederaufnahmehemmer (SRI) Trizyklische Antidepressiva Trizyklische SRI wirken vor allem als Serotonin-Wiederaufnahmehemmer. Wirkstoffe sind: Clomipramin (Anafranil®). nicht selektive Monoamin-Wiederaufnahme-Hemmer (NSMRI) Noradrenalin-Wiederaufnahmehemmer (NRI) Trizyklische Antidepressiva, kürzer Trizyklika, leiten ihren Namen (trizyklisch – v. griech.: drei Ringe) von der dreifachen Ringstruktur dieser Wirkstoffe ab. Strukturelle und damit auch neurophysiologische Unterschiede zeigen sich in der Substitution und in den Seitenketten dieser Aromate. Das erste trizyklische Antidepressivum Imipramin (Tofranil®)wurde 1956 von Ciba-Geigy entwickelt. Als weitere Substanzen folgten zum Beispiel Clomipramin (Anafranil®) und Amitriptylin (Saroten®). Sie greifen in mehrere Neurotransmittersysteme gleichzeitig ein, indem sie die Wiederaufnahme von Serotonin, Noradrenalin und Dopamin hemmen und auf Azetylcholin-, Histamin- oder auch Adrenozeptoren wirken. Daher sind bei trizyklischen Antidepressiva auch die Nebenwirkungen vielfältig. Trizyklische Antidepressiva Trizyklische NRI wirken vor allem als Noradrenalin-Wiederaufnahmehemmer. Wirkstoffe sind: Desipramin (Pertofran®), Nortriptylin (Nortrilen®). Daneben noch Maprotilin (Ludiomil®) – als Trizyklikum aufgefasst. Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI) Trizyklische SNRI wirken vor allem als Serotonin-und-NoradrenalinWiederaufnahmehemmer. Wirkstoffe sind: Amitriptylin (Saroten®), Doxepin (Sinequan®), Imipramin (Tofranil®), Opipramol (Insidon®). TZA mit unsicherem Wirkmechanismus Trimipramin (Stangyl®) ist ein trizyklischer Wirkstoff, bei dem die hauptsächliche monoaminerge Wirkkomponente noch nicht sicher geklärt werden konnte. Es blockiert im ZNA verschiedene Serotonin-, Dopamin- und α-Adrenorezeptoren. Die Monoamin-Rückaufnahme aus dem synaptischen Spalt in die 154 präsynaptischen Vesikel wird nicht beeinflusst. Bei den tetrazyklischen Antidepressiva (TetraCA) wird durch den vierten Ring die räumliche Struktur der anderen drei Ringe positiv zugunsten der antidepressiv wirksamen Konformation stabilisiert. Die tetrazyklischen Antidepressiva sind sowohl in ihrer Wirkung als auch Struktur (sie haben ja auch drei Ringe neben dem vierten, sind also in gewisser Weise trizyklisch) den trizyklischen sehr ähnlich; einige Substanzen (zum Beispiel Maprotilin) beeinflussen insbesondere das Noradrenalin stärker. Trotz ihrer engen Verwandtschaft zu den Trizyklika werden sie nicht einfach unter diesen subsummiert und in der Praxis auch nicht in eine eigene Gruppe der Tetrazyklika zusammengefasst. Vielmehr werden sie einzeln in die Gruppen Noradrenerges Antidepressivum mit Hemmung präsynaptischer Alpha-2-Rezeptoren (Mianserin) und Noradrenerges und spezifisch serotonerges Antidepressivum (Mirtazapin) eingeordnet oder – im Falle von Maprotilin – als Einzelsubstanz stehen gelassen; Maprotilin kann jedoch wirkungsmäßig sehr gut den trizyklischen Noradrenalin-Wiederaufnahme-Hemmern zugeordnet werden. 155 Selektive Wiederaufnahmehemmer Selektive Serotonin-/Noradrenalin-Wiederaufnahmehemmer (SSNRI) Selektive Serotonin-Wiederaufnahmehemmer (SSRI) Die SSRI blockieren speziell die Rezeptoren, die für die Wiederaufnahme des Botenstoffes Serotonin zuständig sind. Wirkstoffe dieser Gruppe sind zum Beispiel Fluvoxamin (Floxyfral®), Fluoxetin (Fluctine®), Citalopram (Seropram®), Escitalopram (Cipralex®), Paroxetin (Seroxat®) und Sertralin (Gladem®/Adjuvin®/Tresleen®). Selektive Noradrenalin-Wiederaufnahmehemmer (SNARI, SNRI) Die Serotonin-Noradrenalin-Wiederaufnahmehemmer (SSNRI) hemmen die Wiederaufnahme von Serotonin und Noradrenalin. Einsatzgebiete sind Depressionen und Angststörungen. Wirkstoffe sind Venlafaxin (Efectin®), Duloxetin (Cymbalta®) und Milnacipran (Ixel®). Selektive Noradrenalin-/Dopamin-Wiederaufnahmehemmer (SNDRI) Die NDRI hemmen die Wiederaufnahme von Noradrenalin und Dopamin. Einsatzgebiete sind Depressionen, vor allem bei Antriebsschwäche. Die bisher einzigen Wirkstoffe in dieser Klasse sind Bupropion (Wellbutrin XR®) und Methylphenidat (Ritalin®, Concerta®), wobei letzteres für die antidepressive Therapie keine Zulassung hat. Die NARI hemmen den Transporter, der Noradrenalin nach erfolgter Signalübertragung natürlicherweise wieder zu den Speicherplätzen zurückbefördert. Noradrenalin verbleibt länger am Wirkort, und seine Wirksamkeit als Signalüberträger steigt. Wirkstoffe dieser Gruppe sind zum Beispiel Reboxetin (Edronax®). Anwendungsgebiete sind akute depressive 157 Erkrankungen, darunter mit Antriebsstörungen einhergehende Depressionen. 158 Andere monaminerge Antidepressiva Noradrenerges Antidepressivum mit Hemmung präsynaptischer Alpha-2-Rezeptoren Diese Medikamente wirken durch die Blockade von inhibitorischen präsynaptischen Auto-Rezeptoren des Alpha-2-Rezeptortyp und bewirken dadurch eine verstärkte Ausschüttung von Noradrenalin. Vertreter dieser Gruppe sind die tetrazyklischen Antidepressiva Mirtazapin (Mirtabene®) und Mianserin (Tolvon®). Noradrenerges und spezifisch serotonerges Antidepressivum (NaSSA) Bei Depressionen (besonders bei Hemmung, Gewichtsverlust, Schlafstörung und Ängsten), wirken meist sedierend, teilweise werden NaSSA auch als Schlafmittel eingesetzt. Wirkstoffe: zum Beispiel Mirtazapin. Serotonin-(5-HT2)-Antagonist-und-Wiederaufnahmehemmer (SARI) Ein Wirkstoff aus dieser Gruppe ist das Trazodon (Trittico®). Es wird eingesetzt zur Behandlung von Depressionen unterschiedlicher Ätiologie mit oder ohne Angstkomponente, anhaltenden Schlafstörungen bei Depressionen sowie zur Behandlung von im Rahmen von Depressionen auftretenden erektilen 159 Dysfunktionen ohne schwerwiegende organische Ursachen. Dual-synaptische Antidepressiva (DSA) Wirken als 5-HT2A-Antagonisten und präsynaptische 5-HT-(Rück-)TransporterInhibitoren. Wirkstoff: Nefazodon. Ist wegen einiger Fälle schweren Leberversagens vom Markt genommen worden. Serotonin-Wiederaufnahmeverstärker (SRE = Serotonin Reuptake Enhancer) Serotonin-Wiederaufnahmeverstärker erhöhen die SerotoninRückaufnahme aus dem synaptischen Spalt und steigern die Feuerungsrate der Neuronen im Hippocampus. Bei Depressionen, ängstlich-depressiven Zustandsbildern, Somatisierung von Depression und Angst, Angst/Depression bei Alkoholabhängigkeit und älteren Patienten. Wirkstoff: Tianeptin (Stablon®). 160 Wirkungsmechanismus wirken auf biogene Amine • o Serotonin-(5-HT2)-Antagonist und Melatonin-(MT1- und MT2)Agonist Agomelatin (Valdoxan®) wirkt agonistisch auf die melatonergen MT1- und MT2Rezeptoren und antagonistisch auf die serotonergen 5HT2C-Rezeptoren. Die dem Melatonin strukturell verwandte chemische Verbindung aus der Gruppe der Antidepressiva wird in der Behandlung von Episoden einer Major Depression bei Erwachsenen eingesetzt. • • • • • • • • • 161 Was bewirkt ein Antidepressivum? Erhöhung der Konzentration von NA und Serotonin im synaptischen Spalt durch Rückresorptionshemmung oder Hemmung des enzymatischen Abbaus (MAO-Hemmer) Empfindlichkeitsveränderung der Rezeptoren (längerfristig: Wirklatenz) ⇒ Grundlage: Depressionen durch Erniedrigung oder Dysbalance von Noradrenalin und Serotonin β-downregulation: Empfindlichkeit und Anzahl wird reguliert; neuere Theorie ⇒ Grundlage: Depression durch Überempfindlichkeit katecholaminerger Rezeptoren in bestimmten Hirnarealen (auch: Serotoninrezeptoren), 5-HT-1a-UpRegulation Abnahme präsynaptischer α2-Autozeptoren durch den Abbau wird die negative Rückkoppelung, die normalerweise die weitere Ausschüttung hemmt, unterbunden! Folge: vermehrte Synthese, Sekretion und Wirkung ⇒ hierauf beruht nach neueren Annahmen die Hauptwirkung der trizyklischen AD zu beachten Wirklatenz (langsame Dosissteigerung) falls auch nach längerer Zeit keine Wirkung: Umstellen auf anderes AD nach 6 Monaten ausschleichend absetzen, falls keine Langzeitbehandlung bei wiederholten Phasen Lithium- (bipolar) oder AD-Prophylaxe (unipolar) 162 Unerwünschte Wirkungen trockener Mund Herzrhythmusstörungen Schwindel Erhöhung des Augeninnendruckes (Grüner Star) Verstopfung Harnverhalten Stimmungsaufhellung Antriebsteigerung Verringerung von Angst Verbesserung des Schlafes Beruhigung Appetitsteigerung Schmerzlinderung Der antihistaminerge Effekt sorgt für Müdigkeit, die jedoch bei längerem Gebrauch des Medikaments nachläßt. SSRI können zu Beschwerden des Magen-Darm-Traktes mit Übelkeit, Erbrechen, Unruhe, Reizbarkeit und Schlafstörungen führen. Selten werden motorische Syndrome, wie Akathisie und Dyskinesen gesehen. 163 164 Wirkungen Einsatzgebiete der Antidepressiva 1. depressionslösend 2. psychomotorisch aktivierend 3. psychomotorisch dämpfend Nebenwirkungen depressive Syndrome, unabhängig von der Ursache Panikstörungen generalisierte Angststörungen Klaustrophobien/ Agoraphobien Zwangsstörungen Essstörungen Schlafstörungen Chronic fatigue syndrome Prämenstruell dysphorisches Syndrom Somatoforme Störungen Schmerzsyndrome Entzugstherapien (Alkohol und illegale Drogen) 165 Nebenwirkungen: Die NW im Sinne unerwünschter Wirkungen richten sich nach dem Ausmaß der Blockade postsynaptischer Rezeptoren: Mundtrockenheit, Schwitzen, Obstipation, Miktions- und Akkomodationsstörungen; selten Harnsperre, Ileus, Glaukomanfall neurologisch Tremor, Dysarthrie, selten (bei hohen Dosen) Dyskinesie, zerebrale Krampfanfälle kardiovaskulär Tachykardie, Hypotonie, Schwindel, Störungen der Erregungsleitung am Herzen psychisch Unruhe, Aktivierung suizidaler Impulse, Müdigkeit, selten Umkippen in Wahn, Manie, Verwirrtheit, Delir endokrin Gewichtszunahme, Potenz- und Libidostörungen, Amenorrhoe dermatologisch, allergisch Ödeme, Exantheme 166 Nebenwirkungen am Beispiel einiger Substanzen und Substanzgruppen Nebenwirkungen • SSRI und AD mit anticholionerger Wirkkomponente führen gehäuft zu sexuellen Funktionsstörungen • TZA – Muskarinische Ach-Rezeptoren • Akkommodationsstörungen, Mundtrockenheit, Verstopfung, Sinustachykardie, Miktionsstörungen, kognitive Störungen bis hin zu Verwirrtheit und Delir (zentrales anticholinerges Syndrom) – Therapie der Blasenentleerungsstörung oder Darmatonie: » Carbachol (Doryl®) » Distigmin (Ubretid®) – Therapie der Tachykardie: » ß-Blocker – Histamin-1-Rezeptoren • Müdigkeit, Sedation, Gewichtszunahme, Verwirrtheit – 5-HT2-Rezeptoren • Gewichtszunahme, Anxiolyse, Sedation – DA-Rezeptoren • Prolaktinanstieg, Libidoverlust, EPMS-Störungen – α1-adrenerge Rezeptoren • orthostatische Hypotonie, Schwindel, Müdigkeit, reflektorische Tachykardie – Therapie der orthostatischen Hypotonie: » Dihydroergotamin (Dihydergot®) vegetativ anticholinerg 167 – Wichtigste kardiale Wirkung derTZA ist die Verlangsamung der Erregungsleitung im Herzen (His-Purkinje-System)!!! » Auch unter normalen Dosierungen können verlängerte QT-Zeiten und ein verlängerter QRS-Komplex auftreten!!! » regelmässige EKG-Kontrollen und vor Einstellung » einschleichend dosieren! » möglichst keine TZA bei älteren Menschen mit kardialer Vorschädigung verwenden – Trizyklika haben auch chinidinartige Wirkungen » Antiarrhythmisch, aber auch proarrhythmogen!!! » Regelmäßige EKG-Kontrollen und vor Einstellung – TZA senken die Krampfschwelle » gehäuft generalisierte Krampfanfälle unter TZA – TZA führen oft zu allergischen Exanthemen, die zum Präparatewechsel zwingen – Cave: Suizidalität (Gefahr der suizidalen Intoxikation) » nur kleinste Packungsgröße verschreiben » eher SSRI geben bei Gefahr des Missbrauchs 168 • Mianserin (Tolvon®) – Ein Medikament der Wahl, wenn ein sedierendes und wenig kardiotoxisches Antidepressivum bei älteren und kardial vorgeschädigten Patienten eingesetzt werden soll. • MAO-Hemmer – Irreversibler MAO-Hemmer Trancylpromin » Tyraminarme Diät zur Vermeidung von hypertonen Krisen – Reversibler MAO-Hemmer (z.B. Moclobemid) » Keine klinisch relevante Wechselwirkung mit Lebensmitteln und Medikamenten » Keine tyraminarme Diät erforderlich » Unruhe und Schlafstörungen als NW » kontraindiziert bei agitierten Depressionen!!! » Nur geringe Toxizität » Agranulozytoserisiko » regelmässige BB-Kontrollen – SSRI » Keine anticholinergen NW » Häufige NW: Unruhe und Übelkeit » Wesentlich weniger giftig als TZA bei Überdosierung! » Häufig sexuelle Funktionsstörungen (verzögerte Ejakulation, seltener auch Libidominderung und Orgasmusstörungen) » evt. Wechsel auf Substanzen mit gleichzeitigem 5-HT2Antagonismus: Mirtazapin (Remeron®, Mirtabene®) 169 – sehr selten kann es unter AD zu einem SIADH kommen: » konzentrierter Urin » Hyponatriämie und verminderte Serumosmolalität » Körperliche Schwäche, Lethargie, Gewichtszunahme! » Kopfschmerzen bis Verwirrtheit, Krampfanfälle und Koma! » Absetzen des AD, evt. Präparatewechsel » engmaschige Elektrolytkontrolle – Induktion einer hypomanischen Phase durch AD bzw. Induktion eines "rapid cycling" durch TZA möglich – Suizidalität: » TZA können durch die Steigerung des Antriebs vor Einsetzen der Stimmungsaufhellung in den ersten Behandlungswochen Suizidalität verschlimmern! » SSRI haben eher einen suizidprotektiven Effekt » Bei Einstellung mit AD (v.a. TZA) und bestehender Suizidalität immer Kombination mit Benzodiazepinen!! – Eine gefürchtete Intoxikationserscheinung mit TZA ist die lebensbedrohliche kardiale Arrhythmie 171 – Noradrenerg und selektiv serotonerge AD (Mirtazapin) » Keine anticholinergen NW » Müdigkeit, Appetitsteigerung, Leukopenie, Ödeme – Serotonin- Noradrenalin-Wiederaufnahmehemmer (Venlafaxin) » Übelkeit, Agitiertheit, RR-Anstieg – Selektiv noradrenerge AD » Keine anticholinerge NW » Schlaflosigkeit, Schwitzen, Miktionsstörungen (Reboxetin) Bei schlagartigem Absetzen von AD kann es sowohl bei TZA, als auch bei SSRI zu einem "Absetzsyndrom" mit spontaner Rückbildung innerhalb weniger Tagekommen: » Schwindel » Gangunsicherheit » Übelkeit, Erbrechen » Grippeähnliche Symptome » Sensible Störungen (Elektrisiergefühl, Parästhesien) » Schlafstörungen » Psychische Störungen wie Gereiztheit, depressive Verstimmungen, Unruhe, Konzentrationsstörungen, mnestische Störungen bis Verwirrtheit 170 » Vorbeugung: ausschleichendes Absetzen von AD Indikationen Depression • A D hier stimmungsaufhellend, antriebssteigernd, antriebdämpfend, • Zielsyndrome: agitiert-ängstlich, gehemmt-depressiv Syndrom Medikation schwere Depression zunächst trizyklische AD, dämpfend oder aktivierend leichte Depression (ambulant) oft nicht-trizyklische AD, niedrig dosiert zusätzlich Wahn zusätzlich NL ängstlich-unruhig sedierende AD • trizyklische AD können auch bei chronisch verlaufenden Depressionen gegeben werden • pharmakologische Dissektion (bei atypischen Depressionen mit erhaltener emotion. Schwingungsfähigkeit wirken MAO-Inhibitoren besser; Bedeutung der Therapieresponse als Klassifikationskriterium) Panikstörung Generalisierte Angststörung Zwangserkrankung (v. a. SSRI) Phobien Eßstörungen chronische Schmerzen 172 Entzugssyndrome Kontraindikationen: Kontraindikation • Alle AD sind kontraindiziert bei: akute Alkohol- oder Medikamentenvergiftung Delirien Myokardinfarkt bestimmte Epilepsieformen Pylorusstenose Harnverhalt Herzerkrankungen Engwinkelglaukom Prostatahypertrophie Keine Kombination von tri- und tetrazyklischen AD mit (irreversiblen) MAO-Hemmern begleitend möglich: Benzodiazepine oder schwachpotente NL – Akuter Alkohol- und Medikamentenvergiftungen – Delir – Harnverhalt • Trizyklika(anticholinerge Wirkkomponente) – – – – – – – Unbehandeltes Engwinkelglaukom Pylorusstenose Störung der Harnentleerung Prostatahypertrophie mit Restharnbildung Paralytischer Ileus Höhergradige AV-Blockierung St.n. akutem Myokardinfarkt • SSRI – Nicht zusammen mit MAO-Hemmern, L-Tryptophan und Triptanen (Migränemittel) – Umstellung SSRI irreversibler MAO-Hemmer und umgekehrt nur mit 14tägigem Intervall !!! • Bei zerebralen Krampfanfällen in der Vorgeschichte Vorsicht mit – TZA und – Maprotilin (Ludiomil®) 173 • Schwangerschaft und Stillzeit Antidepressiva Antidepressiva Wirkstoff: Citalopram • • • • • • • • • • • • • Citalopram "Torrex" Citalopram Sandoz Citalopram "Areana" Citalopram "Generieon" Citalopram "Hexal" Citalopram "Interpharm" Citalopram 174 Wirkstoff: Fluoxetine • • • • • • • • • • • • "Pharma & Co" Citalopram "1A Pharma" Citalopram "ratiopharm" Citalopram Sandoz Citalostad Citareana Citor Eostar Pram Seropram • • • • • • • • • • • Felicium Floeein Fluetine Dura Pae Fluetine Fluoxenorm "Generieon" Fluoxetin "Generieon" Fluoxetin "Lannaeher" Fluoxetin "Areana" Fluoxetine "Stada" Fluoxetin "Generieon" Fluoxetin "Lilly" Fluoxetin • • • • • • • • Wirkstoff: Fluvoxamin • • • 175 "1A Pharma" Fluoxibene Fluoxistad Flux "Hexal" Fluxil FluxoMed Mutan NuFluo Positivum Felixsan Floxyfral Fluvoxamin "1A Pharma" 176 Antidepressiva Wirkstoff: Mianserin • • • Mianserin "Areana" Mianserin "ratiopharm" Tolvon Wirkstoff: Milnacipran • Daleipran, Ixel Wirkstoff: Duloxetin • Ariclaim, Cymbalta, Xeristar, Yentreve Antidepressiva Wirkstoff: Mirtazapin • • • • • • • • • Lanazapin Mirtabene Mirtabene "ratiopharm" Mirtaron Mirtazapin Sandoz Mirtazapin "Alter nova" Mirtel Remeron Remeron SolTab 177 Wirkstoff Paroxetin • • • • • • • • • • • • • • • • Allenopar Ennos Glaxopar Paluxetil Paroeetan Paroglax Paroxat Paroxetin "Merkle Paroxetin "Allen" Paroxetin "Areana" Paroxetin "GSK Paroxetin "Interpharm" Paroxetin "Pharma & Co" Paroxetin "1A Pharma" Paroxetin "ratiopharm" Paroxetin "Salutas" Paroxetin Sandoz Seroxat Wirkstoff Escitalopram • Cipralex, Entaet Wirkstoff Bupropion • Wellbutrin XR 178 Behandlungseinstieg und Verlauf: Antidepressiva • Zunächst Erstellen eines Gesamtbehandlungsplanes mit Wahl des Schwerpunktes: Psychotherapie oder Medikation • Vermittlung eines (auch biologischen) Krankheitsmodells, z.B. Depression als "Stoffwechselstörung" des Gehirns, zur Verbesserung der Compliance für die medikamentöse Therapie • Aufklärung über die zu erwartenden NW und über die zu erwartende Wirkungslatenz von 2 Wochen • Immer vorweg Wirkstoff Reboxetin • Edronax® • Reboxetine® "Pharmaeia & Upjohn" Wirkstoff Sertralin • Gladem® • Sertralin® "ratiopharm" • Tresleen® Wirkstoff Venlafaxine • Efectin ER®, Efectin® – – – – – – 179 Kardiale Vorbelastungen abklären Prostatahypertrophie, Harnentleerungsstörungen abklären Krampfanfälle in der Vorgeschichte abklären Labor (BB, Leber- und Nierenwerte) EKG machen, um Überleitungsstörungen auszuschließen EEG (bei TZA – RR, Puls 180 Bei anderen AD: Im Verlauf: – BB, Leber- und Nierenwert-Kontrolle sowie EKG und EEG nach einem Monat, dann halbjährlich – Bei allen AD regelmäßige Routineuntersuchungen notwendig: • Medikamentöse Rezidivprophylaxe meist jahrelang, oft lebenslang notwendig, da die Depression eine rezidivierende Erkrankung ist!!! • Bei TZA: – In den ersten drei Monaten 14tägig BB (Ausnahme: Mianserin (Tolvon®): wöchentlich in den ersten Monaten), danach monatlich über die Dauer eines halben Jahres, anschließend vierteljährig – Leber- und Nierenwerte in den ersten drei Monaten monatlich, anschließend vierteljährlich – Kontroll-EKG nach einem Monat, bei Menschen > 60J. halbjährlich weitere Kontrollen – Kontroll-EEG nach einem Monat – Monatlich RR und Puls • Wenn nach 4 Wochen unter ausreichender Dosierung keine Wirkung erzielt wird, sollte das AD gewechselt werden • Nach 4 Wochen ausgebliebener Wirkung spricht man von Nichtansprechen auf ein AD • Erst nach frustranen Versuchen mit 2 Antidepressiva über jeweils 4 Wochen kann von Therapieresistenz gesprochen werden. 181 182 Interaktionen: • Pharmakokinetische Interaktionen Mögliche Maßnahmen bei Therapieresistenz: – Cave mit einigen SSRI, die bei Komedikation die Wirkungen der anderen Medikamente abschwächen oder (meist) erheblich verstärken!! – Dosiserhöhung, evt. Drug monitoring – Präparatewechsel – Kombination zweier AD mit unterschiedlichen Wirkprofilen (KI beachten!!) • Bewährt hat sich die Kombination von Amitriptylin mit langsam steigenden Dosen von Tranylcypromin – Vorsicht mit Kombinationstherapien bei diesen Medikamenten • Pharmakodynamische Interaktionen – Cave: Keine Kombination von MAO-Hemmern mit – Lithium-Augmentation – Kombination eines AD mit Schlafentzugstherapie – Hochdosierte Gabe von MAO-Hemmern (Tranylcypromin >40mg) führt oft zum Erfolg! • SSRI wegen der synergistischen Effekte und der Gefahr eines zentralen Serotoninsyndroms • TZA wegen der Gefahr toxischer Effekte mit nachfolgender zentraler Hyperaktivität biogener Amine, die symptomatisch ähnliche Auswirkungen haben wie das Serotoninsyndrom – Nur Monotherapie mit MAO-Hemmern – bei Präparatewechsel Sicherheitsabstände beachten: » Wechsel von/auf SSRI: • Irreversible MAO-Hemmer sollen mindestens 2 Wochen vor Beginn einer Therapie mit einem SSRI abgesetzt werden. Umgekehrt soll nach Therapie mit einem SSRI eine Karenzzeit von einigen Tagen (mindestens 5 x t1/2, bei Fluoxetin (Fluctine®) mindestens 5 Wochen!!!) eingehalten werden, bis ein MAO-Hemmer verordnet wird. • Cave: Aufklärung über Risiken und Diätvorschriften – Kombination von AD + T3 – Anafranil-Infusionen – EKT (Elektrokrampftherapie) • Fluoxetin (Fluctine®) • Fluvoxamin (Floxyfral®) • Paroxetin (Seroxat®) 183 » Wechsel von/auf TZA oder andere AD: » Karenzzeit 14 Tage nach Absetzen des MAO-Hemmers bzw. 7 Tage184 nach Absetzen des TZA MAO-Hemmer ►hemmen das Enzym Monoaminoxidase (MAO) und hemmen auf diese Weise den Abbau von biogenen Aminen. Dieses Enzym baut die Botenstoffe Serotonin, Dopamin, Noradrenalin und Adrenalin ab. Werden MAO-Hemmer eingenommen, steigt daher die Konzentration dieser Substanzen an. • irreversible Hemmung synaptischer der Isoenzyme MAO-A (Abbau von Serotonin und Noradrenalin) und MAO-B (Abbau von Dopamin) bei Tranylcypromin (Jatrosom N®) Interaktion mit Tyramin !!! • reversivle Hemmung synaptischer MAO-A bei Moclobemid (Aurorix®) Indikationen: Das bewirkt eine geringere Metabolisierung der Neurotransmitter Serotonin und Noradrenalin, ihre Konzentration nimmt zu, was zu einer Verbesserung von Stimmung und Antrieb bei Depressionen führt. Gehemmte Depression, soziale Phobien, Therapieresistenz gegen TCA Aufgrund dieser Eigenschaft werden sie als Antidepressiva eingesetzt. Hierbei tritt allerdings die stimmungsaufhellende (thymoleptische) Wirkung gegenüber der antriebssteigernden (thymeretischen) Wirkung zurück. Vorkommen: In der äußeren Mitochondrien-Membran neuronaler und nicht neuronaler Zellen 2 Isoformen: MAO-A und MAO-B Da Tyramin Moclobemid aus seiner Bindung an MAO-A verdrängt, kommt es unter Moclobemid bei Tyraminaufnahme mit der Nahrung nicht wie bei irreversiblen MAO-Hemmern zu hypertensiven Krisen. 185 Interaktionen: Tranylcypromin und Tyramin • • • Kompetitive Hemmung der NA-Aufnahme in die Speichervesikel Kompetitive Hemmung der MAO Hemmung der Wiederaufnahme von freigesetztem NA durch Konkurrenz um den Carrier Körpereigene Amine werden verlangsamt abgebaut (Tryptamine, Serotonin, Noradrenalin, Adrenalin, Dopamin, Melatonin, und Histamin), die dann bei den Stoffwechselvorgängen vermehrt zur Verfügung stehen. Dasselbe gilt allerdings auch für körperfremde Amine, etwa Tyramin, wie es beispielsweise in Rotwein, manchen Käsesorten und Schokolade vorkommt. Bei Genuss solcher Nahrungsmittel kann es unter Therapie mit Tranylcypromin zu RR-Anstieg bis hin zu hypertensiven Krisen mit lebensbedrohlichen Folgen (Hirnblutungen) kommen. ► indirektes Sympathomimetikum Bei der Einnahme muss zusätzlich eine strenge tyraminarme Ernährung eingehalten werden!!!! 187 186 • Cave: MAO-Hemmer vor Operationen – irreversible MAO-Hemmer mindestens 2 Wochen vor OP absetzen, damit Narkosezwischenfälle vermieden werden – reversible MAO-Hemmer können bis 2 Tage vor der Operation gegeben werden • Cave: Keine Kombination von anticholinerg wirkenden AD mit anticholinerg wirkenden NL bei älteren Patienten wegen der Gefahr eines zentralen anticholinergen Syndroms • Cave: Keine Kombination von AD mit Sympathomimetika wegen der Gefahr einer hypertensiven Krise • Cave: AD mit a1-antagonistischer Wirkung können die Wirkung von Antihypertensiva verstärken oder vermindern • Cave: Vermeide die Kombination von TZA mit Antiarrhythmika vom Chinidintyp • Cave: Keine Kombination von AD mit Alkohol wegen der Gefahr der gegenseitigen Wirkungsverstärkung bis zum Koma 188 Tranquillantien (Beruhiungsmittel) Tranquillantien (Beruhiungsmittel) Als klinischen Tranquilizereffekt bezeichnet man ihre angstlösende, beruhigende und affektiv entspannende Wirkung, jedoch keine antipsychotische Wirkung. Auch niedrig dosierte Neuroleptika, dämpfende tricycl. Antidepressiva z.B. Insidon®, Antieptileptika/Neuropathiepräparte z. B. Lyrica®, einige Betarezeptoren-Blocker z. B. Beloc® und Phytotherapeutika (pflanzliche Sedativa) z. B. Baldrian können dieselbe Wirkung zeigen. Bis 1960 war Meprobamat der Hauptvertreter der Tranquilizer Seitdem sind Benzodiazepine die wichtigste und verbreitetste Gruppe unter den Tranquillantien. Tranquilizer sind eine Gruppe von Psychopharmaka zur Behandlung von Angst- und Spannungszuständen; werden auch als Anxiolytika oder Ataraktika bezeichnet; alter Begriff ist Psychosedativum 189 190 Anxiolytika/Tranquilizer Benzodiazepine Neue Studien zu Baldrian: schlaffördernde Wirkung setzt erst im Laufe einer mehrwöchigen Therapie ein; soll GABAerg wirken und im Gehirn Adenosinrezeptoren aktivieren. Adenosin ist ein endogen relevanter Wirkstoff, der sich tagsüber im Gehirn anreichert und nachts abgedaut wird. 191 Einteilungen: • Nach klinischem Wirkprofil – – – – Sedierend/hypnogen (schlafanstoßend) Muskelrelaxierend (muskelentspannend) Anxiolytisch (angstlösend) Antiepileptisch/antikonvulsiv • Nach pharmakokinetischen Eigenschaften – Kurz wirksam – Mittellang wirksam – Lang wirksam 192 Halbwertzeiten der Benzodiazepine Metaboliten sind Substanzen, die als Zwischenstufen oder als Abbauprodukt von Stoffwechselvorgängen des Organismus entstehen. Lange HWZ und lang wirksame aktive Metaboliten: Wirkstoffe von Arzneimitteln werden in der Regel durch den Stoffwechsel verändert und vom Körper zu einem oder mehreren Metaboliten umgewandelt. Merke: bei den langwirksamen Benzodiazepinen besteht die lange Wirksamkeit und die Kumulationsgefahr (!) v.a. durch die aktiven Metaboliten, meist Nordazepam und Oxazepam Nicht selten entfalten erst diese Metaboliten die eigentliche pharmakologische Wirkung. 193 194 Mittellange bis kurze HWZ und aktive Metaboliten: • Diazepam (Valium®) (20-40 Std.) • Alprazolam (Xanor®) (10-15 Std.) – Nordazepam (36-200 Std.) – Oxazepam (4-15 Std.) – Hydroxylalprazolam (10-15) • Chlordiazepoxid (Librium®) (5-30 Std.) • Bromazepam (Lexotanil®) (10-20 Std.) – Demoxepam (45 Std.) – Nordazepam (36-200 Std.) – Oxazepam (4-15 Std.) – Hydroxybromazepam (kurz) • Dikaliumchlorazepat (Tranxilium®) (40-80 Std.) – Nordazepam (36-200 Std.) – Oxazepam (4-15 Std.) Mittellange bis kurze HWZ ohne aktive Metaboliten: • Prazepam (Demetrin®) (100 Std.) – Nordazepam (36-200 Std.) – Oxazepam (4-15 Std.) • Lorazepam (Temesta®)(8-24 Std.) • Oxazepam (Anxiotit®, Praxiten®) (4-15 Std.) • Clobazam (Frisium®) (12-60 Std.) – Desmethylclobazam (50-100) 195 196 Wechselwirkungen • Alkohol-, Hypnotika-, Analgetikawirkungen werden durch Tranquillantien verstärkt; dabei z. T. Wirkungen, die allein nicht kämen • spezielle Benzodiazepin-Antagonisten 4 Hauptgruppen (nach Metabolismus) 1. Diazepamtyp (langlebige pharmakologisch wirksame Metaboliten) 2. Oxazepamtyp (keine langlebigen Metaboliten) 3. Nitrazepamtyp (keine langlebigen Metaboliten) 4. Typ der tetrazyklischen Benzodiazepine (keine langlebigen Metaboliten) Wirkungsprinzip: Verstärkung der hemmenden Funktion der GABAergen Synapsen (Hyperpolarisation der Chloridionen-Kanäle) Indikationen: • Benzodiazepine können als – – – – – Hypnotika Tranquilizer Antiepileptika Muskelrelaxantien und Narkotika eingesetzt werden • In der Psychiatrie Zusatzmedikation zu – – – – Depressionen Kriseninterventionen Entzugsbehandlungen Antiepileptika 197 Benzodiazepine entfalten ihre Wirkung dadurch, dass sie im ZNS, aber auch im PNS die Wirkung des Neurotransmitters Gamma-Aminobuttersäure (GABA) verstärken. Sie binden an eine spezifische Komponente des GABAA-Rezeptor und erleichtern dadurch die Bindung von GABA an seinen Rezeptor. Darüber hinaus erhöhen sie die Öffnungsfrequenz von Chloridkanäle, die mit dem GABA A-Rezeptor verbunden sind, und induzieren eine Hyperpolarisation der Zellmembran. Durch die verstärkte Wirkung von GABA kommt es zu einer gedämpften Aktivität bestimmter ZNS-Areale und einer zu verminderten Antwort auf emotionelle und psychische Reize. Als Hyperpolarisation bezeichnet man in die übermäßige Polarisierung einer Zellmembran. Eine Nervenzelle weist in Ruhe ein negatives Membranpotential auf. Dieses kann durch verschiedene Einflüsse (hemmende Synapsen, Öffnen von Kaliumkanälen) noch weiter gesteigert werden. Eine Hyperpolarisation der Nervenzellmembran erfolgt nach jeder Depolarisation. Damit trägt die Hyperpolarisation entscheidend zur Refraktärzeit bei und schützt vor Übererregung. 199 198 Therapie mit Benzodiazepinen: • Achtung: Suchtgefahr bei längerdauernder Anwendung (bei zur Sucht prädisponierten Menschen oder bereits an Sucht erkrankten auch bei kurzer Einnahme!) Merke: im Regelfall nicht länger als drei Monate! • Sehr zurückhaltender Einsatz bei Patienten mit Suchtanamnese im ersten Trimenon, präpartal und in der Stillzeit (floppy infant-baby) Nebenwirkungen: • Sehr verträglich. Bis auf evt. Tagesmüdigkeit keine wesentlichen NW • Bei längerer Behandlung aber Entwicklung einer Abhängigkeit • evt. Probleme der Kumulation durch lange Wirksamkeit bzw. aktive Metaboliten Kontraindikationen: Cave: • Nicht bei Myasthenia gravis 200 • Nicht bei akuten Alkohol-, Analgetika-, Psychopharmaka-Intoxikationen!! Tranquillantien-Benzodiazepine Chemische Merkmale • heterogen • häufigste Gruppe: Benzodiazepine Wirkmechanismus (Benzodiazepine) • • • • • → Effekte an Anwesenheit endogener γ-Aminobuttersäure (GABA) gebunden, Aufhebung durch GABA-Antagonisten (z.B. Bicucullin) oder Hemmung der GABA-Synthese → Benzodiazepine reagieren mit einem speziellen Benzodiazepinrezeptor, der zusammen mit dem GABA-Rezeptor einen Komplex bildet (Rezeptoren v. a. im frontalen und occipitalen Cortex, im Hippocampus und Cerebellum) → Förderung der durch GABA vermittelten synaptischen Hemmung! Konformationsänderung des GABA-Rezeptors erhöht die Affinität von GABA zum Rezeptor, sie kann effektiver damit reagieren → weitere Folge: Cl-Kanäle öffnen, Hyperpolarisation, Erregbarkeit↓ (je nach Lokalisation unterschiedliche Folgen) Pharmakokinetik • • • • • • • • • Gute und schnelle Resorption, maximale Konzentration 2-4 h später Abbau in der Leber Ausscheidung über die Niere Hauptstoffwechselprodukte Oxazepam und Desmethyldiazepam (pharmakodynamisch noch aktiv; ähnliche Wirkung wie Ausgangssubstanz, jedoch langsame Elimination) Gefahr → Kumulation des Metaboliten ⇒ HWZ der Substanz hat nicht unbedingt Bedeutung, auch die der Metaboliten beachten! klinische Einteilung (trotzdem) 201 schnell (2-5 h), mittelschnell (6-24 h) und langsam (>24 h) Pharmakodynamik • Die Benzodiazepine wirken auf die GABA - Rezeptoren, vorwiegend auf die GABA-α Rezeptoren und deren Untergruppen. Angst und Erregung werden in niedriger Dosierung im Hippocampus und im Corpus Amygdaloideum beeinflusst • Verwirrung und Amnesie, sowie sedative und hypnotische Wirkung scheinen durch GABA - Rezeptoren in der Großhirnrinde zu entstehen • Für antiepileptische Wirkungen scheinen GABA - Rezeptoren im Neocortex und Hippocampus verantwortlich zu sein • Für das Suchtpotential und die psychische Abhängigkeit wird die Wirkung auf das verhaltensverstärkende System verantwortlich gemacht • Die Unterschiede der verschiedenen Benzodiazepine beruhen auf der unterschiedlichen „Neigung“ sich an den verschiedenen Varianten der GABA-α anzudocken 202 Wirkungen Anxiolyse (Unterdrückung der Folgeerscheinungen von Angst-, Spannungs- und Erregungszuständen) Beruhigung und Schlafförderung Muskelrelaxation Antikonvulsive Wirkung v.a. bei hoher Dosierung: Müdigkeit keine extrapyramidalen und keine antipsychotische Wirkungen kaum toxisch z.T. hang-over Effekt und EEG-Veränderungen (Diazepam!) → Schläfrigkeit, intellektuell ↓, Reaktionen ↓↓ Rebound-Effekt (nach Absetzen Ruhelosigkeit und Schlafstörungen) z.T. mnestische Störungen im Prinzip alle 4 Wirkungen in allen Medikamenten der Gruppe, aber unterschiedlich stark Nebenwirkungen Veränderung der Schlafphasen Verringerung des REM und Tiefschlafs REM-Rebound nach Absetzen vermehrter REM-Schlaf, oft Alpträume, unruhig, Wsk. durch Ausschleichen ↓ Gewöhnung und Toleranz höhere Dosen nötig; durch Enzymzunahme (Metabolismus wird beeinflußt); jedoch bei Benzos nicht so stark Abhängigkeit Suchtpotential; Kumulation und Hangover v. a. bei Präparaten mit längerer HWZ: Kumulation gefährlich: u. U. Vergiftungen (z.B. mit Barbituraten); Hang-over Effekte am nächsten Tag (Müdigkeit, Aufmerksamkeit ↓); auch bei ↓ der Nierenfunktion und bei Alten Rebound Phänomene nach Absetzen Hyposomnie, Angst, Schwindel, Schwäche, ... Paradoxe Effekte bei alten Patienten Aufgeregtheit und Verwirrtheit sonstige NW Verstärkung der Alk-Wirkung (u.U. bis zum Tod), u.U. Atemdepression; Übelkeit und Erbrechen; Mundtrockenheit; Libidoabfall, Blutdruckabfall Indikationen krankhafte vegetativ-nervöse Reaktionen + Schlaflosigkeit Angst-, Spannungs-, Verstimmungszustände, Reizbarkeit Nach chronischer Anwendung kommt es zur Gewöhnung, die durch Kumulation überdeckt sein kann → psychische und physische Abhängigkeit! 203 204 Benzodiazepine Schwangerschaft/Stillzeit Wirkmechanismus s.o. • Hauptangriffsort: Limbisches System → Verstärkung der GABA-Wirkung und Unterdrückung der emotionsbedingten Aktivierung (indirekt schlaffördernd) • Folgen • • • • . Erleichterung des Einschlafens Erhöhung der Weckschwelle und Verminderung des gelegentlichen Aufwachens Zunahme an NREM-Schlaf, Abnahme des REM-Schlafs kurzfristig erfrischender Schlaf, aber langfristig Gewöhnung.. • • Indikationen und Kontraindikationen • • • • • • Bei Einschlafstörungen kurzfristig Benzodiazepine mit kurzer HWZ (max. für 1-2 Wochen) Bei Durchschlafstörungen kurzfristig Benzodiazepine mit längerer HWZ Nicht bei bestehender Alkohol- oder Medikamentenabhängigkeit Nicht bei akuten Intoxikationen mit Alkohol, Drogen oder Medikamenten Nicht bei Myasthenien, cerebellärer Ataxie oder Schlafapnoe Nicht bei Schwangerschaft (Floppy infant Syndrom) 205 • Verabreichung im 1. Trimenon: – Werden Benzodiazepine im 1. Trimenon verabreicht, besteht der Verdacht, dass sie Rachen-Gaumenspalten verursachen können. Mit Sicherheit kann dies aber nicht nachgewiesen werden. Verabreichung am Ende der Schwangerschaft: – Bei Verabreichung am Ende der Schwangerschaft besteht die Gefahr, dass sich ein Floppy-Infant-Syndrom entwickelt. Benzodiazepine und Stillen: – Benzodiazepine treten in die Muttermilch über und können den Säugling auf diese Weise dämpfen. – Da der Säugling Benzodiazepine nur schlecht abbauen kann, akkumulieren sich diese im Körper und führen wegen der muskelrelaxierenden Wirkung zum Floppy-Infant-Syndrom. Entzugserscheinungen: – Bei regelmäßigem Gebrauch von Benzodiazepinen in der Schwangerschaft können sich beim Kind nach der Geburt Entzugserscheinungen zeigen. 206 Floppy-Infant-Syndrom/FIS (=Syndrom des schlaffen Säuglings) • Das „floppy infant“-Syndrom bezeichnet den klinischen Phänotyp einer Skelettmuskelhypotonie im ersten Lebensjahr mit der Trias aus - ungewöhnlicher Haltung (u.a. „Froschhaltung“ der Beine), - vermindertem Widerstand gegen passive Bewegungen und - abnormer Gelenkbeweglichkeit. • Ebenso Trinkschwäche/Schluckstörungen/Speichelfluß • Kinder mit Floppy-infant-Syndrom neigen zur Überstreckung der Gelenke („Froschhaltung“). Klinisch kann dies durch Stellungsänderungen des Neugeborenen nachvollzogen werden: • Bei Halten des Kindes in der Bauchlage pendeln die Extremitäten in Extensionshaltung. • Bei Anheben des Oberkörpers durch Zugausübung auf die Arme wird der Nacken überstreckt. 207 208 Benzodiazepinabhängigkeit Phasenmodell der l o w - d o s e BenzodiazepinAbhängigkeit • Die Wirkung von Benzodiazepinen verändert sich bei längerem Gebrauch (über 2 - 8 Wochen) erfahrungsgemäß in 3 Phasen, welche in eine Abhängigkeit münden können. • Dieser Ablauf sollte mit einem Patienten rechtzeitig thematisiert werden. Das erlaubt auch die Benzodiazepin-Problematik noch ohne den Widerstand des Patienten gegenüber dem Thema Sucht anzusprechen. 1. Phase: "Wirkumkehr" / Relative Entzugserscheinungen / keine Dosissteigerung • Gewöhnung führt zu einer relativen Unterdosierung. Patient steigert Dosis noch nicht. • Unterdosierung führt zu Entzugserscheinungen, die nicht als solche erkannt werden: – typische Trias: • verstärkte Symptome der psychischen Grunderkrankung • Stimmungslabilität • gestörtes Körpergefühl – mögliche zusätzliche Symptome: • Schlafstörungen • Ängste • gereizte Verstimmungszustände 209 2. Phase: "Apathie-Phase" / Moderate Dosissteigerung • • 210 3. Phase: "Sucht-Phase" / Deutliche Dosissteigerung Patienten beginnen Dosis leicht zu steigern ("2 - 3 Tabletten pro Tag") Es treten Langzeitnebenwirkungen auf: – typische Trias: • Gefühlserleben abgeschwächt • Vergesslichkeit und geistige Leistungsminderung • gestörtes Körpergefühl / verminderte körperliche Energie – mögliche zusätzliche Symptome: • Fähigkeit zur Selbstkritik abgeschwächt • gereizte Verstimmungszustände • Konfliktvermeidung • Überforderung in bzw. Vermeidung von neuen oder belastenden Situationen • muskuläre Schwäche -> Sturzgefahr • Appetitlosigkeit • Vermeidung des Themas 'Tabletten' / heimliche Einnahme • Abhängigkeitskriterien nach ICD-10 sind erfüllt – Typische Trias: • Bezug von Benzodiazepinen aus zusätzlichen Quellen • Kontrollverlust / Intoxikationszeichen • Abstumpfung und fehlende Selbstkritik 211 212 Abhängigkeitskriterien high-dose - Abhängigkeit Von einer Abhängigkeit wird gesprochen, wenn innerhalb eines Jahres einmal drei oder mehr der folgenden Kriterien erfüllt waren: ein starker Wunsch, oder eine Art Zwang, psychotrope Substanzen zu konsumieren verminderte Kontrollfähigkeit körperliches Entzugssyndrom Nachweis einer Toleranz fortschreitende Vernachlässigung anderer Vergnügen oder Interessen anhaltender Substanzkonsum trotz Nachweises eindeutiger schädlicher Folgen • Menschen mit einer Abhängigkeit vom Polytoxikomanie-Typ entwickeln häufig eine High-Dose-Abhängigkeit (>20mgValium/Tag). • Verfügbarkeit von Benzodiazepinen in der Szene ist weiterhin hoch. • Benzodiazepine sind bei polytoxikomanen Konsumenten sehr beliebt. Benzodiazepine in adäquater Dosierung können zu einer Beruhigung im psycho-sozialen Bereich führen, die soziotherapeutisch genutzt werden kann Benzodiazepine können bei ausgewählten Patienten auch im Sinne der Schadensminderung oder Palliation (Linderung) indiziert sein. 213 214 Eine rein repressive Haltung Benzodiazepinen gegenüber im Bereich Hoch-Dosis- Abhängigkeit berücksichtigt nicht, Ende 2012 erstellt: Novelle der Psychotropenverordnung und der Suchtgiftverordnung. • dass Menschen mit einem Benzodiazepin-Beikonsum eine ernstzunehmende Zweiterkrankung haben, nämlich entweder eine: • Benzodiazepin-Abhängigkeit (deren Entzug Monate dauern kann und so lange einer regelmäßigen Benzodiazepinabgabe bedürfen) oder eine • nicht erkannte psychiatrische Komorbidität, die − mit einem Benzodiazepin zwar gelindert, aber nicht korrekt behandelt ist oder − mit einem Benzodiazepin korrekt behandelt sein kann (weil es keine praktikable bessere Behandlung gibt). 215 Diese Novellen schreiben fest, dass generell Benzodiazepine auf einem Rezept nicht mehr wiederholt abgegeben werde dürfen. Ne repetatur! Flunitrazepam (Guttanotte®, Rohypnol®, Somnubene®) bleibt weiterhin eine psychotrope Substanz, muss aber den Verschreibungsregeln von Suchtgiften entsprechend rezeptiert werden: Mit Suchtgiftvignette, Ausfertigung des Rezeptes in Ziffern und ausgeschriebenen Zahlen, vollständiger Unterschrift und vor allem Dokumentationspflicht. 216 Non-Benzodiazepine: Schlafstörungen/Hypnotika: ► chemisch nicht mit Benzos verwandt, aber spezifische Bindung am BZD1Rezeptor • verstärken im ZNS die Wirkung GABAergen Neurone (Effekt am GABA-ARezeptor; durch Benzo- Antagonisten Flumazenil aufgehoben) • Wirkung viele Gemeinsamkeiten mit Benzos • Indikation jedoch nur als Schlafmittel und in der Anästhesie • Toleranz und Abhängigkeit möglich Nebenwirkungen Zopiclon (Somnal®) • bitterer, metallischer Geschmack im Mund, trockene Mundschleimhaut, Schläfrigkeit, leichte Einschränkung psychomotorischer Funktionen Zolpidem (Ivadal®, Zoldem®) • Kopfschmerzen, Schwindel, Benommenheit, gastrointestinale Beschwerden • Beurteilung der Non-Benzodiazepin-Hypnotika „3 Z“ : 1. 2. 3. • • • • • Zaleplon (Sonata®) Zolpidem (Stilnox®, Ivadal®, Mondeal®, Zoldem®) und Zopiclon (Imovane®, Ximovan®): hinsichtlich pharmakologischer Wirkung kein Unterschied zu Benzodiazepinen, da gleicher Ansatzpunkt (spezifische Bindung am BZD1-Rezeptor) seltener Hang-Over-Effekte seltener Rebound-Phänomene bei Zolpidem und Zopiclon relative Toleranz- und Abhängigkeitsentwicklung Flurazepam (Dalmadorm®) ist ein hochwirksames, weil lang wirkendes Hypnotikum, welches aber wegen ausgesprochener Kumulationsgefahr und Risiko für Hang-Over-Effekte nur eingeschränkt empfehlenswert ist!!! 217 Hypnotika 218 • Merke: Zaleplon, Zopiclon und Zolpidem greifen als chemisch neuartige Nicht-Benzodiazepin-Hypnotika an einem Subtyp des Benzodiazepin-Rezeptors an keine scharf definierte Substanzgruppe (jedes Mittel, das Schlaf erzeugen kann) • Substanzgruppen: – Vorteile: • • • • – Aldehyde (Chloralhydrat) – Benzodiazepine (Diazepam, Flunitrazepam, Oxazepam, Temazepam, Triazolam) – Diphenhydramin, Doxylamin – Promethazin – Clomethiazol (Distraneurin) – Melatonin – Tryptophan – Pflanzliche Präparate – Non-Benzodiazepin-Hypnotika – Thalidomid (Contergan) heute nur noch als Krebsmedikament zugelassen, gehört zur Gruppe der Piperidindione, einer strukturellen Abwandlung der Barbiturate Geringe Alkoholinteraktion Fehlende muskelrelaxierende Wirkung Verminderte Rebound- und Residualeffekte bei Zolpidem und Zopiclon relative Toleranz- und Abhängigkeitsentwicklung • Vor jedem Hypnotika-Einsatz gründliche Abklärung der Schlafstörung: – Durch Lebensumstände? Herstellung einer "natürlichen Erschöpfung" – Somatische Ursachen? – Depression? • Niederpotente Neuroleptika sind wegen ihrer höheren NWRate eher zurückhaltend einzusetzen, aber dort indiziert, wo Suchtgefahr besteht! 219 220 Thalidomid ( CONTERGAN®) Vor ~ 60 Jahren kam die Substanz Thalidomid als angeblich besonders gut verträgliches Schlafmittel und gegen die morgendliche Schwangerschaftsübelkeit (CONTERGAN® oder SOFTENON®) auf den Markt. Es genügte schon eine einzige Tablette, um Missbildungen der Gliedmaßen (Dysmelie) beim Ungeborenen hervorzurufen!!! In Österreich und in der Schweiz hieß das Mittel Softenon® und war verschreibungspflichtig. Softenon wurde 1962 vom Markt genommen. Offiziell gibt es in Österreich dreizehn Contergan-Opfer, da man hier damals sehr restriktiv mit der Rezeptpflicht umging. In der Schweiz wurden neun contergangeschädigte Kinder geboren. Dass sich die Gliedmaßen gar nicht oder nur unvollständig ausbildeten, liegt unter anderem an der hemmenden Wirkung von Thalidomid auf Wachstumsfaktoren wie VEFG (Vascular Endothelial Growth Factor) und bFGF (Basic Fibroblast Growth Factor). Es verhindert damit, dass sich die Blutgefäße ausbilden. - - - > Genau diesen antiangiogenetischen Effekt nutzen Mediziner nun in der Krebstherapie, denn der wachsende Tumor ist auf die Versorgung durch neue Blutgefäße angewiesen. Zusätzlich hilft Thalidomid dem Immunsystem, gegen entartete Zellen vorzugehen. Es steigert die Zahl der im Blut zirkulierenden natürlichen Killerzellen; die Werte der zytotoxischen Immunmodulatoren Interferon-g und Interleukin-2 steigen an. Auch bringt es den Zellzyklus der Myelomzellen zum Erliegen, indem es Proteine hemmt, die die Apoptose inhibieren. 221 Thalidomid (Contergan®) Vom Schlafmittel zum Krebsmedikament Aufgrund seiner antiangiogenetischen und immunmodulatorischen Wirkung ist es seit 2009 in den Deutschland gegen eine besonders bösartige Krebsart zugelassen: das multiple Myelom Dieser bösartige Tumor der B-Lymphozyten zählt zu den Non-HodgkinLymphomen. Dabei entartet eine Plasmazelle und vermehrt sich unkontrolliert, vor allem im Knochenmark. Geschieht dies an mehreren Stellen im Skelett, sprechen Mediziner von einem multiplen Myelom. Die Knochensubstanz löst sich auf, das Blutbild verändert sich und andere wichtige Organe wie die Nieren nehmen Schaden. Für Patienten, bei denen erst in den vergangen zehn Jahren ein multiples Myelom festgestellt wurde, verbesserte sich das Gesamtüberleben um 50 Prozent. Es stieg von 30 auf 45 Monate an, verglichen mit den Patienten, die früher an dieser Krebsart erkrankten. 222 Der Fall Contergan Geschätzte 10.000 missgebildete Kinder weltweit, der Großteil davon in Deutschland - das ist die traurige Nebenwirkungs-Bilanz des Schlafmittels »Contergan«, das in Deutschland von 1957 bis 1961 freiverkäuflich zu erhalten war. 1954 synthetisiert der Apotheker Wilhelm Kunz die Substanz Thalidomid für die Firma Grünenthal. Ursprünglich als Antibiotikum gedacht, zeigt es in Tierversuchen starke sedativ-hypnotische Wirkung bei guter Verträglichkeit. Das Arzneimittelgesetz schreibt zu diesem Zeitpunkt noch keinen Nachweis von Wirksamkeit und Unbedenklichkeit vor. So kommt Thalidomid am 1. Oktober 1957 in Deutschland als »Contergan« auf den Markt. Genau zwei Jahre später gehen bei der Firma nach eigenen Angaben erste Meldungen zu Nebenwirkungen ein: Irreversible Nervenreizungen an Händen und Füßen. 1961 beantragt Grünenthal aufgrund dieser Polyneuritis die Verschreibungspflicht. Am 18. Dezember 1961 beginnt die Staatsanwaltschaft ihre Ermittlungen. Der Prozess beginnt am 27. Mai 1968. In der Zwischenzeit können Wissenschaftler die Teratogenität von Thalidomid am Neuseeland-Kaninchen nachweisen. Da den Angeklagten nach damaliger Gesetzeslage ein schuldhaftes Verhalten nicht eindeutig nachgewiesen werden kann, wird das Verfahren am 18. Dezember 1970 wegen »geringfügiger Schuld« ohne eine Verurteilung eingestellt. Grünenthal verpflichtet sich, einmalig 114 Millionen DM an eine Stiftung für die Opfer zu zahlen. Damit wird das Unternehmen von weiteren Ansprüchen freigestellt. 223 224 Wirkungen: Barbiturate Barbiturate sind Arzneimittel mit beruhigenden, schlaffördernden und krampflösenden Eigenschaften. Sie wurden früher als Schlafmittel und Beruhigungsmittel verwendet, wurden aber weitgehend durch die besser verträglichen Benzodiazepine und andere Wirkstoffe ersetzt. Sie werden heute hauptsächlich noch gegen Epilepsie und Krampfzustände verwendet. zentral hemmend beruhigend schlaffördernd krampflösend Atemdepressiv Wirkmechanismus: 225 226 Wirkstoffe: Barbiturate sind Derivate der Barbitursäure: Indikationen: •Barbexaclon (Maliasin®, ausser Handel) •Butalbital (Cafergot PB®, ausser Handel) •Pentobarbital (Sterbehilfe, Tierarzneimittel) •Phenobarbital (Aphenylbarbit®) Antiepileptikum, Sedativum bei Erregungszuständen •Primidon (Mysoline®) Antiepileptika •Thiopental (Pentothal®) Anästhesie Epilepsie, Fieberkrämpfe Anästhesie Entzugsbehandlung (Phenobarbital) In diesen Indikationen durch die besser verträglichen Benzodizepine ersetzt: Unerwünschte Wirkungen: Schlafstörungen Unruhe- und Erregungszustände Toxizität, Suizid Toleranz Abhängigkeit, Missbrauch Zentral hemmend: Müdigkeit, Schläfrigkeit, Lethargie Hangover am folgenden Tag Paradoxe Reaktionen: Erregungszustände Allergische Reaktionen Beeinflussung des Vitamin D- Metabolismus, Knochenerkrankungen Verminderte Folsäure-Spiegel Weitere Verwendung: •In der Sterbehilfe (Natriumpentobarbital) HWZ bei Erwachsenen 2-6 Tage !!! •Zum Einschläfern von Tieren 227 228 Phasenprophylaxe Phasenprophylaktika: Lithium • Ein Phasenprophylaktikum (auch Stimmungsstabilisierer/ Mood Stabilizer genannt) ist ein Psychopharmakon, welches bei bestimmten seelischen Erkrankungen wie z. B. rez. Depression oder bipolar affektiver Störung zur Verhinderung neuer Krankheitsphasen angewendet wird. Serotonin-agonistisch, Einfluss auf das zirkadiane System (Verlängerung der Phasen, Synchronisation der verschobenen Phasen), Aufhebung des negativen Feedback bei NA und Serotonin Wirkungsweise • • • ähnliche elektrophysiologische Eigenschaften wie Na+ und K+, aber 25 mal langsamer aus der Zelle transportiert Ca++-Einstrom wird verändert; Hyperpolarisation und Inaktivierung der Zelle Hemmung der Rezeptor-G-Protein Kopplung bei second-messenger Systemen → Je nach Zelle/Hirnregion abschwächende oder verstärkende Wirkung Anwendung • • • • 229 Lithium Manie Bipolar-affektive Störungen (Manisch-Depressive Erkrankungen) Vorbeugende Therapie bei der (unipolaren) Depression Vorbeugende Therapie bei schizoaffektive Störung (allerdings keine offizielle Zulassung) 230 Lithium Nebenwirkungen • • • • • • • • • • • Phasenprophylaktika: Lithium (Quilonorm®) Carbamazepin (Neurotop®, Tegretol®) Valproinsäure (Depakine®) Lamotrigin (Lamictal®) Neuroleptika (Seroquel®) • • • Wirkung Initial Händetremor Magen-Darmstörungen Polyurie, Durst (Störungen der Konzentrationsfähigkeit der Niere, vermehrte Wasserausscheidung) Kontraindikationen • Nierenversagen • Myokardinfarkt • erstes Schwangerschaftsdrittel (sonst Missbildungen an Herz, Atemwegen und Schilddrüse) Später Händetremor Gewichtszunahme Polyurie, Durst, Schwindel, Ödeme, Nierenschäden Erbrechen, Durchfälle mäßige Leukocytose Struma, Schilddrüsenmangelfunktion EKG- und EEG-Veränderungen Mattigkeit, selten Verwirrtheit und Konzentrationsstörungen Vergiftungen • • • • • • • • → nur geringe therapeutische Breite, regelmäßige Plasmaspiegelkontrolle obligat grobschlägiger Tremor Diarrhoe, Erbrechen Reflexsteigerung Somnolenz bis Koma Dysarthrie, Ataxie, Dyskinesien im EEG Allgemeinveränderungen und Senkung der Krampfschwelle, Krampfanfälle → Ursachen von Vergiftungen Dehydration, Kochsalzmangel (durch Diäten, Schwitzen, Fieber, Diuretika, Nierenerkrankung) 231 232 Phasenprophylaktika und Behandlung der Manie und bipolaren Psychose Lithium • • Achtung: – – – – Bei Neueinstellung auf Lithium: – Somatische Anamnese (Niere, Herz, Schilddrüse, Schwangerschaft!!!) – Internistische und neurologische Untersuchung – BB, BSG, Nüchternblutzucker, Nierenwerte und Nierenfunktion, T3, T4, EEG, EKG, RR, Puls, – Ggf. Schwangerschaftstest • Spiegelbestimmung (therapeutisch 1,0 - 1,2mmol/l, zur Augmentation 0,6 0,8mmol/l) – – – – Morgens vor Medikamenten-Einnahme 12 Stunden nach der letzten Medikamenteneinnahme erste Bestimmung in der ersten Woche danach im ersten Monat wöchentlich, danach monatlich, nach einem halben Jahr dreimonatliche Kontrollen – immer Mitbestimmung von Kreatinin! – Jährlich T3, T4, Na, K, Ca, Kreatininclearence, EKG • Geringe therapeutische Breite! Renale Ausscheidung (cave: Interaktion mit Diuretika) Deshalb Spiegelkontrollen erforderlich (s.o.) Cave: Kochsalzmangel und Dehydration führt u. U. zu Intoxikationserscheinungen !!! Mögliche Ursachen: • Diäten • Schwitzen • Fieberhafte Infekte • Nierenerkrankungen • Interaktionen mit Diuretika Intoxikationserscheinungen (meist ab 1,5 mmol/l) – Übelkeit, Erbrechen, Durchfall – Ataxie und Dysarthrie – Grobschlägiges Zittern der Hände – Rigor – Extreme Müdigkeit und Kraftlosigkeit, Schläfrigkeit, Verlangsamung – Schwindel, Krampfanfälle – Bewußtseinsstörung bis zum Koma 233 234 Phasenprophylaktika: Carbamazepin • Allgemeine mögliche Nebenwirkungen (können dann mit Spiegelerhöhung kontinuierlich in Intoxikationserscheinungen übergehen!) – – – – – – Zittern Konzentrations- und Merkfähigkeitsstörungen Müdigkeit, Muskelschwäche Polyurie und Polydipsie Gewichtszunahme, Ödeme Kropfbildung und Veränderung des Stoffwechsels der Schilddrüsenhormone und des Parathormons – Herzrhythmusstörungen und EKG-Veränderungen – Anstieg der Leukozyten im Blutbild • Einsatzgebiete: – Bei bipolaren Psychosen • Zwei Phasen innerhalb von vier Jahren oder • Insgesamt drei Phasen – Bei unipolaren affektiven Psychosen • Zwei Phasen innerhalb von 5 Jahren oder • Insgesamt 4 Phasen • Absolute Kontraindikationen: – Akutes Nierenversagen – Myokardinfarkt – Erstes Trimenon der Schwangerschaft • Merke: Lithium 48 Stunden vor operativen Eingriffen und Narkosen 235 absetzen • • • eigentlich Antiepileptikum neuronaler Wirkmechanismus noch unbekannt regelmäßige Blutspiegelkontrollen empfehlenswert Nebenwirkungen • • • • • • neurologisch-psychiatrisch (Schwindel, Ataxie, Kopfschmerz, Müdigkeit) kardiovaskulär (Arrhythmie, AV-Block, Bradykardie) hämatologisch (Leukopenie, Agranulocytose, Thrombocytose, aplastische Anämie) hepatisch (Cholestase) endokrin (T3,T4-Senkung, Cortisol ↑, Natrium ↓) dermatologisch (Exantheme) Kontraindikationen • • • Überempfindlichkeit gegenüber Carbamazepin und trizyklischen AD Vorsicht bei AV-Block oder schweren Leberfunktionsstörungen keine Kombination mit irreversiblen MAO-Hemmern Anwendungsbereiche • Phasenprophylaxe • Antimanisch 236 Carbamazepin • genaue Wirkweise ebenfalls unbekannt • Effekte auf neuronale Ionenkanäle mit der Folge einer Reduktion der neuronalen Entladungsfrequenz • NW: Valproinsäure U. a. Wirkungen auf das GABAerge System • NW: – Müdigkeit, Benommenheit, Schwindel, Ataxie, Sehstörungen, Übelkeit, Erbrechen im Verlauf sich bessernd – Häufig allergische Hautveränderungen! Gefahr eines Stevens-JohnsonSyndroms oder Lyell-Syndroms – Hämatotoxische NW (reversible Neutropenien, selten Agranulozytose) – Ggl. Haarausfall – Zentralnervöse NW: • Sedierung, Parästhesien, Tremor, selten Ataxie • Interaktionen: – Cave: Kombination mit anderen potentiell knochenmarktoxischen Substanzen, wie Clozapin (Leponex®)!! – Cave: Keine Kombination mit MAO-Hemmern – Bei Kombination mit Lithium erhöhte Neurotoxizität! – Cave: Absinken des Plasmaspiegels trotz gleichbleibender Dosierung durch Enzyminduktion – Cave: Abschwächung der Wirkung von Antikoagulantien und Antikonzeptiva • KI: – – – – Kardiale Überleitungsstörungen Schwere Leberfunktionsstörungen Bekannte Knochenmarkschäden Akute intermittierende Porphyrie • Spiegelkontrollen erforderlich 237 – Gastrointestinale Beschwerden (v.a. zu Therapiebeginn) – Cave: Hepatotoxizität und Pankreatitiden – Ggl. Reversible Thrombopenien oder Leukopenien (zwingen nicht unbedingt zum Absetzen) • Interaktionen • KI: – Vorsicht bei Knochenmarksschädigungen, Niereninsuffizienz, Gerinnungsstörungen Maniebehandlung: • Medikamentenwahl – In Deutschland ist Lithium zur Behandlung der Manie die erste Wahl, weil es als einziges der drei Phasenprophylaktika in dieser Indikation zugelassen ist – Wegen der langen Wirklatenz (Monate bis Jahre!!!) und der fehlenden Sedierung eignet sich aber Lithium zur Behandlung von akuten Manien, "rapid cycling und affektiven Mischzuständen nicht so gut wie Carbamazepin oder Valproinsäure. (Dies ist die Erfahrung des Referenten. In Forschung und Lehre wird dieser Punkt kontrovers diskutiert!) – Häufig muß Lithium kombiniert werden, z.B mit einem NL – Bei Lithium-Nonrespondern oder bestehenden Kontraindikationen gegen Lithium ist Carbamazepin als Monotherapeutikum oder in Kombination mit Lithium für die Maniebehandlung zugelassen – Nach den Zulassungsbestimmungen kann Valproinsäure erst als Mittel der dritten Wahl eingesetzt werden. – Valproinsäure ist überdies besser verträglich als Lithium • Behandlungshinweise: – In schweren Manien mit psychotischen Symptomen kommen initial Neuroleptika zum Einsatz – Wegen der hohen Rezidivneigung manischer Phasen stellt bereits die erste Phase die Indikation einer Rezidivprophylaxe dar! – Nach mehreren Phasen (manisch oder depressiv) muß eine dauerhafte Prophylaxe erwogen werden. – Cave: nach Absetzen von Lithium ist die Rezidivgefahr höher als ursprünglich! • Absetzversuch ganz langsam über Monate 239 238 Lamotrigin • Das Antiepileptikum Lamictal® ist besonders zur Vorbeugung depressiver Phasen geeignet, vor allem dann, wenn es zu raschen Phasenwechseln (rapid cycling) kommt. Die Aufdosierung des Lamotrigins sollte extrem langsam erfolgen (beginnend mit 25 mg), da es sonst zu schweren Hautreaktionen kommen kann. Indikationen − Epilepsie − Polyneuropathie − Migräneaura − Depersonalisations- und Derealisationssymptomen, insbesondere in Kombination mit SSRIs 240 Nootropika und Antidementiva Lamotrigin Typische Nebenwirkungen Einführung • Schwindel, Müdigkeit, Schafstörungen • Hautreaktionen, Exantheme, exfoliative Dermatitis, StevensJohnson - Syndrom, Lyell-Syndrom, • Koordinationsstörungen / Ataxie • Gelenkschmerzen • Übelkeit, Erbrechen, Durchfall • Konjuktivitis / Bindehautentzündung • Doppelbilder • Agranulozytose • zentralnervös wirksame Medikamente, die sich positiv auf Hirnfunktionen wie Gedächtnis, Konzentration, Lernund Denkfähigkeit auswirken sollen. • Pharmakologisch sehr heterogene Substanzgruppe • Nebenwirkungen und entsprechend auch Kontraindikationen finden sich im Wesentlichen bei den Acetylcholinesterasehemmern, für die auch der eindeutigste Wirksamkeitsnachweis besteht! Kontraindikationen Schwere Lebererkrankungen Schwere Nierenerkrankungen 241 242 Wirkmechanismen, Nebenwirkungen und Gegenanzeigen der Antidementiva Wirkungsmechanismen • Wirkmechanismen der Nootropika und zerebralen Vasotherapeutika – Eher hypothetische Überlegungen: • Verbesserung der gestörten Mikrozirkulation und Kalziumhomöostase • • • – Nootropika(z.B. Pirazetam: Nootropil®) – Kalziumantagonisten » z.B. Nimodipin: Nimotop® » Wirksamkeitsnachweis nicht erbracht. » Gingko biloba: Tebonin® 243 – Ausgleich des cholinergen Transmitterdefizits bei Alzheimer-Patienten durch Acetylcholinesterase-Hemmer • Donepezil (Aricept®) • Galantamin (Reminyl®) • Rivastigmin (Exelon®) • Tacrin (Cognex) – Glutamatmodulation: • Memantin (Axura®, Ebixa®) wirken symptomatisch und protektiv auf den Verlauf wirken nur in 10-20% der Fälle einzelne Substanzen und ihre Wirkmechanismen und häufige Nebenwirkungen: – Co-ergocrin, Nicergolin • Mischwirkung aus partiellem alpha-Adrenozeptor- und 5-HT-Agonismus • Keine gesicherte Wirksamkeit – Desferrioxamin • Chelatbildner – Donepezil, Physostigmin, Rivastigmin • Azetylcholinesterase-Hemmer • Nebenwirkungen: – V.a. anfangs bei 10-20% (!) cholinerge Nebenwirkungen: – Übelkeit und Erbrachen – Durchfall oder Verstopfung – Schwindel 244 – Niedriger Blutdruck • Gesicherte Wirksamkeit bei der leichten bis mittelschweren Alzheimer-Demenz • Donepezil und Rivastigmin sind wesentlich besser verträglich als Tacrin, weshalb letzteres nicht mehr eingesetzt werden sollte! • Gegenanzeigen und Beschränkungen: – Gingko biloba – Indomethacin • • Memantin – Nimodipin – Piracetam (Nootropil®) • • • • 245 Cyclooxigenase-Hemmer (Antiphlogistikum) – • – Rivastigmin darf bei Überempfindlichkeiten gegen das Präparat und schwerer Leberinsuffizienz gar nicht, bei bestimmten Herzerkrankungen nur unter größter Vorsicht eingesetzt werden. – Donepezil darf nicht bei unbehandelten Magen-/Darmulzera gegeben werden und ebenfalls nur mit großer Vorsicht bei bestimmten Herzerkrankungen. – Tacrin darf zusätzlich auch bei schwerer Alzheimer-Demenz und anderen Demenzen sowie in der prämenopausalen Frauen (wegen des Teratogenitätsrisikos) nicht gegeben werden Unbekannt NMDA (Glutamat)-Antagonist Ca-Antagonist Kein einheitlicher Wirkmechanismus, beeinflusst GABAerges Sytem und Ionenkanäle Gut verträglich Keine ausreichend nachgewiesene Wirksamkeit – Selegilin – A-Tocopherol (Vit. E) • • MAO-B-Hemmer und Antioxidans Antioxidans Indikationen/Einsatzgebiete: •Demenz bei Alzheimer-Erkrankung (DAT) •Vaskuläre und gemischte Demenz •Demenz vom Lewy-Körperchen-Typ •Demenz bei anderen Erkrankungen •"leichte kognitive Störung" (MCI) 246 Psychopharmaka und Psychopharmakotherapie in der Psychiatrie Psychopharmakotherapie im Alter Psychopharmakotherapie bei Nierenund Leberfunktionstörungen Psychopharmakotherapie in der Schwangerschaft und Stillzeit Psychopharmakotherapie bei psychiatrischen Notfälle 247 248 Psychopharmakotherapie im Alter Vorsicht bei Medikamenten im Alter: Vorbemerkungen: • alte Menschen haben eine erhöhte Suszeptibilität (d.h.Empfänglichkeit,Gegenteil ist Resistenz) gegenüber • Antidepressiva: – Vermeide TZA mit starker anticholinerger Komponente – Verwende Sedierung Parkinsonoid Anticholinerge Wirkungen Orthostase • • • • • • • Oft sind bei alten Menschen renale Clearance und der hepatische Metabolismus vermindert SSRI Venlafaxin (Efectin®) Moclobemid (Aurorix®) Reboxetin (Edronax®) Mirtazapin (Remeron®, Mirtabene®) wenn TZA nötig bei mässig erhöhtem Risiko – Desipramin (Pertofran®) und – Nortriptylin (Nortrilen®) 249 • Antikonvulsiva/Phasenprophylaktika: - Vermeide Lithium Verwende – Carbamazepin – Valproinsäure • Neuroleptika: - - 250 • Anxiolytika und Hypnotika: - Vermeide: – Benziodiazepine (außer Lorazepam (Temesta®) und Oxazepam (Praxiten®) - Verwende: – Nicht-Benzodiazepin-Hypnotika: • Zolpidem (Zoldem®) • Zopiclon (Somnal®) Vermeide NL mit starker anticholinerger Wirkung und überhaupt Trizyklika: – Clozapin!! (Leponex®) – Chlorpromazin (Chlorazin®) – Levomepromazin (Nozinan®) – Thioridazin (Melleril®) Verwende möglichst atypische NL oder typische NL mit geringer anticholinerger Wirkung – Amisulprid (Solian®) – Melperon (Buronil®) – Pipamperon (Dipiperon®) – Sulpirid (Dogmatil®) – Auch Olanzapin oder Haldol oder Risperdal in niedriger Dosierung bei mässig erhöhtem Risiko! 251 – Wenn Benzodiazepine nötig, dann mit mässig erhöhtem Risiko • Lorazepam (Temesta®) • Oxazepam (Praxiten®) Antidementiva: - Verwende Donepezil (Aricept®) • Merke: Die Lewy-Body-Demenz weist eine besondere Vulnerabilität gegenüber 252 Neuroleptika auf!!! Häufigste Pharmaka bei Medikamentennebenwirkungen im Alter • Antihypertensiva 36% (davon 20,5% Diuretika) • Psychopharmaka 24,8% • Nichtsteroidale Analgetika und Antiphlogistika 17,8% • In den meisten Fällen wird eine UAW nicht erkannt • Hauptproblem: relative Überdosierung im Alter • Im höhren Lebensalter gilt: Start low and go slow! Medikamentennebenwirkungen im Alter Differenzierter Blick auf die Medikation bei Sturz Verwirrtheit Depression Schläfrigkeit Schwindel Inkontinenz Harnverhalt, Obstipation Mutsch ler: Ph arma koth era pi e im Alte r, 3. Aufl., wiss ensc haftli ch e Verl ags ges el lsch aft, 199 9 253 254 Pharmakokinetik: Ausscheidung Altersbedingte Veränderungen Renale Durchblutung ⇓ Anzahl der Nephrone ⇓ GFR um ca. 1 ml / min / Jahr ⇓ Klinische Konsequenzen Verzögerte Elimination vorwiegend renal ausgeschiedener Medikamente: Amphotericin Aminoglykoside Gyrase-Hemmstoffe Atenolol Digoxin Tubulusfunktion, ca. 1% / Jahr ⇓ 255 Lithium und NASR Cave: unter Selbstmedikation mit NSAR ist Lithiumintoxikation möglich!! Das gilt auch für Lithium und Coxibe Wahrscheinlich wird durch die Hemmung der Prostaglandinsynthese die Nierendurchblutung und GFR reduziert 256 Pharmakokinetik Veränderung der HWZ von Benzodiazepinen im Alter Benzodiazepin % Zunahme der HWZ Halbwertzeit (HWZ) Alprazolam 10 – 1 5 h + 40 Bromazepam 10 – 20 h, keine Metabol. + 75 Diazepam 20 – 40 h + langw. Metabol. + 125 - 200 Flunitrazepam Flurazepam 10 – 30h, langw. Metabol. 2 h aber langw. Metaboliten 0 + 35 -115 Lorazepam 12-15 h, keine akt. Metabol.; keine cytochrom. Verstoffw. Nitrazepam 15 – 30 h; keine Metabol. Oxazepam 4 –15 h, keine akt. Metabol. Keine cytochrom. Verstoffw. 0 Temazepam 5 – 14 h; keine akt. Metabol. 0 0 + 40 257 258 Nac h: Förstl. Le hrb uch für Ger ont opsyc hi atrie, Th iem e Hemmung von CYP durch SSRIs P450-Induktion Durch gleichzeitige Einnahme von Johanniskraut kann die Konzentration u.a. folgender Medikamente herabgesetzt werden: Substanz 1A2 2C9 2C19 2D6 3A4 Fluoxetin + ++ +-++ +++ + Norfluoxetin + ++ +-++ +++ ++ Sertralin + + +-++ + + Desmethylsertralin + + +-++ + + Paroxetin + + + +++ + Fluvoxamin +++ ++ +++ + ++ Citalopram + 0 0 0 0 Duloxetin 0 0 0 ++ 0 • Antiinfektiva (einschl. einiger HIV Medik.) Venlaflaxin 0 0 0 + 0 • TZA (Amitryptilin / Nortryptilin um 20-40%↓) Mirtazapin 0 - - + 0 • Cumarine (Phenprocoumon, Warfarin) • Cyclosporin • Carbamazepin • Digoxin • Orale Kontrazeptiva DÄ 97, Heft 5, 04.02.2000 Nac h :R. Kön ig: Intera ktio ne n un d Wirkm ech an isme n vo n Psych op har mak a; Thie me 2 00 0 Nac h :R. Kön ig: Intera ktio ne n un d Wirkm ech an isme n vo n Psych op har mak a; Thie me 2 00 0 259 260 Vermeidung pharmakodynamischer Interaktionen bei Psychopharmaka P450-Induktion Vorsicht bei Kombinationen von Substanzen mit ähnlichen Rezeptorbindungsprofilen Ginko biloba mit Induktion auf CYP2C19 / 2C9 senkt Spiegel von z.B.: z. B. a1-antagonistische TZA, Neuroleptika mit Antihypertensiva) Blutdruckabfall (Beispiel: Atosil/Seroquel) • Citalopram / Es-Citalopram z.B. mehrere Medikamente mit anticholinergen Eigenschaften, z.B. niederpotente Neuroleptika und atropinhaltige Augentropfen Zentrales anticholinerges Delir • Diazepam / Flunitrazepam • Pantoprazol / Omeprazol / Esomeprazol • Phenprocoumon und Warfarin (CYP 2C9) Cave: auch internistische Präparate können anticholinerg wirken (Bsp.: Cortison, Ca-Antagonisten, Urologika) Nac h :R. Kön ig: Intera ktio ne n un d Wirkm ech an isme n vo n Psych op har mak a; Thie me 2 00 0 261 Vermeidung pharmakodynamischer Interaktionen bei Psychopharmaka 262 Beispiel für “Cave Psychopharmaka” im Alter Vorsicht bei Kombinationen von Substanzen, die auf unterschiedliche Weise zur Ausschüttung eines wirksamen Metaboliten/Stoffes führen Achten Sie u.a. auf: best. (niederpotente) NL, die sedierend, anticholinerg, orthostatisch wirken Trizyklische Antidepressiva (z. B. Trim ipram in, Am itryptilin) (anticholinerg, kardiotoxisch) (z. B. MA O-Hemmer und SSRIs) Paroxetin; Fluvoxam in, Fluoxetin (P450 Enzym inhibitoren) Serotoninsyndrom best. Antibiotika (Ciprofloxacin, Erythrom ycin, Clarythrom ycin...) ( P450-Inibitoren, Überdosierungsproblem im Alter...) Vorsicht bei Kombinationen von Substanzen, die beide in den Elektrolythaushalt eingreifen Carbam azepin (Hyponatriäm ie, Enzym induktion...) Lithium (Geringe therapeutische Breite, Problem Kom bi m it ACE-Hemmern) Benzos: (Sedierung, überwiegend zu lange HWZ) Hyperkaliämie bei ACE- Hemmer + kaliumsparendes Diuretikum 263 264 Beispiele SSRI / SNRI und Blutung Sehr starke Inhibitoren Unter SSRI 1651 Fälle von oGIB, 248 Ulcusperforationen sollten bei Polypharmazie und in der gerontologischen bei 10.000 Kontrollen aus gleichartigen Praxen Pharmakotherapie Kontrollen 1% SSRI 3,1% nicht eingesetzt werden !!, ASS und SSRI 7,2% da sie die Blutspiegel der Komedikation potenziell stark anheben können, evtl. bis in toxische Bereiche. gleichzeitige Einnahme von NSAR und SSRI 15,6% Abajo et al., Brit. Med. J. 1999, 319,1106 ALTERNATIV Reboxetin / Mirtazapin 265 266 Nikotinkonsum ab 10 Zig./Tag SSRI und orale Antikoagulation Abbauprodukte sind Benzpyrene welche die Enzyme CYP1A2 verbrauchen !! BLUT UNGSTYPEN flächige oder petechiale Hausteinblutungen z.B. müssen Raucher die Doppelte Menge von Duloxetin einnehmen Nasenbluten Blutungen des Magen-Darmtraktes Das hat auch Gültigkeit für Grillfleisch und THC IN DER KOMBINATIONST HERAPIE VON SSRI UND ANT IKOAGULANZIEN SIND RELEVANT: Alternativ Citalopram, Sertralin, Venlafaxin Serotonineffekte auf die Blutgerinnung Die Inhibition des Abbaus der Anitikoagulantien Bottlen der R et al. 1 99 8, Fortschritte Ne urol og ie u nd Ps ych iatri e Bottlender R et al. 1998, Fortschritte Neurologie und Psychiatrie 267 268 Inhibitor Pharmakokinetische Alternative Clarithromycin, Erythromycin Azithromycin Induktor Pharmakokinetische Alternative Ciprofloxacin Enoxacin CYP1A2+3A4 Levofloxacin Johanniskraut Paninduktor Citalopram, Mirtazapin, Reboxetin Duloxetin CYP2D6 Venlafaxin Ginko biloba Galantamin, Donepezil, Rivastigmin, Memantine Fluoxetin, Paroxetin, Fluvoxamin Citalopram Omeprazol, Esomeprazol Pantoprazol CYP3A4 Inhibiert CYP2C19, induziert 1A2 Grapefruitsaft Orangensaft, Apfelsaft Hemmt irreversibel CYP3A4 Dr. Eckermann 2007 Dr. Eckermann 2007 269 270 Hyponatriämie Induktor Pharmakokinetische Problemsituation 120-129 mmol/l – mittelschwer Rauchen 10 Zigaretten Cave: De-Induktion wenn pro Tag CYP1A1/2, 2E1, UGT´s Nikotinkonsum reduz. wid < 120 mmol/l schwer Cannabis (THC) Erhöhtes Lebensalter, weibliches Geschlecht, CYP 1A2 Cave: Cave: De-Induktion Polypharmazie mit intern. Medikamenten u.a. Saluretika und ACE-Hemmer ( ↓ Resorpt. im dist Tubulus) Carbamazepin, AD (SSRI, SNRI (Mirtazapin), TZA), Opiate (↑ ADH), Nikotin, NSAR Linksherzinsuff. da Volumenzunahme nach Natriumzufuhr Dr. Eckermann 2007 271 272 273 Pharmakotherapie bei Nierenfunktionsstörungen: 274 - Problematisch sind folgende Medikamente: Die meisten Psychopharmaka zeigen bei Nierenfunktionsstörungen ein geringes Risiko, einige ein mäßiges, und nur wenige sind problematisch – Unbedenklich eingesetzt werden können: • AD – Mianserin (Tolvon®) – Moclobemid (Aurorix®) – Nortriptylin (Nortrilen®) – SSRI – TZA • Phasenprophylaktika – Valproinsäure • Neuroleptika – Butyrophenone – Olanzapin (Zyprexa®) • Anxiolytika und Hypnotika – Non-Benzodiazepin-Hypnotika – Mit Vorsicht auch Benzodiazepine (mässiges Risiko) • Antidementiva – Lithium • Ausweichmedikament: Valproinsäure! – Amisulprid und Sulpirid • Ausweichmedikamente: Butyrophenone (z.B. Haloperidol (Haldol®)), Olanzapin (Zyprexa®) - Donepezil (Aricept®) 275 276 Pharmakotherapie bei Leberfunktionsstörungen: • Die meisten Psychopharmaka zeigen bei Leberfunktionsstörungen ein zumindest mäßiges Risiko, was eine Dosisanpassung erfordert – Unbedenklich eingesetzt werden können: • Lithium • Amisulprid (Solian®) und Sulpirid (Dogmatil®) • Kurzwirksame Benzodiazepine, z.B. – Lorazepam (Temesta®) – Oxazepam (Anxiolit®, Praxiten®) – Besondere Vorsicht ist geboten bei: • Trizyklika • Valproinsäure • Clozapin • Phenothiazin (v.a. Chlorpromazin) 277 Bemerkungen zu Psychopharmakotherapie in der Schwangerschaft und Stillzeit Beim Menschen teratogene Arzneimittel • • • • • • • • • • • • • • ‼! Merke: nahezu alle Psychopharmaka sind plazentagängig und gehen in die Muttermilch über !‼ Merke: besonders heikel ist eine Behandlung mit Psychopharmaka im 1. Trimenon !‼ Merke: der Gynäkologe oder Pädiater sollte in die Pharmakotherapie einer Schwangeren miteinbezogen werden !‼ Merke: folgende Problemkomplexe: • Teratogenität • Perinatal-Syndrome • Postnatale Entwicklungs- und Verhaltensstörungen 278 279 (Alkohol) Antiepileptika (klassische) !!!!!!!! Cumarin-Antikoagulanzien Diethylstilbestrol Gestagene Glucocorticoide Lithium Methimazol Misoprostol Penicillamin Retinoide !!!!!!! (Thalidomid) !!!!!!! Trimethoprim Zytostatika (insbes. Antimetabolite) 280 Antiepileptika Lithium • Klassische Antiepileptika sind teratogen, unabhängig ob eine Epilepsie behandelt wird oder eine andere Erkrankung. • Risiko für eine Ebstein-Anomalie etwa 1/1.000 nach Exposition in der Frühschwangerschaft • Spontaninzidenz Ebstein-Anomalie ca. 1/20.000 Valproinsäure • hat das höchstes embryotoxisches Risiko unter den Antiepileptika, 2-3 x höhere Fehlbildungsrate, 20-30 x häufiger Neuralrohrdefekte - Daher keine Valproinsäure für psychiatrische Indikationen 281 Selektive SerotoninWiederaufnahmehemmstoffe (SSRI) 282 Sind SSRI teratogen? Jedoch: • Schwedisches Geburtsregister: Nur bei Paroxetin schwach signifikantes Ergebnis für Herzfehlbildungen (Septumdefekte) bei nicht signifikant erhöhter Gesamtfehlbildungsrate (Källén 2007). • Spanisches Fehlbildungsregister: hoch signifikante Assoziation Paroxetin und Aortenanomalien nicht signifikant erhöhter Gesamtfehlbildungsrate. • Allerdings beruhte diese Berechnung auf nur 3 Kindern mit solchen • Fehlbildungen (Rodriguez-Pinilla 2005, pers. Mitteilung). • ENTIS-Studie: Paroxetin und Herzfehlbildungen: 7/348 (2,0%) vs. 8/1358 (0,6%); RR 3,4 (KI 1,25-9,36) (Diav-Citrin 2006) • Bupropion-Register GlaxoSmithKline (Cole 2007): bei knapp 2000 • Schwangeren mit Mono- oder Kombinationstherapie Paroxetin leicht • erhöhte Gesamtfehlbildungsrate RR 1,89 (1,2-2,6), Herzfehlbildungen nicht signifikant. • Kanad. Studie: ASD etwas häufiger und bei Kombination mit Benzos Herzfehlb. insgesamt (Oberlander 2008). • Keine Hinweise auf erhöhtes Fehlbildungsrisiko bei mehreren tausend im 1. Trimenon exponierten Schwangerschaften (z.B. Einarson 2008, Bruyère 2008, Davis 2007, Vial 2006, Garbis 2005, Malm 2005, Hallberg 2005) 283 284 Sind SSRI teratogen? (Alwan et al. 2007) • 9622 Kinder mit großen Fehlbildungen (je =>200) vs. 4092 Kindern ohne Fehlbildung • Fluoxetin und Kraniosynostose Sertralin und Anenzephalie Paroxetin und Anenzephalie Pulmonalstenosen Omphalozele Gastroschisis • Kein signifikantes Risiko für Herzfehlbildungen insgesamt. • Schwachpunkte: Insgesamt 265 Tests mit 54 positiven Ergebnissen (14 erwartet) Expositionserfassung erst 6 Wochen bis 2 Jahre nach Geburt SSRI und das Neugeborene • Etwa 30-40% der Kinder, deren Mütter bis zur Geburt SSRI nahmen, hat Anpassungsstörungen mit zentralnervösen Störungen (Übererregbarkeit, Trinkstörungen, Sedierung, vereinzelt auch Krampfanfälle) und Atemstörungen. • Diese Anpassungsstörungen dauern meist nur wenige Tage und sind häufig selbst limitierend. Sie stellen entweder einen Entzug oder serotonerge Toxizität dar (Levinson-Castiel 2006, Beaulac-Baillargeon 2006, Ferreira 2007, Moses-Kolko 2005, Pakalapati 2006, Sanz 2005). 285 SSRI und das Neugeborene • Es gibt Hinweise, dass SSRI am Ende der Schwangerschaft einen persistierenden pulmonalen Hochdruck beim Neugeborenen (PPHN) verursachen können. • Das Risiko könnte in der Größenordnung von etwa 1 auf 100 exponierte Kindern liegen (Chambers 2006, Källén 2008). • Es gibt Hinweise, dass unter SSRI vermehrt Frühgeburten auftreten. 286 Derzeitige Empfehlung zur Auswahl von Antidepressiva bei Neueinstellung und möglichem Kinderwunsch • SSRI: Sertralin, Citalopram • TCA: Amitriptylin, Clomipramin, Desipramin, Imipramin, Nortriptylin • MAO-Hemmer: Wegen möglicher hypertensiver RR-Krisen wird von der Gabe von MAO-Hemmern abgeraten 287 288 Atypika in der Schwangerschaft Publizierte Berichte Neuroleptika Die „klassischen“ Neuroleptika Haloperidol und Phenothiazine stehen nicht im Verdacht Fehlbildungen zu verursachen, sind aber nicht alle systematisch untersucht. Atypische Neuroleptika haben sich bislang ebenfalls nicht als teratogen beim Menschen gezeigt, allerdings sind sie mit Ausnahme von Olanzapin und Clozapin unzureichend untersucht. Experimentelle Teratologie: Aripiprazol bei Ratten: z.B. Zwerchfellhernien Ziprasidon bei Kaninchen: Kardiovaskuläre Fehlbildungen und Nierenveränderungen Haloperidol bei Mäusen: Gaumenspalten, Neuralrohrdefekte; bei Ratten: verringertes Hirnwachstum > mehr als 300 Schwangerschaftsverläufe publiziert 289 290 Schlussfolgerung psychiatrische Medikation in der Schwangerschaft Schlussfolgerung psychiatrische Medikation in der Schwangerschaft 1. Die eigentlichen Psychopharmaka haben bisher kein nennenswertes Fehlbildungsrisiko beim Menschen erkennen lassen – dennoch kritisch Notwendigkeit einer Therapie prüfen. 1. Stabile Einstellung der Mutter steht im Vordergrund. Kein abruptes Absetzen/Umstellen bewährter Medikation wegen vermeintlicher Teratogenität. Regelmäßige Kontrollen, ggf. Spiegelbestimmung. 2. Klassische Antiepileptika sind teratogen, vor allem Valproinsäure - daher möglichst vermeiden. 2. Sonographische Feindiagnostik nach Therapie im 1. Trimenon anbieten – keine Fruchtwasserpunktion wg Medikamenten. 3. Psychopharmaka verursachen zentralnervöse und respiratorische Anpassungsstörungen bei jedem 3. Neugeborenen ggf. Dosisreduktion vor Geburt. Entbindung in Klinik mit Neonatologie. 3. Generell bei Neueinstellung im reproduktionsfähigen Alter länger erprobte Medikamente vorziehen. Neue Mittel sind keineswegs immer besser. 4. Kritische Erörterung einer Familienplanung bei instabiler Patientin! 291 292 Psychopharmaka in der Stillzeit • Es gibt hinreichend gut untersuchte TCA, SSRI und Neuroleptika, die grundsätzlich Stillen erlauben. Bei sorgfältiger Auswahl sind Symptome beim Kind selten. • Ebenso wie in der Schwangerschaft sollte auch in der Stillzeit die Therapie einer stabilen Patientin nicht geändert werden, selbst wenn sie ein unzureichend untersuchtes Medikament einnimmt. • Vorsicht jedoch bei Opiaten und Benzodiazepinen, insbesondere wenn diese neu angesetzt werden, das Kind ein Frühgeborenes ist, unter 2 Monaten und/oder unter Atemstörungen leidet. SSRI und SNRI in der Stillzeit • Citalopram: im Plasma des Kindes Ja, aktiver Metabolit in Milch Nein, UAW beim Kind unruhiger Schlaf • Escitalopram: im Plasma des Kindes Nein, UAW beim Kind Irritabilität • Fluoxetin: im Plasma des Kindes Ja, aktiver Metabolit in Milch Ja, UAW beim Kind Irritabilität, Krämpfe • Fluovoxamin: im Plasma des Kindes Ja, aktiver Metabolit in Milch Nein, UAW beim Kind Ikterus • Mirtazapin: im Plasma des Kindes Ja, aktiver Metabolit in Milch Ja, UAW beim Kind – • Paroxetin: im Plasma des Kindes Nein, aktiver Metabolit in Milch Nein, UAW beim Kind – • Sertralin: im Plasma des Kindes Ja, aktiver Metabolit in Milch Ja, UAW beim Kind unruhiger Schlaf • Venlafaxin: im Plasma des Kindes Ja (Metabolit), aktiver Metabolit in Milch Nein, UAW beim Kind -- 293 294 Komplikationen bei der Einnahme von Psychopharmaka: Lithium in der Stillzeit • Relative Dosis zwischen 0 und 30% (11 Mutter-KindPaare; Moretti 2003), in der Hälfte der Fälle waren es jedoch unter 10%. • Im Serum der Säuglinge nach Absinken der postnatal hohen Werte kaum ein Drittel der mütterlichen Werte. Keiner der 11 Säuglingen zeigte verdächtige Symptome • Jedoch andere Publikation: 2 Monate alter Säugling mit Tremor und abnormem Bewegungsmuster (Serumwerte 2x so hoch wie die der Mutter (Übersicht in Llewellyn 1998) 295 Serotonin-Syndrom • Das Serotonin-Syndrom (seltener auch serotonerges Syndrom) tritt durch einen Serotonin-Überschuss im Gehirn auf, welcher in der Regel durch die Einnahme (besonders in Kombination) von MAO-Hemmern, SSRI, trizyklischen Antidepressiva und Johanniskraut ausgelöst wird. • Meist tritt das Serotonin-Syndrom vier bis sechs Wochen nach Beginn der Medikamenteneinnahme auf. 296 Auslöser : Symptome eines Serotoninsyndroms autonom vegetative Symptome Pulsanstieg Blutdruckanstieg Schwitzen „Grippegefühl“ Übelkeit (akutes) Erbrechen Durchfall Kopfschmerzen schnelle Atmung Pupillenerweiterung Klasse Wirkstoffe Antidepressiva MAOIs, TCAs, SSRIs, Mirtazapin, Venlafaxin Opioide Tramadol, Pethidin ZNS Stimulanzien Phentermin, Diethylpropion, Amphetamin, Sibutramin, MDMA, Kokain 5-HT1 Agonisten Triptane Andere Selegilin, Tryptophan, Buspiron, Lithium, Linezolid, Dextromethorphan Symptome einer zentralnervösen Erregung Unruhe Akathisie (Sitzunruhe) Halluzinationen Hypomanie Störungen des Bewusstseins Koordinationsstörungen neuromuskuläre Symptome Tremor gesteigerte Reflexe Myoklonie pathologische Reflexe Krämpfe Anfälle 297 Auslösende Substanzen: • Serotonerge Medikation, v.a. – SSRI – MAO-Hemmer – Trizyklische Antidepressiva – Lithium – Kokain/Amphetamin SSRI Discontinuation Syndrome SSRI Discontinuation Syndrome (SSRI Absetzsyndrom), ist ein Zustand, der beim abrupten oder nicht abrupten Absetzen von Selektiven Serotonin- und/oder Noradrenalin-Wiederaufnahmehemmern (SSRI, SNRI) auftreten kann. Beschreibung Risiko: • Kombinationen, insbesondere – MAO-Hemmer mit anderen Antidepressiva – SSRI mit L-Tryptophan – SSRI mit Lithium – cave auch Antidepressiva und Opiate mit Serotoninwirkung wie Tramadol oder Pethidin • Poor-metabolizer-Status Pathophysiologie: • zentrale Serotoninwirkung • "Serotonin syndrome is the result of overstimulation of 5-HT1A receptors in central grey nuclei and the medulla and, perhaps, of overstimulation of 5-HT2 receptors." (Birmes et al., 2003) Therapie: • Absetzen des verursachenden Medikaments • evtl. Dantrolen (Dantamacrin®) • evtl. Cyproheptadin (Peritol®) • Intensivmedizinisches Monitoring, Sicherung der Vitalfunktionen • Symptomatische Behandlungsmaßnahmen 298 299 • Absetzerscheinungen treten in der Regel in den ersten 24 Stunden bis 1 Woche nach Absetzen ein. Der Zeitpunkt des Eintretens der Symptome hängt unter anderem von der Dosis der Medikation und der Halbwertszeit der Wirksubstanz ab. Die bei SNRI vergleichsweise starken Absetzerscheinungen können durch die gleichzeitige Einnahme von Fluoxetin vermindert werden. • SSRI haben kein Abhängigkeitspotential im konventionellen Sinn. Ein plötzliches Absetzen der Wirkstoffgruppe kann aber sowohl körperliche und psychische Entzugserscheinungen hervorrufen. • Das Einstellen der Behandlung mit Dopamin-Antagonisten kann eine intensive Psychose mit Merkmalen wie Größenwahn, Halluzinationen und erhöhtem Suizidrisiko hervorrufen. Es wird empfohlen, die Dosis nur in kleinen Schritten (Verringerung um 10% der Erhaltungsdosis) und unter Überwachung eines Arztes zu verringern. • Obwohl das Syndrom durch bekannte Symptome nicht eindeutig identifiziert werden kann, ist es wahrscheinlich dass Patienten mit Verwirrtheitszuständen, grippeartigen Zuständen und Schlaf- oder Empfindungsstörungen innerhalb 24 bis 72 Stunden300 nach dem Absetzen Absetzerscheinungen entwickeln. Symptome Folgende Symptome können beim SSRI Absetzsyndrom auftreten: • Orthostatische Störungen (Kreislaufbeschwerden), Schwindel und Gleichgewichtsstörungen bei Kopfbewegungen wie drehen des Kopfes oder horizontale Bewegungen der Augen (Blick nach links oder rechts) • Empfindungsstörungen wie Schwindel, Höhenangst und Empfindungen, die an leichte Stromschläge erinnern und meist ausgehend von der Mitte des Körpers in die Extremitäten ausstrahlen oder auch am ganzen Körper auftreten; Tinnitus • Motorische Störungen (Zucken, Tics) und Schwierigkeiten bei alltäglichen Bewegungen (aufstehen, gehen) • Schlafstörungen, lebhafte Träume, Müdigkeit, Tagschläfrigkeit (das Gefühl, plötzlich einzuschlafen) • Verdauungsstörungen (Durchfall, Verstopfung), körperliches Unwohlsein (Kopfweh, verstopfte Nase, Abgeschlagenheit, Knochen- und Gelenksschmerzen, fieberartige Zustände) • Stimmungsschwankungen, Muskelkrämpfe, Zittern, aggressives Verhalten, Manie, schwere Depression und Suizidgedanken Anzeichen für ein SSRI Discontinuation Syndrom: • Unterbrechung, Beendigung oder Verringerung der Dosis einer mit SSRI oder SNRI geführten Behandlung über vier Wochen oder länger • Symptome, die sich im sozialen Umfeld bemerkbar machen • Symptome, die nicht von der Wirkung von anderen Medikationen, deren Absetzen oder Drogenkonsum verursacht werden können • Symptome, die nicht denen entsprechen, wogegen die Behandlung mit SSRI begonnen wurde • Diese Symptome verschwinden bei erneuter Erhöhung der Dosis auf die gewohnte Menge. 301 Mechanismus 302 Prävention und Behandlung • Absetzerscheinungen beim Absetzen von Antidepressiva indizieren nicht Sucht im allgemeinen Sinn, sie sind mehr das Ergebnis der Versuche des menschlichen Gehirns, erneut ein neurochemisches Gleichgewicht nach dem Absetzen des Medikaments zu erzeugen. • Diese Symptome können meist durch Ausschleichen (langsames Verringern der Dosis) über die Dauer von Wochen oder Monaten vermindert oder gänzlich verhindert werden. Auch diese Methode ist aber speziell bei Patienten mit Langzeitbehandlung nicht immer erfolgreich. 303 • Die Patienten sollten über die kurze Halbwertszeit von SSRI informiert werden. Speziell bei einer Umstellung auf Medikamente mit kürzerer Halbwertszeit (beispielsweise Paroxetin), ist dieser Punkt wichtig. • Obwohl nicht sichergestellt werden kann, dass das SSRI Discontinuation Syndrom nicht auftritt, können das Wiedereinsetzen der Erhaltungsdosis sowie das langsame Ausschleichen die Symptome mildern oder ganz verschwinden lassen. • Trizyklische Antidepressiva (bspw. Amitriptylin) können leichte bis mittelschwere Entzugserscheinungen, insbesondere Kreislaufbeschwerden, lindern. 304 Langzeitsymptome Post SSRI Sexual Dysfunction • Bei einigen Patienten, speziell jene unter Langzeitmedikation oder großen Dosen, können Langzeitsymptome auch lange nach Beendigung des Absetz-Syndroms auftreten. • Hierbei können leichtere (Verwirrtheit, schlechtes Kurzzeitgedächtnis, Konzentrationsschwierigkeiten, Tinnitus) oder schwere Symptome (Psychomotorische Unruhe, Tachykardie, Depersonalisierung), • sexuelle Dysfunktion in Form von Post SSRI Sexual Dysfunction (PSSD) oder Persistent sexual arousal syndrome (= sexuelle Dauererregung, v.a. Frauen, bis zu 250 Orgasmen/d, Auslöser sind leichte Vibrationen-z.B. Bus fahren, Fön, seit 2001 bekannt) extreme Angstzustände wie vor der Behandlung mit SSRI auftreten. • Bisher wurde nur wenig über diese Phänomene geforscht. Zuverlässige wissenschaftliche Analysen sind derzeit nicht verfügbar. Berichten von Patienten zu folge, verbessern sich die Langzeitsymptome nach dem Absetzen von SSRI innerhalb von zwei Jahren signifikant. Es gibt aber auch Fälle, in denen die Symptome nie wieder abklingen. Symptome: Eines oder mehrere der folgenden sexuellen Symptome beginnen mit dem Absetzen des SSRI vor allem bei Langzeitmedikation und hohen Dosen oder bleiben über das Absetzen hinaus bestehen: • verminderte oder nicht vorhandene Libido • Impotenz oder reduzierte Vaginalbefeuchtung • Schwierigkeiten, eine Erektion oder sexuelle Erregung hervorzurufen oder aufrechtzuerhalten • andauernde genitale Erregungsstörung trotz fehlender sexueller Erregtheit • schwacher, verspäteter oder fehlender Orgasmus (Anorgasmie) • Orgasmus ist weniger oder überhaupt nicht befriedigend (ejakulatorische Anhedonie) • vorzeitiger Orgasmus • verminderte Empfindlichkeit des Penis, der Vagina oder der Klitoris • genitale Gefühlstaubheit • keine oder verminderte Reaktion auf sexuelle Reize • vermindertes Sperma-Volumen • Dauererektion (Priapismus) • Emotionale Abstumpfung 305 306 Malignes Neuroleptisches Syndrom Risikofaktoren • • Die Entstehung des malignen neuroleptischen Syndroms kann durch Risikofaktoren begünstigt werden. Dazu zählen beispielsweise • MNS in der Anamnese • • • Das maligne neuroleptische Syndrom (MNS) ist eine seltene Nebenwirkung der Einnahme von Neuroleptika. Es stellt einen in der Psychiatriegefürchteten Notfall dar, weil es schnell verläuft und rasch lebensbedrohliche Komplikationen verursachen kann. Risiko: Kombinationen, hohe Medikamentendosen bei etwa 1‰ - 1% aller Neuroleptikabehandlungen, nach Behandlungsbeginn oder nach Dosissteigerung zurückliegendes MNS, dann Rezidivrate um 15-30% Auslösende Arzneistoffe • Als Auslöser eines MNS kommen in Betracht: Carbamazepin, Chlorpromazin, Perazin, Pipamperon, Triflupromazin (niederpotente Neuroleptika), Chlorprothixen, Flupentixol (Thioxanthene), Desipramin, Trimipramin (Trizyklische Antidepressiva), Domperidon, Metoclopramid (Prokinetika), Fluphenazin, Perphenazin (Phenothiazine allgemein), Haloperidol, Benperidol, Melperon (Butyrophenone), Lithium, Pimozid, Risperidon, Aripiprazol (alle atypischen Neuroleptika), Sertralin, Escitalopram (SSRI), Sulpirid, Amisulprid (Benzamide),Tiaprid, Venlafaxin (SNRI) 307 – speziell in den ersten beiden Wochen nach einem MNS besteht extremes Risiko des Wiederauftretens • rasche Dosiserhöhung eines Neuroleptikums • Einnahme hochpotenter (stark antipsychotisch wirkender) Neuroleptika • hohe Dosierung • bestehende Gehirnschäden • Neuroleptika-Verabreichung an Kinder oder Jugendliche • parenterale Neuroleptika-Verabreichung (i. v., i. m.) 308 Symptome: Differenzialdiagnose • Das maligne neuroleptische Syndrom ist gekennzeichnet durch extrapyramidal-motorische Störungen - darunter – Akinese (Bewegungsarmut), Rigor (Muskelstarre) (typisch); extreme Muskelsteife (Rigidität) (ähnlich dem Befund bei maligner Hyperthermie) – nur gelegentlich: Tremor – Hyporeflexie – Opisthotonus (Überstreckung der Rumpfmusk.+ Extremitäten, starke Rückwärtsneigung des Kopfes), Trismus (Mund-oder Kiefersperre) – Blickkrämpfe, u. a. • • • • • Dem MNS ähnliche Bilder können auftreten bei Serotonin-Syndrom Maligner Hyperthermie (in der Anästhesie) Hitzschlag hypokinetischer Krise (beim ParkinsonSyndrom) • Infektionen des ZNS • Drogengebrauch • febrile Katatonie (bei schizophrener Psychose) • Vegetative Entgleisung - beispielsweise mit – Fieber (typisch), starkem Schwitzen – Tachykardie, Tachypnoe, Blutdruckänderungen – Harn- bzw. Stuhlinkontinenz oder Harnverhalt • psychische Störungen - z. B. – – – – – Stupor/ Katalepsie (Bewegungsstarre) Verwirrtheit Mutismus (Spracharmut) Bewusstseinsstörungen bis zum Koma Katatonie (unnatürliche, stark verkrampfte Haltung des Körpers) • auffällige Laborbefunde - etwa – – – – extreme CK- sowie Transaminasen-Erhöhung Myoglobinurie (bei Rhabdomyolyse) Leukozytose metabolische Azidose 309 Behandlung • Wichtigste Maßnahme und kausale Therapie ist das Absetzen des auslösenden Medikaments. • Alle weiteren Maßnahmen sind eher unterstützend und beziehen sich auf die Sicherung der Lebensfunktionen (ggf. Beatmung, Rehydratation) und auf die Vermeidung weiterer Komplikationen (etwa durch Wadenwickel zur Fiebersenkung). • An Medikamenten werden u. a. eingesetzt: • Heparin zur Thrombose- und Embolie-Prophylaxe • Benzodiazepine zur Muskelrelaxation, auch zur Sedation • Dantrolen zur Beherrschung der Muskelrigidität (siehe maligne Hyperthermie) • Amantadin oder Bromocriptin zur Behebung der Akinese und der Parkinson-Symptome 311 310 Verlauf und Prognose • Das MNS beginnt meistens hochakut und fulminant. Die Eintrübung, sowie besonders Muskelstarre und Fieber können dabei rasch zunehmen und schnell eine lebensgefährliche Dekompensation (Endpunkt: Multiorganversagen) bewirken. Das maligne neuroleptische Syndrom muss darum auf der Intensivstation behandelt werden. • Die Letalität des MNS beträgt unbehandelt bis 20 Prozent. Sie ist in letzter Zeit rückläufig. Entscheidend für den Verlauf des MNS sind das Erkennen der Erkrankung, und das sofortige Absetzen des Neuroleptikums. Die Dauer einer MNS-Erkrankung beträgt insgesamt etwa fünf bis zehn Tage. • Ein malignes neuroleptisches Syndrom kann in der Zeit nach überstandener Erkrankung besonders schnell wieder auftreten. Daher kann jegliche neuroleptische Medikation nur extrem vorsichtig wieder aufgenommen werden, möglichst mit niederpotenten Stoffen oder atypischen Neuroleptika und in niedrigen Dosen. 312 Neurotransmitter-toxische Syndrome ►Zentrales anticholinerges Syndrom Risiko: • hohes Alter • zerebrale Vorschädigung • Medikamentenkombinationen Auslösende Substanzen: • Atropin • Antidepressiva • Neuroleptika • Antihistaminika • Tollkirsche, Bilsenkraut, Stechapfel, Engelstrompete Pathophysiologie: • Blockade zentraler muscarinischer (Acetylcholin-) Rezeptoren 313 ►Adrenerges Syndrom Auslösende Substanzen: • Desipramin, Imipramin, Nortriptylin, Kombinationen auch Reboxetin? Amphetamine? Therapie: • Absetzen des verursachenden Medikaments • evtl. Physostigmin (Anticholium®, cave Bradykardie, Arrhythmie, Asthma, Gefäßstenosen) • Intensivmedizinisches Monitoring, Sicherung der Vitalfunktionen • Symptomatische Behandlungsmaßnahmen • Zuwendung, Reorientierungshilfe 314 ►Zentrales antihistaminerges Syndrom Auslösende Substanzen: • Dimenhydrinat, Promethazin • Olanzapin, Quetiapin • Antidepressiva, z.B. Amitriptylin, Mirtazapin Pathophysiologie: • Hemmung der Noradrenalin-Wiederaufnahme Symptome: • zentrale Stimulation • Krämpfe • Tremor • (labile) arterielle Hypertonie, Tachykardie • Verstärkung adrenerger Wirkungen Symptome: • delirante Symptomatik mit – Desorientiertheit, Aufmerksamkeitseinschränkung, Auffassungsminderung – Erregung, Angst, motorischer Unruhe – (optischen) Halluzinationen, Verkennungen, Paranoia – Dysarthrie, Asterixis, Tremor • Mydriasis, Akkomodationsstörung, Glaukomgefahr • trockene Haut, Hyperthermie, Mundtrockenheit • Harnverhalt, Obstipation bis zum paralytischen Ikterus • Tachykardie, tachykarde Herzrhythmusstörungen • Krampfanfälle • Bewußtseinsstörungen bis zum Koma Symptome: • delirantes Syndrom • Sedierung • Blutdruckabfall 315 316 ►Entzugssyndrom ►Katatones Syndrom Psychische/neurologische Entzugssymptome: • delirantes Syndrom mit Desorientiertheit, Verwirrtheit, Angst, psychomotorischer Unruhe, optischen Halluzinationen, ggf. Paranoia • Schwindel, Koordinationsstörungen, Tremor • Kopfschmerzen, Gliederschmerzen, Muskelschmerzen • evtl. Krampfanfälle • evtl. Bewusstseinsstörung Vegetative Entzugssymptome: • Tachykardie • Blutdruckerhöhung • Schwitzen, evtl. Fieber • Übelkeit, ggf. Erbrechen Risiko: • unbehandelte katatone Schizophrenie Symptome: • • • • • • Stupor, Mutismus "wächserne Biegsamkeit" (Haltungs-) Stereotypien, Manierismen, Katalepsie Negativismus, Befehlsautomatie, Echopraxie "perniziöse Katatonie": Fieber, Exsikkose Gefahr eines Raptus Therapie: • • • • Antipsychotische Medikamentenbehandlung ggf. Sedierung evtl. Sicherung/Fixierung evtl. Elektrokrampftherapie 317 318 Differentialdiagnose: • Bei allen Syndromen bis auf die Katatonie kommt eine delirante Symptomatik vor. • Alle gehen mit Fieber einher, allenfalls die Katatonie nicht, das Entzugssyndrom unregelmäßig. • Das anticholinerge Syndrom unterscheidet sich durch Mydriasis und trockene, rote Haut und ist nicht akinetisch-rigorös. • Das Serotoninsyndrom, das MNS und die Katatonie zeigen einen erheblichen Rigor. • Bei serotonerger Überstimulation treten abdominelle Schmerzen/Krämpfe und Diarrhoe auf, Myoklonien und Reflexsteigerung. • Das MNS ist durch besondere Ausprägung von Akinese und Rigor gekennzeichnet, Leukozyten, CK und Myoglobin sind erhöht. • Die Katatonie ist weniger delirant als psychotisch, stupurös/mutistisch und zeigt Stereotypien, bizarre Haltungen und Katalepsie. • Entzugssyndromen fehlen in der Regel bizarrer Psychotizismus und extrapyramidalmotorische Symptome. • Die Anamnese ergibt den entscheidenden Hinweis, sofern der Patient Auskunft geben kann oder will. • Die Patienten sind oft polyneuropathisch, myopathisch, hepatotoxisch und im Aspekt stigmatisiert. 319 320 Wirkstoff CH D/A Info Antidepressiva Psychopharmaka und Psychopharmakotherapie in der Psychiatrie Überwiegende oder selektive Serotonin-RI Überwiegende 5HT-RI (auch anticholinerge und anti-a1-adrenerge Eigenschaften) SSRI: Seletiver Serotonin-RI (keine Medikamenten-Liste antihistaminerge und keine oder minimale anticholinerge Potenz) Clomipramin (TZA) Anafranil Anafranil Auch für Zwangsstörung, Angststörung, Katalepsie und chronische Schmerzsyndrome zugelassen Fluoxetin Fluctine Fluctine Auch für Panikstörung, Zwangs-störung, Bulimie und prämenstruelles Syndrom zugelassen Fluvoxamin Floxyfral Floxyfral Auch für Zwangsstörung, soziale Phobie , Panikstörung und Bulimie zugelassen Paroxetin Deroxat Seroxat Auch für Zwangsstörungen, Angst-Störung, Panikstörung, soziale Phobie und prämenstruelles Syndrom zugelassen Sertralin Gladem Tresleen Auch für 322 Zwangsstörung, Panikstörung, sozialer Phobie, PTSD und prämenstruelles Syn. Amitriptylin (TZA) Saroten Saroten Stark sedierend (H1Blockade) Amitriptylinoxid (TZA) --- Equilibrium Stark sedierend (H1Blockade) Dibenzepin (TZA) Noveril Noveril Vergleichsweise gering sedierend Doxepin (TZA) (besonders sedierend wegen starker antihistaminerge Wirkung) Sinquan Sinequan Stark sedierend (H1Blockade) Imipramin (TZA) Tofranil Tofranil Sedierend. Auch für Panikstörungen, Enuresis und Kataplexie zugelassen 321 Citalopram SNRI: Selektive (überwiegend) 5HT-, aber auch NARI. Keine Seropram Pram Venlafaxin Efectin Milnacipran Ixel antihistaminerge, anticholinerge oder antoadrenerge Potenz Duloxetin Cymbalta Dual-serotonerge AD (überwiegende 5-HT-RI + 5-HT2Antagonist) Nefazodon Nefadar Nefedar Auch für Panikstörung zugelassen Angststörungen, Sozialphobie, Kombinierte 5-HTund NA-RI Diabet. PNP (alle haben in unterschiedlicher Ausprägung auch anticholinerge und a1antiadrenerge Effekte) Potenter Inhibitor von CYP 3A4, cave mit Komedikationen Überwiegende oder selektive NA-RI Überwiegende NA-RI Nortriptylin (TZA) Nortrilen Nortrilen Nur gering anticholinerg Nur gering anticholinerg Desipramin (TZA) --- Pertofran Lofepramin (TZA) Gamonil Gamonil Maprotilin (TetraZA) Ludiomil Ludiomil Viloxazin --- Vivalan Überwiegende NA-RI + H1-, 5-HT2- und a1/a2-antagonistische Effekte Mianserin (TetraZA) Tolvon Tolvon NARI: Selektiver NA-RI Reboxetin Edronax Edronax Sedierend. Nur gering anticholinerg Sedierend 323 324 NDRI: Überwiegende oder selektive DA/NARI MAO-Hemmer (reversibel) Bupropion Zyban Wellbutrin XR Moclobemid (MAO-AHemmer) Aurorix Aurorix Selegilin (MAO-BHemmer) Selegilin Selegilin Auch für soziale Phobie zugelassen. Häufiger Schlafstörungen Phasenprophylaktika Lithium Lithiumcarbonat Quilonorm Quilonum Valproinsäure Valproat Orfiril, Depakine Orfiril Carbamazepin Carbamazepin Tegretol Tegretal Andere Wirkmechanismen Fehlende Monoamin-RI; antihistaminerg, anticholinerg, antiserotonerg, a1antiadrenerg SARI (SerotoninAntagon.+RI: Schwache 5-HT-RI ; antagonistisch an 5HT2- und a1adrenergen Rezeptoren Weitgehend fehlende Monoamin-RI; NaSSA antagonistische Wirkung an H1-, 5-HT2-, 5-HT3und a2-adrenergen Rezeptoren Trimipramin (TZA) Trazodon Surmontil Trittico Trittico Häufiger Priapismus Aufklärung Remeron Mirtabene Sedierend. Bisher im Ggs. zu TZA und SSRI keine sexuellen Funktionsstörungen Mirtazapin (TetraZA) Noradrenerges und spezifisch serotonerges Antidepressivum(NaSSA) SRE (Serotonin-R-Verstä Vermutlich schwache 5HT-, NA- und DA-RI durch den Inhaltsstoff Hyperforat SNRI Stangyl Stablon Hypericum ReBalance Jarsin 325 326 Photosensibilität! Neuroleptika Butyrophenone Benperidol --- Glianimon Bromperidol --- Impromen Chlorpromazin Chlorazin Propaphenin Haloperidol Haldol Haldol Fluphenazin Dapotum Dapotum Pipamperon Dipiperon Dipiperon Levomepromazin Nozinan Neurocil Melperon --- Eunerpan Perphenazin Trilafon Decentan Thioridazin Melleril Melleril Risperidon Risperdal Risperdal Promazin Prazine Protactyl Chlorprotixen Truxal Truxal Clopentixol --- Ciatyl Zuclopenthixol Clopixol Ciatyl-Z Sulpirid Dogmatil Dogmatil Antivertiginosum Flupentixol Fluanxol Fluanxol Dibenzodiazepine Clozapin Leponex Leponex Thienobenzodiazepin Olanzapin Zyprexa Zyprexa Amisulprid Solian Solian Antidepressive und Wirkung auf Negativsymptomatik in niedriger Dosierung Phenothiazine Thioxanthene Benzisoxazol(piperidin) Benzamide Dibenzothiazepin Quetiapin Seroquel Seroquel (selektive Blockade von D2-artigen Rezeptoren, vorwiegend im mesolimbischen und tuberoinfundibulären, weniger im nigrostriatalesn System) 327 328 Anxiolytika Benzodiazepine (HWZ) ß-Blocker Diazepam Diazepam, Valium Diazepam, Valium Chlordiazepoxid +Amitriptylin Limbatril Limbatril Chlordiazepoxid --- Librium Dikaliumclorazepat Tranxilium Tranxilium Prazepam Demetrin Demetrin Clobazam Urbanyl Frisium Alprazolam Xanax Xanax Bromazepam Lexotanil Lexotanil Propranolol Inderal Dociton Flunitrazepam (20-30), aktiver Metabolit Rohypnol Rohypnol Flurazepam (Kumulationsgefahr, bis 250), drei aktive Metaboliten Dalmadorm Dalmadorm Lormetazepam (8-15), kein aktiver Metabolit Noctamid Noctamid Triazolam (1,5-5), kein aktiver Metabolit Halcion Halcion Chloralhydrat Chloralhydrat Chloraldurat rot/blau Chloraldurat rot/blau Promethazin (Phenothiazinderivat) Promethazin Promethazin Atosil Non-BenzodiazepinHypnotika Zolpidem Stilnox Stilnox Zopiclon Imovane Ximovan Hypnotika Benzodiazepin-Hypnotika Lorazepam Oxazepam Partieller 5-HT1a-Agonist Buspiron Buspar Bespar H1-Blocker (+antiadrenerg, + anticholinerg) Hydroxyzin Atarax Atarax H1-Blocker (+antidopaminerg, + 5HT2a-antagonistisch Opipramol Insidon Insidon Unbekannte Wirkung, vermutlich an GABARezeptoren 329 Kava-Kava Kavasedon Kavasedon, Limbao 120 330 Suchtbehandlung Alkohol Antidementiva AzetylcholinesteraseHemmer Partieller aAdrenozeptor- und 5HT-Mechanismus Gingko biloba Donepezil Aricept Aricept Rivastigmin Exelon Exelon Tacrin --- Cognex Co-dergocrin Hydergin Hydergin Entzugsbehandlung Clomethiazol Distraneurin Distraneurin Entwöhnungsbehandlung (Antagonismus des glutamergen Systems NMDA-Rezeptorkomplex) Acamprosat Campral Campral Intoxikationsbehandlung Neuroleptika s. dort (Haldol) Benzodiazepine Entzugsbehandlung --- Entwöhnungs-behandlung --- Antidot Flumazenil Anexate Anexate Clonidin Catapresan Catapresan Gingko biloba Opiate (z.B. Codein, Heroin, Methadon) NMDA (Glutamat)Antagonist Memantin --- AkatinolMemantine Ca-Antagonist Nimodipin Nimotop Nimotop Uneinheitlicher Wirkmechanismus Piracetam Nootropil Nootrop Entzugsbehandlung Benzodiazepine s. dort (Diazepam) 331 Entwöhnungsbehandlung Naltrexon Nemexin Nemexin Antidot Naloxon Narcan Narcanti 332 Kokain, Amphetamine, "synthetische Drogen" (Ecstasy, MNMA, MDA) Nikotin Entzugsbehandlung Benzodiazepine Entwöhnungsbehandlung Antidepressiva s. dort Intoxikationsbehandlung Benzodiazepine s. dort Entzugsbehandlung Nikotinpflaster Bupropion Neuroleptika s. dort Entwöhnungbehandlung --- Intoxikationsbehandlung --- Zyban nicht zugelassen Ca-Antagonisten Psychotomimetika (LSD, Meskalin, Psilocybin u.a.) Sexualtherapeutika Entzugsbehandlung --- Entwöhnungsbehandlung --- Intoxikationsbehandlung Benzodiazepine s. dort Neuroleptika s. dort Sildenafil. Förderung der Erektion durch Hemmung des Abbaus von cGMP über Blockierung der Phosphodiesterase Viagra Viagra Cyproteronazetat Androcur Androcur Cannabis Entzugsbehandlung --- Entwöhungs-behandlung --- Intoxikations-behandlung Benzodiazepine s. dort Neuroleptika s. dort 333 334 Wirkungsmechanismus/Angriffspunkte Stimulantien Stoffe • Methylxanthine (z.B. Koffein) und Amphetamine und Verwandte Amphetamine (wie auch Dopamin, NA und A): Abkömmlinge des Phenylethylamins (sind aber im Gegensatz zu den anderen Katecholaminen relativ lipophil), schwache bis mäßig starke Basen; können die Blut-Hirn Schranke permeieren • besonders wirksam: linksdrehende Formen von Amphethamin und Methamphetamin (zentral wirksam) • Hydroxylgruppe am -Kohlenstoff; Lipophilie, dadurch weniger zentral wirksam z.B. Norpseudoephedrin (Appetitzügler) • bestimmte Substituenten (Methoxygruppe), zusätzlich halluzinogene Wirkung (Bsp.: Ecstacy) 335 Amphetamin (alpha-Methylphenethylamin, auch Phenylisopropylamin oder umgangssprachlich Speed) als Substrat des Monoamintransporters in der Plasmamembran von dopaminergen, noradrenergen und adrenergen Neuronen (und in der Speichervesikelmembran) Konkurriert mit Monoaminen (v.a. NA und A) um die Aufnahme in entsprechende Nervenenden und Vesikel Keine Affinität zu Adrenozeptoren oder Dopaminrezeptoren Wirkung ist also indirekt durch nicht exocytotische, transportervermittelte Freisetzung von Neurotransmittern (NA-Konzentration in der Zelle steigt stark an, da keine Aufnahme in Vesikel; Umkehr des Na+-Carriers ⇒ NA und Na+ aus der Zelle) Peripherie: NA; zentral: NA, DA, u.U. auch A ⇒ Wiederholte Gabe führt zur Toleranzentwicklung durch Entleerung der Monoaminspeicher (da Aufnahme von Monoaminen in die Speicher gehemmt) 336 Therapeutische Wirkung Amphetaminwirkung • • ⇒ Kompetetive und reversible Hemmung des intraneuronalen Abbaus von NA durch MAO ⇒ Hemmung der Wiederaufnahme von NA in die Vesikel → Carriervermittelter Transport von NA aus der Zelle ⇒ Agonistische Wirkung an Catecholamin- und Serotoninrezeptoren; enzymatische Umwandlung in falsche Transmitter mit geringerer Affinität zu Adrenozeptoren; Auch früher als Weckamine bezeichnet therapeutisch nur zentrale Wirkungen bedeutsam: in geringen Dosen (5-10mg) Freisetzung von Dopamin und Noradrenalin im Gehirn Dopamin ⇒ euphorisierend (mesolimbisch) Noradrenalin ⇒ antriebssteigernd, stimulierend (Leistungssteigerung, Unterdrückung von Hunger und Müdigkeit) • • Indikationen • • • Narkolepsie (Methylphenidat; Fenetyllin) hyperkinetisches Syndrom bei Kindern (Methylphenidat- Ritalin®; Fenetyllin) Appetitzügler (Norpseudoephedrin) Nebenwirkungen NA: peripher Vasokonstriktion (Blutdruck ↑), Schwitzen, Mundtrockenheit, Tremor, reflektorische Bradykardie, Tachyarhythmien, extrem: Myokardinfarkt; Mißbrauch kann zum Tod führen als Crack(Kokainsalz+Natron/Backpulver), Speed, Crystal (N-Methylamphetamin, auch Methamphetamin oder Metamfetamin genannt (umgangssprachlich Crystal Meth, abgekürzt Meth oder Crystal), Ice (Base von Metamphetamin) in der Drogenszene → führen zu extremer psychischer Abhängigkeit und Gewöhnung (Toleranz); aber keine ausgeprägte körperliche Abhängigkeit: kein Entzugssyndrom, nur einige akute Absetzerscheinungen (den normalen Folgen entgegengesetzt) • • • 337 338 Cocain • Akute Vergiftungen • bei sehr hohen Dosen: viel Dopamin im ZNS → psychotische Zustände, Wahn, Halluzinationen (auch nach chronischer Anwendung; für mehrere Tage), Krämpfe, Delir Alkaloid, chemisch mit dem Atropin verwandt Wirkmechanismus • • • Wechselwirkungen • mit MAO-Inhibitoren: Verstärkung der Wirkung Hemmung der Zellmembran-Carrier für NA, DA und Serotonin in höheren Konzentrationen Blockade spannungsabhängiger Na+-Kanäle → lokalanästhetisch psychotrope Wirkung vermutlich v.a. durch Wiederaufnahmehemmung von NA, DA und Serotonin; Euphorie vermutlich v.a. Dopamin (Beteiligung an der mesolimbischen dopaminergen Belohnungsbahn) Zentralnervöse Wirkung • • • • • • • Pharmakokinetik • gute Lipidlöslichkeit, daher nahezu vollständige Resorption • Ausscheidung über die Niere, unverändert und als Konjugat mit Glucuronsäure Verminderung der Müdigkeit Gefühl der Leistungsfähigkeit Intensivierung angenehmer Empfindungen Unterdrückung von Hunger Unruhe/Angst in hohen Dosen visuelle und taktile Halluzinationen Krämpfe Kreislaufwirkungen • 339 • periphere Mechanismen: sympathisch innerviertes Gewebe → ↑ der NAWirkung, z.B. ↑ der positiv chronotropen Wirkung von NA und elektr. Stim. auch über zentralnervöse Steigerung des Sympathikustonus → Blutdruck ↑340 und Tachykardie Rauschmittel: Cannabis Stoffe Pharmakokinetik • • bei Inhalation steigt der Plasmaspiegel fast so schnell an, wie bei intravenöser Injektion (bei oraler oder nasaler Applikation langsamer) → erklärt den intensiven „flash“ • fast vollständige Metabolisierung; HWZ (Plasma) etwa 1 h • Toleranz gegen Euphorie schnell, gegen Kreislaufwirkung kaum → Abhängigkeitsgefahr • kaum körperliche Entzugssymptome Vergiftung • v.a. Herz-Kreislaufprobleme 341 • • • Je nach Zubereitung: Haschisch (Harz der Spitzen der weiblichen Hanfstaude; 36% ∆9THC) Marihuana (tabakartiges Gemisch aus getrockneten Blättern und Blüten; 1-3% ∆9THC) Haschischöl (30-50% ∆9THC) ⇒ Hauptwirkstoff: ∆9 Tetrahydrocannabinol (∆9THC) Wirkungsmechanismen und Angriffspunkte • Wirken über den Cannabiniod-Rezeptor (an G-Protein gekoppelt: Aktivierung hemmt die Adenylatcyclase und blockiert Ca+-Kanäle) • Vorkommen v.a. in Basalganglien, Hippocampus, Cerebellum • endogene Liganden: Ethanolamide ungesättigter Fettsäuren Pharmakodynamik • akut • Entspannung • Abrücken von Alltagsproblemen • Apathie (angenehm) • milde Euphorie • phantasievolles beglückendes Denken • Intensivierung der Sinneswahrnehmung • Vigilanz bei kleinen Dosen ↓, bei großen ↑ (Erregung bis psychotische Zustände) manchmal • ängstliche Unruhe • aggressive Gereiztheit vegetativ • rote Augen, Tachykardie, Hunger, Mundtrockenheit, antiemetisch, analgetisch, 342 antikonvulsiv Chronisch Konsum: Hanfarten • • • • Toleranz (gewisse Kreuztoleranz zu Ethanol und Barbituraten) psychische Abhängigkeit aber physisch nicht annähernd so stark wie bei Alkohol und Opiaten jedoch mildes Entzugssyndrom möglich (Ruhelosigkeit, Schlafstörungen, vegetative Symptome) • Persönlichkeitsveränderungen (amotivationale Syndrome), substanzinduziertePsychosen v.a. bei jungen Männer Die Hanfpflanze gehört zur Familie der Cannbaceae (Hanfgewächse, Hanfartige), der als zweite Pflanze der Hopfen angehört, der ebenso psychoaktive Wirkung hat. • Pharmakokinetik • ∆9THC = lipophil • metabolisiert und im Gewebe angereichert • vollständige Ausscheidung erstreckt sich über einen Monat • 80% über Darm, 20% über Niere • 343 Cannabis sativa Cannabis indica (gewöhnlicher Hanf) (indischer Hanf) Cannabis ruderalis (wilder Hanf) Wirkung Wirkstoff • • Die berauschende Wirkung von Hanf beruht auf seinen Cannabinoiden (komplexe Mischung psychoaktiver Substanzen aus der Hanfpflanze ). Insbesondere dem THC wird dabei ein Großteil der Effekte zugeschrieben. Aber auch Wirkstoffe wie CBN,CBD,CBG,CBC spielen eine wichtige Rolle. Die Wirkung von Cannabisprodukten rührt also nicht wie oft angenommen vom THC allein. Vielmehr finden sich im Cannabisharz viele Substanzen mit unterschiedlichen Wirkungen, die sich gegenseitig verstärken oder hemmen. Daher ergeben sich je nach genauer je nach Wirkstoffgehalt und prozentueller Verteilung der Cannabisprodukte verschiedene Wirkungsweisen. Marihuana enthält meist zwischen 3 und 15 Prozent THC. Bei einzelnen Züchtungen wurden auch THC-Werte um die 20 oder 30% gemessen. Der THCGehalt von Haschisch schwankt immens, ist aber in der Regel höher, als der von Marihuana. Zwischen 5% und über 50% wurden gemessen. Durch spezielle Veredelungsverfahren kann man aus Marihuana so genanntes Haschöl gewinnen, welches THC-Konzentrationen von bis zu 90 Prozent haben kann. • • • • • Wirkung Positiv erlebte Wirkungen • • Fühlen - Häufig ist der Rausch von euphorischen Gefühlen gekennzeichnet ("high") bei gleichzeitiger emotionaler Gelassenheit. • • Denken - Übliche Denkmuster treten in den Hintergrund. Neuartige Ideen und Einsichten, verbunden mit starken Gedankensprüngen, prägen das Denken unter Cannabiseinfluss. • • Gedächtnis - Das Kurzzeitgedächtnis wird gestört. Was vor 5 Minuten geschehen ist, gerät bereits in Vergessenheit. In Gemeinschaft Gleichgesinnter wird dies oft als amüsant erlebt. • • Wahrnehmung - Subjektiv wird die Wahrnehmung intensiviert, sonst Nebensächliches wird deutlicher wahrgenommen. Wegen der Störung des Kurzzeitgedächtnisses scheint die Zeit langsamer zu verstreichen. • • Kommunikation - Das Gemeinschaftserleben unter Freunden wird intensiviert, oft verbunden mit Albernheit. Konsumenten haben das Gefühl, sich besser in den anderen versetzen zu können. • • Körpererleben - Einerseits schlägt das Herz schneller, andererseits erleben Konsumenten eine wohlige Entspannung. Ein Gefühl der Leichtigkeit bei gleichzeitig verlangsamten Bewegungen macht sich breit. Cannabis – Marihuana erzeugt in der Regel eine entspannende und beruhigende Wirkung. In hohen Dosen wirkt es auch halluzinogen. Das Wirkspektrum von Cannabis ist sehr breit und hängt von verschiedenen Faktoren ab. Die subjektive Wirkung des Cannabis lässt sich schwer beschreiben. Sie ist viel detaillierter und vielschichtiger, als man es sich vor dem ersten Konsum erwartet. Das ist wohl auch ein Grund, warum viele Menschen beim ersten Cannabiskonsum keine Wirkung spüren, weil sich die Erwartung eben kaum mit der tatsächlichen Wirkung deckt. Allgemein kann man sagen, dass Cannabis die Wahrnehmung intensiviert und die Stimmung, in der man sich vor dem Konsum befand, vor allem vertieft. Das Rauscherlebnis kann allerdings sehr variieren sodass Wirkung von Mensch zu Mensch sehr unterschiedlich empfunden wird. Für die psychoaktive Wirkung von Haschisch und Marihuana ist vor allem der Wirkstoff Tetrahydrocannabinol (THC) verantwortlich. Sie wird allerdings von den weiteren enthalten Cannabinoiden beeinflusst und entsteht somit erst durch eine Wechselwirkung verschiedener Substanzen. Die Wirkung von Cannabisprodukten rührt also nicht wie oft angenommen vom THC allein. Vielmehr finden sich im Cannabisharz viele Substanzen mit unterschiedlichen Wirkungen, die sich gegenseitig verstärken oder hemmen. Daher ergeben sich je nach genauer Dosierung und je nach Wirkstoffgehalt und prozentueller Verteilung der Cannabisprodukte verschiedene Wirkungsweisen. Hanf in der Medizin • • Hanf ist nicht nur eine der vielseitigsten Kulturpflanzen, dank seiner Cannabinoide sind auch die Anwendungsmöglichkeiten von Cannabis in der Medizin überaus vielfältig. Die medizinische Verwendung der Pflanze Hanf ist mindestens 4500 Jahre alt. Die alten Chinesen nutzen Hanf u. a. gegen Malaria, Rheuma und bei Entzündungen. Der Leibarzt des römischen Kaisers Nero verordnete Hanf als Schmerz- und Beruhigungsmittel. Hildegard von Bingen (1098-1179), Martin Luther (1483-1546), die englische Königin Viktoria (1819-1901) - die Liste der Medizinalhanf- Konsumenten ließe sich endlos fortsetzen. Obwohl Hanf noch 1937 bei über 100 Krankheitsbildern verschrieben wurde, strich man ihn 1941 von der Medikamentenliste. Die medizinische Verwendung von Cannabis verschwand in den Kriegsjahren fast völlig, die Forschung an einer der ältesten Medizinalpflanzen des Menschen wurde im Hintergrund aber fortgesetzt. Wie Hanf hilft- Wem Hanf helfen kann Hanf in der Medizin • • • • Die moderne Cannabis-Forschung beginnt mit der Isolierung des wichtigsten psychotropen Wirkstoffes Delta-9-THC im Jahre 1964 durch Forscher der Universität von Jerusalem. THC wirkt muskelentspannend, antiepileptisch, stimmungsaufhellend, brechreizhemmend, appetitsteigernd, leicht verstopfend, augeninnendrucksenkend, bronchienerweiternd, beruhigend, schmerzhemmend, schlaffördernd, juckreizstillend, entzündungshemmend, antibiotisch, gefäßerweiternd, gerinnungshemmend und fiebersenkend.. Natürliche Hanfprodukte können in Europa (noch) nicht verschrieben werden. Dafür gibt es mittlerweile eine große Anzahl an verschreibungsfähigen CannabinoidPräparaten, deren Wirkstoffe synthetisch hergestellt werden müssen. • • • • Aufgrund seines vielfältigen Wirkungsspektrums sind auch die Diagnosen bei denen Hanfkonsum als Therapie in Frage kommt weit gefächert: - Krebs- und Aids-Patientinnen hilft Hanf gegen Übelkeit und Erbrechen, die oft als Nebenwirkung der Chemotherapie entstehen. Zudem steigert Hanf den Appetit und bremst so die krankheitstypische Auszehrung der Patienten. - Spastiker ziehen ihren Nutzen aus den antiepileptischen Eigenschaften der Hanfharze, auch beim Tourette- Syndrom und ähnlichen Erkrankungen werden die positiven Therapieergebnisse auf diese Wirkung von THC zurückgeführt. - Patienten mit Glaukom (grüner Star) hilft Hanf indem es den Augeninnendruck senkt. Vielfach wird eine drohende Erblindung dadurch verzögert oder gar verhindert. Nachteil dieser Präparate ist, dass ihnen die ausgewogenen Wirkstoffkombination natürlichen Hanfs fehlt. Von den Patienten, die auch Erfahrung mit Cannabis haben, wird ihre Wirkung als unangenehmer und reicher an Nebenwirkungen empfunden, was vor allem auf das Fehlen von Cannabidiol (CBD) zurückzuführen ist. Wie Hanf hilft- Wem Hanf helfen kann • • • • • THC lindert asthmatische Krämpfe indem es die Bronchien erweitert.. Allerdings steht das Rauchen von Hanf unter dem Verdacht das Risiko von Krebserkrankungen zu steigern.. Einige der ältesten Anwendungen von Hanf als Medizin vertrauen auf seine schmerzlindernden Effekte. Hanf wirkt auch in geringen Dosen sehr gut bei neuropathischen Schmerzen wie Migräne, Arthritis, Menstruationsschmerzen oder degenerative Erkrankungen des Bewegungsapparates. Die stimmungsaufhellende Wirkung von Hanf. Darüber hinaus berichten Patienten von positiven Effekten bei so unterschiedlichen Erkrankungen wie Allergien, Juckreiz, Schluckauf, Tinnitus oder Darmreizungen. Allen Anwendungsgebieten gemein sind die geringen Nebenwirkungen. So ist in der Regel lediglich eine geringe Gewichtszunahme. Cannabis Rechtliche Aspekte von Cannabis Österreich Cannabis unterliegt den Bestimmungen des Suchtmittelgesetzes (SMG). Die Einstufung von Cannabis als Suchtgift im Sinne des Gesetzes stützt sich auf das Einheitsabkommen über die Betäubungsmittel. Nach dem Gesetz ist zu bestrafen, wer Cannabis erwirbt, besitzt, erzeugt, einführt, ausführt oder einem anderen überlässt oder verschafft. Nicht strafbar ist der Konsum, der grundsätzlich auch ohne Besitz möglich ist. In der Praxis wird aber auch der Konsum kriminalisiert, weil er fast immer mit dem Besitz einhergeht; so begründet das bloße Mitrauchen an einem fremden Joint die Straftat des Besitzes. Grundsätzlich droht schon bei geringen Mengen eine Freiheitsstrafe von bis zu sechs Monaten oder Geldstrafe (§ 27 Abs. 1 SMG), strengere Strafen gelten für das Überlassen von Suchtgift an Minderjährige (§ 27 Abs. 2 Z 1 SMG) und bei Delikten im Zusammenhang mit der gewerblichen Drogenkriminalität (§ 27 Abs. 2 Z 2 SMG). Erwerb und Besitz von großen Suchtmittelmengen für den Eigengebrauch fallen unter den „milderen“ § 27 Abs. 1 SMG. Die Erzeugung, Ein- und Ausfuhr und das Inverkehrsetzen von großen Suchtmittelmengen werden nach dem weit strengeren § 28 SMG bestraft, wobei die Begehung im Rahmen einer Bande bzw. kriminellen Vereinigung schulderschwerend, eine eventuell vorhandene Sucht als überwiegendes Tatmotiv dagegen schuldmindernd gewertet werden. Der Schwerpunkt der strafrechtlichen Verfolgung in Österreich liegt in der Regel bei Delikten mit größerem Umfang, offiziell gilt der Grundsatz Therapie statt Strafe. Als geringe Menge gilt Cannabis mit einem Wirkstoffgehalt von weniger als 20 g THC, was je nach THC-Gehalt des Produkts zwischen 80 und 300 g getrockneter Cannabis-Blüten entspricht. Bei Strafverfahren wegen des Erwerbs und Besitzes von geringen Mengen muss die Staatsanwaltschaft die Anzeige gemäß § 35 SMG für eine Probezeit von zwei Jahren zurücklegen, wodurch Gelegenheitskonsumenten vor einer übermäßigen Kriminalisierung geschützt werden sollen. Bei einem erneuten Suchtgift-Vergehen innerhalb der Probezeit wird das Verfahren jedoch wieder aufgenommen. Die Zurücklegung der Anzeige setzt eine Stellungnahme der Gesundheitsbehörde voraus, ob der Angezeigte als Dauerkonsument einer gesundheitsbezogenen Maßnahme gemäß § 11 SMG (amtsärztliche Untersuchungen, Entzugsmaßnahmen, Psychotherapie) bedarf. Der Staatsanwalt kann jedoch gemäß § 35 Abs. 4 SMG von der Einholung einer Stellungnahme absehen, wenn der Angezeigte ausschließlich eine geringe Menge Cannabis für den Eigenverbrauch erworben und besessen hat, und kein Grund zu der Annahme besteht, dass er einer gesundheitsbezogenen Maßnahme bedürfe. Gesundheitsbezogene Maßnahmen bei Cannabis bestehen in der Regel aus Beratungsgesprächen und der regelmäßigen Abgabe von Urinproben über einen längeren Zeitraum. Saatgut und Pflanzen unterliegen dem Suchtmittelgesetz, wenn sie zur Erzeugung von Suchtgift geeignet sind oder mehr als 0,3% THC enthalten. Es gibt hier einen gewissen rechtlichen Freiraum, weil Samen, Blätter, Stängel, Wurzeln und Jungpflanzen diesen THC-Gehalt nicht erreichen und nicht als Suchtgift gelten. Tatsächlich kann man in zahlreichen Geschäften Samen und Jungpflanzen erwerben, die zu potenten Cannabis-Pflanzen heranwachsen können. Der unerlaubte Anbau von Cannabis-Pflanzen für Zwecke der Suchtmittelgewinnung (Herstellung) ist eine Verwaltungsübertretung, die gemäß § 6 Abs 2 iVm § 44 Z 1 SMG mit Geldstrafe bis zu 36 300 Euro, im Nichteinbringungsfall mit Freiheitsstrafe bis zu sechs Wochen bestraft wird. Gerichtlich strafbar ist grundsätzlich erst die Handlung der Suchtmittelgewinnung, d. h. die Trennung der THC-haltigen Pflanzenteile von der Pflanze zwecks Suchtmittelerwerb. Doch in der Praxis werten die Gerichte oft bereits den Anbau bzw. die Herstellung als versuchte Erzeugung im Sinne des SMG. Der Anbau von Cannabis-Pflanzen für Zwecke, die nicht der Suchtmittelgewinnung dienen, etwa als Zierpflanzen oder als PapierRohstoff, ist unabhängig vom THC-Gehalt der Sorte straffrei. Halluzinogene/Psychedelika (“LSD-artige“) Stoffe • • • • • • • • erhebliche chemische und pharmakologische Heterogenität Indolethylamine (LSD oder Psilocybin) → gleiches Grundgerüst wie Serotonin Phenylethylamine (Mescalin) → ähnlich wie Catecholamine Phenylisopropylamine (Amphetamine) → ähnlich wie Catecholamine Prototyp: LSD (D-(+)-Lysergsäurediethylamid) synthetisches Mutterkornalkaloid → zu fast allen Serotoninrezeptoren hohe Affinität halluzinogener Effekt durch partialagonistische Wirkung am Serotonin2A-Rezeptor Pharmakodynamik akuter Gebrauch Psychotrope Effekte nach 20-25 mg oral: Illusorische Verkennungen optische, akustische, taktile Halluzinationen Synästhesien Raum-Zeit Wahrnehmung verändert Depersonalisationserleben, Selbstüberschätzung Stimmung kann schnell von Euphorie oder Dysphorie umschlagen (und umgekehrt) → Horrortrip hier häufiger und schwerer als bei Cannabis • Vegetative NW (sympathomimetisch: Tachykardie, Blutdruckanstieg, Pupillenerweiterung, Temperaturanstieg, Schwitzen, Tremor) 357 • • • • • • • chronischer Gebrauch: • Toleranzentwicklung innerhalb von 3-4 Tagen (nach Beendigung Rückbildung innerhalb von 4-7 Tagen); u.U. durch Downregulation der Serotoninrezeptoren • kaum mal psychische Abhängigkeit, da meist intermittierender Gebrauch • keine physische Abhängigkeit und Entzugssymptome • Flashback möglich (Tage bis Jahre nach der Applikation) • u.U. LSD-Psychose 358 Phencyclidin und Verwandte Stoffe • • • • • • Phencyclidin (PCP; Drogenszene, „Engelsstaub“) zunächst als Anästhetikum, das nicht das Bewußtsein ausschaltet jedoch in Aufwachphase Delirien und Halluzinationen chemisch mit Narkosemittel Ketamin verwandt bindet an NMDA-Rezeptoren und hemmt da v.a. den Ca+-Einstrom in Schizophrenieforschung wichtig: PCP-Psychose hat Positiv- und Negativsymptome Pharmakodynamik • • • • • • • akut Euphorie und Erregung Gefühl der Stärke und Unverletzlichkeit Wahrnehmung des eigenen Körpers, von Raum und Zeit gestört Angst, optische, akustische Halluzinationen, Isolationsgefühl Aggressivität, Reizbarkeit Fehleinschätzung der Realität für den Trip oft Amnesie; danach oft Psychose chronisch • • • Toleranz und psychische Abhängigkeit selten physische Abhängigkeit und Entzugssymptome 359 bei Langzeitabusus Angst, Depression, Beeinträchtigung der kognitiven Fähigkeiten 360