e - doc-herrmann
Werbung

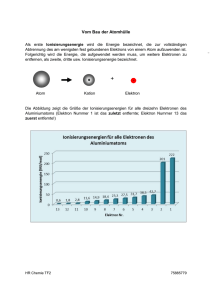
1 Atomhülle - Elektronen chemische Vorgänge spielen sich in erster Linie in der Atomhülle ab, sind also mit einer Änderung der Energiezustände der Elektronen verbunden. Energie der Elektronen Die Energie eines Elektrons setzt sich aus Kinetischer Energie (Bewegungsenergie) und Potentieller Energie (Lageenergie) zusammen. Die Potentielle Energie nimmt mit dem Abstand zum Atomkern zu, da gegen die Anziehungskräfte "Protonen - Elektronen" Arbeit verrichtet werden muß, sobald man ein Elektron vom Atomkern entfernt. Durch Energiezufuhr (Wärmeenergie, Elektrische Energie, Lichtenergie) kann die Energie eines Elektrons erhöht werden: e-* hf (=Licht, Wärme) e+ Dieser neue Energiezustand ist jedoch sehr instabil, deshalb kehrt das Elektron in seinen ursprünglichen Energiezustand zurück (Grundzustand): e-* hf (=Licht, Wärme) e+ Dabei wird Energie in Form von Licht oder Wärmeenergie (IR-Licht) frei. 2 Vl: Lithiumchlorid, Natriumchlorid und Kaliumnitrat werden auf einer mit konz. Salzsäure (HCl) angefeuchteten, ausgeglühten Platinöse in die nicht leuchtende Teclubrennerflamme gebracht B: 1. Lithiumchlorid färbt die Flamme 2. Natriumchlorid färbt die Flamme 3. Kaliumnitrat färbt die Flamme E: Anhand der Flammenfärbung können die Metallatome der Verbindungen identifiziert werden. Ionen - Ionisierungsenergie Entfernt man ein Elektron ganz aus dem Anziehungsbereich des Atomkerns, so muß man für jedes Elektron einen ganz bestimmten Energiebetrag aufwenden, die sogenannte Ionisierungsenergie. Dabei entstehen positiv geladene Atome, sogenannte KATIONEN (positiv geladen). Besitzt dagegen z. B. ein Atom ein E1ektron zuviel (= mehr als seine Kernladungszahl), so ist es negativ geladen, man nennt es ANION (negativ geladen). Ionen sind also geladene Teilchen! Taucht man in eine wäßrige Lösung zwei Metall- oder Graphitstäbe und legt zwischen ihnen eine Gleichspannung an, so wandern die negativ geladenen Ionen zur positiv geladenen Elektrode, der ANODE (+), positiv geladene Ionen wandern zur negativ geladenen Elektrode, der KATODE (-), daher kommen auch die Namen KATIONEN (die zur Katode- wandern) und ANIONEN (die zur Anode+ wandern). 3 Ionisierungsenergien Mißt man die Ionisierungsenergie. des ersten Elektrons verschiedener Elemente, so erhält man Diagramm 125.1 B: Die Ionisierungsenergie steigt bis zu den Atomen der Edelgase an und fällt jeweils bei den Alkalimetallen steil ab. Edelgase He --> Li Ne --> Na Alkalimetalle Ar --> K E: Elektronen werden vom Atomkern um so stärker gebunden, je geringer ihr Abstand vom Atomkern ist. -> Der steile Abfall der Ionisierungsenergie bei den Alkalimetallatomen liegt am größeren Abstand des äußersten Elektrons zum Atomkern im Vergleich zum (Abstand des äußersten Elektrons des) jeweiligen Edelgasatom (mittlerer Abstand). -> Starke Zunahme des Atomradius vom Edelgas zum nächsten Alkalimetall B: Sprunghafte Zunahme der Ionisierungsenergie beim 10. und beim 2. Elektron -> Existenz eines gemeinsamen Bauprinzips der Elektronenhülle Ionisierungsenergie für das jeweils erste Elektron verschiedener Atome 4 Ionisierungsenergie und Nummer des Elektrons Energiestufen- und Schalenmodell der Atomhülle 5 Die Ionisierungenergie ist umgekehrt proportional zur Gesamtenergie eines Elektrons. -> Elektronen mit höherer Energie (kernferner) lassen sich leichter abspalten als Elektronen mit niedrigerer Energie (kernnäher). Daraus läßt sich ein Energiestufenschema ableiten: Alle Elektronen eines Energiestufenbereichs bezeichnet der Chemiker als „Schale“. Regeln für die Besetzung von Energiestufen mit Elektronen (empirisch): 1. Die energieärmste (= 1. Stufe) enthält maximal 2 Elektronen. 2. Die 2. Stufe enthält maximal 8 Elektronen => Gemeinsames Bauprinzip: Gleiche Maximal-Elektronenzahl auf sich entsprechenden Energiestufen, wobei sich jedoch die Abstände der Energiestufen bei verschiedenen Atomen voneinander unterscheiden. 6 Schalenmodell Elektronen in bestimmten Energiebereichen bewegen sich in bestimmten (mittleren) Abständen vom Atomkern, den sog. Schalen - besser Kugelschalen. Jeder Energiestufe entspricht eine Kugelschale. Atombau und Periodensystem der Elemente (PSE) Anordnung der Elemente im PSE 1. Atome in der gleichen Reihe (=Periode) besitzen die gleiche Anzahl von Schalen. 2. Beim Übergang von Edelgasatomen zu Alkalimetallatomen kommt eine neue Schale hinzu. 3. Untereinanderstehende Atome (= Gruppen) besitzen eine verschiedene Anzahl von Schalen, aber in der äußersten Schale (= energiereichster Zustand) die gleiche Anzahl von Elektronen (außer He)! 4. Die Periodennummer entspricht der Schalenanzahl. 5. Die Gruppennummer entspricht der Anzahl der Elektronen in der äußersten Schale. B: Elemente gleicher Gruppen zeigen oft ähnliche chemische Eigenschaften, z. B. sind alle Edelgase sehr reaktionsträge, alle Alkalimetalle reagieren heftig und in der gleichen Weise mit Wasser ... E: Die Anzahl der Elektronen auf der äußersten Schale (= Außenelektronen) bestimmt weitgehend das chemische Verhalten eines Elements! (In der Kurzschreibweise eines Atoms gibt man deshalb nur die Außenelektronen an.)