Scarica PDF - labormedizinische zentrum Dr Risch
Werbung

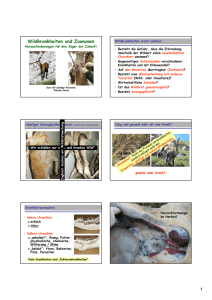
Riport 70 Mitteilungen zur aktuellen Labordiagnostik 4 Zoonosen gestern – heute – morgen 5 Rechtsgrundlagen der Zoonosenbekämpfung und Beispiele für deren Umsetzung 6 Epidemiologische Situation des Auftretens von Zoonosen (CH, AT, FL) 7 Begünstigen tierfreundliche Haltungssysteme die Verbreitung von Zoonosen? 8 Wildbahnassoziierte Zoonosen: Bakterielle Erreger 10 Wildbahn- assoziierte Zoonosen: Parasitäre Erreger 12 Lebensmittelassoziierte Zoonosen: Klassische Erreger 13 Lebensmittelassoziierte Zoonosen: Spezielle Erreger 14 Antibiotikaresistenzen und Nutztierhaltung 15 shortriport 24 Hämatologie Klinische Chemie Klinische Immunologie Medizinische Mikrobiologie Medizinische Genetik Ausgabe 70 im Sommer 2012 1 Impressum Verantwortlich für den Inhalt dieser Ausgabe: Dr. sc. nat. Gert Risch PD Dr. med. Lorenz Risch, MPH Dr. med. Martin Risch Dr. rer. nat. Sabine Berchtold Dr. med. Walter Fierz, MHIM Dr. phil. Peter Hagemann Dr. farm./chim. Paola Jelmini Dr. med. Christian Lee Dr. med. Pedro Medina Escobar Dr. rer. nat. Martine Michel Blanco Prof. Dr. med. Urs Nydegger Dr. phil. II Michael Ritzler Dr. rer. biol. hum. Ute Wiedemann Dr. sc. nat. ETH Monika Wydler Dr. phil. II Manfred Zerlauth Layout / Gestaltung IDconnect Design Solutions Bergstrasse 45, FL-9495 Triesen [email protected] www.id-connect.com www.risch.ch Ziegelrain 25 5000 Aarau Bubenbergplatz 10 3011 Bern Gersauerstrasse 8 6440 Brunnen Rue des Lilas 8 2800 Delémont Via Arbostra 2 6963 Pregassona STS 177 REG NR. 13231 2 Akkreditierung nach ISO 17025 * Zertifizierung nach ISO 9001:2000 * Landstrasse 157 9494 Schaan* Blumenrain 105 2501 Biel Schaffhauserstrasse 126 8302 Kloten Mühlentalstrasse 28 8200 Schaffhausen* Fröhlichstrasse 7 5200 Brugg Waldeggstrasse 37 3097 Liebefeld-Bern Theatergasse 26 4500 Solothurn Zoonosen Mit der 70-sten Ausgabe des Riports geben wir Ihnen einen Rückblick zum Sonderthema «Zoonosen». Anlass für das Thema war das XVIII. Diagnostik-Symposium, welches in Zusammenarbeit mit dem Amt für Veterinärmedizin am 29. März 2012 in Schaan abgehalten wurde. Wir leben in einer Zeit, in welcher unsere Lebensräume starken Veränderungen unterzogen sind. Die Nachfrage nach gesunden und kostengünstigen Nahrungsmitteln steigt. Parallel dazu verändert die Verdichtung der Lebensräume und der Raubbau an der Natur die Lebensbedingungen ganz generell. Damit drängen sich neue epidemiologische Fragestellungen auf. Ihnen, liebe Leserinnen und Leser, ist sicher noch die Kontamination der Sprossgewächse 2011 in Deutschland mit gravierenden Auswirkungen auf das Gesundheitswesen in Erinnerung (mehrere hundert Konsumenten erlitten ein akutes Nierenversagen). Ursache war eine Kontamination mit dem Enterotoxin bildenden Keim Escherichia Coli O104:H4. Dieser epidemiologische Ausbruch erregte als einer der letzten Beispiele viel Medienaufmerksamkeit (neben Vogel-, Schweinegrippe, Westnile-Virus, etc.). 1. Reihe von links: Lukas Perler, Gert Risch, Pietro Vernazza, Roger Stephan 2. Reihe von links: Peter Malin, Norbert Nowotny, Gertraud Schüpbach, Franz Allerberger, Joachim Frey 3. Reihe von links: Wolfgang Burtscher, Peter Much, Bruno Gottstein, Lorenz Risch Zoonosen halten sich nicht an Territorialgrenzen. Deshalb wurden von schweizerischen und österreichischen Fachexperten gemeinsam erstmals in einer ganztägigen, grenzüberschreitenden Veranstaltung sowohl die veterinärmedizinischen wie auch die humanmedizinischen Aspekte der Zoonosen thematisiert. In dieser Ausgabe erhalten Sie vom ersten Inputreferat von Christian Griot eine allgemeine Übersicht. In den Beiträgen der Kollegen Damoser und Perler wurden die Rechtsgrundlagen der Zoonosenbekämpfung und die epidemiologische Situation des Auftretens von Zoonosen in alpenländischem Gebiet vorgestellt. Kollegin Schüpbach bezog Stellung zu den verschiedenen Tierhaltungssystemen. Die wildbahnassoziierten Zoonosen wurden von den Kollegen Frey und Gottstein vorgestellt. Die Referenten Stephan und Allerberger sprachen über lebensmittelassoziierte Zoonosen. Letztlich bezog Kollege Much Stellung zur derzeitigen Lage im Bereich der Antibiotikaresistenzen. Der Riport 70 ist somit eine aktuelle Zusammenfassung von Praxis relevanten Themen bezüglich Zoonosen. Die Experten versuchten das heutige Wissen zu bündeln und Fragestellungen aus der Hausarztpraxis zu beantworten. Ich bin überzeugt, dass die Schnittstelle zwischen der Veterinärmedizin und der Humanmedizin weiter gepflegt werden muss und sehe dies als ersten Schritt für weitere Aktionen. Eine engere Zusammenarbeit zwischen diesen beiden Fachdisziplinen steht nach meiner Meinung vorrangig im allgemeinen Interesse der Öffentlichkeit. Als Ärzte wie auch als Konsumenten sind wir aufgefordert, uns vermehrt mit der Thematik von Zoonosen auseinander zu setzen. Nach wie vor dürfen wir auf eine hochwertige, die Gesundheit nicht schädigende Lebensmittelproduktion zurück greifen und hoffen, dass diese gute Versorgungslage uns noch lange erhalten bleibt. Mit dieser lesenswerten Ausgabe möchten wir Sie in den verdienten Sommerurlaub entlassen und hoffen, dass Sie unversehrt und mit vielen schönen Erlebnissen bestückt, mit viel Freude wieder an die Arbeit zurück kehren werden. Freundliche Grüsse Dr. med. Martin Risch 3 Zoonosen gestern – heute – morgen PD Dr. med. vet. FVH Christian Griot Zoonosen sind Infektionskrankheiten, die auf natürlichem Wege vom Tier (Vertebraten) auf den Menschen übertragen werden können (WHO, 1959). Die Zoonoseerreger umfassen Bakterien, Viren, Parasiten, Pilze oder andere biologische Einheiten (z.B. Prionen). Die Zoonosen sind charakterisiert durch ein Tierreservoir, bestimmte Übertragungsmodi und eine definierte Krankheit beim Menschen. Ursprünglich verstand man unter Zoonosen lediglich Tierkrankheiten. Während des vorletzten Jahrhunderts fand ein Wandel in der Bedeutung der Bezeichnung statt. Neben den eigentlichen Tiererkrankungen verstand man Mitte des 19. Jahrhunderts unter Zoonosen nun auch Erkrankungen, die vom Tier auf den Menschen übertragen werden konnten. Beim heutigen Gebrauch der Bezeichnung Zoonose wird keine Unterscheidung hinsichtlich des Übertragungsweges gemacht. Zoonosen können also vom Mensch auf ein Tier oder vom Tier auf den Menschen übertragen werden. Bereits im Mittelalter wurden Seuchen bei Tieren und Menschen als (gleichartige und gleichwertige) Katastrophen dargestellt. Die Krankheiten zeigten sich beim Tier und Mensch oft zeitgleich. In vielen Fällen handelte es sich um zoonotische Erkrankungen. Die Übertragbarkeit von Tierkrankheiten auf den Menschen ist seit Mitte des 19. Jahrhunderts bekannt. Die ersten wissenschaftlichen Arbeiten befassten sich mit Parasiten (z.B. Bandwurm des Menschen, der sich aufgrund einer ungenügenden Erhitzung von Schweinefleisch auf den Menschen übertragen liess). E. Jenner beobachtete, dass Melkerinnen kaum je an Pocken erkrankten. Er schloss daraus, dass diese mit einem Agens in Kontakt kommen, das sie „resistent“ gegenüber der Infektion mit Pocken machte. Daraus entwickelte er das Konzept der Pockenimpfung. Je nach Erreger können die Tiere ebenfalls erkranken oder asymptomatisch infiziert sein. Die Erreger können entweder auf direktem Weg vom Tier auf den Menschen übertragen werden oder indirekt über Tierprodukte (vor allem Lebensmittel) und Arthropoden (Stechmücken, Zecken, Läuse u.a.). Manche Zoonoseerreger haben auch das Potenzial der Übertragung von Mensch zu Mensch. 4 tische und ökologische Faktoren, die die Lebensbedingungen von Tieren und Vektoren verbessern. Zunehmend warme Winter führen beispielsweise zu verbesserten Bedingungen für Zecken. Gegen die meisten Zoonoseerreger existiert keine wirksame Impfung. Umso wichtiger sind andere geeignete Massnahmen der Infektionsüberwachung und -kontrolle. Prof. E. Leberecht Wagner (1829-1888) prägte den Begriff: Zoon = Lebewesen, Nosos = Krankheit Griechisch, 1876 zum ersten Mal verwendet Zoonosen haben weltweit eine immense Bedeutung. Bisher wurden über 250 verschiedene Zoonosen beschrieben. Aktuelle Beispiele für einen Übergang von Erregern oder bestimmten Erregerstämmen vom Tierreservoir auf den Menschen sind das aviäre Influenzavirus H5N1, das SARS-Virus oder auch das Virus der Affenpocken. Die Gründe für eine verstärkte Ausbreitung von Zoonoseerregern liegen zum einen beim Menschen selbst. Freizeit- und berufliche Aktivitäten im Freien oder die Haltung exotischer Haustiere erhöhen die Wahrscheinlichkeit des Kontakts mit infizierten Tieren und Vektoren. Landwirtschaftliche, verkehrstechnische und siedlungsbedingte Aktivitäten lassen den Menschen immer weiter in entlegene Regionen der Erde vordringen. Veränderte Bedingungen der Lebensmittelproduktion und der Ernährung fördern ebenfalls die Verbreitung von Zoonoseerregern. Einen starken Einfluss auf die geografische Verbreitung von Zoonosen haben klima- Nachdem zoonotische Erkrankungen weiterhin eine wichtige Rolle spielen werden, sind Massnahmen zur Erkennungsprävention und Bekämpfung wichtig. Diese Massnahmen müssen einheitlich koordiniert werden, nicht nur in der Schweiz. Die korrekte und emotionslose Aufklärung der Öffentlichkeit in Sachen Zoonosen wird in Zukunft an Bedeutung zunehmen, dabei werden die Medien in allen Bereichen eine wichtige Rolle einnehmen müssen. Autor PD Dr. med. vet. FVH Christian Griot Institut für Viruskrankheiten und Immunprophylaxe Nationales Referenzlabor für hochansteckende Tierseuchen 3147 Mittelhäusern Rechtsgrundlagen der Zoonosenbekämpfung und Beispiele für deren Umsetzung MR Dr. Johann Damoser Im Jahr 2005 wurde in Österreich das Bundesgesetz zur Überwachung von Zoonosen und Zoonoseerregern erlassen. Gegenstand des Gesetzes ist die ordnungsgemässe Überwachung von Zoonosen, Zoonoseerregern sowie diesbezüglicher Antibiotikaresistenzen und die epidemiologische Abklärung von lebensmittelbedingten Krankheitsausbrüchen. Ziel des Gesetzes ist die Koordination der erforderlichen Massnahmen sowie der Informationsaustausch zwischen den mit der Materie befassten Organisationseinheiten, wobei Meldepflichten, Überwachungs- und Bekämpfungsmassnahmen auf Grund bereits bestehender Bundesgesetze nicht berührt werden. Insbesondere die EU-Zoonosenrichtlinie 2003 / 99 / EG wird daher im österreichischen Zoonosengesetz und der darauf beruhenden Geschäftsordnung für die Bundeskommission für die Überwachung von Zoonosen umgesetzt. Von besonderer Bedeutung ist dabei die Regelung der Abläufe in Zusammenhang mit der Abklärung bundesländerübergreifender lebensmittelbedingter Krankheitsausbrüche, da dabei die Mitwirkung einer Vielzahl von jeweils für ihren Fachbereich zuständigen Behörden und Untersuchungsstellen erforderlich ist. Dabei ist zu beachten, dass die Länder hinsichtlich veterinär- und lebensmittelrechtlicher sowie humanrechtlicher Bestimmungen im Rahmen der mittelbaren Bundesverwaltung an die Weisungen des Bundesministers gebunden sind. Ihnen obliegt jedoch prinzipiell die Organisation der Verwaltung und damit die Umsetzung der jeweils erforderlichen Massnahmen in ihrem Wirkungsbereich. Bei bundesländerübergreifenden Krankheitsausbrüchen ist jedoch die koordinierende Rolle des Bundes unerlässlich. Kernstruktur zur Koordination der Tätigkeiten zwischen Lebensmittel-, Human-, Futtermittel- und Veterinärbereich sowie zwischen Bund und Ländern ist die Bundeskommission zur Überwachung von Zoonosen (Bundeszoonosenkommission, BKZoon). Auf Landesebene ist die Etablierung einer parallelen Struktur zur Koordination der genannten Fachbereiche vorgeschrieben, wobei der Leiter der Lan- deskommission für Zoonosen oder dessen Stellvertreter in die BKZoon zu entsenden ist. Neben den bereits genannten Vertretern gehören der BKZoon auch Mitglieder des Bundesministeriums für Landesverteidigung an, welche insbesondere für Fragen des Bioterrorismus eingebunden sind. Weiters befinden sich im genannten Gremium Vertreter aus den korrespondierenden Bereichen der Agentur für Gesundheit und Ernährungssicherheit (AGES), welche Spezialisten für Fragen der Diagnostik, Epidemiologie, statistischen Auswertung und Risikobewertung zu entsenden haben. Die Geschäftsstelle der BKZoon dient der administrativen Unterstützung des Leiters sowie der Dokumentenverwaltung, um für die jeweiligen Mitglieder einer bestimmten Arbeitsgruppe den geschützten Zugang zu allen relevanten Informationen sicherzustellen. Im Rahmen der BKZoon wurden zur praktischen Umsetzung der Aufgaben vier Arbeitsgruppen geschaffen, welche sich mit der Abklärung lebensmittelbedingter Krankheitsausbrüche, der Überarbeitung von Z oonosenüberwachungsprogrammen sowie mit Fragen der Entwicklung von Antibiotikaresistenzen befassen. Der gegenständliche Vortrag befasst sich im Speziellen mit der Abklärung bundesländerübergreifender lebensmittelbedingter Krankheitsausbrüche. Autor MR Dr. Johann Damoser Abteilungsleiter Tiergesundheit und Veterinärrecht Bundesministerium für Gesundheit, Wien (A) 5 Epidemiologische Situation des Auftretens von Zoonosen (CH, AT, FL) Dr. med. vet. Lukas Perler Klinische Fälle von etlichen Zoonosen werden im Alpenraum (CH, AT, FL) aufgrund der obligatorischen Meldepflicht sowohl beim Menschen als auch beim Tier erfasst. Passive und aktive Überwachungsprogramme – insbesondere in der Veterinärmedizin – erlauben es zudem, die epidemiologische Situation und Veränderungen nachhaltig zu verfolgen und die Wirkung von Bekämpfungsmassnahmen zu überprüfen. Aufgrund der hohen Fallzahlen spielen lebensmittelassoziierte Zoonosen bei Menschen eine wichtige Rolle. Die Campylobacteriose ist die häufigste Zoonose, die Salmonellose kommt am zweithäufigsten vor. Während dem aufgrund von wirksamen Bekämpfungsmassnahmen die Fallzahlen der Salmonellose seit Jahren rückläufig sind, kann dieser positive Trend bei der Campylobacteriose nicht beobachtet werden. Die Zielvorgaben der EU zur Bekämpfung der Salmonellen-Infektionen beim Geflügel (Elterntiere / Masttiere / Puten 1 %, Legehennen 2 %) werden in der CH, in AT und im FL bereits unterschritten. Fallzahlen 2011 ausgewählter Zoonosen beim Mensch im Alpenraum Anz. Fälle Schweiz inkl. FL1 Anz. Fälle Österreich 2 Campylobacteriose spp. 6656 5332 Salmonellose spp. 1253 2218 Listeriose (Listeria monocytogenes) 66 26 Tularämie 12 4 Trichinellose 1 1 Tollwut 0 0 k. A. 7 Krankheit Echinococcose (Hunde– und Fuchsbandwurm) Fallzahlen 2010 ausgewählter Zoonosen beim Tier im Alpenraum Andere Zoonosen - insbesondere solche, die durch direkten Kontakt zwischen Tier und Mensch übertragen werden – kommen im Alpenraum im Vergleich zu den lebensmittelassoziierten Zoonosen selten bis sporadisch vor. Diesbezüglich zeigt ein Vergleich mit der Gesamt-EU, dass andere Mitgliedstaaten teilweise deutlich stärker betroffen sind (z.B. Trichinellose, Listeriose). Die epidemiologische Situation zum Auftreten von Zoonosen wird vereinfacht dargestellt durch «Human-related», «Pathogen-related» und «Clima/Environmentrelated» Faktoren beeinflusst. So sind beispielsweise einige Fälle von Brucellose beim Menschen in der Schweiz in den letzten Jahren mit grösster Wahrscheinlichkeit auf vermehrte Auslandreisen und Migration von Menschen zurückzuführen. Jedoch können sich auch einzelne Faktoren überlagern. Brucella suis zirkuliert auch in der europäischen Wildschweinepopulation, was im Jahr 2009 zu einem Ausbruch von Brucellose in einem Hausschweinebestand in der Schweiz geführt hat. Das Aufflackern von boviner Tuberkulose in Europa und insbesondere das Auftreten von Mycobacterium caprae beim Rotwild und vereinzelt auch in Rinderbeständen im Alpenraum zeigt deutlich, dass 6 Anz. Fälle Schweiz inkl. FL 3 Anz. Fälle Österreich 4 Trichinellose 1 2 Tollwut 0 0 Bovine Tuberkulose 0 8 (M. caprae) Krankheit Salmonellosen beim Geflügel (Zielvorgaben Überwachung EU): Elterntiere / Masttiere / Puten < 1 %, Legehennen < 2 % : Die Zielvorgaben wurden in A / CH / FL in allen Tierkategorien erreicht. Campylobacterüberwachung in Masthühnern 2010: CH / FL: 400 Herden, davon positiv 112 C. jejuni und 20 C. coli. Dies entspricht 33 %. A: 396 Herden, davon 46.7 % positiv C. spp. sich einzelne Erreger durch Veränderungen von Ökosystemen und Biodiversität neue Nischen erobern bzw. alte Habitate zurückerobern. Schlussendlich beeinflussen lokale / regionale und generalisierte Veränderungen der Umwelt die epidemiologische Situation der Zoonosen im Alpenraum. Änderungen der Artenvielfalt und des Nahrungsangebotes, wechselnde Niederschlagsmengen und Temperaturen können Stressfaktoren darstellen, welche die Fauna in Form von Stress und veränderter Selektion treffen. Eine Studie aus Österreich zur Tularämie zeigt diesbezüglich, dass durch den Klimawandel die Reservoirfunktion der Feldhasen zu dieser Zoonose beeinflusst und das heute bekannte Endemiegebiet sich möglicherweise bis 2035 signifikant erweitern kann. 1 BAG: Arzt- oder Labormeldungen (Meldeverord- nung) / 2BMG: laborbestätigte Fälle, vorläufiger Jahresbericht 3 BVET / 4 AGES Die epidemiologische Situation der Zoonosen und Erfahrungen aus Überwachungsund Bekämpfungsmassnahmen zeigen deutlich, dass der «One-Health Ansatz» zukunftsweisend ist. Aktuelle Problemstellungen erfordern gemeinsame Lösungsansätze zwischen Human- und Veterinärmedizin, Lebensmittelsicherheit, Umweltwissenschaften und Landwirtschaft. Autor Dr. med. vet. MScVPH Lukas Perler Bundesamt für Veterinärwesen Leiter Fachbereich Tiergesundheit 3003 Bern-Liebefeld Begünstigen tierfreundliche Haltungssysteme die Verbreitung von Zoonosen? Prof. Dr. med. vet. Gertraud Schüpbach Besonders tierfreundliche Haltungssysteme haben zum Ziel, das Wohler- gehen und die Gesundheit von Tieren zu verbessern. Dies kann bedeuten, dass sie auch weniger anfällig für Zoonosen sind, d.h. für Krankheiten, die vom Tier auf den Menschen übertragen werden. Andererseits haben Tiere in tierfreundlicher Haltung oft vermehrt Kontakt zur Aussenwelt und die Haltungssysteme sind schwieriger zu reinigen. Dies kann zu einem erhöhten Risiko für eine Ansteckung mit Zoonoseerregern führen. Die Forschung zu Zoonosen zeigt, dass je nach Epidemiologie der verschiedenen Zoonoseerreger und Art der Haltung sowohl ein positiver als auch ein negativer Effekt möglich ist. Bei den meisten Zoonoseerregern, für die vergleichende Untersuchungen zwischen besonders tierfreundlichen und konventionellen Haltungssystemen vorliegen, wurde kein Unterschied zwischen den Haltungen gefunden. So war bei Mastschweinen die Prävalenz von Salmonellen, Campylobacter und Yersinien in Haltungssystemen mit und ohne Auslauf ins Freie vergleichbar. Für Salmonellen bei Legehennen konnte gezeigt werden, dass der Wechsel von Käfighaltung zu tierfreundlicheren Haltungssystemen in der EU nicht mit einem vermehrten Vorkommen von Salmonellen verbunden war. Im Gegenteil, die Prävalenz von Salmonellen war in alternativen Haltungssystemen sogar geringer als in Käfighaltung. Bei Toxoplasmose wäre zu erwarten, dass Schweine mit Auslauf häufiger Kontakt mit Oozysten aus Katzenkot und demnach auch eine höhere Prävalenz aufweisen als Schweine in geschlossenen Ställen ohne Auslauf ins Freie. In einer aktuellen Studie waren jedoch bei beiden Gruppen nur 2 % der Schweine positiv für Toxoplasma. Bei Hühnern ist die Prävalenz von Campylobacter in Betrieben mit Freilandhaltung höher als bei Stallhaltung. Einerseits überleben die Bakterien auf der Weide und können neu eingestallte Tiere infizieren. Andererseits kann die Weide mit Kot von Wildvögeln kontaminiert sein, was ebenfalls eine mögliche Ansteckungsquelle ist. Für Zoonosen, bei denen Wildtiere ein Reservoir darstellen, sind Tiere in Freilandhaltung allgemein stärker gefährdet als Tiere in geschlossenen Ställen ohne Kontaktmöglichkeiten zu Wildtieren. Während des Ausbruchs der Vogelgrippe bei Wildvögeln in der Schweiz im Jahr 2006 wurde die Freilandhaltung von Hausgeflügel vorübergehend eingeschränkt, um eine Ansteckung von Hausgeflügel zu verhindern. Bei den Schweinen ist Brucellose eine Zoonose, die zwar bei Hausschweinen ausgerottet ist, aber nicht bei den Wildschweinen. Schweine, die auf der Weide gehalten werden, haben deshalb ein grösseres Ansteckungsrisiko als Schweine in geschlossenen Ställen oder mit besonders eingezäuntem Auslauf. In tierfreundlichen Haltungssystemen sind die Tiere tendenziell gesünder und müssen seltener mit Antibiotika behandelt werden. In Studien bei Mastschweinen und Hühnern zeigte sich deshalb auch, dass die Resistenzlage von Zoonoseerregern und anderen Keimen in tierfreundlichen Haltungssystemen besser war als in konventionellen Systemen. Die tierfreundliche Haltung von Hühnern in einem Tierfreundliche Haltung und gesunde Tiere und Lebensmittel sind kein Widerspruch. Vermutlich spielen andere Faktoren eine weitaus grössere Rolle für die Verbreitung von Zoonoseerregern als die Art des Haltungssystems. Jeder Tierhalter kann durch gute Hygiene und Zukauf von gesunden Tieren dazu beitragen, dass die von ihm produzierten Lebensmittel frei von Zoonoseerregern sind. Stall mit Aussenklimabereich und Einstreu bedeutet kein erhöhtes Risiko für das Vorkommen von Zoonoseerregern (Foto: M. Harisberger). Autor Prof. Dr. med. vet. Gertraud Schüpbach-Regula Veterinary Public Health Institut Vetsuisse Fakultät, Universität Bern 3012 Bern 7 Wildbahnassoziierte Zoonosen: Bakterielle Erreger Prof. Dr. Joachim Frey Bei der Übertragung von Zoonose-Erregern auf den Menschen spielen Haus- und Wildtiere, verschiedene Vektoren aber auch andere Übertragungswege wie z.B. der direkte Kontakt mit erlegtem Wild, eine zentrale Rolle (Abbildung 1). Übertragungen von Zoonosen vom Wildtier direkt oder indirekt durch einen Vektor auf den Menschen werden wegen der seltenen Begegnungen Wildtier – Mensch wenig beobachtet. Sie beschränken sich meistens auf hoch pathogene Erreger. Wildbahnassoziierte, bakterielle Erreger mit allgemein hoher Virulenz oder hoher epidemiologischer Bedeutung für Infektionen bei Menschen sind Brucella spezies, Coxiella burnetii, Francisella tularensis, Leptospira interrogans, Yersinia pestis sowie die Tuberkuloseerreger Mycobacterium microti oder auch M. caprae; letzterer ist nahe mit Mycobacterium bovis, dem Erreger der Rindertuberkulose verwandt. Für die Schweiz sind vor allem F. tularensis, Brucella spezies sowie möglicherweise M. caprae und M. microti als wildbahnassoziierte Zoonose-Erreger von Bedeutung. Tularämie: eine aufkommende Infektionskrankheit der Schweiz Tularämie ist eine klassische Zoonose, die durch Infektionen mit dem fakultativ intrazellulären Bakterium Francisella tularensis hervorgerufen wird. Die infektiöse Dosis für Menschen ist sehr gering und liegt bei 10 - 30 Keimen, die meistens durch Inhalation von Aerosolen oder über Hautkontakt aufgenommen werden. Zudem scheinen blutsaugende Arthropoden an der Übertragung auf Mensch und Tier beteiligt zu sein. F. tularensis ist auf der nördlichen Hemisphäre weit verbreitet. Das Bakterium gehört zur Biologischen Risikoklasse 3. Gemäss European Medicines Agency (EMA) und internationalen Zentren für Krankheitsüberwachung und Prävention (z.B. CDC) gehört F. tularensis zu den sechs gefährlichsten biologischen Agenzien, deren Ausbringung etwa im Falle eines bio-terroristischen Anschlages schwerwiegende Konsequenzen für die öffentliche Gesundheit hätten. Allgemein wird den zwei Subtypen von F. tularensis unterschiedliche Virulenz zugesprochen. Typ A, F. tularensis subsp. tularen8 Wildtiere Haustiere Mensch Abbildung 1: Übertragungswege von wildbahnassoziierten Zoonose-Erregern sis der in Nord-Amerika vorherrscht, wird meist mit letalen humanen Infektionen in Zusammenhang gebracht während dem in Europa vorherrschenden Subtypen B, F. tularensis subsp. holarctica erhöhte Virulenz für Tiere zugesprochen wird. Neuste Studien aus den USA zeigen aber, dass beide Typen A und B für den Menschen ein vergleichbar hohes Gefährdungspotential besitzen. In der Schweiz war Tularämie nach sporadischen Ausbrüchen bei Jägern und Metzgern in den 50er Jahren über längere Zeit nicht diagnostiziert worden. Ab 1997 bis 2006 wurden vereinzelte Infektionen von F. tularensis bei Mensch, Wildtieren und Zootieren (Kleinaffen) festgestellt. Seit 2007 nehmen die Fälle jedoch stark zu, sind aber im Vergleich zu anderen Infektionen relativ selten (2011: 21 Infektionen bei Mensch und 6 bei Wildtieren). Verschiedenste Infektionen von F. tularensis bei Menschen konnten eindeutig als wildtierassoziierte Zoonosen bestätigt werden und wurden entweder durch direkten Kontakt mit Tieren (Wildhüter beim Einsammeln von verendeten Hasen, Wanderer durch Biss einer moribunden Haselmaus) oder über die Nahrungskette ( Verzehr von Wildbret, das ungenügend gegart wurde) verursacht. Molekularepidemiologische Analysen zeigen, dass die in der Schweiz vorherrschenden F. tularensis Stämme zur Westeuropäischen Gruppe von F. tularensis subsp. holarctica gehören (Pilo et al. 2009). Sie sind alle empfindlich auf die zur Behandlung von Tularämie benutzten Antibiotika, so dass eine wirksame Therapie der Tularämie möglich ist. Brucella suis: ein endemischer Erreger in Wildschweinen Brucellose beim Menschen ist eine schwerwiegende Infektion die hauptsächlich durch Brucella melitensis (Maltafieber) und Brucella abortus (Bangsches Fieber) hervorgerufen wird. Allerdings werden alle Brucella spezies als hochpathogene Keime der Risikogruppe 3 zugeordnet. Die Schweiz und das Fürstentum Liechtenstein sind frei von Brucellose der Haustiere. Hier sind Infektionen durch B. melitensis und B. abortus bei Menschen reiseassoziiert. Untersuchungen von Wildschweinen haben ergeben, dass 29 % mit Brucella suis biovar 2 infiziert waren. B. suis biovar 2 ist für den Menschen allerdings nicht hochansteckend. Im Gegensatz dazu gelten Brucella suis biovar 1 und 3 für den Menschen als hochpathogen. Biovar 1 und 3 wurden in Südosteuropa ebenfalls bei Wildschweinen gefunden. Kürzlich wurde ein Brucellose Ausbruch durch B. suis biovar 2 in einem Hausschweinbetrieb (Wollschweine) in der Westschweiz festgestellt. Molekular-epidemiologisch konnte nachgewiesen werden, dass die Infektion nicht direkt durch Wildschweine der Region übertragen wurde. Allerdings lässt die nahe genetische Verwandtschaft der in den Hausschweinen gefundenen B. suis biovar 2 Stämme mit den BrucellaStämmen aus Wildschweinen vermuten, dass die Übertragung von B. suis biovar 2 vom Wildschwein auf Hausschweine in anderen geographischen Regionen stattgefunden hat und durch Zukauf infizierter Trägertiere in die westschweizer Herde verschleppt wurde (Wu et al. 2011). Obwohl keine humanen B. suis Infektionen in der Schweiz gemeldet wurden, kann B. suis biovar 2 Infektionen beim Menschen verursachen. Deshalb und auf Grund der hohen Virulenz von B. suis biovar 1 und 3, welche in Europa auch existieren, sollten Wildschweine, die zum Verzehr vorgesehen sind, auf mögliche B. suis-Infektionen getestet werden. Tuberkulose im Vormarsch? Verschiedene Spezies des «Mycobacterium tuberculosis complex» wie Mycobacterium bovis, Mycobacterium microti, Mycobacterium caprae und Mycobacterium canettii sind wichtige zoonotische Tuberkuloseerreger. Mycobacterium avium subsp. paratuberculosis ist der Erreger der Paratuberkulose oder «Johnes disease» der Rinder. Der Erreger wird mit Morbus Crohn beim Menschen in Verbindung gebracht und gilt deshalb als potentieller Zoonose-Erreger. Alle genannten Spezies sind auch aus Wildtieren isoliert worden und müssen deshalb auch als wildbahn- assoziierte Zoonose-Erreger betrachtet werden. In den letzten Jahren sind im östlichen Alpenraum vermehrt Ausbrüche von M. caprae bei Rotwild entdeckt worden. M. caprae scheint bei Rindern und Ziegen in Europa recht verbreitet zu sein. Zudem sind auch menschliche Infektionen mit M. caprae diagnostiziert worden, was diesen Erreger zu einem Kandidaten möglicher wildbahnassoziierter Tuberkulose macht (Prodinger et al. 2005). In einem gross angelegten EMIDA ERA-NET Projekt wird die Prävalenz von Mycobacterien bei Rothirsch, Reh, Wildschwein sowie auch Gemse und Steinbock eruiert, um deren Rolle als Tuberkulose Träger zu eruieren (www.tb-alpine-wildlife.org). Bis anhin sind in der Schweiz und im Fürstentum Liechtenstein keine Tiere mit Mycobacterien aus dem Mycobacterium tuberculosis complex gefunden worden. Literatur Pilo,P., Johansson,A., Frey,J., 2009. Identification of Francisella tularensis cluster in central and western Europe. Emerg. Infect. Dis. 15, 2049-2051. Prodinger,W.M., Brandstatter,A., Naumann,L., Pacciarini,M., Kubica,T., Boschiroli,M.L., Aranaz,A., Nagy,G., Cvetnic,Z., Ocepek,M., Skrypnyk,A., Erler,W., Niemann,S., Pavlik,I., Moser,I., 2005. Characterization of Mycobacterium caprae isolates from Europe by mycobacterial interspersed repetitive unit genotyping. J. Clin. Microbiol. 43, 4984-4992. Wu,N., Abril,C., Hinic,V., Brodard,I., Thur,B., Fattebert,J., Hussy,D., Ryser-Degiorgis,M.P., 2011. Free-ranging wild boar: a disease threat to domestic pigs in Switzerland? J. Wildl. Dis. 47, 868-879. Referenzdiagnostik Das Zentrum für Zoonosen, bakterielle Tierkrankheiten und Antibiotikaresistenz (ZOBA) (www.vbi.unibe.ch/content/zoba_ diagnostik__referenzfunktion/index_ ger.html) und das Nationale Referenzzentrum für Anthrax und weitere hochpathogene Bakterien (NANT ) (www.vbi. unibe.ch/content/nant/index_ger.html) am Institut für Veterinär-Bakteriologie der Universität Bern, erfüllen im Auftrag der Bundesämter für Veterinärwesen, respektive Gesundheit, die Referenzfunktionen für tierische, respektive menschliche, Isolate von Francisella tularensis und Brucella sp. Das Institut für Veterinärbakteriologie in Zürich fungiert u.a. als Referenzlabor für Tuberkulose und für Coxiella burnetii www.ivb.uzh.ch. Insgesamt decken also die beiden veterinärbakteriologischen Institute der Vetsuisse-Fakultät die bei einheimischen Wildtieren relevanten bakteriellen Zoonoseerreger ab. Autor Prof. Dr. Joachim Frey Institut für Veterinär-Bakteriologie Universität Bern 3001 Bern 9 Wildbahnassoziierte Zoonosen: Parasitäre Erreger Prof. Dr. Bruno Gottstein Infektionskrankheiten, die von Wirbeltier zu Mensch und von Mensch zu Wirbeltier über- tragbar sind, werden als Zoonosen bezeichnet. Wenn es sich bei den Erregern um Protozoen, Helminthen oder Arthropoden handelt, spricht man konventionell von parasitären Zoonosen. Die vorliegende Zusammenfassung präsentiert eine Auswahl wichtiger parasitärer Zoonosen, welche im Zusammenhang mit Wildtieren und dem Menschen stehen, dies im mitteleuropäischen Raum. Trichinellose Menschen können sich durch Aufnahme von rohem Fleisch (Schwein, Wildschwein, Pferd und anderen Tierarten) mit Larven verschiedener TrichinellaArten infizieren. Aus den Larven entwickeln sich Adultstadien, die den Dünndarm besiedeln, wo die Weibchen Larven produzieren, die von der Darmschleimhaut aus über die Lymph- und Blutbahn in die Skelettmuskulatur gelangen, dort in Muskelzellen eindringen und sich einkapseln (Ausnahme: Trichinella pseudospiralis). Das Krankheitsbild der Trichinellose wird durch intestinale und vor allem muskuläre Symptome geprägt. Grad und Dauer der klinischen Erscheinungen hängen von der Infektionsdosis und der Vermehrungsrate der Trichinellen ab. Schon 50 - 70 Larven von T. spiralis vermögen beim Menschen Krankheitserscheinungen auszulösen. Die anderen Arten sind offenbar weniger humanpathogen. Die Diagnose der Trichinellose erfolgt i. d. R. durch den Antikörpernachweis, ab der 3. Woche p. i. treten Serumantikörper auf. Klinisch chemische Befunde liefern weitere diagnostische Hinweise. Bei Wildschwein und Bär ist die Trichinellenuntersuchung obligatorisch. Bei positivem Nachweis, ebenfalls bei Schwein und Pferd, wird der ganze Schlachttierkörper unabhängig von der Befallsdichte, als ungeniessbar erklärt. Beim Import von Schweine- und Pferdefleisch werden im Rahmen der Gesundheits- und Genusstauglichkeitszeugnispflicht Angaben zur erfolgten Trichinellenuntersuchung oder zu Massnahmen für deren Inaktivierung verlangt. Die Schweiz gilt als frei von Trichinella spiralis, aber T. britovi kommt in einem Wildtierzyklus vor. So gelten z. Z. ca. 1 - 2 % der Füchse als infiziert, ca. 24 % der Luchse sowie < 1 % der Wildschweine. 10 Entwicklungszyklus von Echinococcus multilocularis: Nyctereutes procyonoides Myocastor coypus Fuchs und Hund sind die wichtigsten Endwirte: Diese beherbergen die winzigen Bandwürmer, die nur 2 - 5 mm lang sind, in ihrem Darm. Nachdem infizierte Mäuse gefressen wurden, dauert es ca. 31 Tage, bis mit dem Kot der Tiere mikroskopisch kleine Bandwurmeier ausgeschieden werden, die für Mäuse und auch den Menschen infektiös sind. Mäuse (v.a. Scher- und Feldmäuse) sind die wichtigsten Zwischenwirte: Nachdem Bandwurmeier gefressen wurden, schlüpfen im Darm der Mäuse kleine Larven des Parasiten aus, die in die Leber einwandern und dort eine tumorähnliche Veränderung hervorrufen. Werden infizierte Mäuse von Endwirten – z.B. Fuchs oder Hund – gefressen, entstehen aus den Leberparasiten der Mäuse neue Bandwürmer im Darm dieser Endwirte. Alveoläre Echinokokkose Die alveoläre Echinokokkose (AE ) des Menschen wird durch die Infektion mit Eiern des Fuchsbandwurmes (Echinococcus multilocularis) verursacht. Nebst Fuchs spielt auch der Hund als Endwirt und somit Infektionsquelle für den Menschen eine Rolle. Der Mensch wird glücklicherweise nur selten von der Erkrankung betroffen. Allerdings ist es sehr wichtig, eine Infektion möglichst früh zu erfassen, weil dann eine effiziente und meist kurative Behandlung eingeleitet werden kann. In der Schweiz ist die AE schon seit vielen Jahrzehnten bekannt, z. Z. werden ca. 20 - 30 neue Fälle pro Jahr erfasst. Die AE ist somit eine zwar schwere, dafür seltene Krankheit. Diese betrifft in über 95 % der Fälle die Leber, im Spätstadium kann eine «Metastasierung» in andere Organe erfolgen. Bei der unbehandelten AE kann die Sterberate sehr hoch sein. Früh- erfassung sowie verbesserte Therapiemöglichkeiten haben im Laufe der letzten Jahre zu einer wesentlichen Erhöhung der Überlebensrate bei behandelten Fällen geführt. Die Inkubationszeit ist sehr lang, sie wird im Durchschnitt auf 5 bis 15 Jahre geschätzt. Die Echinokokkose des Menschen wird mit klinischen Methoden (bildgebende Verfahren) sowie durch serologische Untersuchungen diagnostiziert. Dazu stehen heutzutage sehr spezifische Methoden zur Verfügung (Em2ELISA, Em18-ELISA, Em-Immunoblot), die ebenfalls eine Früherfassung der Infektion ermöglichen (d.h. Erfassung, lange bevor eine infizierte Person erkrankt). Solche Tests sollten nur in spezialisierten Labors beantragt werden. Beim AE-Patienten gilt die vollständige operative Entfernung des Parasiten als kurative Behandlungsmassnahme. Eine sichere Chemotherapie gibt es noch nicht, aber die Wirkstoffe Albendazol (und Mebendazol) erzielen sehr gute Teilerfolge. Bei E. multilocularis ist eine Prophylaxe schwierig. Vorsicht beim Umgang mit Füchsen (ggf. Plastikhandschuhe tragen), in bekannten endemischen Gebieten keine rohen, potentiell kontaminierten Konsumationsgüter (z.B. Fallobst oder Freilandgemüse) einnehmen, oder dann diese vorgängig sehr gut waschen. Echinococcus-Eier können durch Erhitzen (Kerntemperaturen > 80 °C) oder Tiefgefrieren bei - 80 °C abgetötet werden. In bekannten Endemiegebieten kann eine Eiausscheidung bei Hunden und Katzen, die Mäuse fressen, durch eine therapeutische Praziquantel-Dosierung (regelmässig alle 4 Wochen zu verabreichen) verhindert werden! Wenden sie sich dazu an ihren Tierarzt. Massnahmen bei Personen mit Kontakt zu infizierten Hunden und Katzen: Über den Hausarzt soll eine erste serologische Untersuchung innerhalb einiger Wochen sowie zwei weitere Untersuchungen nach 6 bzw. 12 Monaten nach Kontakt zu infizierten Hunden und Katzen erfolgen. Toxoplasmose Toxoplasma gondii durchläuft im Epithel des Dünndarmes von feliden Endwirten (Haus- und Wildkatze, Luchs) einen geschlechtlichen Zyklus, der mit der Ausscheidung von Oozysten im Kot endet. In der Aussenwelt werden die Oozysten innerhalb weniger Tage durch Ausbildung von Sporozoiten für viele Arten von Zwischenwirten (Säugetiere, Vögel, Mensch) infektiös. Nach oraler Aufnahme sporulierter Oozysten durch Zwischenwirte befallen die Parasiten kernhaltige Zellen diverser Organe / Gewebe (u. a. Muskulatur, ZNS), wo sie sich zunächst als sog. Tachyzoiten rasch vermehren. Nach Ausbildung einer Immunantwort entstehen durch Vermehrung über Bradyzoiten später Gewebezysten, die viele Zystozoiten enthalten und die über Jahre persistieren können. Die Infektion von Menschen erfolgt nebst durch orale Aufnahme sporulierter Oozysten ebenfalls durch Verzehr zystenhaltigen Fleisches. Bei einer nicht-immunen Frau ist eine diaplazentäre Übertragung der Erreger auf den Fetus möglich. Die Folgen einer solchen Infektion können schwer- Trichinella: Spezies, die in Mitteleuropa vorkommen domestischer Zyklus silvatischer Zyklus (T. spiralis) T. britovi T. pseudospiralis T. spiralis Quelle: Soulé and Dupoy Camet (1991) Im sogenannten domestischen Zyklus mit T. spiralis spielt – weltweit betrachtet – das Hausschwein die wichtigste Überträgerrolle. In Europa können Wildtiere wie Wildschwein, Fuchs, Wolf, Marder, Dachs und Luchs ebenfalls Träger von Trichinellen sein, wobei bei diesem sylvatischen Zyklus vor allem T. britovi eine Rolle spielt. T. pseudospiralis kommt in Mitteleuropa sehr selten vor. wiegend sein. So können latente Infektionen bei Immunschwäche (z.B. AIDS, Organtransplantation) aktiviert werden und zu einer zerebralen oder generalisierten, symptomatischen Toxoplasmose führen. In der Schweiz finden sich bei omni- und herbivoren Haus- bzw. Nutztieren hohe Durchseuchungsquoten. Bei Wildtieren gibt es keine zuverlässigen Zahlen dazu, aber man muss davon ausgehen, dass die Prävalenzen (z.B. beim Wildschwein sowie bei anderem jagdbaren Wild) ähnlich derjenigen bei Haustieren sind. Coenurose Migrationen von Wildtierarten im europäischen Raum, wie z.B. der Wolf, können auch in die Verbreitung von (zoonotischen) Parasitenarten in vorhergehend nicht-endemische Regionen resultieren. Ein Beispiel dafür ist das Wiederauftreten der Coenurose in der Schweiz, vorerst bei gealpten Schafen in der Südostschweiz, wo der Parasit über Herdenschutzhunde aus Italien eingeschleppt wurde. Einige Jahre später erfolgten dann in der Südwestschweiz mehrere Coenurose-Fälle bei einheimischen Wildwiederkäuern (Steinbock, Gämse), welche nun – mit grosser Wahrscheinlichkeit – über eingewanderte Wölfe aus Italien angesteckt wurden. Bei der Coenurose handelt es sich um bis zu faustgrosse Larven von Bandwürmern der Arten Taenia multiceps / Taenia serialis. Prädilektionsstelle für die Larvenentwicklung ist das Hirn. Differentialdiagnostisch gilt es mit bildgebenden Verfahren sowie Serologien (spezifische ELISA's und Immunoblots) dieses Krankheitsbild von einer Neurozystizerkose oder einer zerebralen Echinokokkose zu unterscheiden. Biopsiematerial wird mittels PCR art-spezifisch identifiziert. Da es sich beim Menschen um eine sehr seltene Erkrankung handelt, ist entsprechend die labordiagnostische Erfahrung sehr beschränkt. Untersuchungen sollten nur bei spezialisierten Laboratorien beantragt werden. Literatur elektronisch unter www.risch.ch/Riport70 Autor Prof. Dr. Bruno Gottstein Direktor Institut für Parasitologie der Universität Bern 3012 Bern 11 Wildbahnassoziierte Zoonosen: Parasitäre Erreger Literatur Gottstein B, Saucy F, Deplazes P, Reichen J, Demierre G, Zürcher C, Busato A, Pugin P: Is a high prevalence of Echinococcus multilocularis in wild and domestic animals associated with increased disease incidence in humans? Emerging Infectious Diseases 7: 408-412 (2001). Berger-Schoch AE, Bernet D, Doherr MG, Gottstein B, Frey CF: Toxoplasma gondii in Switzerland: A serosurvey based on meat juice analysis of slaughter pigs, wild boar, sheep and cattle. Zoonoses and Public Health 58: 472-478 (2011). Frey CF, Schuppers ME, Müller N, Ryser-Degiorgis MP, Gottstein B: Assessment of the prevalence of Trichinella spp. in red foxes and Eurasian lynxes from Switzerland. Vet Parasitol. 159: 295299 (2009). Lebensmittelassoziierte Zoonosen: Klassische Erreger von Lebensmittelinfektionen Prof. Dr. med. vet. Roger Stephan Gemäss World Health Organization (WHO) sind lebensmittelassoziierte Erkran- kungen auch heute noch Ursache für viele humane Erkrankungen. Scallan et al. (2011) gehen in den USA jährlich von 47 Millionen Fällen, 126 000 Hospitalisationen und 3000 Todesfällen aus, wobei dadurch Kosten von rund 77 Milliarden Dollar (Scharff et al. 2012) entstehen. Bakterielle Ursachen stehen dabei im Vordergrund. Campylobacter und Salmonellen gehören zu den bedeutendsten Lebensmittelinfektionserregern und führen zusammen in der EU und aber auch weltweit die Hitliste an (Anonymous 2011). Daneben sind eine ganze Reihe weiterer Lebensmittelinfektions- (z.B. Listeria monocytogenes, Shigatoxin-bildende Escherichia coli, Yersinia enterocolitica, Vibrio parahaemolyticus) und Lebensmittelintoxikationserreger (z.B. Staphylococcus aureus, Clostridium perfringens, Clostridium botulinum) von Bedeutung. Im Rahmen dieses Artikels wird vertieft auf Campylobacter, Salmonellen und enterovirulente E. coli eingegangen. In den letzten 10 Jahren hat die Gruppe der thermophilen Campylobacter spp. als Erreger lebensmittelbedingter Erkrankungen zunehmend an Bedeutung gewonnen. Sie sind heute weltweit die wichtigsten lebensmittelassoziierten bakteriellen Erreger, die zu akuten Durchfallkrankheiten des Menschen führen. Lebensmittelassoziiert haben folgende drei Spezies, die zur Gruppe der «thermophilen Campylobacter» gehören, eine Bedeutung: Campylobacter coli, Campylobacter jejuni und Campylobacter lari, wobei Campylobacter jejuni für den Hauptteil der humanen Erkrankungen verantwortlich ist. Die Gattung Salmonella gliedert sich in zwei Arten, S. enterica und S. bongori, wobei sich S. enterica in mehrere Subspecies oder Unterarten aufgliedert (S. enterica subsp. enterica, S. enterica subsp. salamae, S. enterica subsp. arizonae, S. enterica subsp. diarizonae, S. enterica subsp. houtenae, S. enterica subsp. indica). Lebensmittelhygienisch relevant ist die Gruppe der nicht typhösen Salmonellen. 8000 7000 6000 5000 4000 3000 2000 1000 0 91 995 999 000 002 003 004 005 006 007 008 009 010 2 19 1 1 2 2 2 2 2 2 2 2 2 Campylobacter Salmonellen Bestätigte humane Campylobacteriosen und Salmonellosen in der Schweiz extraintestinale Krankheiten auslösen. Darmpathogene E. coli werden zurzeit in 8 Gruppen eingeteilt (EPEC, ETEC, EIEC, AEEC, DAEC, EDTEC, NTEC, STEC), wobei den Shigatoxin-bildenden E. coli (STEC), synonym Verotoxin-bildende E. coli ( VTEC) oder Enterohämorrhagische E. coli (EHEC) aus Lebensmittel-hygienischer Sicht eine ganz spezielle Bedeutung zukommt. STEC wurden 1982 in den USA erstmals als «emerging foodborne pathogens» beschrieben und führten seither auch in Europäischen Ländern zu lebensmittelbedingten Ausbrüchen (siehe Ausbruch assoziiert zu E. coli O104:H4 im Frühsommer 2011 in Deutschland) oder sporadischen Einzelerkrankungen. Literatur Anonymous. The European Union summary report. Trends and sources of zoonoses and zoonotic agents and food-borne outbreaks in 2009. EFSA Journal 2011; 9: 2090-2468. Scallan et al. Foodborne illness acquired in the United States-unspecified agents. Emerg. Infect. Dis. 2011; 17: 16-22. Scharff et al. Economic burden from health losses due to foodborne illness in the USA J. Food Protect. 2012; 75: 123-131. Autor Prof. Dr. med. vet. Roger Stephan Institut für Lebensmittelsicherheit und Hygiene Während die meisten Escherichia coli (E. coli) Stämme apathogen sind, können bestimmte Stammvarianten intestinale oder 12 Vetsuisse Fakultät Universität Zürich 8057 Zürich Lebensmittelassoziierte Zoonosen: Spezielle Erreger von Lebensmittelinfektionen Prof. Dr. Franz Allerberger Unter Brucellosen werden Infektionen mit Bakterien der Gattung Brucella verstanden. Das Erregerreservoir sind infizierte Nutztiere. Die Übertragung auf den Menschen erfolgt durch Brucella-haltige Lebensmittel (Rohmilch und daraus hergestellte Produkte) oder über direkten Kontakt mit infizierten Tieren und deren Ausscheidungen. Eine direkte Übertragung von Mensch zu Mensch ist äusserst selten (in Einzelfällen durch Stillen oder Bluttransfusionen). Die Spezies B. melitensis tritt vor allem bei Schafen und Ziegen in Mittelmeerländern auf; beim Menschen wird diese Infektionskrankheit als Maltafieber bezeichnet. B. abortus verursacht das seuchenhafte Verwerfen bei Rindern und die Bang’sche Krankheit beim Menschen. B. suis ist in Europa selten und findet sich neben Schweinen hauptsächlich bei Feldhasen. Für den kulturellen Nachweis des Erregers sollte wiederholt Blut abgenommen werden, möglichst vor Beginn der antibiotischen Therapie; auch Knochenmark, Urin und sonstige Gewebeproben eignen sich für den kulturellen Erregernachweis. Der serologische Nachweis von spezifischen Antikörpern ist ebenfalls diagnostisch; positive ELISA-Ergebnisse sollten mittels Serumlangsamagglutination überprüft werden. Im Jahr 2010 gab es in Österreich nur drei dokumentierte Fälle; zwei Fälle wurden als importierte Fälle gemeldet, der dritte Fall mit unbekanntem Status bezüglich Infektionsort. Listeria monocytogenes kann die Krankheit Listeriose verursachen. Die Erreger kommen in der Umwelt weit verbreitet vor, sowohl in Abwässern, der Erde und auf Pflanzen. Lebensmittel tierischer Herkunft wie Rohmilch, Weichkäse, Räucherfisch oder rohes Fleisch können während der Gewinnung (z.B. beim Melken oder Schlachten) oder der Herstellung verunreinigt werden. Auf Grund ihrer für Bakterien ungewöhnlichen Fähigkeit zu Wachstum auch bei niedrigen Temperaturen, können sich Listerien im Kühlschrank vermehren. Im Rahmen einer Lebensmittelinfektion zeigen sich erste Krankheitszeichen innerhalb von 3 - 70 Tagen. Der Erregernachweis erfolgt mittels Anzucht aus Blut, Gehirn- oder Rückenmarkflüssigkeit, Eiter oder Stuhl. Die Wertigkeit der serologischen Listeriose-Diagnostik ist sehr kritisch zu hinterfragen. Im Jahr 2010 wurden in Österreich beim Menschen 34 Fälle invasiver Listeriose registriert, wobei drei Fälle in Verbindung mit Schwangerschaften auftraten. Die Sterblichkeit lag bei 12 % (vier der 34 Patienten verstarben). Ein Anstieg an Fällen im Jahr 2009 war auf einen lebensmittelbedingten Krankheitsausbruch zurückzuführen, auf den Verzehr von kontaminiertem Quargel-Käse. Die Weiterleitung von klinischen Listerien-Isolaten an Referenzlaboratorien zur molekularbiologischen Subtypisierung stellt die Grundvoraussetzung für eine rasche Erkennung von Listeriose-Ausbrüchen. Das Hepatitis E Virus ist der Erreger einer sehr selten, aber zunehmend häufig diagnostizierten Hepatitis. Die Übertragung erfolgt nicht nur fäkal-oral, sondern auch durch Genuss von Fleisch / Innereien vom Schwein / Wildschwein oder von Hirsch, Rind, Schaf oder Ziege, selten auch intrauterin oder parenteral. Die Inkubationszeit beträgt meist 26 - 42 Tage. Die Diagnostik der Hepatitis E erfolgt durch den Nachweis von virusspezifischen IgM- (und IgG-) Antikörpern aus Serum ab Symptomenbeginn und von HEV-RNA mittels PCR aus Serum oder Stuhl (der Höhepunkt der Virämie und der Ausscheidung von HEV mit dem Stuhl liegen in der Inkubationsphase und in der frühen akuten Erkrankungsphase). In Österreich wurden im Jahr 2010 nur sieben Erkrankungen dokumentiert, obwohl die Seroprävalenz bei Gesunden in Industriestaaten ca. 1 % beträgt. Zu den konkreten Quellen für in Mitteleuropa erworbene Hepatitis E-Erkrankungen, insbesondere zur Rolle von Schweinefleisch, ist bislang nur wenig bekannt. werden auch als Trichinellen oder Trichinen bezeichnet. Die Infestation erfolgt durch den Verzehr von rohem oder ungenügend erhitztem Fleisch, das eingekapselte Trichinella-Larven enthält. Bevorzugt werden sauerstoffreiche, d.h. gut durchblutete Muskeln befallen. Die Inkubationszeit beträgt 5 bis 15 Tage. Die Verdachtsdiagnose kann durch den Nachweis spezifischer Antikörper im Blut des Patienten bestätigt werden; bei massivem Befall kann ein Nachweis der Larven im Gewebe gelingen. Bei den während der letzten drei Jahrzehnte in Österreich gemeldeten Trichinellose-Fällen handelt es sich ausschliesslich um importierte Fälle (Österreich 2010: fünf TrichinelloseErkrankungen). Die Qualität der agrarindustriellen Nahrungsmittelproduktion in Mitteleuropa stellt heute die Notwendigkeit der amtlichen Trichinen-Fleischbeschau beim Hausschwein in Frage: kein einziger der im Jahr 2010 in Österreich untersuchten 5.577.679 Schlachtkörper zeigte Trichinen. Autor Prof. Dr. Franz Allerberger Trichinellosen werden durch Larven von Rundwürmern – vor allem der Art Trichinella spiralis – verursacht. Diese Erreger Bereichsleiter Humanmedizin Agentur für Gesundheit und Ernährungssicherheit AGES, Wien (A) 13 Antibiotikaresistenzen und Nutztierhaltung Dr. Peter Much Seit der ersten bewussten Anwendung von Antibiotika ist die Bedrohung durch resistente Keime sowohl für den Menschen als auch für Tiere gestiegen. Man muss sich bewusst sein, dass Antibiotikaresistenzen ein natürliches Phänomen sind, da viele Klassen von Antibiotika natürliche Substanzen darstellen und in vielen Fällen von Bodenbakterien gebildet werden, um sich selbst u.a. vor den eigenen produzierten Antibiotika zu schützen. Sogar in Proben von 30.000 Jahre alten Permafrostböden konnten Gene gefunden werden, die Resistenzen gegenüber ß-Laktamantibiotika, Tetrazykline oder Glykopeptide kodieren. Viele dieser Resistenzmechanismen sind gene- Werden Antibiotika eingesetzt, kann das zur Selektion jener Klone führen, die Resistenzgene gegenüber den verabreichten Antibiotika tragen. Im Resistenzmonitoring in der Veterinärmedizin in Österreich werden Pathogene wie Salmonellen und thermotolerante Campylobacter und Indikatorkeime, wie die natürlich vorkommenden E. coli und Enterokokken, aus Darminhalten gesunder, geschlachteter Nutztiere (Rinder, Schweine, Hühner) isoliert. Die zu untersuchenden Tiere werden nach einem randomisierten Stichprobenplan ausgewählt und im AGES-Labor in Graz wird nach der Anzüchtung aus Probenmaterial eine willkürlich ausgewählte Kolonie vom Nährmedium entnommen, die gesuchte Bakterienspezies bestätigt und dieses Isolat der Resistenztestung zugeführt. Sind im untersuchten Tier Antibiotika eingesetzt worden, so wurden resistente Klone selektioniert, es liegen nur mehr diese resistenten Isolate vor oder sie liegen zumindest in einer höheren Anzahl als ihre nicht-resistenten Verwandten vor. Somit steigt die Wahrscheinlichkeit, von diesen Tieren resistente Keime zu gewinnen. Es liegt die Vermutung nahe, dass, wenn in einer Tierpopulation hohe Resistenzanteile gefunden werden, eine Selektion von resistenten Keimen stattgefunden hat und somit häufiger Antibiotika eingesetzt wurden. In Österreich liegen zum Antibiotikaverbrauch noch keine entsprechenden Daten auf Basis der unterschiedlichen Nutztierpopulationen vor, welche diese Theorie belegen könnten. Die Abbildung zeigt das Resistenzverhalten der Indikatorbakterien E. coli, isoliert aus gesunden geschlachteten Masthühnern, Rindern und Schweinen, gegenüber ausgewählten antimikrobiellen Wirkstoffen im Jahr 2010. Diese Daten aus der Veterinärmedizin sind jedoch mit den Daten aus der Humanmedizin u. a. wegen der unter14 resistent (%) tisch kodiert und können von Bakterien auch über ihre Speziesgrenzen hinweg übertragen werden. 100 90 80 70 60 50 40 30 20 10 0 Masthuhn Rind Schwein GEN STR FOT SMX TMP CIP NAL Antimikrobielle Substanz AMP CHL TET Abbildung: Resistenzverhalten der Indikatorbakterien E. coli aus gesunden geschlachteten Masthühnern, Rindern und Schweinen gegenüber ausgewählten antimikrobiellen Wirkstoffen in Österreich im Jahr 2010 (GEN Gentamicin, STR Streptomycin, FOT Cefotaxim, SMX Sulfamethoxazol, TMP Trimethoprim, CIP Ciprofloxacin, NAL Nalidixinsäure, AMP Ampicillin, CHL Chloramphenicol, TET Tetrazyklin) schiedlichen Methodik der Resistenztestung und dem Anlegen verschiedener Grenzwerte, was die Bewertung von resistent oder sensibel betrifft, nicht oder nur sehr bedingt vergleichbar. Der Rückschluss daher ist nicht zulässig, generell beim Auftreten von Resistenzen bei Isolaten vom Menschen diese auf Antibiotikagaben bei Tieren zurückzuführen. In einer schottischen Studie über die Epidemiologie von multiresistentem Salmonella Typhimurium DT104 konnte belegt werden, dass Tiere und Menschen unterschiedliche Populationen an diesen Salmonellen aufweisen und nur ein geringer Anteil der gemeinsamen Stämme erstmals bei Tieren gefunden wurde, wodurch die Autoren zum Schluss kommen, dass die sympatrische Tierpopulation nicht die Hauptquelle der bei Menschen beobachteten Diversität an Resistenzen sein kann. mehrere Jahre vorliegen, können valide Analysen über die Zusammenhänge zwischen dem Verbrauch von Antibiotika und dem Auftreten von Resistenzen durchgeführt werden. Literatur Allen, H.K. et al., 2009. Functional metagenomics reveals diverse b-lactamases in a remote Alaskean soil. The ISME Journal. 3, 243-251 Mather, A.E. et al., 2012. An ecological approach to assessing the epidemiology of antimicrobial resistance in animal and human populations. Proc. R. Soc. B. 279 no. 1733 1630-1639. Autor Dr. Peter Much In Österreich wird heuer begonnen, den Antibiotikaverbrauch auf Tierartenebene zu erheben. Erst wenn solche Daten über Daten-Statistik-Risikobewertung Agentur für Gesundheit und Ernährungssicherheit AGES, Wien (A) short-Riport 24 März 2012 Bern Delémont Lugano Schaffhausen * Schaan * Zürich-Nord www.risch.ch Aktuelle HCV-Diagnostik Die Infektion mit Hepatitis C-Virus (HCV) ist auch bei uns stark verbreitet (die Prävalenz in der Schweiz beträgt ca. 0.7 - 1 %, weltweit ca. 3 %). Da diese Infektion meistens lange ohne Symptome schlummert und erst nach vielen Jahren zu einer schweren Erkrankung führen kann, ist eine gute Diagnostik sehr wichtig, damit die betroffenen Patienten rechtzeitig richtig therapiert und eine weitere Übertragung der Infektion verhindert werden kann. Die langwierige, teure und für den Patienten stark belastende Therapie ist einerseits von der Viruslast (viral-load) und vom Virus-Genotyp, aber auch vom Erkrankungsgrad der Leber abhängig. Erreger und Übertragung Beim Hepatitis C-Virus handelt es sich um ein RNA-Virus der Familie der Flaviviren. Es kommt in 6 Genotypen sowie diversen Untertypen vor. Die Übertragung erfolgt parenteral durch Kontakt mit infiziertem Blut oder Körpersekreten. Ein relativ grosses Übertragungsrisiko besteht bei i.v.-Drogenabusus und Transfusionen. Das Infektionsrisiko bei ungeschütztem Geschlechtsverkehr mit einem infizierten Partner oder die Übertragung einer infizierten Schwangeren auf ihr ungeborenes Kind sind geringer (1- 6 %). Eine Infektion nach Nadelstichverletzungen bei medizinischem Personal ist ebenfalls ziemlich selten (0.4 %). Das Infektions-Risiko ist jedoch in jedem Fall abhängig von der Viruslast (viral load). ISO 17025 / Nr. STS 177 akkreditiert durch SAS * ISO 9001 / Nr. 13231 zertifiziert durch SQS * Erkrankung Nach einer akuten Erkrankung an Hepatitis C geht diese in 60 - 80 % der Fälle in eine chronische, meist symptomlose Infektion über, die allmählich zur Leberfibrose führt. Bei 5 - 20 % entwickeln sich nach 20 - 30 Jahren eine Leberzirrhose und/oder ein Leberkarzinom. Eine spontane Heilung nach Infektion erfolgt lediglich in ca. 15 % (als Vergleich: die spontane Heilungsrate beträgt bei der Infektion mit HBV ca. 90 %). Diagnostik Screening: HCV-Antikörper / HCV-Antigen Die Antikörperbildung setzt frühestens 4 - 6 Wochen nach Infektion, meist aber erst nach 2 - 6 Monaten ein und erlaubt keine Unterscheidung zwischen einer aktiven und einer ausgeheilten Infektion. Das Antigen ist bis zu 5 Wochen vor den Antikörpern nachweisbar. Mit der Antigenbestimmung verkleinert sich das diagnostische Fenster bei einer frischen Infektion damit deutlich. Der Nachweis von HCV-Antigen deutet auf eine akute oder chronische Infektion mit dem HCV-Virus hin und bestätigt die Spezifität der HCV-Antikörper. Mit der von uns eingesetzten TestKombination von HCV-AK und HCV-Ag sind wir in der Lage, die Screening-Diagnostik zu verbessern. Seite 2 Weiterführende HCV-Diagnostik und Therapieverlaufskontrolle HCV-Immunoblot Der HCV-Immunblot ist in erster Linie ein Bestätigungstest bei unklarer Serologie. Er wird bei HCV-AK-positivem und HCV-Agnegativem Testresultat angewendet. Damit kann zwischen einer abgelaufenen Infektion und einem falsch positiven HCV-AK-Test, z.B. durch eine Kreuzreaktion oder durch eine unspezifische Reaktion, unterschieden werden. Viral load Die Bestimmung des viral loads mittels PCR ist wichtig für die Abschätzung der Infektiosität, dient aber vor allem als Therapieverlaufskontrolle. Wegen der hohen Sensitivität der quantitativen Methode (die Nachweisgrenze im lmz Dr Risch liegt bei 8 IU/ml) kann heute auf eine vorgängige qualitative Bestimmung, die früher notwendig war, verzichtet werden. Zunehmend wird der viral load auch als Bestätigungstest eines positiven Screeningresultates eingesetzt, zumal der Test auf einem unabhängigen Nachweisverfahren beruht. Diagnostik als Therapieentscheidungshilfe Virus-Genotypisierung Die Bestimmung des Virusgenotyps wird zur Therapieindikation durchgeführt. Die Behandlung der HCV-Infektion ist abhängig vom jeweiligen Genotyp. Der Genotyp 1, der bei uns am häufigsten vorkommt, ist gleichzeitig der Virus-Genotyp mit der schlechtesten Prognose. Eine Therapie bei Infektion mit diesem Genotyp dauert zudem in der Regel mit 48 Monaten deutlich länger als die Therapie von einem anderen Genotyp, die meist über 24 Monate mit besseren Erfolgsaussichten dauert. Fibrose-Test ELF (Enhanced Liver Fibrosis) Mit hoher Sensitivität und Spezifität ist der ELF-Test ein guter Marker für eine Leberfibrose und damit eine Entscheidungshilfe bei der Fragestellung HCV-Therapie. Durch diesen einfachen Blut-Test kann in vielen Fällen eine riskante Leberbiopsie vermieden werden. Beim ELF-Test wird ein Score-Wert bestimmt, welcher aus 3 verschiedenen Serum-Biomarkern bestimmt wird. · Hyaluronsäure (HA) · Procollagen III N-terminal peptides (PIIINP) · Gewebe-Inhibitor der Matrixmetaloproteinase (TIMP1) Die Biomarker werden mittels Immunoassay-Test bestimmt. Der berechnete Score-Wert gibt ein Mass für den Grad einer Leberfibrose. www.risch.ch IL28B Genotypisierung Mit der IL28B-Genotypisierung des Patienten gibt es einen zusätzlichen Marker zur Abschätzung des natürlichen Verlaufs und die Erfolgsaussichten einer Therapie. Verantwortlich für den Inhalt Dr. sc. nat. ETH Monika Wydler, FAMH Mikrobiologie und Klinische Immunologie Dr. med. Walter Fierz, MHIM, FAMH Klinische Immunologie