Die Hierarchie der Erregungsleitung des Herzens
Werbung

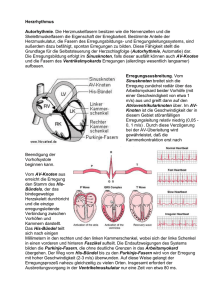
1 Die Hierarchie der Erregungsleitung des Herzens Wolfgang Herzberg 28.10.2014 Die Hierarchie der Erregungsleitung des Herzens – beginnend am av-Knoten - basiert auf einer Kaskade zunehmender Membranpotentiale (MRP) bei identischen Membranschwellen: das niedrigste MRP im av-Knoten, das höchste MRP im terminalen Purkinje-Netz am Übergang zu den Myozyten – also streng genommen schon nicht mehr dem Reizleitungssystem zugeordnet. Damit bei Ausfall eines höher gelegenen Zentrums das darunter liegende jederzeit die impulsgebende Führung übernehmen kann, müssen alle Stufen der Kaskade in gleicher Weise funktionell autark ausgestattet sein. Diese Ausstattung hat folgende Merkmale: 1. Die Abgrenzung einer Stufe zur voraufgehenden und zur folgenden ist durch eine scharfe Trennung der MRP definiert. 2. Alle Stufen sind durch Na+ Ionen-Leckströme (vermutlich in gleicher Rate pro Membranfläche) charakterisiert. 3. Mit Beginn der Erregung einer Stufe läuft ein fortschreitender Depolarisationsvorgang ab, der vor Erreichen des Stufen-Endes ein „Ereignis“ erzeugt. Dieses „Ereignis“ ist der Schlüssel zur Übertragung der Erregung auf die Folgestufe. 4. Damit das Ausbleiben des „Ereignisses“ dazu führt, dass die Erregungsleitung am Ende der Stufe zum Stehen kommt, besitzt jede Stufe ein „Ausgangshindernis“. 5. Da alle Vorgänge elektrophysiologisch betrachtet auf einer Membranerregung fußen, kann das „Ereignis“ eigentlich nur eine kollektiv-synchrone Erregung der gesamten Membranoberfläche der betreffenden Stufe sein. 6. Das bedeutet, dass die fortschreitende Erregung einzelner Fasern schließlich eine kollektive Depolarisation der gesamten Membranoberfläche der Stufe erzeugen muss, die wiederum nur durch eine wachsende extrazelluläre Negativität ausgelöst sein kann. 7. Was aber steckt elektrophysiologisch hinter dem „Ausgangshindernis“ ? Da die Erregung bei Ausbleiben der kollektiven Depolarisation am Ende der Stufe „stirbt“, müssen dort die Abstände der Faserzellen so groß sein, dass die Intensität der induktiv-magnetischen Felder zu gering ist, um jenseits dieses Zellabstandes den nächstliegenden Na+ Ionen Kanal noch depolarisieren zu können. Es bestünde alternativ auch die Möglichkeit, dass die Abstände der Na+ Ionen Kanäle am Ende der Stufe zu groß werden – gewissermaßen außer Reichweite geraten, was auch durch eine MRP-Stufe bei gleichen Abständen erzeugt würde. 8. Da nun aber die membranöse Oberflächenmorphologie der Fasern (siehe „Der AV-Knoten“) so beschaffen ist, dass sie die Erzeugung stärkerer induktiv-magnetischer Felder nicht zuläßt, was auch als ein Schutz der kardiomyozytären Umgebung vor akzidentieller Depolarisation begriffen werden kann, sind Erwägungen, die den Einsatz stärkerer Induktionsfelder einschließen, nicht realistisch. 28.10.2014 Revision 0 Wolfgang Herzberg 2 9. Ferner läßt sich zeigen, dass der Bau der Fasern kaum geeignet ist, um etwa durch eine breitere interzelluläre Spalte eine Erregung „sterben“ zu lassen. Vielmehr wird diese solange immer tiefer in den interzellulären Spalt eindringen, bis die Verengung so groß geworden ist, dass die Erregung über eine wachsende zunehmend hermetisch gefangene extrazelluläre Negativität auf die Gegenseite überspringen kann. „Sterben“ wird eine Erregung erst dann, wenn eine breite Diskontinuität der gesamten Faser besteht – eine Unterbrechung – das Ende der Faser. 10. Wenn man diesen Ansatz vertieft, dann besteht das Ausgangshindernis aus dem Ende aller orthograden – primären - Fasern der Stufe. Eine Erregung dieser Fasern kommt also immer am Ende der Stufe zum Stehen. Wird vor dem Erreichen des Faserendes die kollektive Depolarisation ausgelöst, dann werden interstitiell ruhende – proximalwärts blind endende – sekundäre Fasern depolarisiert, die dann das Erregungssignal synchron zur folgenden Stufe transportieren und dort die Funktion primärer Fasern übernehmen (Abb.1). Abb.1 Das Bau-Prinzip der „Stufe“: Die Erregungsrichtung weist nach rechts. Die primären Fasern (schwarz) erzeugen eine kollektive Depolarisation und erregen die Sekundärfasern (grau). Da diese Fasern im Falle eines Blockes ektopische Erregungen erzeugen, sind alle sekundären Fasern vor Verlassen der Stufe miteinander vernetzt, damit die Synchronizität des Signaltransportes gewährleistet bleibt. 11. So betrachtet wird die Synchronizität der Signalübertragung durch die kollektive Depolarisation erzeugt, das „Ausgangshindernis“ aber durch das Ende der primären StufenFasern. 12. Die MRPsec der sekundären Fasern ist immer höher als das der primären. 13. Damit die kollektive Depolarisation der primären Fasern die Membranschwelle der sekundären Fasern depolarisieren kann, müssen die verbliebenen unerregten Endstücke der primären Fasern vor Beginn der kollektiven Depolarisation noch lang genug sein, damit das kollektiv und synchron verschobene Na+ Ionen Kontingent ausreicht, um über das Maß der extrazellulären Negativität die höhere Potentialdifferenz (∆MPsec) aus Membranschwelle (MPM) und MRPsec kompensieren zu können. 14. Die kollektive Depolarisation der primären Fasern wird also dann ausgelöst, wenn die extrazelluläre Negativität der unmittelbaren Faser-Umgebung die Potentialdifferenz (∆MPprim) aus Membranschwelle (MP) und MRPprim der primären Fasermembran kompensiert. Die kollektive Depolarisation der primären noch unerregten Restfasern aber hebt die extrazelluläre Negativität in Form eines Überschusses auf das Niveau der sekundären Potentialdifferenz (∆MPsec). 15. MRPprim – MPM = ∆MPprim MRPsec – MPM = ∆MPsec ∆MPprim < ∆MPsec 16. Wenn die kollektive Depolarisation in ihrer Kapazität zu gering ist, um die sekundären Fasern zu depolarisieren oder sogar ganz ausbleibt, dann schreitet die schon früh-diastolisch 28.10.2014 Revision 0 Wolfgang Herzberg 3 begonnene Selbstdepolarisation der sekundären Fasern aufgrund der Tätigkeit ihrer Na+ Leckkanäle weiter fort. Ist die Signal-Erregungsfrequenz der primären Fasern doppelt so groß wie die Automatie-Frequenz der sekundären Fasern, dann wird die Automatie der sekundären Fasern mit der kollektiven Depolarisation der nächsten Erregungswelle gelöscht. Ist die Signal-Frequenz aber geringer, so wird die Automatie der sekundären Fasern eine Erregung erzeugen. Da alle sekundären Fasern einer Stufe gleichermaßen zur Automatie befähigt sind, wird die Erregung zuerst an der schnellsten sekundären Faser ausgelöst, gefolgt von den langsameren. Damit die asynchronen Einzelsignale nicht unabhängig voneinander die Stufe verlassen können, sind die Fasern untereinander so vernetzt, dass das schnellste Automatiesignal das gesamte sekundäre Faserbündel depolarisieren muss und damit die Erregungswelle synchronisiert. 17. Die Kaskade der MRP sorgt dafür, dass die Automatiefrequenz der sekundären Fasern jeweils kleiner ist als die der primären. Auf diese Weise ist gesichert, dass das höhere Zentrum immer wieder – z.B. nach einer passageren Störung - die Frequenzführerschaft übernehmen kann. 18. Da die sekundären Fasern passiv depolarisiert werden, während die primären Fasermembranen die kollektive Depolarisation aktiv erzeugen müssen, werden große Gesamtoberflächen der primären Fasern benötigt und nur kleine bis kleinste Oberflächen der sekundären Fasern derselben Stufe. Somit befinden sich nur wenige sekundäre Fasern in der Nachbarschaft der vielen primären. Da die sekundären Fasern mit Verlassen der Stufe nunmehr als primäre Fasern den aktiven Part übernehmen müssen, nimmt die Anzahl der Fasern durch Teilungen bei Verlassen der Stufe erheblich zu. 19. Alle physikalischen Vorgänge der Depolarisation laufen ohne extramembranöse Energiezufuhr ab – im wesentlichen wird potentielle Energie, die in der Repolarisation und der diastolischen Erholungsphase regeneriert wird, umgewandelt. Unter normalen Bedingungen wird bis zur kollektiven Depolarisation eine konstante Mindestzeit benötigt. Diese Zeit ist für jede Sufe spezifisch. Liegt eine Repolarisationsstörung vor, die häufig nutritiv verursacht ist, dann verringert sich zum einen in Folge schwächerer Aktionspotentiale die Ausbreitungsgeschwindigkeit der Erregung und zum anderen nimmt die Gesamtzeit bis zum Erreichen der kollektiven Depolarisation aufgrund geringerer Kontingente transmembranös verschobener Na+ Ionen zu. Wenn die Erregung der primären Fasern die Faserenden erreicht, bevor die kollektive Depolarisation ausgelöst worden ist, bricht die Erregung ab. Erkennbar wird der drohende Erregungsabbruch an einer Verlängerung der jeweiligen Überleitungszeit. Somit hat jede Stufe mit einem Ausgangshindernis ihre eigene Grenzüberleitungszeit. Da die Überleitungszeit des av-Knotens mit etwa 50 ms von insgesamt etwa 90 ms (nach Wiggers aus Schütz, 9) die bei weitem längste einer einzelnen Stufe ist, fallen die Zeiten der mindestens drei weiteren Stufen nicht so sehr ins Gewicht und entziehen sich somit einer oberflächlichen elektrokardiographischen Nachweisbarkeit. Diese drei weiteren Stufen sind folgende: 1. His-Bündel 2. Terminales Purkinje-Netz der Papillarmuskulatur 3. Terminales Purkinje-Netz der Kammermuskulatur Ob es noch weitere zwischengeschaltete Stufen gibt, ist unklar. 28.10.2014 Revision 0 Wolfgang Herzberg 4 Wird aufgrund einer Repolarisationsstörung die Grenzüberleitungszeit überschritten, fällt die kollektive Depolarisation aus und schafft so im nachgeschalteten Reizleitungssystem eine unverbrauchte Energiereserve, die für die Weiterleitung der folgenden Erregungen wieder ausreichend ist. Diese Energiereserve entsteht dadurch, dass die Substrattransportrichtung des Reizleitungssystems der Erregungsausbreitungsrichtung entgegen gerichtet ist. Wenn somit eine Erregung abbricht, dann wird einmalig die Repolarisationsarbeit und die myozytäre Kontraktionsarbeit des gesamten nachgeschalteten Erregungsleitungssystems gespart und somit steigt der Substratgehalt der systolisch gepumpten Ernährungsflüssigkeit für die nächsten Erregungssalven kurzfristig an. In den Nutzen dieser Reserve gehen die Fließgeschwindigkeit der Ernährungsflüssigkeit und ihre qualitative und quantitative Zusammensetzung ein. Die Störung der Erregungsleitung im His-Bündel kann aufgrund seiner normalerweise nur geringen Überleitungszeit im EKG nicht nachvollzogen werden. Ist zudem auch die Erregungsleitung im avKnoten verzögert, was aufgrund nutritiver Ursachen wahrscheinlich ist, dann gehen die Vorgänge des His-Bündels im av-Geschehen unter. Man muss aber dennoch davon ausgehen, dass die Mobitz-Block-Störungen ebenfalls einem „Wenckebach-Mechanismus“ folgen. Dieses wird auch dadurch gestützt, dass in Abhängigkeit vom Grad der Störung eine Kaskade der Blöcke bekannt ist: 4:1, 3:1, 3:2, 2:1. Auch im His Bündel werden die Überleitungszeiten abgestuft länger und schließlich fällt eine kollektive Depolarisation aus. Vielleicht ist dieser Vorgang bei ungestörtem av-Knoten im EKG gerade noch erkennbar. Die Schritte der zeitlichen Verzögerung lägen aber sicherlich nur im einstelligen Millisekunden-Bereich. Komplexer aber als der „Wenckebach-Mechanismus“ des av-Knotens sind die Ursachen der veschiedenen Mobitz-Blöcke; denn wie ist es möglich, dass bei überleitendem av-Knoten das HisBündel Blöcke erzeugen kann, wenn doch der av-Knoten die „letzte Wiese“ der nutritiven Versorgung ist und darum eigentlich vor dem His-Bündel ausfallen müßte. Um dieses Phänomen dennoch schlüssig durch die alles verursachende nutritive Mangelversorgung erklären zu können, muss man sich genauer mit dieser Versorgung befassen. Die Substratherkunft ist der interstitielle Raum des Myokards. Dort wird es über die coronare Versorgung angereichert – wir nennen es darum Sc (S = Substrat, c = coronar). Der Substratfluß durch das Schlauchsystem der Reizleitung erfolgt mit der Geschwindigkeit Sc/T = Sc ∙ ν (T = P-P-Zeit, ν = Sinusfrequenz) Wenn dieReizleitung durch einen Block unterbrochen wird und eine Herzaktion bei fortgesetztem Sinusrythmus ausfällt, dann bleibt das kontraktionsbezogene Substratkontingent im Interstitium des Myokards unverbraucht liegen. Mit der folgenden Systole wird somit ein hochwertiges Substratkontingent (Sc/T) aus der Myokardwand in das Schlauchsystem exprimiert. Je nach Blocktyp wird dieses Kontingent dann von drei (4:1), zwei (3:1) oder einem (2:1) Kontingent(en) minderwertiger Substratqualität gefolgt. Alle Einzelkontingente sind bei gleicher Sinusfrequenz gleich groß (Sc/T). Da die Fließgeschwindigkeit der Substratsäule davon abhängt, wie hoch die Rate der Aussetzer ist, verhalten sich die Geschwindigkeiten wie 2/3 ( 2:1 Block) zu 3/4 ( 3:1 Block) zu 4/5 ( 4:1 Block). 28.10.2014 Revision 0 Wolfgang Herzberg 5 Wenn man nun annimmt, dass die Abfolge der konstanten räumlichen Längsausdehnungen der einzelnen Substratkontingente in dem Hohlraumabschnitt von av-Knoten und Hisbündel gerade so positioniert ist, dass die Grenze benachbarter Kontingente mit der Grenze zwischen av-Knoten und Hisbündel in etwa übereinstimmt und mit jeder Systole genau eine komplette Substrat-Periode (Abb.2) befördert wird, dann gerät mit jeder Systole immer die folgende Substrat-Periode mit der vorhergehenden in räumliche Deckung. Dieses Geschehen folgt einem zufälligen und individuellen Zusammentreffen verschiedener Parameter des Herzens. Wenn es nun auch noch der Zufall so einrichtet, dass der av-Knoten mit jeder systolischen Substratverschiebung immer den hochwertigen Abschnitt aus der „Myokard-Pause“ erhält, dann ist die av-Knoten Aktivität nicht beeinträchtigt und nur das Hisbündel ist durchgehend unterversorgt. Abb.2 Die Substratsäulen in den basisnahen Kammerschenkeln. Die Bewegung dieser Säule erfolgt Richtung av-Knoten (nach oben). Die Abfolge der systolisch erzeugten Substratabschnitte unverbrauchter (+) und verbrauchter (-) Substratqualität wird durch den Block-Typ vorgegeben. Die Fließgeschwindigkeit ermöglicht bei geeigneten räumlichen Verhältnissen ein stets gleiches Verteilungsmuster am avKnoten (a) und am Hisbündel (h). Mit den Mobitz-Block-Pausen verschafft sich auch das Hisbündel eine begrenzte Verbesserung der Substratqualität, da die Grenzen der Substrat-Tranchen nicht so scharf sind, wie es das Diagramm der Abbildung 2 suggeriert. Da aber mit der Entstehung eines Blockes der Substrattransport pro Zeit abnimmt, wird das im Fluß befindliche Substrat vom gesamten Reizleitungssystem abhängig vom Block-Typ intensiver ausgebeutet. Somit schafft das „Ausweichen“ in einen Block generell keine dauerhaft stabile Ergodynamik sondern besitzt eine Tendenz hin zur weiteren Zunahme der Störung. In dem Moment aber, wo ein spezieller Mobitz-Block-Typ aufgrund dieser schleichend wachsenden Minderversorgung auf den höherfrequenteren Block-Typ umschaltet, wird die „Schrittlänge“ der bisherigen Periodik verkürzt und damit wird aus einer „stehenden Welle“ eine „wandernde Welle“ erzeugt. Der av-Knoten erhält nun unweigerlich auch die ausgelaugten Substratabschnitte. Die Folge: av-Block ! Wenn man nach den Ursachen fragt, die hinter den nutritiven Störungen des kardialen Reizleitungssystems diese stereotypen Überleitungsstörungen erzeugen, dann wird die coronare Minderperfusion wahrscheinlich die häufigste Ursache sein, gefolgt von jeglicher Schwächung der myokardialen Kontraktionsfähigkeit (Herzdilatation, Myokardnarbe). Wenn das tatsächlich zutrifft, ergäbe sich daraus die Indikation, für jegliches Neuauftreten einer Überleitungsstörung die mögliche Ursache einer coronaren Stenose durch eine Coronar-Katheteruntersuchung auszuschließen. 28.10.2014 Revision 0 Wolfgang Herzberg