+ + CH3OH - Institut für Organische Chemie
Werbung
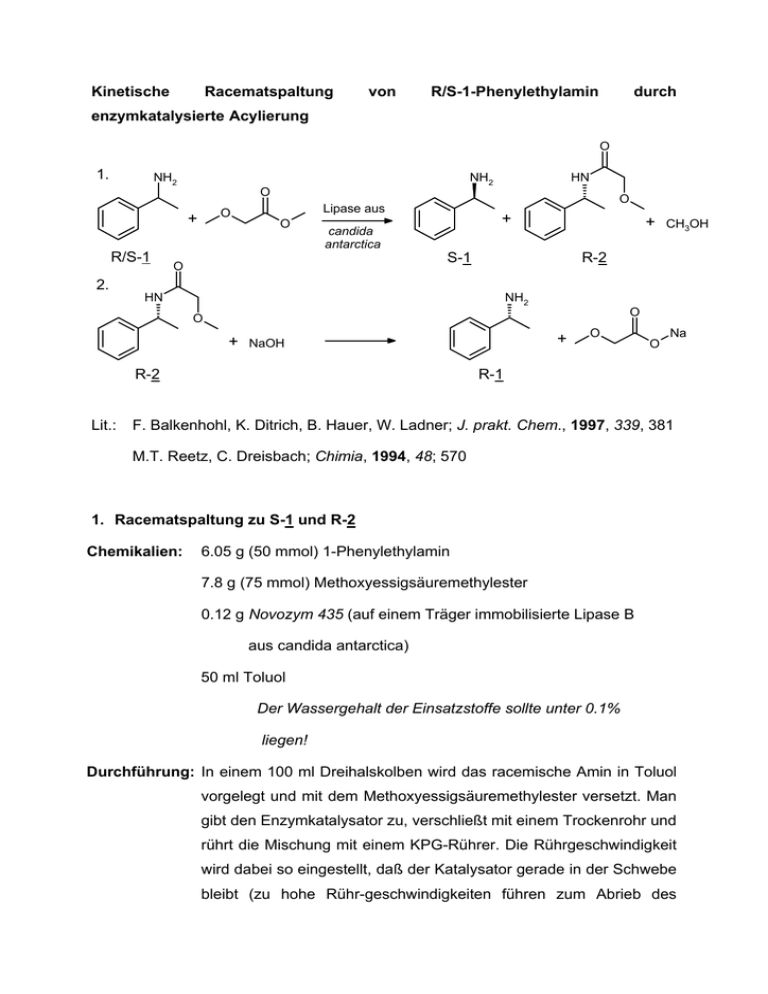
Kinetische Racematspaltung von R/S-1-Phenylethylamin durch enzymkatalysierte Acylierung O 1. NH2 NH2 HN O O + R/S-1 O Lipase aus O + candida antarctica + S-1 O CH3OH R-2 2. NH2 HN O O + R-2 Lit.: + NaOH O O Na R-1 F. Balkenhohl, K. Ditrich, B. Hauer, W. Ladner; J. prakt. Chem., 1997, 339, 381 M.T. Reetz, C. Dreisbach; Chimia, 1994, 48; 570 1. Racematspaltung zu S-1 und R-2 Chemikalien: 6.05 g (50 mmol) 1-Phenylethylamin 7.8 g (75 mmol) Methoxyessigsäuremethylester 0.12 g Novozym 435 (auf einem Träger immobilisierte Lipase B aus candida antarctica) 50 ml Toluol Der Wassergehalt der Einsatzstoffe sollte unter 0.1% liegen! Durchführung: In einem 100 ml Dreihalskolben wird das racemische Amin in Toluol vorgelegt und mit dem Methoxyessigsäuremethylester versetzt. Man gibt den Enzymkatalysator zu, verschließt mit einem Trockenrohr und rührt die Mischung mit einem KPG-Rührer. Die Rührgeschwindigkeit wird dabei so eingestellt, daß der Katalysator gerade in der Schwebe bleibt (zu hohe Rühr-geschwindigkeiten führen zum Abrieb des Katalysators). Isolierung: Nach 72 Stunden wird der Katalysator über Kieselgel abfiltriert und das klare Filtrat unter Rühren mit 10 %iger HCl auf pH 1 gebracht1). Die untere wässrige Phase wird abgetrennt und die organische Phase noch zweimal mit je 7 ml Wasser extrahiert. Die vereinten wässrigen Phasen werden noch einmal mit 10 ml Toluol extrahiert und die vereinten organischen Phasen über Natriumsulfat getrocknet. Man entfernt das Lösungsmittel im Vakuum am Rotationsverdampfer und erhält 4.6 g (94 % d. Th.) N-(R-1Phenylethyl)-methoxyacetamid vom Schmp. 63°C zurück. Optische Reinheit: 99 %ee. Die verbliebene wässrige Phase wird durch Zugabe von 50 %iger Natronlauge unter Kühlung auf pH 14 gebracht1). Man extrahiert dreimal mt je 10 ml Toluol, trocknet die vereinten organischen Phasen über Natriumsulfat und entfernt das Lösungsmittel im Vakuum am Rotationsverdampfer. Der verbliebene Rückstand wird unter vermindertem Druck destilliert. Man erhält 3 g (95 % d. Th.) S1-Phenylethylamin (S-1) vom Sdp. 69°C / 15 mbar als farblose Flüssigkeit. Optische Reinheit: 99.4 %ee. 1.) Wozu dient diese Maßnahme? 2.) Hydrolyse von R-2 zu R-1 Chemikalien: 4.0 g (20 mmol) N-(R-1-Phenylethyl)-methoxyacetamid 1.0 g Triethanolamin 4.0 g 50%ige Natronlauge (=0.5 mol) Durchführung: In einem Rundkolben wird das N-(R-1-Phenylethyl)methoxyacetamid vorgelegt und mit Triethanolamin2) und der 50 %igen Natronlauge versetzt. Man erhitzt unter Rühren auf 120°C und rührt 8 Stunden bei dieser Temperatur. Isolierung: Man verdünnt die Lösung mit 10 ml Wasser und extrahiert zweimal mit je 10 ml Toluol. Die vereinten Extrakte trocknet man über Natriumsulfat, entfernt das Lösungsmittel im Vakuum am Rotationsverdampfer und destilliert den verbliebenen Rückstand unter vermindertem Druck. Man erhält 2.3 (94% d. Th.) R-1-Phenylethylamin vom Kp.: 69°C / 15 mbar als farblose Flüssigkeit. Optische Reinheit: 99 %ee. 2.) Welchen Vorteil bietet Triethanolamin als Lösungsmittel vor z. B. Ethanol oder Glykolmonomethylether als Lösungsvermittler? Auswertung des Versuchs: Entscheidend ist die Enantiomerenreinheit der Produkte R-1 , S-1 und R-2. Sie wird am genauesten durch analytische Hochdruckchromatographie (HPLC) an chiralen Säulen bestimmt. Hier wird die klassische Methode der Bestimmung der optischen Aktivität für R-1, S-1 und R-2 jeweils angewandt. Man vergleiche die Drehwerte mit denen der Reinsubstanzen in Ethanol R-1 +30.2°, S-1 -30.2° (c = 10 in Ethanol) R-2 +40.2°, S-2 -40.2° (c = 10 in Ethanol) R-N-(1-Phenylethyl)-methoxyacetamid) +111.4° (c = 10 in Ethanol) Nach diesem Verfahren, welches die nahezu quantitative Isolierung beider Enantiomere erlaubt, werden industriell im Tonnenmaßstab racemische primäre Amine getrennt. Die entscheidende Entdeckung war, daß die enzymkatalysierte Acylierung mit Methoxyessigsäureester hundertmal rascher verläuft als mit Essigsäureester und daß die Fixierung des gewünschten Enzyms auf einem (Wiederverwendung!). Träger dessen Lebensdauer drastisch erhöht