Copyright
Werbung

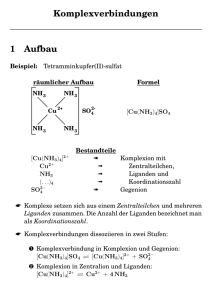
Richard Göttlich Siegfried Schindler Parham Rooshenas Chemisches Grundpraktikum im Nebenfach Mit 176 Abbildungen Higher Education München • Harlow • Amsterdam • Madrid • Boston San Francisco • Don Mills • Mexico City • Sydney a part of Pearson plc worldwide Book_Chem.Grundpraktikum_11-07-08.indb 3 08.07.2011 10:41:09 6 Komplexchemie (Koordinationschemie) L L M L L linear M L L L tetraedrisch M L L L L L quadratisch planar L M L L L oktaedrisch Abbildung 6.3: Beispiele für Koordinationspolyeder Aus: Schmuck, C., Engels, B., Schirmeister, T. & Fink, R. (2008) Neutrale Moleküle, wie H2O, NH3 oder CO, liefern keinen Beitrag zur Ladung des Komplexes: Beispiel: Cu2+ + 4 NH3 → [Cu(NH3)4]2+ Für Komplexe, die verschiedene Arten von Liganden enthalten, erhält man die resultierende Ladung entsprechend: Beispiele: Co3+ + 4 NH3 + 2NO2– → [Co(NH3)4(NO2)2]+ einfach positiv → [Co(NH3)3(NO2)3] Co3+ + 2 NH3 + 4NO2– → [Co(NH3)2(NO2)4]– Co3+ + 3 NH3 + 3NO2– neutral einfach negativ Nomenklatur von Komplex­ verbindungen 6.5 In der Formel eines Komplexes steht zuerst das Symbol des Zentral­ atoms. Darauf folgen die Liganden in alphabetischer Reihenfolge der Symbole. Hierbei ist zu beachten, dass z. B. CO als Ligand im Namen vor dem Cl als Ligand zu nennen ist (Begründung: Einbuchstabige Symbolzeichen (C = Kohlenstoff, O = Sauerstoff) werden zweibuchstabigen 96 Book_Chem.Grundpraktikum_11-07-08.indb 96 08.07.2011 10:41:57 6.6 Reaktivität von Komplexen Symbolzeichen (Cl = Chlor) vorangestellt.). Die Formel des Komplexes wird in eckige Klammern gesetzt. Im Namen werden zuerst alle Liganden alphabetisch genannt und ohne Berücksichtigung ihrer Anzahl, d. h. der multiplikativen Vorsilben (wie z. B. hexa). Zum Schluss steht der Name des als Zentralatom vorliegenden Elements. In negativ geladenen Komplexen endet der Name des Zentralions auf –„at“. Er wird in einigen Fällen von lateinischen Namen abgeleitet: Silber → Argentat; Gold → Aurat; Kupfer → Cuprat; Eisen → Ferrat; Nickel → Nicolat. Namen anionischer Liganden besitzen stets die Endung –„o“. An Anionennamen, die auf –„id“, –„it“ oder –„at“ enden, wird ein –„o“ angehängt. Beispiele: – – – – – F : Fluorido; Cl : Chlorido; Br : Bromido; I : Iodido; CN : Cyanido; – – H : Hydrido; O2–: Oxido; OH : Hydroxido; O22–: Peroxido. Neutrale und kationische Liganden haben keine bestimmte Endung, werden jedoch in Klammern gesetzt. Beispiele sind Aqua (für H2O), Ammin (für NH3), Carbonyl (CO) und Nitrosyl (NO). Die Oxidationsstufe des Zentralions wird am Ende des Namens mit in Klammern gesetzten römischen Ziffern gekennzeichnet. Beispiele: [Cr(NH3)6]Cl3 Hexamminchrom(III)-chlorid [CuCl4(OH2)2] Diaquatetrachloridocuprat(II) K[Co(CN)(CO)2(NO)] Kaliumdicarbonylcyanidonitrosylcobaltat(0) 2– Reaktivität von Komplexen 6.6 Wie bereits zu Beginn erwähnt, unterscheiden sich Komplexe auch in ihren chemischen Reaktionen von den Komponenten, aus denen sie zusammengesetzt sind. Ag+ bildet mit Cl– schwer lösliches AgCl, wohingegen [Ag(NH3)2]+ mit Chlorid-Ionen keinen Niederschlag bildet. Auch die Komplexsalze unterliegen (ähnlich den einfachen Salzen, Säuren und Basen) der Dissoziation in wässriger Lösung. Hiermit ist gemeint, dass z. B. bei einem anionischen Komplex wie K3[Fe(CN)6] nicht nur eine Dissoziation in 3 K+ und [Fe(CN)6]3– beim Lösen auftritt, sondern dass auch das Komple97 Book_Chem.Grundpraktikum_11-07-08.indb 97 08.07.2011 10:41:57 6 Komplexchemie (Koordinationschemie) xanion [Fe(CN)6]3– einer Dissoziation in Ionen unterliegt. Diese sog. zweite Dissoziation der Komplexsalze zerlegt diese in die Einzelionen. Dabei ist die Dissoziation für verschiedene Komplexsalze, wie weiter oben bereits kurz erwähnt, natürlich unterschiedlich stark. Je stabiler der Komplex ist, desto weniger dissoziiert er in seine Einzelionen. So ist z. B. das oben beschriebene [Fe(CN)6]4– ein extrem stabiles Anion und nicht einmal unsere Magensäure vermag, die toxische Blausäure daraus freizusetzen. Die unterschiedliche Beständigkeit der Komplexe gegenüber Fällungsmitteln kann zur Trennung von Elementen (qualitative Analyse) genutzt werden. So gelingt z. B. der Nachweis von Cl– neben Br– und I– mithilfe des [Ag(NH3)2]+-Komplexes. NH3 bindet an Ag+-Ionen so fest, dass das Löslichkeitsprodukt von AgCl nicht mehr überschritten wird. AgCl lässt sich also durch Zugabe von verdünntem NH3-Wasser auflösen. Dies gelingt bei AgBr nur noch unvollständig mit konzentriertem NH3 und bei AgI gar nicht mehr, da deren Löslichkeitsprodukte kleiner sind. Die Beständigkeit des Diamminkomplexes des Silbers reicht hier nicht mehr aus, eine Fällung zu unterdrücken, sodass AgI sich durch Zugabe von NH3 nicht in Lösung bringen lässt. Es handelt sich natürlich auch bei der zweiten Dissoziation um eine Gleichgewichtsreaktion, für die das MWG gilt. Die Reaktion von „rechts“ nach „links“ ist die vollständige Dissoziation. Die Reaktion von „links“ nach „rechts“ ist die Komplexbildung (die Reaktion erfolgt natürlich in Teilreaktionen, hier ist die Gesamtreaktion gezeigt): Fe2+ + 6 CN– ⇌ [Fe(CN)6]4– eingesetzt in das MWG: [Fe(CN)6 ]4– = konstant = 1037 l6 ⋅ mol −6 = K [Fe2+ ] ⋅ [CN–]6 Diese Konstante wird bei den Komplexsalzen als Komplexbildungskonstante K bezeichnet (Achtung: Die Dimension der Konstanten K kann für verschiedene Komplexsalze unterschiedlich sein!). Je größer diese Konstante ist, desto kleiner ist die Konzentration der Einzelionen in Lösung bzw. umso beständiger ist der Komplex. In diesem Beispiel ist K außerordentlich groß bzw. der Komplex sehr stabil, unter anderem da dieser Komplex die „Edelgaskonfiguration“ (18 Außenelektronen) aufweist. 98 Book_Chem.Grundpraktikum_11-07-08.indb 98 08.07.2011 10:41:57 6.7 Darstellung von Komplexverbindungen Versuch 1 Darstellung des Tetraminkupfer(II)-Komplexes Stellen Sie sich ca. 2 mL einer Lösung her, schuss versetzt. Beobachtung (Farbe), Re- die Cu2+-Ionen enthält. Diese Lösung wird aktionsgleichung? mit konzentriertem Ammoniak im Über- Darstellung von Komplexverbindungen 6.7 Der erste in der Literatur (Alchemia 1597) beschriebene Metallkomplex war der Tetramminkupfer(II)-Komplex, der von dem Arzt und Alchemisten Andreas Libavius (Mitbegründer der modernen Chemie) synthetisiert wurde. Dessen Herstellung gelingt sehr einfach aus wässrigen Lösungen von Kupfer(II)-Salzen und Ammoniak. Die intensiv blaue Farbe des Komplexes lässt sich auch sehr gut für den Nachweis von Kupfer(II)Ionen in Lösung verwenden. Wird gelbes Blutlaugensalz zu einer Kupfersulfatlösung gegeben, bildet sich der Kupferhexacyanidoferrat(II)-Komplex, der schwer löslich ist und damit aus der Lösung ausfällt. Genau diese Reaktion wird auch beim Schönen vom Wein angewendet. Zugabe von gelbem Blutlaugensalz zum Wein führt insbesondere zur Fällung der Kationen des Kupfers und des Eisens (die Niederschläge werden dann abfiltriert). Kupfersulfat wurde früher in großem Umfang zur Schädlingsbekämpfung und gegen Pilzerkrankungen im Weinanbau angewendet. Die Fällung der Metallionen mit gelbem Blutlaugensalz wurde in den 1920iger Jahren eingeführt Versuch 2 Darstellung des Kupferhexacyanidoferrat(II)-Komplexes Zu 2 mL der ausstehenden Kaliumhexa- Kupfer(II)-sulfat-Lösung gegeben. Beob- cyanidoferrat(II)-Lösung (gelbes Blutlau- achtung und Reaktionsgleichung? gensalz) wird tropfenweise 1 mL einer 99 Book_Chem.Grundpraktikum_11-07-08.indb 99 08.07.2011 10:41:57 6 Komplexchemie (Koordinationschemie) Abbildung 6.4: Welcher Zusammenhang besteht hier? Wein, gelbes Blutlaugensalz (links) und Kupfersulfat (rechts) und ist als Blauschönung bekannt (►Abbildung 6.4). Blauschönung, da Eisen(II)-Ionen hier das weiter unten beschriebene intensiv gefärbte Berliner Blau bilden. Der alte Name „Blutlaugensalz“ leitet sich von der ursprünglichen Darstellung dieses Metallkomplexes ab, da hierfür tatsächlich Blut als ein Grundstoff eingesetzt wurde. Heute wird Blutlaugensalz selbstverständlich nicht mehr so hergestellt. Bevor die Digitalfotografie ihren Siegeszug angetreten hat, war die Komplexchemie des Silbers extrem wichtig für die Herstellung und die Entwicklung von Filmmaterial (Kinofilme, Filme für Fotoapparate, Papierabzüge und auch Röntgenfilme). Silbersalze wie z. B. das Silberchlorid sind lichtempfindlich und bilden unter Einwirkung von Licht elementares schwarzes Silber. Ein Film wurde daher beim Belichten dunkel. Bei der Entwicklung des Films wurde dieser Effekt zunächst noch chemisch durch den Entwickler verstärkt und dann durch ein Fixierbad abgestoppt. Fixiersalz ist Natriumthiosulfat, welches das Silbersalz, welches nicht reagiert hatte, durch Komplexierung löslich machte und damit aus dem Film entfernen konnte. Heute ist die Hauptanwendung der Komplexchemie des Silbers eher eine ziemlich traurige Angelegenheit. Für die Gewinnung von Gold und Silber wird oft die sogenannte Cyanidlaugerei durchgeführt. Dabei wird Gold oder Silber durch Behandlung mit Cyanidlösungen aus dem Gestein herausgelöst (Bildung von wasserlöslichen Komplexen). Dies 100 Book_Chem.Grundpraktikum_11-07-08.indb 100 08.07.2011 10:41:58 6.7 Darstellung von Komplexverbindungen Versuch 3 Darstellung des Diamminsilber(I)chlorid-Komplexes Stellen Sie sich eine Lösung von ca. 1 mL Was beobachten Sie? Geben Sie eine Re- her, die Chlorid-Ionen enthält. Diese Lösung aktionsgleichung an. Jetzt wird verdünnte wird mit verdünnter HNO3 angesäuert und NH3-Lösung im Überschuss zugegeben. Be- dann mit 1 mL Silbernitratlösung versetzt. obachtung und Reaktionsgleichung? Versuch 4 Darstellung des Silberhexacyanidoferrat-Komplexes Nehmen Sie zwei saubere Reagenzgläser das zweite ca. 1 mL gelbe Blutlaugensalz- und geben Sie in jedes 1 mL AgNO3-Lö- lösung sung. Füllen Sie nun in das erste Reagenz- sung). Was beobachten Sie? Geben Sie je glas ca. 1 mL rote Blutlaugensalzlösung eine Reaktionsgleichung an. (Kaliumhexacyanidoferrat(II)-Lö- (Kaliumhexacyanidoferrat(III)-Lösung), in Versuch 5 Nachweis von Phosphorsäure in Cola Säuern Sie ca. 1 mL Cola mit etwa 1 mL über 80 °C). Lassen sie die Probe nach dem konzentrierter HNO3 an und versetzen Erwärmen eine Weile (ca. 10 Min.) stehen. Sie sie anschließend mit etwa. 1 mL Am- Was beobachten Sie? Geben sie eine Reak- moniummolybdat-Lösung, (NH4)2MoO4. tionsgleichung an. Erhitzen Sie das Gemisch schwach (nicht 101 Book_Chem.Grundpraktikum_11-07-08.indb 101 08.07.2011 10:41:58 6 Komplexchemie (Koordinationschemie) Versuch 6 Darstellung des Triaquatrithiocyanatoeisen(III)-Komplexes Stellen Sie sich 1 mL einer Lösung her, setzt (die Lösung nicht verwerfen, sondern die Fe3+-Ionen enthält. Die Lösung wird für Versuch 7 aufbewahren!). Beobach- tropfenweise mit Ammoniumthiocyanat- tung, Reaktionsgleichung? Lösung (nicht in großem Überschuss!) ver- wiederum hat aufgrund der Toxizität des Cyanids oftmals katastrophale Auswirkungen auf die Arbeiter und / oder die Umwelt. Eine weitere Anwendung findet sich bei der Silberspiegelherstellung. Silberspiegel lösten die Quecksilberspiegel ab, bei deren Herstellung eine große Zahl der Arbeiter schwere Quecksilbervergiftungen erlitt. Ein Video über die Herstellung eines Silberspiegels können Sie bei den CWS-Inhalten finden. Abbildung 6.5: Künstlicher Daumen, künstliches Blut Wie schon für die Kupfer- und Silberionen angedeutet ist die Komplexbildung auch sehr gut für ihre Anwendung in der analytischen Chemie geeignet. Im folgenden Versuch werden Sie einen Phosphatkomplex des Molybdäns kennenlernen mit dem Sie die Phosphorsäure in Cola-Getränken nachweisen können. Achtung: Nicht jede Cola enthält Phosphorsäure! Wie unter 6.2 beschrieben sind Eisenverbindungen für unsere Gesundheit extrem wichtig. Das dort bereits angesprochene Hämoglobin bindet den Sauerstoff reversibel in einer komplexchemischen Redoxreaktion. Das Superoxidion ist hier ein zusätzlicher einzähniger Ligand. Die intensive rote Farbe des Blutes und auch die Unterschiede der roten Farbe, je nachdem ob das Blut viel (arterielles Blut) oder wenig (venöses Blut) Sauerstoff enthält, wird durch den Eisenkomplex hervorgerufen. Die meisten Komplexverbindungen sind intensiv gefärbt. Farblich sehr ähnlich zum Blut ist eine Lösung des Eisen(III)-Thiocyanat-Komplexes. Richtig konzentriert ist die rote Lösung mit dem Auge nicht vom echten 102 Book_Chem.Grundpraktikum_11-07-08.indb 102 08.07.2011 10:41:59 6.7 Darstellung von Komplexverbindungen Farben sehen ist etwas, was in unserem Kopf stattfindet. Nur ein sehr kleiner Teil der elektromagnetischen Strahlung kann von unseren Augen wahrgenommen werden (sichtbares Licht im Bereich von etwa 400–800 nm). Problematisch ist dabei aber, dass ich bei meinem Farbempfinden nicht weiß, ob die andere Person die gleiche Empfindung hat, wenn wir z. B. einen roten Gegenstand betrachten (denken Sie auch an die Farbblindheit vieler Menschen). Ohne auf die Details eingehen zu können, dies würde den Rahmen dieses Buches sprengen (schauen Sie sich das Phänomen der Farbe einmal in den grundlegenden Büchern der Physik und der Chemie an) ist die „Entstehung“ von Farben in der Chemie recht einfach zu verstehen. Es sind immer die Übergänge von Elektronen, deren Energie im Bereich vom sichtbaren Licht liegt. Wird zum Beispiel ein Elektron durch Wärme (Energiezufuhr mit dem Bunsenbrenner) von einem niedrigeren in ein höheres Energieniveau übertragen (man spricht von Anregung), kann dieses angeregte Elektron wieder in niedrigere Energieniveaus zurück „fallen“ wobei Licht im sichtbaren Bereich ausgesendet wird (gilt natürlich auch für die elektromagnetische Strahlung, die nicht im sichtbaren Bereich liegt!). Man spricht hier von Emission oder bei der genaueren Analyse vom Messen eines Emissionsspektrums. Dies spielt auch eine große Rolle bei analytischen Verfahren (siehe Kapitel 8). Umgekehrt kann Licht dazu verwendet werden, Elektronen anzuregen. Man spricht dann von Absorption. Haben wir zum Beispiel eine farbige Lösung eines Stoffes, der blaugrünes Licht (ca. 500 nm) für die Elektronenanregung absorbiert, dann nimmt unser Auge nur noch den restlichen Anteil des Lichts (die Komplementärfarbe rot) wahr. Die Lösung erscheint uns daher rötlich. Da unsere Augen wie oben bereits angesprochen für die genaue Beschreibung der Farben unzuverlässig sind, werden physikalische Analysemethoden verwendet. Man misst dazu ein UV-vis-Spektrum der Lösung. Dies gibt uns exakte Angaben darüber, welches Licht absorbiert wurde (also welche Energieübergänge der Elektronen hier stattgefunden haben). Zur Messung verwendet man ein Spektralphotometer und Grundlage der Messung ist das Lambert-Beersche Gesetz. Neben der Analyse der elektronischen Übergänge lässt sich mit dieser Messmethode auch eine Konzentrationsbestimmung durchführen. Schauen Sie sich hierzu auch das Video auf der Website über die Messung eines UV-vis-Spektrums an. 103 Book_Chem.Grundpraktikum_11-07-08.indb 103 08.07.2011 10:41:59 6 Komplexchemie (Koordinationschemie) Versuch 7 Maskierung von Eisen(III)-Ionen und Nachweis von Fluorid-Ionen in der Zahnpasta Zu einem Teil der Lösung aus Versuch 5 ungefähr 1 mL in ein weiteres Reagenzglas wird Natriumfluorid-Lösung im Über- und verdünnen noch einmal mit 3 mL Was- schuss zugesetzt. Beobachtung, Reaktions- ser. Zu dieser Lösung geben Sie einen 1 cm gleichung? langen Zahnpastastreifen. Das Reagenzglas Nehmen Sie ca. 0,5 mL der roten Lösung wird mit einem Stopfen verschlossen und von Versuch 5 und verdünnen Sie diese kräftig geschüttelt. Beobachtung, Reakti- mit ca. etwa 6 mL Wasser. Davon geben Sie onsgleichung? Blut zu unterscheiden. Solches „Kunstblut“ wird daher gerne in ShowExperimenten eingesetzt (►Abbildung 6.5). Unterschiedlich starke Bindungen gibt es auch in der Komplexchemie. Genauso wie die stärkere Säure die schwächere Säure aus ihren Salzen verdrängen kann, so kann auch ein stärkerer Ligand einen schwächeren Liganden aus seinen Komplexen verdrängen. Dies wird unter anderem bei den sogenannten Maskierungsreaktionen ausgenutzt. So kann es sein, dass bei einem Nachweis auf eine Verbindung eine Farbreaktion beobachtet werden soll. Leider enthält die Lösung auch Eisen(III)- und Thiocyanat-Ionen, sodass die intensive rote Farbe des Komplexes jegliche Beobachtung unmöglich macht. Fluorid-Ionen sind aber gegenüber Eisen(III)-Ionen stärkere Liganden und verdrängen die Thiocyanatligan- Abbildung 6.6: Berliner Blau als Antidot gegen Vergiftungen mit Thalliumverbindungen Aus: Schmuck, C., Engels, B., Schirmeister, T. & Fink, R. (2008) Versuch 8 Darstellung von Berliner Blau Zu 1 mL einer FeCl3-Lösung wird tropfenweise eine K4[Fe(CN)6]Lösung (gelbes Blutlaugensalz) gegeben. Was beobachten Sie? Geben sie eine Reaktionsgleichung an. 104 Book_Chem.Grundpraktikum_11-07-08.indb 104 08.07.2011 10:42:00 6.7 Darstellung von Komplexverbindungen den. Der gebildete neue Fluoridokomplex ist farblos und würde dann die zu beobachtende analytische Farbreaktion nicht mehr stören. Ziemlich viel Aufsehen hat ein eigentlich recht unscheinbarer Eisenkomplex gemacht, der als Berliner Blau bekannt wurde (auch Preußisch Blau genannt – Prussian Blue im Englischen). Entdeckt wurde er durch Zufall von Diesbach und Dippel in Berlin. Bis zur Entdeckung des Berliner Blaus wurde in der Malerei kaum die Farbe Blau verwendet. Grund dafür war, dass hierfür Ultramarin verwendet werden musste, welches ähnlich kostbar wie Gold war. Erst das billig herzustellende Berliner Blau führte zu einer wahren „Blau-Explosion“ in der Malerei. Es wird auch heute noch als Farbpigment verwendet, z. B. in der Kosmetik bei manchen Produkten für blaue Lidschatten. Auch unabhängig von der Farbe weist das Berliner Blau weitere interessante Eigenschaften auf. So wird sein komplexes magnetisches Verhalten intensiv erforscht, um möglicherweise neue elektronische Baumaterialien entwickeln zu können. In der Medizin wird es gegen Vergiftungen mit Thalliumsalzen (Thalliumsulfat wurde früher – heute verboten – als Rattengift verwendet) eingesetzt (►Abbildung 6.6). Aus Berliner Blau wurde auch erstmals HCN (Cyanwasserstoff) dargestellt. Daher kommt der Name Blausäure. Die Säure selbst ist nämlich farblos! Versuch 9 Farbvergleich von Nickel(II)-Komplexen Nehmen Sie fünf möglichst saubere Re- fallenden Menge Wasser auf und mischen agenzgläser und nummerieren Sie diese Sie gut. Was beobachten Sie? Geben Sie von 1 bis 5 durch. Füllen Sie in jedes der eine Reaktionsgleichung an und erklären Reagenzgläser genau 1 mL der ausstehen- Sie das Phänomen. den Nickel(II)nitratlösung (c = 0,5 mol / L). Anschließend geben Sie der Tabelle (un- Tabelle zu Versuch 9: ten) folgend genau die angegebene anstei- Nummer des Reagenzglases 1 2 3 4 5 V(Ni2+-Lösung) in mL 1 1 1 1 1 gende Menge Ethylendiaminlösung (c = 0,5 mol / L) hinzu, füllen die Reagenzgläser genau mit der in der Tabelle angegebenen V(en-Lösung) in mL – 1 2 3 4 V(H2O) in mL 5 4 3 2 1 105 Book_Chem.Grundpraktikum_11-07-08.indb 105 08.07.2011 10:42:00 Copyright Daten, Texte, Design und Grafiken dieses eBooks, sowie die eventuell angebotenen eBook-Zusatzdaten sind urheberrechtlich geschützt. Dieses eBook stellen wir lediglich als persönliche Einzelplatz-Lizenz zur Verfügung! Jede andere Verwendung dieses eBooks oder zugehöriger Materialien und Informationen, einschließlich der Reproduktion, der Weitergabe, des Weitervertriebs, der Platzierung im Internet, in Intranets, in Extranets, der Veränderung, des Weiterverkaufs und der Veröffentlichung bedarf der schriftlichen Genehmigung des Verlags. Insbesondere ist die Entfernung oder Änderung des vom Verlag vergebenen Passwortschutzes ausdrücklich untersagt! Bei Fragen zu diesem Thema wenden Sie sich bitte an: [email protected] Zusatzdaten Möglicherweise liegt dem gedruckten Buch eine CD-ROM mit Zusatzdaten bei. Die Zurverfügungstellung dieser Daten auf unseren Websites ist eine freiwillige Leistung des Verlags. Der Rechtsweg ist ausgeschlossen. Hinweis Dieses und viele weitere eBooks können Sie rund um die Uhr und legal auf unserer Website herunterladen: http://ebooks.pearson.de