dv isotherme
Werbung
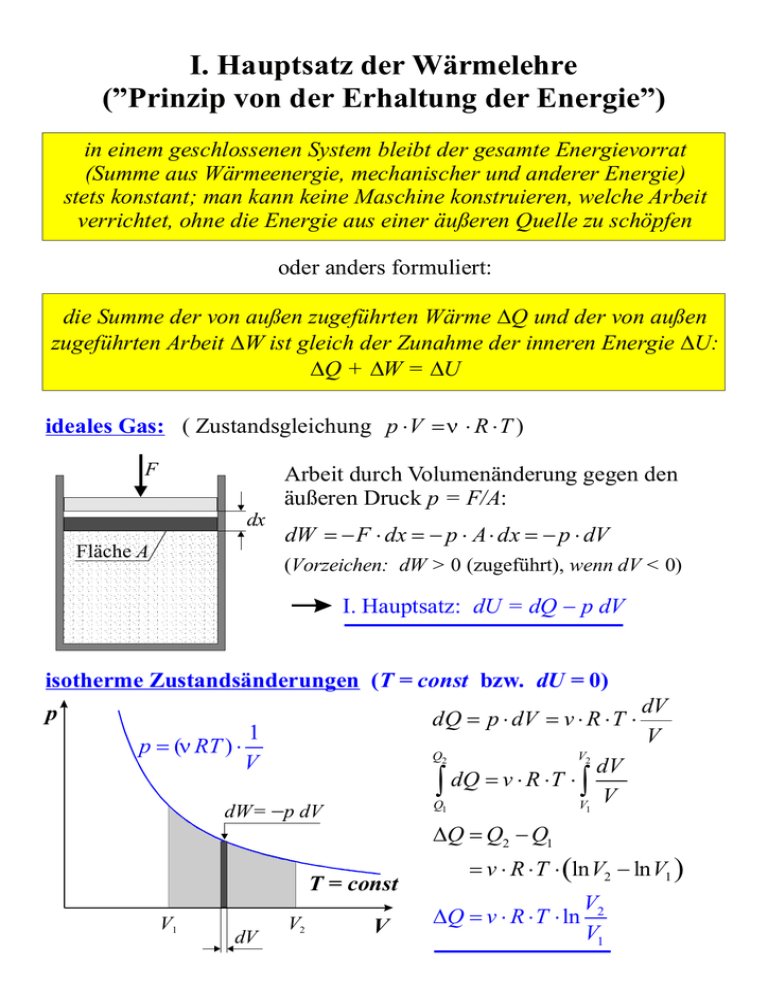
I. Hauptsatz der Wärmelehre (”Prinzip von der Erhaltung der Energie”) in einem geschlossenen System bleibt der gesamte Energievorrat (Summe aus Wärmeenergie, mechanischer und anderer Energie) stets konstant; man kann keine Maschine konstruieren, welche Arbeit verrichtet, ohne die Energie aus einer äußeren Quelle zu schöpfen oder anders formuliert: die Summe der von außen zugeführten Wärme ∆Q und der von außen zugeführten Arbeit ∆W ist gleich der Zunahme der inneren Energie ∆U: ∆Q + ∆W = ∆U ideales Gas: ( Zustandsgleichung p ⋅ V = ν ⋅ R ⋅ T ) F Arbeit durch Volumenänderung gegen den äußeren Druck p = F/A: dx Fläche A dW = − F ⋅ dx = − p ⋅ A ⋅ dx = − p ⋅ dV (Vorzeichen: dW > 0 (zugeführt), wenn dV < 0) I. Hauptsatz: dU = dQ − p dV isotherme Zustandsänderungen (T = const bzw. dU = 0) p p = (ν RT ) ⋅ dQ = p ⋅ dV = v ⋅ R ⋅ T ⋅ 1 V Q2 V2 dV V V1 Q1 ∆Q = Q2 − Q1 T = const dV V2 ∫ dQ = v ⋅ R ⋅ T ⋅ ∫ dW= −p dV V1 dV V V = v ⋅ R ⋅ T ⋅ (ln V2 − ln V1 ) ∆Q = v ⋅ R ⋅ T ⋅ ln V2 V1 I. Hauptsatz der Wärmelehre (adiabatische Zustandsänderung eines idealen Gases) ideales Gas: ( Zustandsgleichung p ⋅ V = ν ⋅ R ⋅ T ) ( innere Energie dU = ν ⋅ cmv ⋅ d T ) adiabatische Zustandsänderungen (dQ = 0) (kein Wärmeaustausch des Systems mit der Umgebung) I. Hauptsatz dU = dW= − p dV ν ⋅ cmv ⋅ d T = −ν ⋅ R ⋅ T ⋅ dV V ⇒ dT R dV =− ⋅ T cmv V Integration: ln T = − R ⋅ ln V + const cmv R cmp − cmv cmp = = −1 = γ −1 cmv cmv cmv ⇒ ln T = − ln V γ −1 + const ⇒ ln T + ln V γ −1 = ln T ⋅ V γ −1 = const T ⋅ V γ −1 = const Anmerkung: c f +2 γ = mp = cmv f pV = ν RT ⇒ T = p ⋅V νR p ⋅V γ = const Pneumatisches Feuerzeug T ⋅ V γ −1 = T ⋅ V 2 / f = const wegen γ − 1 = f +2 2 −1 = f f f Luft = ftrans + f rot = 3 + 2 = 5 (zweiatomige Moleküle) Carnot'scher Kreisprozeß (I) Expansion Kompression TH TL isotherm bei TH Va TH adiabatisch Vb TH Vb TH Vc TL isotherm bei TL Vc TL Vd TL adiabatisch Vd TL p TH TL a b d Va Vd c Vb Vc V Va TH Carnot'scher Kreisprozeß (II) TH TL a Wtot b Va d Vd Prozess a→b (isotherm) Vb c Vc V Volumen V Arbeit ∆Wab = −v ⋅ R ⋅ TH ⋅ ln Vb Va b→c ∆Wbc = − [U (TH ) − U (TL )] (adiabatisch) c→d (isotherm) ∆Wcd = + v ⋅ R ⋅ TL ⋅ ln Vc Vd d→a ∆Wda = − [U (TL ) − U (TH )] (adiabatisch) ausgetauschte Wärme Änderung der inneren Energie ∆Qab = −∆Wab ∆U ab = 0 ∆Qbc = 0 ∆U bc = ∆Wbc ∆Qcd = −∆Wcd ∆U cd = 0 ∆Qda = 0 ∆U da = ∆Wda Bilanz der Arbeit: Wtot = [| ∆Wab | + | ∆Wbc |]− [| ∆Wcd | + | ∆Wda |] Vb Vc = ν ⋅ R ⋅ TH ⋅ ln − TL ⋅ ln Va Vd V = ν ⋅ R ⋅ [TH − TL ]⋅ ln b Va b → c: TH ⋅ Vbγ −1 = TL ⋅ Vcγ −1 d → a: TH ⋅ Vaγ −1 = TL ⋅ Vdγ −1 Vb / Va = Vc / Vd bzw. ln(Vb / Va ) = ln(Vc / Vd ) Carnot'scher Kreisprozeß (III) Wärme-Kraft-Maschine: Umwandlung von Wärme-Energie in mechanische Arbeit Definition des Wirkungsgrads η: η= Wtot von der Maschine verrichtete (= abgegebene) Arbeit = QH aus dem heißen Reservoir aufgenommene Wärme Wtot = ν ⋅ R ⋅ [TH − TL ]⋅ ln Vb Va QH = ∆Wab = ν ⋅ R ⋅ TH ⋅ ln ⇒ Vb Va η= TH − TL T =1− L <1 TH TH Richtungsumkehr des Kreisprozesses Kälte-Maschine, Wärme-Pumpe: Transport von Wärme vom tieferen auf ein höheres Temperaturniveau TH TL a Wtot b d Va Vd Vb c Vc Volumen V Definition der Leistungszahl ε einer Wärmepumpe: ε= QH Wtot = dem heißen Reservoir zugeführte Wärmemenge durch die Maschine von außen zugeführte Arbeit QH = ∆Wba = ν ⋅ R ⋅ TH ⋅ ln Wtot = ν ⋅ R ⋅ [TH − TL ]⋅ ln Vb Va Vb Va ⇒ ε= TH >1 TH − TL











