Biochemie: Propädeutikskript
Werbung

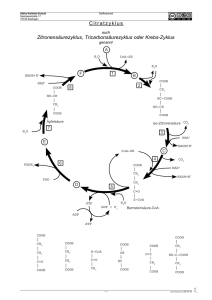
propädeutische Einführung Dozent : Datum : Hr. Breter 03.11.98 essentielle Nahrungsmittel sind : Aminosäuren Vitamine Mineralstoffe Fettsäuren Elemente (O2) Wasser Definition: Essentielle Nahrungsbestandteile sind Stoffe, die der Körper nicht selbst synthetisieren kann, aber benötigt und daher von außen zufügen muß. Kohlenhydrate [ Cn (H2O)n] Eselsbrücke KH sind Substanzen mit mehreren OH-Gruppen. Man könnte auch sagen Polyhydroxyaldehyde / - ketone. Klassifizierung Triosen Tetrosen Pentosen Hexosen Heptosen C3 C4 C5 C6 C7 sehr speziell Vorkommen in Nukleinsäuren sehr speziell Klasse Triose Triose keine Triose, wird aber meist dazu gezählt ihr fehlt die Aldehydoder Ketongruppe Strukturformel / Name HO-CH2 | C=O | HO-CH2 CH3 | C=O | CH3 Dihydroxyaceton Aceton O=CH | HO-CH | HO-CH2 HO-CH2 | HO-CH | HO-CH2 Glycerinaldehyd Glycerin O=C-OH | HO-CH | HO-CH2 Glycerinsäure / Glycerat Biochem Propaedeutik Verwandte Seite 1 von 30 Pentosen H–C=O | H – C – OH | H – C - OH | H – C – OH | H – C – OH | H H – C1 = O | H – C2 – H | H – C3 - OH | H – C4 – OH | H – C5 – OH | H Ribose (Aldehyd) H2C - OH | C=O | H – C - OH | H – C – OH | H – C – OH | H 2 – Desoxy - Ribose Ribulose (Keton) Hexosen Beziehung Strukturisomerie bei gleicher Summenformel (hier: C6 H12 O6) sind es doch unterschiedliche Stoffe Enantiomerie beide Moleküle stehen in der Beziehung von Bild und Spiegelbild Ausschlaggebend für die Benennung nach D oder L ist die Position der OH –Gruppe des am weitesten von der höchstoxidierten Gruppe entfernten C – Atoms d -> dexter -> rechts l -> links Beispiele HC = O | C – OH | HO – C | C – OH | C – OH | CH2 OH CH2 OH | C=O | HO – C | C – OH | C – OH | CH2 OH Glucose Fructose HC = O | C – OH | HO – C | C – OH | C – OH | CH2 OH HC = O | HO - C | C - OH | HO - C | HO - C | CH2 OH D - Glucose Epimerie beide Moleküle unterscheiden sich in der Lage von nur einer OH – Gruppe D – Galaktose heißt dann C4 – Epimer zur D – Glucose D – Mannose ist C2 – Epimer zur D - Glucose L - Glucose HC = O | C – OH | HO – C | C – OH | C – OH | CH2 OH HC = O | C – OH | HO – C | HO - C | C – OH | CH2 OH D - Glucose Anomerie beide Moleküle unterscheiden sich in der Lage der OH – Gruppe am endständigen C – Atom, das die intramolekulare Halbacetalbildung durchführt H D - Galaktose OH C | C – OH | HO – C | C – OH | C | CH2 OH HO O α - D - Glucose Grundformen: 1. O Pyran Biochem Propaedeutik H C | C – OH | HO – C | C – OH | C | CH2 OH β - D - Glucose 2. O Furan Seite 2 von 30 O Hexosen in der Halbacetalform – Ringdarstellung Das O befindet sich immer rechts oben, das im folgende C-Atom im Uhrzeigersinn ist C1. Alle sich rechts befindlichen OH-Gruppen stehen nun unten, alle linken demzufolge oben. C6 steht bei der D – Reihe also immer oberhalb von C5, bei der L – Reihe unterhalb von C5. Steht die OH – Gruppe von C1 unten, handelt es sich um ein α - Molekül, für ein β - Molekül stünde sie oben. Pyranosen Furanosen CH2OH CH2OH O 5 O OH OH 4 OH 1 OH OH 3 O CH2OH OH OH OH OH 2 OH OH α - D – Glucose α - D – Galactose OH α - D - Fructose OH – Gruppen Alkoholische Unterscheidung in Primäre -> oxidieren / dehydrieren -> Aldehyde Sekundäre -> oxidieren / dehydrieren -> Ketone Tertiäre Oxidation nicht ohne Zerstörung des Moleküls möglich Reaktionsfreudigkeit: gering Alkoholische im Cycloalkan = OH - Gruppe Halbacetalische Reaktionsfreudigkeit: H OH | | H–C–O–C– | | Phenolische Reaktionsfreudigkeit: gut, wirken reduzierend gut, reagieren sauer, da sie zur Dissoziation neigen Reaktionen von Alkoholen / Aldehyden / Carbonsäuren 1. 2. 3. 4. 5. 6. CH2OH Alkohol + Alkohol Aldehydhydrat + Alkohol Carbonsäure + Alkohol Aldehydhydrat + Aldehydhydrat Carbonsäure + Aldehydhydrat Carbonsäure + Carbonsäure Biochem Propaedeutik -> -> -> -> -> -> Ether + Wasser C–O–C Halbacetal + Wasser CHOH – O – C Ester + Wasser C – CO – O – C unwichtig unwichtig O O Säureanhydrid + Wasser C – O – C Seite 3 von 30 OH Kohlenhydrate II Datum: 10.11.98 Dozent: Hr. Breter OH | -C| -C| | -C| -C| Alkan Alkohol O || -C | -C| O || C -OH | -C| OH | -C -OH | -C| Aldehyd Carbonsäure Aldehydanhydrat C | N–C | C | C – N+ – C | Wichtige Funktionelle Gruppen 1. Aminogruppe NH2 | Aminogruppe C C sek. Amin tert. Amin (di – methyl – amin) prim. Amin 2. HN – C | C quat. Amin (tetra – methyl – ammonium) Thioalkohol C – S – H Thioalkohol 3. Säureamide O || - COOH + H2N – C - 4. Thioester - C – N – CH2 | H O || - COOH + HS – CH3 Thiol 5. -> -> - C – S – CH3 sind im Gegensatz zu Estern energiereich Peroxide O–O–H | -C–C- 6. cyclische Schwefelverbindungen Biochem Propaedeutik S S Thiophan Thiophen Seite 4 von 30 7. cyclische Stickstoffverbindungen N N | H N | H Pyrrol N N Imidazol N N N N N Pyrimidin Pyradin N Purin Indol Kohlenhydrate – Vollacetale – Saccharide Zucker : KH, die in wässriger Lösung Cyclo-Halbacetale bilden CH2OH CH2OH O 5 O OH OH 4 1 OH OH OH 3 O CH2OH OH OH OH CH2OH OH OH 2 OH OH α - D – Glucose α - D – Galactose OH α - D – Fructose Vollacetalbildung (analog Vollketalbildung) CH2OH O 5 OH 1 4 OH O- OH 3 R R ist in der Regel kein Nichtzuckeralkohol (=Aglucon) gewesen 2 OH 1. Reaktionen mit OH – Gruppen 1.1. Alkoholische 1.2. Halbacetalische (beide Halbacetal – OH – Gruppen reagieren miteinander) Disaccharid Glucose + Glucose = Trehalose wirken nicht reduzierend, weil eine HA-OH mehr da ist -- OH HO-- 1.3. Halbacetalische (es reagiert eine Halbacetal – OH – Gruppe mit einer beliebigen OH – Gruppe des Halbacetals) Polysaccharid Glucose + Glucose + Glucose + ... = Maltose wirkt immer wieder reduzierend --OH Biochem Propaedeutik --OH Seite 5 von 30 Bildung von Maltose (Malzzucker) mit Strukturformeln CH2OH CH2OH O 5 O OH OH 1 4 O OH OH 3 OH OH 2 OH OH α - 1,4 – Glycosilische Bindung kann zum Polysaccharid werden α - D – Glucopyranosido – 1,4 - α - D – Glucopyronose drückt oxidiertes HA-OH aus drückt unversehrtes HA-OH aus Makromolekülform des Polysaccharids: Glycogen, Stärke eine Schleife enthält 6 Glucose – Moleküle diese Struktur ist gut abbaubar im Körper Macht man die selbe Reaktion mit β - Glucose entsteht Zellulose. Deren Struktur ist gerade, sie ist im Körper nicht abbaubar. Dafür eignet sie sich aufgrund ihrer Struktur hervorragend zum Abstützen von Pflanzen. Bildung von Lactose (Milchzucker) CH2OH CH2OH O 5 OH O OH OH 4 1 OH 3 O OH OH 2 OH OH β - D – Galactose α - D – Glucose β - D- Galactopyranosido – 1,4 - α - D – Glucopyranose Bildung von Saccharose (Rohrzucker, Rübenzucker) Damit die beiden HA-OH miteinander reagieren können, OH muß man die Fructose drehen. CH2OH O 1 O CH2OH OH 5 2 O OH OH 3 OH α - D – Glucose α - D – Glucopyranosido – 1,2 - β - D – Fructofuraosid Biochem Propaedeutik Seite 6 von 30 6 CH2OH 4 OH β - D – Fructose 2. Reaktionen mit NH – Gruppen (N - Glycosilisch) nur in Nucleinsäuren Nucleotiden es reagieren immer β - Ribose und eine Base NH2 N N Adenin N CH2OH N O Adenosin Ribose OH OH Exkurs zu energiereichen Verbindungen [1] Säureanhydride - Phosphorsäureanhydride Metaphosphat Pyrophosphat Diphosphat O O || || O- - P – O – P – O| | OO- reiner Phosphorsäureanhydride unreine Phosphorsäureanhydride: Phosphorsäure – Carbonsäure – Anhydrid Phosphorsäure – Schwefelsäure – Anhydrid O O || || O- - P – O – C – R | O- O O || || O- - P – O – S = O | | OO- [2] Thioester O || R – CH2 – C – S – CH2 – R [3] Phosphoenolester O || C – OH O | || C – O – P – O|| CH2 Phosphorester sind i. d. R. nicht energiereich [4] P / N – Bindungen CH2 – COOH O| | CH3 – N – C – NH – P = O || | NH O- Biochem Propaedeutik Kreatinphosphat (alles) Guanodini - Essigsäure Imino - harnstoff Seite 7 von 30 NH2 | C=O | NH2 Harnstoff Aminosäuren Datum: 18.11.98 Dozent: Hr. Breter Oxidationsprodukte aus Kohlenhydraten: H O \ // C | C – OH | HO – C | C – OH | C – OH | CH2OH Oxidation D – Glucose Aldose (weil Aldehyd) HO O \ // C | C – OH | HO – C | C – OH | C – OH | CH2OH D – Gluconsäure an C1 oxidiert H O \ // C | C – OH | HO – C | C – OH | C – OH | O = C - OH oder D – Glucuronsäure an C6 oxidiert Einsatz zur Synthese von Glucosaminoglycanen (Aminozuckerpolymere) Aminozuckergrundmolekül: CH2OH O 5 Die NH2 – Gruppe (Aminogruppe) befindet sich immer an dieser Stelle, nur die Art des Zuckers kann variieren. OH 1 4 OH OH OH Hier handelt es sich um ein D - Glucosamin 2 3 NH2 Vorgehensweise: aktivierte Glucose: O || N CH2OH O 5 OH 1 4 OH OH 3 O 2 OH O O || || -- O – P – O – P – O | | OOPhosphatsäureanhydridbindung // O -- CH2 OH N O OH An C1 von Glucose wird ein Phosphatrest an die Halbacetalgruppe angehängt (Glucose-1Phosphat). Der andere Reaktionspartner, Uridin, besteht aus dem Pyrimidinderivat (Cycloamid) Uracil und der Ribose. Er liegt als Uridintriphosphat in einem Gleichgewicht vor. In der Lösung gibt es nun also neben Uridintriphosphat (UTP) auch dessen Edukte Uridinmonophosphat (UMP) und Pyrophosphat. In der Zelle aber wird Pyrophosphat zersetzt und damit aus dem Gleichgewicht entfernt. die Spaltung von UTP in UMP und Pyrophosphat ist irreversibel. Das Glucose-1-Phosphat reagiert über eine Phosphatsäureanhydridbindung mit UMP zu Uridindiphosphatglucose (UDP-Glucose). Das ist aktivierte Glucose. GTP (Guanintriphosphat) aktiviert Mannose CTP (Cytosintriphosphat) wichtig im Peptidstoffwechsel UTP (Uridintriphosphat) aktiviert den Rest Begriffe: Homoglycane Heteroglycane Cellulose Dextrine Glycogen Polymere aus einem Monosaccharid Polymere aus verschiedenen Monosacchariden Glycosaminglucane pflanzl. Polysaccharid, β 1-4 Bindungen mit β 1-6 Verzweigungen Glucose, β 1-4 Bindungen, nicht abbaubar tierisch, α 1-4 glucosilische Bindungen, α 1-6 Verzweigungen Biochem Propaedeutik Seite 8 von 30 Eine absolut stickstofffreie Ernährung führt zu einem Stickstoffverlust von 2 – 3 g / Tag im Körper. Da Proteine zu ca. 16% aus Stickstoff bestehen, sind diese 2 – 3 g / Tag 16% des täglichen Proteinverlustes. ohne Stickstoff verlieren wir 12 – 20 g Proteine / Tag Verlust über - Haare (fallen aus) und Hautschuppen - Urin (Harnsäure, Harnstoff und Kreatin) - Darm Um den Proteinverlust auszugleichen muß man ca. 0,5 g Proteine / kg Körpergewicht / Tag zuführen. Also bei einer 70 kg schweren Person 30 . 35 g Protein / Tag. Die Differenz zwischen der benötigten und der errechneten Menge hängt damit zusammen, daß der Körper bei Proteinzufuhr auch mehr Proteine verbraucht (spezifische dynamische Wirkung der Proteine). Die wünschenswerte Bilanz sind nach der deutschen Gesundheitsdefinition 0,8 – 1 g /kg Körpergewicht / Tag, davon 40% tierisches und 60% pflanzliches Eiweiß. Definition: Aminosäuren sind ein KW-Gerüst mit einer Säuregruppe (normalerweise –COOH) und einer NH2 – Gruppe. Aminosäuren sind die Bausteine der Proteine. es gibt 60 – 80 Aminosäuren im Organismus, davon 35 im intermediären Stoffwechsel und davon 20 proteinogene (proteinaufbauend) Die Proteine werden zwar aus nur 20 AS synthetisiert, aber während sie „reifen“, werden sie mit verschiedenen Gruppen versehen. Untersucht man also fertige Proteine, finden sich mehr als 20 Bausteine. Aufteilung der AS: in essentielle / nicht essentielle AS (es gibt 11 nicht ess. und 9 AS, die der Körper zwar dringend benötigt, aber nicht selbst synthetisieren kann) in glucogene / ketogene AS (16 AS, bei deren Abbau Glucosestrukturen freigesetzt werden und 4 AS, bei deren Abbau Acetoaldehyde (aktivierte Essigsäure) entsteht.) Nomenklaturregeln, Namengebende Säuren essentielle AS sind alle verzweigten Moleküle, cyclische Moleküle (soweit sie nicht aus anderen ess. AS synthetisiert werden können) und Moleküle mit Thioesterbrücken. Kennzeichen: saure AS sind solche mit zwei oder mehr Säuregruppen Namen sind manchmal an die alte Nomenklatur angelegt. Dort wurde das höchstoxidierte C-Atom (meist COOH) mit 1, das zweite dann mit 2 oder α, das dritte mit 3 oder β, das vierte mit 4 oder χ und das letzte immer mit omega bezeichnet. D und L bezeichnen wie gewohnt rechts und links, beziehen sich hier auf die Lage der NH2 –Gruppe bei cyclischen AS geben o, m, p (ortho, meta, para) Stellungen am Ring an ( o = 12 Uhr, m = 2 Uhr, p = 4 Uhr) Homologe Reihe der Carbonsäuren C1 Ameisensäure C2 Essigsäure C3 Propionsäure Buttersäure C4 C5 Valeriansäure C6 Capronsäure ein Beispiel einer nicht protogenen AS: Ornithin COOH | NH2 – CH | (CH2)3 | NH2 Biochem Propaedeutik HOOC – COOH HOOC – (CH2)1 – COOH HOOC – (CH2)2 – COOH HOOC – (CH2)3 – COOH HOOC – (CH2)4 – COOH HOOC – CH = CH – COOH Carbaminsäure (instabil Seite 9 von 30 Oxalsäure Malonsäure Bernsteinsäure, Salze: Succinate Glutarsäure Adipinsäure (cis) Maleinsäure (trans) Fumorsäure CO2 + NH3) COOH | NH2 Proteinogene Aminosäuren: O OH \\ / C | H2N – C – H | H Glycin O OH \\ / C | H2N – C – CH | CH – CH3 | C2 H5 isoLeucin O OH \\ / C | H 2N – C – H | (CH2)2 | S – CH3 Methionin O OH \\ / C | H 2N – C – H | (CH2)2 | O = C – NH2 Glutamin COOH | H – C – NH2 | O OH \\ / C | H 2N – C – H | CH / \ CH3 CH3 O OH \\ / C | H 2N – C – H | CH3 Alanin L - α - Propionsäure Valin L - α - isoValeriansäure O OH \\ / C | H 2N – C – H | CH – OH | CH3 O OH \\ / C | H 2N – C – H | CH2OH Serin O OH \\ / C | H 2N – C – H | (CH2)2 | COOH Aminoglutarsäure Glutaminsäure Lysin Cystein Asparaginsäure Asparagin Säureamid O OH \\ / C | H 2N – C – H | CH2 | Phenylalanin COOH N -CH2 – CH – COOH | NH2 NH | OH Biochem Propaedeutik O OH \\ / C | H 2N – C – H | CH2 | O = C – NH2 Arginin COOH | H – C – NH2 | CH2 N | Histidin Thyrosin p - Hydroxiphenylalanin Leucin L - α - isoCapronsäure O OH \\ / C | H 2N – C – H | CH2 | SH Threorin O OH \\ / C | H 2N – C – H | CH2 | COOH O OH \\ / C | H 2N – C – H | (CH2)3 | NH | NH2 – C = NH O OH \\ / C | H 2N – C – H | (CH2)4 | NH2 O OH \\ / C | H 2N – C – H | C2H3 / \ CH3 CH3 NH Prolin Seite 10 von 30 Tryptophan Aminosäuren II Datum: 24.11.98 Dozent: Hr. Breter Verdauung der Proteine (Aufspaltung in die Aminosäuren) durch Endopeptidasen (Angriff auf die Enden des Moleküls) Pepsin (Magen) Trypsin (Pankreas) Chymotrypsin (Pankreas) durch Exopeptidasen (Angriff in der Mitte des Moleküls) Carboxypeptidase (Pankreas) Aminopeptidase (Dünndarm) Oligopeptidase (Dünndarm) Dipeptidase (Dünndarm) Verkettung der AS im Protein O || O H C - ... || | | H2N – C – N - CH | | CH R | R Säureamidbindung im Aminosäurenzusammenhang auch Peptidbindung Die Leber ist das zentrale Organ der Aminosäuren – Verwaltung. Sie reguliert den AS – Pool. Im Pool befinden sich alle freien AS des Organismus, das sind ca. 70 g. Täglich werden ca. 300 g Proteine synthetisiert und wieder abgebaut. Die Leber entscheidet darüber, welche AS abgebaut werden und wie die Zusammensetzung des Pools ist. Da es eigentlich keine Speichermöglichkeiten für freie AS gibt, müssen die essentiellen ständig zugeführt werden. Proteine Synthesen HÄM Purine Kreatin AS - Pool Abbau Überschuß Hormone Schilddrüsenhormon T3 und T4 Adrenalin biogene Amine AS - Decarboxylierung ABBAU DER AMINOSÄUREN Einführung in Enzymgestalt Verhalten von Doppelbindungen beim Hydrieren Butadien CH2 = CH – CH = CH2 Buten CH3 – CH = CH – CH3 Biochem Propaedeutik + H2 Seite 11 von 30 FAD (Flavin Adenin Dinucleotid) (nützlich zum AS Abbau mit Desaminierung) O || CH2 N N CH2 N N \\ O N | CH2 | (CHOH) O | || CH2 – O – P – O – | Obis hier: Vitamin B2 N CH2 OH Bei Aufnahme von H2 wird FAD zu FAD H2. Dies geschieht (wie bei Buten) über eine 1 – 4 Addition an den Stickstoff: N N = C – C = N + H2 NH – C = C – NH N OXIDASE O OH OH NAD (Niacinsäureamid Adenin Dinucleotid) (arbeitet intramitochondrial) Nicotinsäure (mit OH) mit NH2 Nicotinsäureamid, Niacinamid (spez. für B – Vitamine) H C=O \ OH o. NH2 N N N O O || || CH2 – O – P – O -– P – O – | | OO- OH NAD bindet H2, indem es NH2 OH bis hier NMN Nicotin Mono Nucleotid N CH2 OH OH H2 H- spaltet. (Diese Reaktion heißt Disoppositionierung, es entsteht ein Proton und ein Hydridion.) Das Hydridion wird am Pyridin – Ring angelagert (siehe rote Veränderung), was ein Umklappen der e-Bindungen zur Folge hat. (das untere N war ursprünglich positiv). Die Reaktion lautet also N O O | O- - P = O | O- H+ + NAD+ + H2 NADH + H+ DEHYDROGENASE NADP Aminosäurenstoffwechsel 1) Genereller Angriff auf N a) Desaminierung (Energieverlust) I) oxidative Desaminierung II) eliminierende Desaminierung III) Desaminierung nach β - Elimination NH3 Freisetzung b) Transaminierung 2) Genereller Angriff auf C- Skelette (Energiegewinn) Biochem Propaedeutik Seite 12 von 30 toxisch sofortiger Abbau nötig geschieht fast nie in der Peripherie oxidative Desaminierung Produkt ist eine α - Ketosäure und NH3 COOH | H2N – CH | R Aminosäure COOH | C = NH FAD reversibel FADH2 + H2 O | irreversibel R Imidazolsäure COOH | C = O + NH3 | R α - Ketosäure FADH2 + O2 Substratwasserstoff H2O2 (Peroxidasen, Katalasen zerstören dieses Zellgift, energieverbrauchend) Sonderfall: oxidative Desaminierung mit NAP+ COOH | H2N – CH | (CH2)2 | COOH Glutaminsäure COOH NAD+ NADH + H+ reversibel | C = NH | (CH2)2 | COOH COOH Glutaminsäuredehydrogenase + H2 O reversibel | C = O + NH3 | (CH2)2 | COOH in den Lebermitochondrien kann NH3 abgebaut und NADH + H+ zu H2O unter Energiegewinn oxidiert werden (ATP – Synthese). Durch Entfernung von NH3 aus dem Gleichgewicht findet die Reaktion trotz ungünstiger Gleichgewichtslage vollständig statt. eliminierende Desaminierung Produkt ist ein KW mit trans – Doppelbindung und NH3 COOH COOH AS – NH3 Lyase | | H2N – CH CH + NH3 | || HC CH2 | | COOH COOH Asparaginsäure Fumurat COOH | H2N – CH | CH2 N | Histidin Biochem Propaedeutik NH AS – NH3 Lyase COOH | CH + NH3 || HC N | NH Urocaninsäure Seite 13 von 30 Desaminierung nach β - Elimination Produkt ist α - Ketosäure und NH3 COOH | H 2N – C – H | H2Cβ - OH o. SH Serin / Cystein COOH | NH2 – C || Dehydratasen CH2 COOH | C = NH | CH3 H2O o. H2S Desulfhydrasen instabil COOH | C=O | CH3 + H2 O Iminosäure + NH3 Brenztraubensäure Bindung des NH3 da Ammoniak das Produkt jeder Desaminierung ist, interessiert auch sein Abbau. Der geschieht z.B. durch Glutaminsäure und ATP. COOH | H2N – CH + ATP | (CH2)2 | COOH Glutaminsäure oxidative Desaminierung eliminierende Desaminierung Desaminierung nach β Elimination Biochem Propaedeutik COOH | Glutaminsynthetat H2N – CH | (CH2)2 | C // \ O O~P energiereich Enzym D – AS – Oxidasen FAD – abhängig GLDH – Reaktion NAD+ AS – Ammoniak – Lyasen [Serin] & Threorin – Dehydratasen und Desulfhydrasen COOH | H2H – CH + ADP + P | (CH2)2 | C // \ O NH2 ehemaliges NH3 χ - Carbonyl amidiert Produkte H2O2 + α - Ketosäure + NH3 Reversibilität nein H2O (ATP !) + NH3 + α Ketoglutaminsäure ungesättigte Doppelbindung in trans + NH3 H2O oder H2S + α - Ketosäure + NH3 ja Seite 14 von 30 nein nein Datum: 01.12.98 Transaminierung (Abbaureaktion für AS, reversibel) COOH | R–C–H | NH2 H 3C H2 C- OH | CH2OH Phosphat \ / HO N COOH | R–C–H | N || CH H 3C | CH2O-P \ / COOH | R–C || N | CH H 3C || CH2O - P \ / N Schiff’sche Base Aldimin HO Pyridoxin (gelangt in katalytischen Mengen in die Zelle [=Vitamin B6, Bedarf: 2 mg / die] und wird dort aktiviert zu Pyridoxalphosphat) Pyridoxalphosphat liegt in zu geringen Mengen für den gesamten Körperbedarf vor, muß also wiedergewonnen werden. Dies geschieht mit der Überführung von Pyridoxamin – Phosphat zurück zu Pyridoxal – Phosphat. HO + H 2O COOH | C=O | R α - Ketosäure CH3 \ HO N Ketimin NH2 | CH2 | CH2O - P / N Pyridoxaminphosphat (Co- Enzym) Vorteil des ganzen: Übertragung der Aminogruppe ohne NH3 - Freisetzung Die Rückreaktion geschieht dann mit ganz bestimmten, reichlich vorhandenen a – Ketosäuren. Das hat den Vorteil, das aus 20 verschiedenen AS in der Leber eine Verbindung resultiert (α-Keto-Glutarat). Im Lebermitochondrium wird Pyridoxamin – P zu Pyridoxal – P überführt und dann mit der GLDH – Reaktion (NH3 H2O unter Energiefreisetzung) zu Harnstoff synthetisiert. α - Ketosäuren Galerie: COOH | C=O | CH2 | CH2 | COOH COOH | C=O | CH2 | COOH COOH | C=O | CH3 Pyruvat Endprodukt im Glucoseabbau Oxalessigsäure α - Keto - Glutaminsäure α - Keto – Glutarat (Salz) Rückreaktion: α - Keto – Gluterat Biochem Propaedeutik + Pyridoxamin-P Ketimin Seite 15 von 30 Aldimin Pyridoxal-P + AS ( Abbau) 1. Muskulatur Wenn im Muskel schnell Energie benötigt wird, kann der Muskel auch Aminogruppen auf Pyruvat übertragen (die entsprechende AS ist Alanin). Pyrodoxal-P und Pyruvat wird an das Blut abgegeben und in den Lebermitochondrien in Glutarat und Pyrodoxamin-P zurücküberführt. Dabei gewinnt der Muskel nichts, da die Reaktion für ihn keine Energie bereitstellt. Aber in der Leber wird die AS abgebaut und es entsteht Glucose, die dann den Muskeln über das Blut zur Verfügung steht. 2. Leber diese Reaktion findet dauernd statt: +B6 Glutaminsäure (GLU) + Oxalacetat α - Keto – Glutarat + Asparaginsäure (ASP) PALP GLU + ASP = Harnstoff Für die Reaktion ist eine Transaminase (hier: Glutaminsäureoxalacetattransaminase GOT) erforderlich. In der Muskulatur und in der Leber wird Glutaminsäurepyrovattransaminase (GPT) verwendet. klinische Anwendung: Messung des [S]GOT und [S]GPT – Spiegels um den regelrechten Abbau von AS zu kontrollieren und so auf die Leberfunktion schließen zu können. ([S] = Serum) Diese Stoffe werden freigesetzt, wenn Herzmuskelzellen (erhöhter [S]GOT – Spiegel (cor)) oder Leberzellen (erhöhter [S]GPT – Spiegel (hepar) oder GLDH - Spiegel) Schaden erlitten haben oder nekrotieren. Physiologische L - α - AS werden in der Regel gar nicht desaminiert, D – α - AS dagegen sollen abgebaut werden (sie sind Bakterienprodukte und kommen über Käse, Joghurt, .. in unseren Körper.) Es gibt für diese AS im Körper kein Transportsystem, wenn sie doch in den Blutkreislauf gelangen, werden erst teilweise in der Leber, aber vollständig in der Niere abgebaut. Außer ihnen wird auch noch Glycin abgebaut, weil sie weder D noch L ist: COOH | H2N – CH – H In der Leber wird Harnstoff gebildet über die Aktivierung der Aminogruppe und Übertragung derselben auf CO2. Dabei verbraucht die Bildung von 1mol Harnstoff 4 mol ATP. Beim Abbau von AS verlieren wir also Energie, die sozusagen der Preis ist für die Entgiftung des Körpers. physikalischer Brennwert 4 9 6 Kohlenhydrate Fette Aminosäuren O || H-N O // N-H =O N | H N | H physiologischer Brennwert in kcal/g 4 9 4 Purin Harnsäure kommt im Vogelstoffwechsel vor und ist wegen ihrer schlechten Wasserlöslichkeit ideal für den Vogel, der mit einem wasserfreien Stoffwechsel viel leichter lebt. Beim Menschen sind Harnsäureablagerungen pathogen ( M (Harnstoff) = 60 g/mol, davon 28 g/mol Stickstoff (ca. die Hälfte) in Proteinen ist ca. 16 % Amminostickstoff also werden aus 100 g Proteinen (16 g N) ungefähr 32 g Harnstoff. Biochem Propaedeutik Seite 16 von 30 Gicht) Kreatin CH2 – COOH / H 3C – N O\ | C – NH2 – P = O || | NH O- Iminoharnstoff (Guanidium) Kreatin dient im Muskel als Kurzzeitenergiespeicher Kreatinphosphat Funktionsweise des Kurzzeitspeichers: ADP + KP ATP + K wenn Kreatin freigesetzt wird, bildet es ein Lactam (inneres Säureamid) und wird zu Kreatinin. H | H-C C=O Lactame sind wichtig u.a. in der Antibiotika-Herstellung (Penicillin ist ein Lactam). Bakterien, die gegen Penicillin resistent sind, haben β - Lactamase. NH CH3 - N Der Kreatinspiegel sollte konstant sein, sein Ansteigen deutet auf eine gequetschte, verbrannte, ... Muskulatur hin C || NH Proteine Datum: 12.01.99 Dozent: Hr. Breter Proteine sind Polyaminosäuren. 1.) Primärstruktur = Aminosäurenfrequenz (genetische Determination) Die Bindung der AS aneinander geschieht über Säureamidbindungen, die im Fall von Peptiden oder Proteinen auch Peptidbindungen genannt werden dürfen. Diese Bindungen sind planar, da sie partielle Doppelbindungen sind, also nicht frei drehbar sind (Keto – Enol – Tautomerie). H O H O H OH H O _ | || _ | || _ | | | || H – N – C – C – N – Cα - C H – N – C – C = N – Cα - C | | | | | R H R R R 2.) Sekundärstruktur a) β - Faltblattstruktur mit einer all – trans Konfiguration der Reste, weil alle benachbarten Reste zueinander in trans stehen 190° Biochem Propaedeutik Seite 17 von 30 b) α- Helix (3,6 AS / Umlauf, in der Mitte ist die Helix hohl und erinnert so an eine Flaschenbürste. Sie beginnt immer an einer freien NH2 – Gruppe und endet mit einer freien COOH – Gruppe. Ihre Form stabilisiert sie mit H – Brücken an den Überkreuzungspunkten [C = O *** H – N], wobei die AS1 mit AS4, AS4 mit AS7 Bindung eingeht. Aufsicht: NH2 c) H – Brücke Stabilisierung der Helix durch H - Brücken COOH Tripelhelix des Kollagens 3.) Tertiärstruktur meint die Lage der Sekundärstruktur im Raum. Sie wird stabilisiert durch - H-Brücken NH2 - Ionenbindungen - schwachen Wechselwirkungen random coil (Zufallsknäuel) - kovalenten Disulfidbrücken Dichte einer Lipiddoppelmembran β-Turn S–S random coil 6 Umläufe mit ca. 22 AS (unpolare AS tendieren zur helicalen Bindung) COOH Faltblätter (Peptidrost) paralleles Faltblatt antiparalleles Faltblatt NH2 COOH 4.) Quartärstruktur Zusammenlagerung von Polypeptidketten, wobei sich immer 4 Monomere zusammentun. Es gibt also für einen Komplex aus zwei Proteinen 5 Möglichkeiten (AAAA, AAAB, AABB, ABBB, BBBB) und damit fünf Isoenzyme. Biochem Propaedeutik Seite 18 von 30 Sonderfall: Kollagen – Tripelhelix hier sind 3 Ketten wie ein Seil ineinander verwoben. Allerdings stört bei 3 Ketten immer ein Rest beim Zusammenlagern auf Höhe des Zusammentreffens braucht man eine AS, die keinen Rest hat (Glycin). Die Tripelhelix ist steiler als die α-Helix und stabil bis 25 °C. Da die Körpertemperatur aber 37°C beträgt, werden bestimmte AS hydroxiliert (Prolin). Gly x Pro Gly x Pro Gly x Pro ... ... ... ... ... ... ... ... ... Pro Gly x Pro Gly x Pro Gly x ... ... ... ... ... ... ... ... ... x Pro Gly x Pro Gly x Pro Gly Im Kollagen sind ca. 30% Glycin (die Enden folgen dem Schema nicht so unbedingt) und ca. 20 – 25% Prolin enthalten. Durch die Hydroxilierung des Prolins können H-Brücken ausgebildet werden, die Stabilität ist gewährleistet bis 37 – 40°C. Um das noch zu toppen, kann Lysin hydroxiliert und dann mit einem Zucker verbunden werden. Bestimmte essentielle AS dürfen im Kollagen nicht enthalten sein Kollagen ist also im großen und ganzen eher minderwertig, weil essentielle AS darin nicht vorkommen. COOH COOH Prolin: N N OH OH \\ / C | H2 N – C – H | CH2 | CH2 | CH2 | CH2 | NH2 Lysin: O O OH \\ / C | H2 N – C – H | CH2 | CH2 | H – C – O - Zucker | CH2 | NH2 Klassifizierung der Proteine in a) einfache und zusammengesetzte (Protein + nicht-Proteinanteil) Proteine Chromophore Gruppe (Hämoglubin) Chromoproteine Nukleinsäuren (Ribosomen) Nucleosomen Lipide Lipoproteine Metalle (Transferin Fe2+-Bindung) Metalloprotein Phosphorsäurereste (Casein) Phosphoproteine b) Strukurproteine (Kollagen, Elastin, ...), Funktionsproteine (Myosin, Aktin) und Serumproteine und Plasmaproteine c) Fibrinäre und Globuläre Proteine, Achsenverhältnis Länge : Breite jeweils über bzw unter 20 : 1 Nachtrag zu Serumproteinen in der Serumelektrophorese (Wanderung der Proteine im eletrischen Feld) kommt folgende Aufteilung zustande: Die χ-Globuline werden auch Immunoglobuline genannt und in den Plasmazellen synthetisiert. Man unterscheidet IgA, IgD, IgE, IgG, IgM. 56% 4% 8% 12% 20% Albumine werden in der Leber synthetisiert. IgG besteht aus zwei schweren und zwei leichteren Ketten. Mit Papain lassen sich diese in 2 Fragmente FAB und ein Fragment Fc (kristallisierbar) spalten. Da sich die Antikörper willkürlich spalten und assoziieren können, sind Antikörper individuell. Albumine α1 Globuline α2 β Biochem Propaedeutik χ Seite 19 von 30 Enzymatisch aktive Proteine Enzyme sind nicht immer, aber i. d. R. Proteine. Sie sind Biokatalysatoren, die die Einstellung des chemischen Gleichgewichts beschleunigen. So laufen bestimmte Reaktionen wasserfrei besser ab (Enzyme können wasserfreie Räume schaffen) oder Enzyme senken die Aktivierungsenergie der Reaktion. Die Einheit der Enzymaktivität ist Katal. Ein Katal bedeutet 1 mol Umsatz / sek. Im klinischen Alltag ist allerdings die Einheit nanoKatal gebräuchlich. Unter der Michaelis-Konstante versteht man das Ausmaß v der Affinität zwischen Enzym und Substrat. Trägt man den Umsatz der Reaktion gegen die Zeit auf, so stellt sich irgendwann das chemische Gleichgewicht ein und die Kurve nähert sich dieser Asymptote an. Die MichaelisKM Konstante ist dabei die Halbmaximalgeschwindigkeit. t Ist sie klein, bedeutet das eine hohe Affinität (Kaum gesehen, schon geschehen), ist sie groß, besteht nur eine geringe Affinität. 6 Enzymklassen Oxidoreduktasen Isomerasen Transferasen Ligasen Lyasen Hydrolasen dehydrieren, hydrieren, O2 einführen Glucose – Fructose, Glucose – Galaktose Gruppenübertragung C – C, C – N Spaltung und Herstellung Polymerspaltung (Verdauung) Jedes Enzym hat eine Ec – Nummer, die es charakterisiert. Lipide Datum: 19.01.99 Dozent: Hr. Breter Def.: Substanz, die schwer / gar nicht wasserlöslich sind, die hingegen gut löslich sind in organischen Lösungsmitteln. Einschub: organische Lebensmittel (unpolar) - Alkane (Hexan) - Ketone - Ether - Alkohole (giftig, kann über die Haut resorbiert werden) - Mono-/ Di-/ Tri-/ Tetrahalogenmethan (giftig) - Benzol ( Tumorbildung) Lipide 1. Fettsäuren („oxidierte“ Alkane) Einschub: Carbonsäuren [keine Fettsäuren] Monocarbonsäuren Ameisensäure Essigsäure Propionsäure Buttersäure Valeriansäure Kapronsäure Dicarbonsäuren Oxalsäure Malonsäure Bernsteinsäure (Succinate) Glutarsäure Adipinsäure ungesättigte Carbonsäuren Fumarsäure trans Maleinsäure cis Fettsäuren: C16 Palmitinsäure 16 ∆8en (Doppelbindung von C8 = C9) Palmitölsäure C18 Stearinsäure 18 ∆9en Ölsäure Biochem Propaedeutik Seite 20 von 30 essentielle Fettsäuren (2 oder mehr Doppelbindungen) Nomenklatur: letzte DB vom Methylende her (bei C3 ist es eine ω3 Fettsäure) ∆9,12,15tri en Linolensäure 1/ 2 \ 3 = 4 / 5 \ 6 = 7 / 8 \ 9 = 10 / 11 \ 12 / 13 \ 14 / 15 \ 16 /17 \COOH ω3 – FS ∆9,12 di en Linolsäure 1/ 2 \ 3 / 4 \ 5 / 6 = 7 \ 8 / 9 = 10 \ 11 / 12 \ 13 / 14 \ 15 / 16 \ 17 /COOH ω6 – FS ∆5,8,11,14tetra en Arachidon 1 / 2 \ 3 / 4 \ 5 / 6 = 7 \ 8 / 9 = 10 \ 11 / 12 = 13 \ 14 / 15 = 16 \ 17 / 18 \ 19 /COOH Die Nummern der C-Atome dienen der Nachvollziehbarkeit der ω - Nomenklatur. Selbstverständlich werden nach IUPAC die Carboxylgruppen C-Atome mit 1 benannt. FS sind i.d.R. cis-konfiguriert, ihre Abbauprodukte sind trans-konfiguriert. DB sind durch zwei Einfachbindungen getrennt und die letzte Doppelbindung ist 3 oder 6 C-Atome vom Methylende entfernt. Einschub: Doppelbindungen isolierte konjugierte divinylmethanrhythmus -C–C=C–C–C– -C=C–C=C–C=C– Farbe -C=C–C–C=C– freie Fettsäuren nicht essentielle Fettsäuren, wirken als Emulgatoren. Deshalb kann man sie nicht frei transportieren, sie müssen an unspezifische Träger gebunden werden. 2. Glycerolipide zugrundeliegender Alkohol ist Glycerol / Glycerin [COH – COH – COH] O || C – OH H2 – C – O – C – R1 | 2 FS | C – OH R2 – C – O – C – H O| H3PO4 || | | C – OH O H 2C – O – P – O || O Diacylglycerophosphat (Phosphatidsäure) 1. Weg: Austausch des Pi (inorganic Phosphat) durch eine FS Triacylglycerol (Talge [tier.] bei Raumtemperatur fest, gesättigte Fettsäuren bzw. Öle [pflanzl.] bei RT flüssig und beinhalten essentielle, also ungesättigte FS) 2. Weg: Addition eines Alkohols an das Phosphat Glycerolphosphatide wie auch bei den Triacylglycerolen kann es bei den FS zu Mikroheterogenität kommen Alkohole: ♦ ♦ Kephaline (auffindbar in den ZNS-Membanen) HO – CH2 – CH – COOH | Serin NH2 Lecithine CH3 | Cholin (Trimethylethanol) HO – CH2 – CH2 – N+ - CH3 | R2 ist hier in der Regel ungesättigt CH3 Biochem Propaedeutik Seite 21 von 30 ♦ ♦ Cardiolipine (mitochondriale Membran) Phosphatidsäurerest – C | C – OH | C – Phosphatidsäurerest Inositolphosphatide, Inositide OH OH OH Myoinositol OH OH 3 Glycerole spaltbar mit Hormonen am Inositoltrisphosphat; der Rest findet Verwendung als Botenstoff in der Zelle OH H2C – FS | HC – FS O | || H 2C – O – P – O | O- OH Phosphatidyl-Inositol 4,5 Bisphosphat (bis, da P nicht in Anhydrid gebunden ist) OH O–P OH O || O – P - OH | OH Spaltprodukte sind Diacylglycerol (DAG) und IP3 (kann aus Ca2+ - Speichern Calcium freisetzen, wurde früher gegen Schizophrenie eingesetzt) Etherlipide H2C – O – CH2 – (CH2)16 - CH3 Etherbindung | HC – O – CO – CH3 CH3 Essigsäure | | H2C – O – P – O – CH2 – CH2 – N+ - CH3 Cholin | CH3 Platelet Activating Factor, wirkt ab 10-11 mol / l Verklumpung Datum: 26.01.99 Wachse (FS-Ester) /\/\/\/\/\/\/\C=O /\/\/\/\/\/\/O FS FS – Alkohol 3. Sphingolipide /\/\/\/\/\/\/\/COOH + HOOC – HCNH2 – CH2 – SH NH | 2 COH – CH – CH – OH /\/\/\/\/\/\/\\/ 2 /\/\/\/\/\/\/\\/COH – C – C – OH NH /\/\/\/\/\/\/\/\/ || Sphingosin + FS Ceramid (Grundkörper der Sphingolipide) auch hier wegen verschiedener FS Mikroheterogenität C= O O Palmitinsäure und Serin CH3 | + O – CH2 – CH2 – N - CH3 Phosphorylcholin | CH3 /\/\/\/\/\/\/\\/COH – C – C – O – P – OH NH C= O /\/\/\/\/\/\/\/\/ Biochem Propaedeutik Seite 22 von 30 Ceramid + Phosphorylcholin = Sphingomyelin (Substanz der Nervenscheiden), einziges Sphingophospholipid aber auch Phosphatid Sphingophospholipide (Sphingomyeline) Sphingolipide Sphingoglycolipide Cerebroside erebrosid cerebrosid lceramide side Glucoc Galacto Lacto~ Trihexy Ganglio Glucocerebrosid / Galactocerebrosid: - O – Glucose - O – Galactose - O – Galactose (an C3 sulfatiert) | SO3H Lactocerebrosid - O – Glucose – Galactose (= Lactose) Trihexosylceramide - O – Glucose - Galactose | Galactose Ganglioside NANA| - O – Glucose - Galactose | n – Acetyl – Galactosamin (NANA = n – Acetyl – Neuramin – Säure 4. Steroide \ | / C=C–C=C / | \ CH3 Isopentadien aktives Isopren Isopentenyldiphosphat O O \ || || C = C – CH2 – CH2 – O – P – O – P – O/ | | | CH3 OO- Biochem Propaedeutik Dimethylalyl-Diphosphat CH3 – C = CH – CH2 – O – P – P | CH3 Seite 23 von 30 Sialinsäure) 2 x aktives Isopren 3 x aktives Isopren 2 x dreimal (C15) C10 = Geranyl – Diphosphat C15 = Farnesyl – Diphosphat C30 = Squalen anguläre Methylgruppe C CH3 CH3 A D C Sterangerüst mit C17 (mit Methyl C19) (ohne den C8 – Schwanz) B D B A 3 C-Atome gehen bei der Synthese verloren cis, wenn Methyl- und H-Rest auf derselben Seite der Ringebene liegen CH3 CH3 A D C Cholesterin kommt nur in Tieren vor, Pflanzensteroide werden kaum resorbiert Cholesterin wird zu Gallensäuren abgebaut, die wichtig sind für die Emulgierung und deshalb im Dünndarm rückresorbiert werden. B HO Gallensäuren ( z.B. 3,7,12 α - Trihydroxicholansäure oder Cholsäure, Bildung in der Leber) HO 21 20 CH3 19 1 2 4 CH3 9 5 18 12 14 10 3 HO 11 8 7 6 17 16 13 23 22 COOH 24 15 HO * * dort versetzt mit Glycocholsäure – CO – NH – C - COOH Taurocholsäure - CO – NH – CH2 – CH2 – SO2 - OH Gallensäuren, die mit Glycocholsäure oder Taurocholsäure versetzt sind, heißen auch konjugierte Gallensäuren. Sie werden dadurch hydrophiler und sind so besser im Gallensaft ausscheidbar. [Aminoethansulfonsäure = Taurin] CH3 Cholesterin Vitamin D3 Vitamin D – Hormon CH3 A C D B HO - Umwandlung des Cholesterins in der Leber zu 7 – Dehydrocholesterol = Provitamin D3 Transport in die Haut und Umwandlung unter UV-Bestrahlung zu Vitamin D3 (Cholecalciferol = Calciol) zurück zur Leber und Hydroxilierung zu 25 – Hydroxy – cholecalciferol oder Calcidiol in die Niere und Hydroxylierung zu Calcitriol = Vitamin D - Hormon CH3 OH CH3 A C OH D B HO Biochem Propaedeutik Seite 24 von 30 Cholesterin ist Hauptbaustein der Steroidhormone Calcitriol wird auch dazugezählt Muttersubstanz (w + m) ist das Progesteron (auch Gestagen) Nebennierenrinde glomeruläre Schicht fasciculäre Schicht retikuläre Schicht Testes Ovarien Mineralocorticoide - Aldosteron (Mineralstoffwechsel) Glucocorticoide - Cortison (Glucosestoffwechsel) androgene Steroide Testosteron C21 C21 C19 (nur Ring mit angulärem CH3) Gestagene / Progesteron Estrogene C21 C18 Ring A aromat., C19 fliegt raus 5. Isoprenoidlipide aktives Isopren ohne Sterangerüstausbildung β - Carotin (Provitamin A) mit konjugierter Doppelbindung (DB) Vitamin A Vitamin K Vitamin E (=Retinal) ist notwendig für Verhornungsvorgänge der Haut und den Sehprozeß, kann während der Schwangerschaft bei Überdosis zu Mißbildungen führen. Leistung: Carboxylierung von AS-Resten im Proteinverband, d.h. der Carboxylgruppe das Wasserstoff zu entfernen (negativ) und z.B. mit Calcium (positiv) zu assoziieren Schutz der essentiellen AS vor Addition, da sie durch ihre DB sehr oxidiergefährdet sind Vitamin A, K, E, D („EDeKA“) kann man bis zur Pathologie überdosieren !!! Die Haupteigenschaft von Vitaminen ist ihre geringe Tagesdosis, die im µg – mg Bereich liegt. Nukleinsäuren – Nukleotide Datum: 02.02.99 Dozent: Hr. Breter Ein Nukleotid besteht aus 1. Phosphorsäure 2. Zucker a) Ribose H3PO4 O HO-H2C OH OH OH b) Desoxyribose O HO-H2C 1 OH OH 3. Base a) Purinbasen H N N 6 1 5 8 2 N b) Pyrimidinbasen N-H 3 4 Die Base und der Zucker sind über eine n – glykosidische Bindung verbunden. Biochem Propaedeutik Seite 25 von 30 9 5 2 N 4 3 N 7 6 1 Base + Zucker = Nukleosid Nukleosid + Phosphorsäure = Nukleotid Bei der Nomenkaltur muß man darauf achten, daß - Basenatome mit normalen Zahlen benannt werden - Zuckeratome mit Zahl‘ (z.B. 5‘, 3‘) benannt werden Purine - osin Pyrimidine - idin Nukleoside (Adenin) (Guanin) (Hypoxanthin) (Xanthin) (Uracil) (Cytosin) (Thymin) Adenosin Guanosin Inosin Xanthosin Uridin Cytidin Thymidin Nukleotide Nukleoside + Sitz der Phosphorsäure Nukleosid – 5‘ Phosphat Nukleosid – 3‘ Phosphat Nukleosid – 2‘ Phosphat (nur bei RNA) Purinbasen NH2 N N N O || N N N-H H-N N-H 6 – Amino – Purin Adenin H2 N 2 – Amino – 6 – Oxopurin Guanin NH || H2N – C – NH2 kein DNA / RNA - Baustein Guanidin (AS) Abbauprodukte der Purinbasen: O || N H-N O || N H-N O || N-H H-N =O N N-H 6 – Oxopurin Hypoxanthin kann in tRNA vorkommen O N-H N-H 2,6 – Dioxopurin Xanthin O N-H N-H 2,6,8 - Trioxopurin Harnsäure hohe Konzentration im Gewebe bei Gicht Pyrimidinbasen O || | H-N O N N-H 2,6 – Dioxopyrimidin Uracil Vorkommen nur in RNA Biochem Propaedeutik O || NH2 O N-H 2 – Oxo – 4 Aminopyrimidin Cytosin Seite 26 von 30 H-N O CH3 N-H 2,4 – Dioxo – 5 - Methylpyrimidin Thymin Nomenklatur der Nukleotide NH2 N N O || O- - P | O- Adenosin – 5‘ – Monophosphat AMP Adenosin – 3‘,5‘ – Bisphosphat Adenosin – 2‘,3‘,5‘ – Trisphosphat N N n-glykosilische Bindung O O-H2C NH2 OH OH | O=P–O | O- O || - P – O| O- N N N Adenosin – 5‘ – Diphosphat (Phosphorsäureanhydridbindung !) O O || || O -P -O–P | | OO- N O O-H2C NH2 N N O || O- - P | OH OH N N 3‘,5‘ – cyclisches AMP ( cAMP) intramolekulare Esterbildung zu einem Phosphorsäurediester O O-H2C OH H 2O OH OH Nukleinsäuren DNA Desoxyribonucleidacid RNA Vorkommen als mRNA hnRNA tRNA rRNA snRNA scRNA Vorkommen: Zellkern Mitochondrien Chloroblasten messenger RNA heterogene nucleäre RNA transfer RNA, 70 – 90 Nukleotide lang ribosomale RNA small nuclear RNA small cytosolic Viren kommen i.d.R. entweder als doppelsträngige (ds) DNA oder einsträngige (ss) RNA vor. Es gibt aber auch Viren mit ss DNA und ds RNA. Der Vorteil von RNA besteht darin, daß die Proteinsynthese direkt vom Genom geschieht hoch infiziös. Der Nachteil ist, daß das Genom erst umgeschrieben werden muß in die komplementäre RNA. Retroviren (z.B. HIV) schreiben ssRNA in DNA um und synthetisieren von der ssRNA. Biochem Propaedeutik Seite 27 von 30 um die Form der DNA zu erklären, hat Chargaff ihre molekularen Bestandteile in Verhältnisse gesetzt und dabei folgendes gefunden: Adenosin Thymidin = genau 1:1 T+A G+C Ergebnis schwankt Guanosin Cytosin = genau 1:1 Purine Pyrimidine = genau 1:1 Chargaff schloss daraus, daß sich je ein Purin mit einem Pyrimidin paart. Es paaren sich A T (bei RNA mit U) C G Struktur der DNA - Doppelhelix 1 Umdrehung der Helix sind 10 Basenpaare Prokaryont: E. coli ds DNA mit 4.000.000 Basenpaaren Eukayont: Hefe Drosophila homo sapiens Pflanzen 14.000.000 bp 180.000.000 bp 3.400.000.000 bp >3.000.000.000 bp NH2 N N N OH | O= P | OH N N N O O-H2C NH2 N O | O= P | OH RNA – Sequenz, AAA N NH2 OH N N O O-H2C N O | O= P | OH OH O O-H2C OH Vitamine Datum: 09.02.99 Dozent: Hr. Breter N OH Es gibt fettlösliche und wasserlösliche Vitamine. Bei allen Vitaminen kann es zu Mangelerscheinungen kommen (Hypovitaminose), nur die fettlöslichen können auch Hypervitaminosen hervorbringen. fettlösliche A, D, E, K wasserlösliche B – Komplex (B1, B2, B6, B12), C, H ♦ VITAMIN B1 Thiamin Thiamin NH2 Thiamindiphosphat Überführung in Coenzym CH2 CH3 CH3 CH2 – CH2 – OH S Biochem Propaedeutik Mangelerscheinung: Beri Beri N+ Mittel gegen Mücken: ½ g/Tag 3 Wochen vorher und während des Urlaubs Seite 28 von 30 ♦ VITAMIN B2 Riboflavin O N CH3 Isoalloxazol – Ring O N N | -C| - C – OH | Ribid - C – OH | - C – OH O O | || || - C – O - - P – O – P – O – CH2 | | | OO- CH3 Riboflavin (Alkohol des Zuckers) OH O Flavin Adenin Dinucleotid = FAD Adenin OH Mangelerscheinung: Pellagra (Hautveränderungen) Aufgabe von FAD: Substratwasserstofftransport ♦ VITAMIN B6 Pyridoxin / Pyridoxol CH2 OH HO CH2 – CH2 – OH Pyridoxol CH3 N H–C=O HO CH3 ♦ O || CH2 – CH2 – O – P – O| O- N Pyridoxalphosphat Aminostoffwechsel NH2 – Übertragung VITAMIN B12 Cobalamin, Extrinsic Factor Mangel: Perniciöse Anämie Megaloblasten – Anämie Aufnahme nur mit Hilfe des Intrinsic Factors (Glycoprotein der Magenschleimhaut) im unteren Ileum. Dosis: 1 – 3 µg / dies N Strukturformel: Corrin – Ring, zu schwer zum zeichnen N N C Biochem Propaedeutik Seite 29 von 30 C N C ♦ VITAMIN C Ascorbinsäure / χ-Lacton der L-Gulonsäure > 100 mg / dies Vitamin C schützt Fe2+, sodaß Fe2+ nicht zu Fe3+ oxidiert wird. Wird gebraucht zur Kollagen-, Adrenalin- und Steroidsynthese. Mangelerscheinung: Skorbut (Kollagenmangel) Überdosis: Durchfall (2 EL innerhalb 3 – 4 Std. kommt es zu Durchfall) ♦ VITAMIN H Biotin, wird von Avitin (kommt im Eiklar vor) gebunden und der Resorption im Magen entzogen Mangelerscheinungen: Hautveränderungen O O || C NH NH S ♦ Mangel || C – OH | H2 N – C – H | (CH2)4 | NH / C \\ O VITAMIN A - wichtig für den Sehvorgang, bei Mangel kommt es zur Nachtblindheit (Hemeralopie) - wichtig für die Embryonalentwicklung , da die Extremitätenausrichtung entlang eines Retinsäuregradienten verläuft, Vitamin A Überdosen stören diese und führen zu Mißbildungen Vitamin A wird zuerst als β-Carotin = Provitamin A aufgenommen, dann in zwei identische Moleküle gespalten und zu Vitamin A = Retinal. Daraus wird entweder durch Oxidation die Retinsäure oder es wird Rhodopsin in den Stäbchen daraus synthetisiert. Provitamin A O // C–H Vitamin A ♦ VITAMIN D Hypervitaminose: Verkalkungen überall s. Kapitel Steroidhormone ♦ VITAMIN E (= Tocopherol) Formel ist zu kompliziert Funktion: Schutz der ungesättigten Fettsäuren, Antioxidans H | C–C=C–H | H ♦ -- // --> O–O | | C – C – C – H Peroxid | | H H VITAMIN K (=Menadion) überträgt CO2 – Gruppen auf Reste der Glutaminsäure Blutgerinnung, Knochenmineralisierung Biochem Propaedeutik Seite 30 von 30