5.5.2 - IOC
Werbung

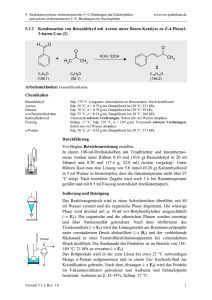
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen 5.5.2 www.ioc-praktikum.de 1,4-Addition von Phenylmagnesiumbromid an Crotonsäure-(2,2-dimethylpropyl)-ester zum 3-Phenyl-butansäure-(2,2-dimethylpropyl)ester (2) C6H5Br + O O Diethylether C6H5MgBr (24.3) (157.0) H3C Mg C(CH3)3 H3C + C6H5MgBr O C(CH3)3 O 2 C9H16O2 (156.2) C15H22O2 (234.3) Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Destillation Chemikalien Brombenzol Sdp. 156 °C, d = 1.50 g/ml, Dampfdruck bei 20 °C: 4 hPa. Crotonsäure-2,2Sdp. 65–66 °C/16 hPa. Wird in Versuch 4.2.1.2 hergestellt. dimethylpropylester Magnesiumspäne, Diethylether Siehe allgemeine Arbeitsvorschrift 4.3.2. Durchführung Vor Beginn Betriebsanweisung erstellen. Nach der allgemeinen Arbeitsvorschrift 4.3.2 wird in einem 250 ml Dreihalskolben mit Rückflusskühler und Trockenrohr, Tropftrichter und KPG-Rührer eine Grignard-Lösung aus 50 mmol (7.85 g, 5.2 ml) Brombenzol, 50 mmol (1.22 g) Magnesiumspänen und 50 ml trockenem Diethylether bereitet.1 Die Lösung wird auf –10 °C gekühlt, bei dieser Temperatur werden innerhalb von 30 min. 30 mmol (4.69 g, 5.4 ml) Crotonsäure-2,2-dimethylpropylester2 in 30 ml Diethylether zugetropft. Nach beendeter Zugabe wird noch 1 h bei –10 °C gerührt. Isolierung und Reinigung Die Reaktionslösung wird unter kräftigem Rühren in ein 600 ml Becherglas auf ein Gemisch aus 100 g Eis, 10 ml Diethylether und 10 ml konz. Salzsäure gegeben. Die organische Phase wird in einem Scheidetrichter abgetrennt, die wässrige Phase wird noch dreimal mit je 15 ml Diethylether extrahiert (→ E1). Die vereinigten organischen Phasen werden mit 10 ml gesättigter Natriumcarbonatlösung (→ E1) und mit 10 ml Wasser gewaschen (→ E1), anschließend über Magnesiumsulfat getrocknet. Nach dem Filtrieren (→ E2) wird das Lösungsmittel am Rotationsverdampfer abdestilliert (→ R1). Versuch 5.5.2, Rev. 1.0 1 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de Der Rückstand wird in einer kleinen Destillationsapparatur mit Spinne und tarierten Vorlagekölbchen im Vakuum fraktionierend destilliert. Man führe ein Destillationsprotokoll und bestimme Menge und Brechungsindizes der erhaltenen Fraktionen, die bei gleichem Brechungsindex vereinigt werden (→ E3). Das Reinprodukt 2 kristallisiert langsam bei Raumtemperatur. Ausbeute an 2: 40–45%, Sdp. 79–82 °C/ 0.1 hPa, Schmp. 33–35 °C. 1 2 Warum müssen trockene Lösungsmittel verwendet werden? Weshalb setzt man nicht Crotonsäuremethyl- oder ethylester ein? Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel E1: Wässrige Phasen mit Spuren von halogenhaltigen organischen Verbindungen → Entsorgung (H2O mit RHal/Halogenid). E2: Trockenmittel → Entsorgung (Anorg. Feststoffe). E3: Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton lösen → Entsorgung (RH). R1: Abdestilliertes Lösungsmittel → Recycling (Diethylether). Auswertung des Versuchs H-NMR-Spektrum von 2 (300 MHz, CDCl3): δ = 0.88 (9 H), 1.33 (3 H), 2.63 (2 H), 3.30 (1 H), 3.72 (2 H), 7.15–7.34 (5 H). b) a) b) a) 8.0 7.0 6.0 401.2 Hz 394.4 Hz 815.1 Hz 807.9 Hz 800.3 Hz 793.1 Hz 787.4 Hz 779.4 Hz 772.6 Hz 764.3 Hz 1009.9 Hz 1002.8 Hz 995.4 Hz 988.0 Hz 980.8 Hz 973.7 Hz 1 5.0 4.0 3.0 1.0 2.0 [ppm] 0.0 C-NMR Spektrum von 2 (75.5 MHz, CDCl3): δ = 22.07 (CH3), 26.40 (CH3), 31.20 (C), 36.62 (CH), 43.00 (CH2), 73.78 (CH2), 126.41 (CH), 126.77 (CH), 128.53 (CH), 145.74 (C), 172.60 (C). 13 LM 180 160 Versuch 5.5.2, Rev. 1.0 140 120 100 80 60 40 20 [ppm] 0 2 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de IR-Spektrum von 2 (Film): 100 T [%] 3065 3030 2870 50 1605 2960 1735 0 4000 3000 2000 1500 1000 ~ [cm-1] ν * Formulieren Sie den zu 2 führenden Reaktionsmechanismus. Weitere denkbare Reaktionsprodukte: Ph H3C O A Ph H3C Ph O B Ph H3C HO Ph C * Mit welchen spektroskopischen Daten lassen sich A–C ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A und B? Literatur, allgemeine Anwendbarkeit der Methode Die 1,4-Addition von RMgX und RLi an α,β-ungesättigte Ketone steht in Konkurrenz zur normalen 1,2Addition (siehe Einführung zu Kap. 5.5). Bei sterischer Abschirmung der Carbonylgruppe wird die 1,4-Addition begünstigt.[1] Aldehyde reagieren daher ausschließlich unter 1,2-Addition. Li-Cuprate (LiCuR2) reagieren ausschließlich unter 1,4-Addition. [1] S.R. Jensen, A.M. Kristiansen, J. Munch-Petersen, Acta Chem. Scand. 1970, 24, 2641–2647; T. KindtLarsen, V. Bitsch, A. Krogh, G. Inger, A. Jart, J. Munch-Petersen, Acta Chem. Scand. 1963, 17, 1426–1432. Versuch 5.5.2, Rev. 1.0 3


![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)