O - IOC-Praktikum
Werbung
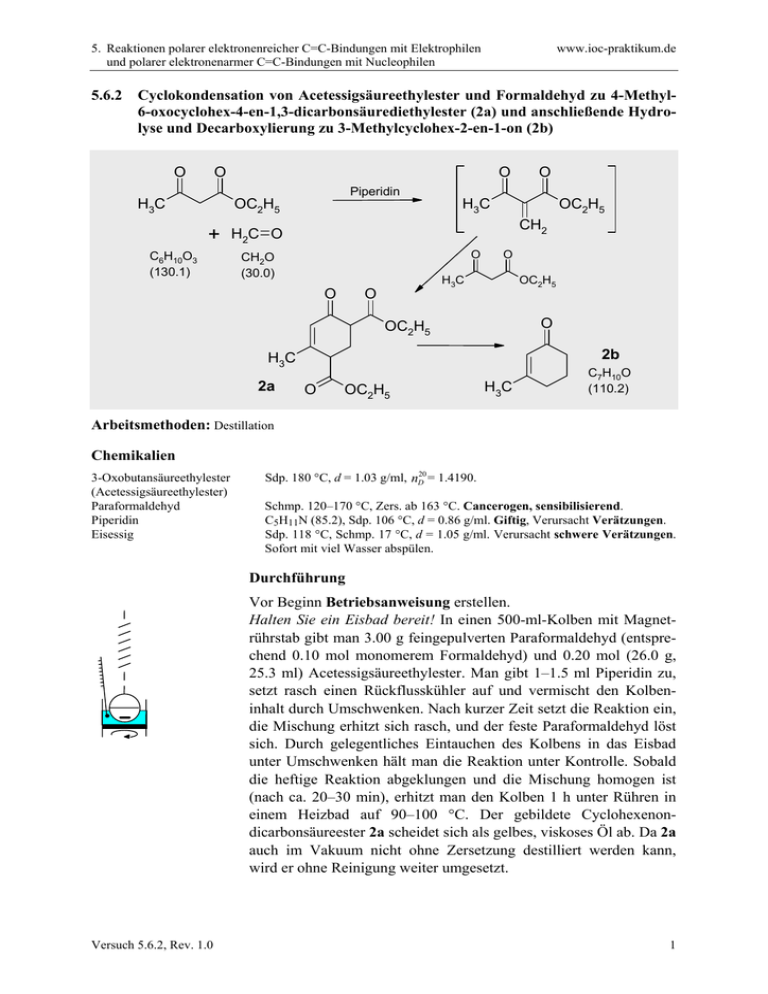
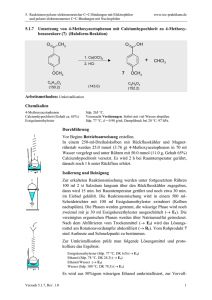
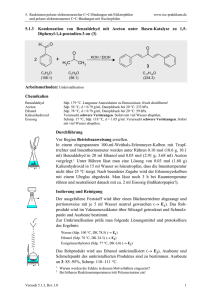
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen 5.6.2 www.ioc-praktikum.de Cyclokondensation von Acetessigsäureethylester und Formaldehyd zu 4-Methyl6-oxocyclohex-4-en-1,3-dicarbonsäurediethylester (2a) und anschließende Hydrolyse und Decarboxylierung zu 3-Methylcyclohex-2-en-1-on (2b) O O O O Piperidin H3C OC2H5 + C6H10O3 (130.1) H3C OC2H5 CH2 H2C O O CH2O (30.0) O O OC2H5 H3C O O OC2H5 2b H3C 2a O OC2H5 H3C C7H10O (110.2) Arbeitsmethoden: Destillation Chemikalien 3-Oxobutansäureethylester (Acetessigsäureethylester) Paraformaldehyd Piperidin Eisessig Sdp. 180 °C, d = 1.03 g/ml, nD20 = 1.4190. Schmp. 120–170 °C, Zers. ab 163 °C. Cancerogen, sensibilisierend. C5H11N (85.2), Sdp. 106 °C, d = 0.86 g/ml. Giftig, Verursacht Verätzungen. Sdp. 118 °C, Schmp. 17 °C, d = 1.05 g/ml. Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen. Durchführung Vor Beginn Betriebsanweisung erstellen. Halten Sie ein Eisbad bereit! In einen 500-ml-Kolben mit Magnetrührstab gibt man 3.00 g feingepulverten Paraformaldehyd (entsprechend 0.10 mol monomerem Formaldehyd) und 0.20 mol (26.0 g, 25.3 ml) Acetessigsäureethylester. Man gibt 1–1.5 ml Piperidin zu, setzt rasch einen Rückflusskühler auf und vermischt den Kolbeninhalt durch Umschwenken. Nach kurzer Zeit setzt die Reaktion ein, die Mischung erhitzt sich rasch, und der feste Paraformaldehyd löst sich. Durch gelegentliches Eintauchen des Kolbens in das Eisbad unter Umschwenken hält man die Reaktion unter Kontrolle. Sobald die heftige Reaktion abgeklungen und die Mischung homogen ist (nach ca. 20–30 min), erhitzt man den Kolben 1 h unter Rühren in einem Heizbad auf 90–100 °C. Der gebildete Cyclohexenondicarbonsäureester 2a scheidet sich als gelbes, viskoses Öl ab. Da 2a auch im Vakuum nicht ohne Zersetzung destilliert werden kann, wird er ohne Reinigung weiter umgesetzt. Versuch 5.6.2, Rev. 1.0 1 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de Man mischt in einem 250-ml-Erlenmeyer-Kolben 60 ml Eisessig und 40 ml Wasser und gibt vorsichtig 6 ml konz. Schwefelsäure zu. Diese Mischung gießt man durch den Rückflusskühler in den Kolben, setzt einen Blasenzähler auf den Rückflusskühler und erhitzt die Mischung bis zum Ende der Gasentwicklung (5 h, längeres Erhitzen, zum Beispiel über Nacht, schadet nicht). Isolierung und Reinigung Man kühlt die Mischung unter Rühren in einem Eisbad. Der Rückflusskühler wird durch einen Tropftrichter mit Druckausgleich ersetzt und die Mischung durch Zutropfen von kalter, 30proz. Natronlauge neutralisiert.1 Man überführt in einen Scheidetrichter, spült den Kolben zweimal mit je 50 ml tert-Butylmethylether nach und trennt die organische Phase ab. Die wässrige Phase wird noch zweimal mit je 100 ml tert-Butylmethylether extrahiert (→ E1). Die vereinigten organischen Phasen wäscht man mit Wasser, bis das letzte Waschwasser neutral reagiert (etwa 3 x 50 ml) (→ E1) und trocknet über Natriumsulfat. Nach dem Abfiltrieren vom Trockenmittel (→ E2) wird das Lösungsmittel am Rotationsverdampfer bei vermindertem Druck abdestilliert (→ R1) und das zurückbleibende ölige Rohprodukt in eine kleine Destillationsapparatur mit Spinne und tarierten Vorlagekölbchen überführt. Fraktionierende Destillation bei vermindertem Druck ergibt nach einem Vorlauf 2b als Öl, (Destillationsrückstand → E3). Ausbeute an 2b: 40–50%, Sdp. 76– 78 °C/23 hPa. 1 Wieviel mol Natriumhydroxid werden für die Neutralisation der Essigsäure und Schwefelsäure benötigt? Berechnen Sie die Menge und stellen Sie nur soviel von der 30 proz. Natriumhydroxid-Lösung her, wie Sie benötigen! Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel E1: E2: E3: R 1: Wässrige Phasen mit organischen Verunreinigungen → Entsorgung (H2O mit RH). Trockenmittel → Entsorgung (Anorg. Feststoffe). Destillationsrückstand in wenig Aceton lösen → Entsorgung (RH). Abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether). Auswertung des Versuchs H-NMR-Spektrum von 2 (300 MHz, CDCl3): δ = 1.84–1.95 (2 H), 1.89 (3 H), 2.16–2.28 (4 H), 5.78 (1 H). 1 2.5 6.0 2.0 5.0 Versuch 5.6.2, Rev. 1.0 4.0 3.0 2.0 1.0 [ppm] 0.0 2 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de C-NMR Spektrum von 2 (75.5 MHz, CDCl3): δ = 22.50 (CH2), 24.42 (CH3), 30.88 (CH2), 36.93 (CH2), 126.55 (CH), 162.91 (C), 199.74 (C). 13 LM 220 200 180 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 2 (Film): 100 T [%] 3030 2825 50 2870 2940 1635 1670 0 4000 3000 2000 1500 -1 ~ ν [cm ] 1000 * Formulieren Sie den zu 2 führenden Reaktionsmechanismus. Weitere denkbare Reaktionsprodukte: O H3C O O H3C HOH2C H O OC2H5 A O H3C OC2H5 HOH2C CH2OH B O H H OC2H5 H3C O O OC2H5 O C O H3C OC2H5 O O O OC2H5 D * Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A–D ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A–C? Literatur, allgemeine Anwendbarkeit der Methode Diese Kondensation eröffnet einen weiteren Zugang zu funktionalisierten Cyclohexan-Derivaten. Die selektive Abspaltung der Ethoxycarbonyl-Gruppe in β-Stellung zur Ketogruppe des Cyclohexenondicarbonsäureesters mit Natriumethanolat ergibt den sogenannten Hagemann Ester, eine Ausgangsverbindung für Naturstoff-Synthesen. Literatur, auf der dieser Versuch beruht: L. I. Smith, G. F. Rouault, J. Am. Chem. Soc. 1943, 65, 631–635. Versuch 5.6.2, Rev. 1.0 3
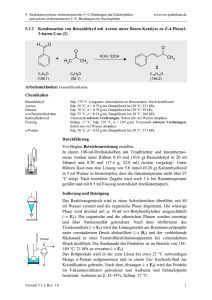

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)