3 - IOC-Praktikum
Werbung

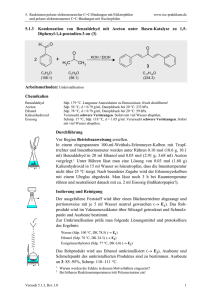
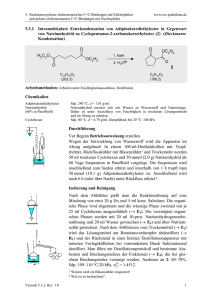
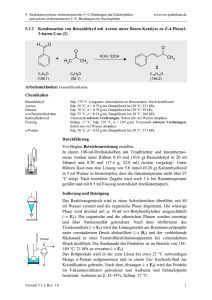
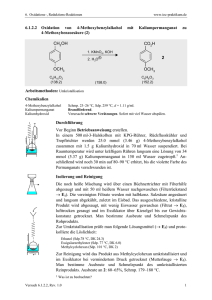
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen 5.1.7 www.ioc-praktikum.de Umsetzung von 4-Methoxyacetophenon mit Calciumhypochlorit zu 4-Methoxybenzoesäure (7) (Haloform-Reaktion) O CH3 O OH 1. Ca(OCl)2 + 2. HCl 7 OCH3 C9H10O2 (150.2) (143.0) CHCl3 OCH3 C8 H 8 O 3 (152.2) Arbeitsmethoden: Umkristallisation Chemikalien 4-Methoxyacetophenon Calciumhypochlorit (Gehalt ca. 65%) Essigsäureethylester Sdp. 265 °C. Verursacht Verätzungen. Sofort mit viel Wasser abspülen. Sdp. 77 °C, d = 0.90 g/ml, Dampfdruck bei 20 °C: 97 hPa. Durchführung Vor Beginn Betriebsanweisung erstellen. In einem 250-ml-Dreihalskolben mit Rückflusskühler und Magnetrührstab werden 25.0 mmol (3.76 g) 4-Methoxyacetophenon in 70 ml Wasser vorgelegt und unter Rühren mit 50.0 mmol (11.0 g, Gehalt 65%) Calciumhypochlorit versetzt. Es wird 2 h bei Raumtemperatur gerührt, danach noch 1 h unter Rückfluss erhitzt. Isolierung und Reinigung Zur erkalteten Reaktionsmischung werden unter fortgesetztem Rühren 100 ml 2 M Salzsäure langsam über den Rückflusskühler zugegeben, dann wird 15 min. bei Raumtemperatur gerührt und noch etwa 30 min. im Eisbad gekühlt. Die Reaktionsmischung wird in einem 500 mlScheidetrichter mit 100 ml Essigsäureethylester extrahiert (Kolben nachspülen). Die Phasen werden getrennt, die wässrige Phase wird noch zweimal mit je 30 ml Essigsäureethylester ausgeschüttelt (→ E1). Die vereinigten organischen Phasen werden über Natriumsulfat getrocknet. Nach dem Abfiltrieren vom Trockenmittel (→ E2) wird das Lösungsmittel am Rotationsverdampfer abdestilliert (→ R1). Vom Rohprodukt 7 sind Ausbeute und Schmelzpunkt zu bestimmen. Zur Umkristallisation prüfe man folgende Lösungsmittel und protokolliere das Ergebnis: Essigsäureethylester (Sdp. 77 °C, DK 6.0) (→ E4) Ethanol (Sdp. 78 °C, DK 24.3) (→ E4) Ethanol/Wasser (→ E3) Wasser (Sdp. 100 °C, DK 78.5) (→ E3) Es wird aus 50%igem wässrigen Ethanol umkristallisiert, zur VervollVersuch 5.1.7, Rev. 1.0 1 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de ständigung der Kristallisation muss etwa 1 h im Eisbad gekühlt werden. Nach dem Absaugen (→ E3) und Trocknen im Vakuumexsikkator über Silicagel sind Ausbeute und Schmelzpunkt zu bestimmen. Ausbeute an 7: 80%, Schmp. 184–185 °C. Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel E1: E2: E3: E4: R 1: Wässrige halogenhaltige Phase mit organischen Resten → Entsorgung (H2O mit RHal/Halogenid). Trockenmittel → Entsorgung (Anorg. Feststoffe). Wässrige Mutterlauge → Entsorgung (H2O mit RH). Organische Mutterlaugen → Entsorgung (RH). Abdestilliertes Lösungsmittel → Recycling (Essigsäureethylester). Auswertung des Versuchs H-NMR-Spektrum von 7 (300 MHz, DMSO-d6): δ = 3.81 (3 H), 6.97–7.07 (2 H), 7.83–7.95 (2 H), 12.63 (1 H). 1 7.0 8.0 14.0 12.0 10.0 8.0 6.0 4.0 2.0 [ppm] 0.0 C-NMR Spektrum von 7 (75.5 MHz, DMSO-d6): δ = 55.29 (CH3), 113.68 (CH), 122.85 (C), 131.23 (CH), 162.72 (C), 166.91 (C). 13 LM 200 180 160 Versuch 5.1.7, Rev. 1.0 140 120 100 80 60 40 20 [ppm] 0 2 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de IR-Spektrum von 7 (KBr): 100 T [%] 50 3025 0 4000 2940 2980 1685 3000 2000 1605 1500 1000 -1 ~ ν [cm ] * Formulieren Sie den zu 7 führenden Reaktionsmechanismus. Weitere denkbare Reaktionsprodukte: CH2Cl O CCl3 O CH3 O OCH3 OCH3 OCH2Cl A B C CH2Cl O OCH2Cl D * Mit welchen spektroskopischen Daten lassen sich A–D ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Siehe Einführung Kap. 5.1. Die Haloform-Reaktion wird meist mit Natriumhypochlorit durchgeführt.[1] Der Gehalt wässriger NaOCl-Lösungen nimmt bei der Lagerung langsam ab, deshalb wird hier das stabile Calciumhypochlorit eingesetzt [1] Siehe z.B. M. S. Newman, H. L. Holmes in Organic Syntheses Coll. Vol. 2 (Hrsg. A.H. Blatt), J. Wiley & Sons, New York, 1943, S. 428–430. Versuch 5.1.7, Rev. 1.0 3




![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)