5.1.3: 1,5-Diphenyl-1,4-pentadien-3-on - IOC
Werbung

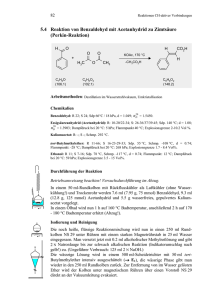
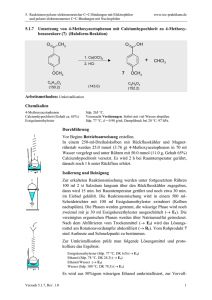
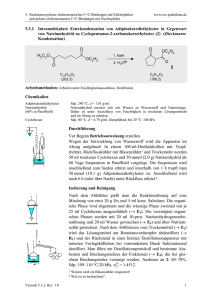
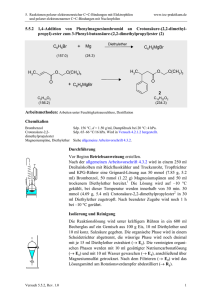
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen 5.1.3 www.ioc-praktikum.de Kondensation von Benzaldehyd mit Aceton unter Basen-Katalyse zu 1,5Diphenyl-1,4-pentadien-3-on (3) H O O O + 2 C7H6O (106.1) KOH / EtOH H3C CH3 C3H6O (58.1) 3 C17H14O (234.3) Arbeitsmethoden: Umkristallisation Chemikalien Benzaldehyd Aceton Ethanol Kaliumhydroxid Eisessig Sdp. 179 °C. Langsame Autoxidation zu Benzoesäure, frisch destillieren! Sdp. 56 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 233 hPa. Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 59 hPa. Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen. Schmp. 17 °C, Sdp. 118 °C, d = 1.05 g/ml. Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen. Durchführung Vor Beginn Betriebsanweisung erstellen. In einem eingespannten 100-ml-Weithals-Erlenmeyer-Kolben mit Tropftrichter und Innenthermometer werden unter Rühren 0.10 mol (10.6 g, 10.1 ml) Benzaldehyd in 20 ml Ethanol und 0.05 mol (2.91 g, 3.68 ml) Aceton vorgelegt.1 Unter Rühren lässt man eine Lösung von 0.03 mol (1.68 g) Kaliumhydroxid in 15 ml Wasser so hinzutropfen, dass die Innentemperatur nicht über 25 °C steigt. Nach beendeter Zugabe wird der Erlenmeyerkolben mit einem Uhrglas abgedeckt. Man lässt noch 3 h bei Raumtemperatur rühren und neutralisiert danach mit ca. 2 ml Eisessig (Indikatorpapier!). Isolierung und Reinigung Der ausgefallene Feststoff wird über einen Büchnertrichter abgesaugt und portionsweise mit je 5 ml Wasser neutral gewaschen (→ E1). Das Rohprodukt wird im Vakuumexsikkator über Silicagel getrocknet und Schmelzpunkt und Ausbeute bestimmt. Zur Umkristallisation prüfe man folgende Lösungsmittel und protokolliere das Ergebnis: Wasser (Sdp. 100 °C, DK 78.5) (→ E1) Ethanol (Sdp. 78 °C, DK 24.3) (→ E2) Essigsäureethylester (Sdp. 77 °C, DK 6.0) (→ E2) Das Rohprodukt wird aus Ethanol umkristallisiert (→ E2), Ausbeute und Schmelzpunkt des umkristallierten Produktes sind zu bestimmen. Ausbeute an 3: 85–95%, Schmp. 110–111 °C. 1 2 Versuch 5.1.3, Rev.1.0 Warum werden die Edukte in diesem Molverhältnis eingesetzt? Bei höheren Reaktionstemperaturen tritt Polymerisation ein! 1 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de Hinweise zur Entsorgung (E) E1: Wässrige Lösung mit Spuren von organischen Verbindungen → Entsorgung (H2O mit RH). E2: Mutterlauge mit organischen Verunreinigungen → Entsorgung (RH). Auswertung des Versuchs H-NMR-Spektrum von 3 (300 MHz, CDCl3): δ = 7.10 (2 H), 7.35–7.48 (6 H), 7.57–7.68 (4 H), 7.75 (2 H). 2137.9 Hz 2121.0 Hz 2334.9 Hz 2319.0 Hz 1 LM 8.0 7.0 6.0 5.0 [ppm] 4.0 C-NMR Spektrum von 3 (75.5 MHz, CDCl3): δ = 125.43 (CH), 128.46 (CH), 129.02 (CH), 130.58 (CH), 134.79 (C), 143.38 (CH), 188.98 (C). 13 LM 200 180 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 3 (KBr): 100 T [%] 3025 3050 3085 50 1665 0 4000 3000 2000 1575 1605 1500 1000 -1 ~ ν [cm ] * Formulieren Sie den zu 3 führenden Reaktionsmechanismus. * Vergleichen Sie das Ergebnis dieses Versuchs mit dem von Versuch 5.1.2. Versuch 5.1.3, Rev.1.0 2 5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen und polarer elektronenarmer C=C-Bindungen mit Nucleophilen www.ioc-praktikum.de Weitere denkbare Reaktionsprodukte: O HO O CH3 OH O CH3 CH3 A B C O CH3 D * Mit welchen spektroskopischen Daten lassen sich A–D ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Literatur, auf der dieser Versuch beruht: [1–2]. Die baseninduzierte gemischte Aldolkondensation mit einer Carbonylverbindung, die keine α-CH besitzt und nur als elektrophile Komponente reagieren kann, hat generelle präparative Bedeutung. [1] C.R. Conard, M.A. Dolliver in Organic Syntheses Coll. Vol. 2 (Hrsg. A.H. Blatt), J. Wiley & Sons, New York, 1943, S. 167–169. [2] B. L. Hawbecker, D.W. Kurtz, T.D. Putnam, P.A. Ahlers, G.D. Gerber, J. Chem. Educ. 1978, 55, 540–541. Versuch 5.1.3, Rev.1.0 3
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)