Kein Folientitel
Werbung

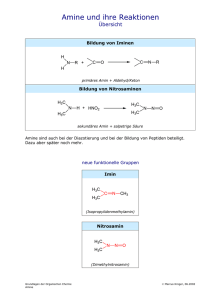
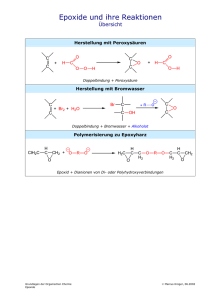
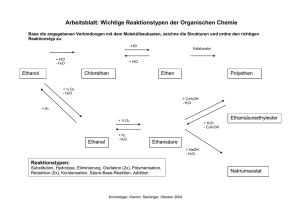
Chemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil 11: 22.12.2004) MILESS: Chemie für Biologen 198 Beispiele für die nucleophile Substitution Nu + geladenes Nucleophil R X Halogenalkan R Nu + X (X = Cl, Br, I) HO R OH Alkohol R O R O R Ether R S R S R Thioether R I Iodalkan I X H Nu + neutrales Nucleophil H O H R - Halogenid R X R Nu H X -H X R X - Halogenalkan R Nu R OH O R O R H H3 N R NH2 prim. RNH2 R NHR sek. R2 N R NR2 tert. H Amine 199 Eliminierungsreaktion Als Konkurrenz zur nucleophilen Substitution wird die 1,2- oder βEliminierung beobachtet. (Jedes Nucleophil ist eine Base!) Auch diese kann monomolekular (E1) oder bimolekular (E2) auftreten. Dabei werden C,C-Mehrfachbindungen gebildet. Es handelt sich um die Umkehrung der elektrophilen Addition. H H H3C C CH2 H3C CH X Base - HX H3C H CH3 + H3C H 2-Methyl-2-buten Saytzeff-Produkt H3C H3C H H H 3-Methyl-1-buten Hofmann-Produkt Das Verhältnis von Saytzeff und Hofmann-Produkt hängt vom jeweiligen Reaktionssystem und von den Reaktionsbedingungen ab. Normalerweise überwiegt das thermodynamisch stabilere SaytzeffProdukt. 200 Carbonylverbindungen: Aldehyde O R = H, Alkyl, Aryl Name: alcoholus dehydrogenatus: der Aldehyd R C H Carbonyl-Gruppe Polare CO-Doppelbindung: Beispiele: δ+ δC O sp2 (planar) O O HC H3C C H Formaldehyd Methanal H Acetaldehyd Ethanal O H3C CH2 C H H Propionaldehyd Propanal O C Bindungsenergie [kJ/mol] C−O 351 C=O 707 C−C 348 C=C 595 O H3C CH2 CH2 C H Butyraldehyd Butanal O C H Salicylaldehyd (o-Hydroxybenzaldehyd) OH Benzaldehyd 201 Carbonylverbindungen: Ketone R1 R2 C O R1, R2 = Alkyl, Aryl ≠ H O H 3 C C CH 3 Aceton Propanon H3C CH2 O C O C CH3 Ethylmethylketon Butanon CH 3 Methylphenylketon Acetophenon O O O Cyclohexanon Campher (Kampfer) O Progesteron Steroid-Hormon 202 Addition von Nucleophilen an die C=O-Gruppe Eine der wichtigsten Reaktionen der organischen Chemie und der Biochemie δ+ δC O H H C OH C O H Nu H Nu Beispiele: R1 R2 C O Nu + H 2O R1 (H+) R2 + ROH R1 (H+) R2 Aldehyd: Keton: H O Hydroxyaldehyd: OH C Hydrat (meist nur in wässriger Lösung stabil) OH OH C OR + ROH R1 (H+) R2 Halbacetal Halbketal H C O (H+) OR + H 2O C OR Acetal Ketal O OH Cyclisches Halbacetal bei Zuckern: Furanosen und Pyranosen 203 Addition von primären Aminen an Ketone R1 R2 NH 2 R C O + O C NH 2 R R2 R1 Nucleophil R1 Halbaminal + NH 2 OH R2 C N R Imin - H 2O Cyclohexanonoxim (Ausgangsprodukt für Nylon6) Cyclohexanon Hydroxylamin O R O R - H2O O + H2N Retinal R1 N OH O H OH - H 2O C NH R R2 N H NH blau: Polypeptidkette Aminosäure Lysin des Proteins Opsin (Vgl. Folie 164) NH Rhodopsin Sehpurpur 204 Aldol-Kondensation 2 H3C C O OH OH (kat.) H3C CH CH 2 C H O - H 2O H3C CH CH C H 2-Butenal Crotonaldehyd 2-Hydroxybutanal Acetaldol Ethanal Acetaldehyd H C C O OH(-) - (-) C H(+) H O O C C C H O H (-) Enolat-Ion = C-Nucleophil H α-Deprotonierung C nucleophile Addition O C C H O - H2O C C O H H α,β-ungesättigte Aldol-Kondensation Carbonyl-Verbindung O H2O + H(+) C C O H O Aldol-Addition Eine sehr wichtige Reaktion zum Aufbau von Kohlenstoff-Gerüsten. 205 Carbonylverbindungen: Carbonsäuren O R H O C C O H Bildung von Dimeren über Wasserstoffbrückenbindungen ⇒ hohe Siedepunkte ⇒ relativ gute Wasserlöslichkeit (bis Buttersäure) R O Siedepunkt R C O OH O H C OH O H3C C OH O H3C CH2 C OH O H3C CH2 CH2 C OH Ameisensäure (Methansäure) 101°C Essigsäure (Ethansäure) 118°C Propionsäure (Propansäure) 141°C Buttersäure (Butansäure) 164°C 206 Dicarbonsäuren Gesättigte Dicarbonsäuren O O O C C C CH2 C OH HO HO Oxalsäure O O O C CH2 CH2 C OH HO OH Bernsteinsäure Malonsäure Ungesättigte Dicarbonsäuren OH O C O O OH C C C H H (Z)-2-Butendisäure Maleinsäure HO H C C C H C OH O (E)-2-Butendisäure Fumarsäure 207 Fettsäuren Gesättigte Fettsäure Stearinsäure Octadecansäure 1 COOH 18 Ungesättigte Fettsäuren H 9 H 10 8 11 6 7 12 13 4 5 14 H 9 2 1 3 COOH 15 16 17 1 COOH H 12 18 18 H H Ölsäure (Z)-9-Octadecensäure Linolsäure (Z,Z)-9,12-Octadecadiensäure 1 H 9 COOH 18 H 12 H 15 H H H Linolensäure (Z,Z,Z)-9,12,15-Octadecatriensäure 208 Dissoziation von Carbonsäuren O R C O H O + H2O R C R C O O + H3O mesomeres Carboxylat-Anion (Ladung ist delokalisiert) Beispiele: O O H C pKS O OH Ameisensäure 3.8 H3C C OH Essigsäure 4.8 Vergleich mit Alkoholen: R O H + H2O pKS ≈ 15 - 16 O H3C CH 2 C OH Propionsäure 4.9 R O + H3O Alkoholat-Anion (Ladung ist lokalisiert) Carbonsäuren sind wesentlich stärkere Säuren als Alkohole. 209 Carbonsäuren mit zusätzlichen funktionellen Gruppen α O H3C CH C OH OH α-Hydroxycarbonsäure Milchsäure chiral O α O β H3C C CH2 C OH β-Ketosäure Acetessigsäure α α O R CH C OH NH 2 H 3C C C OH O α-Aminocarbonsäure: Aminosäure R ≠ H: chiral R = H: achiral: Glycin O C H α-Ketosäure Brenztraubensäure Pyruvat O O C O O OH C O C CH 2 CH CH 2 C OH H3C β Cα OH HO OH H Citronensäure Enolform 3-Carboxy-3-hydroxypentandisäure, eine Hydroxytricarbonsäure 210 Nucleophile Substitution an der Carbonyl-Gruppe δ+ R C δO + Nu X sp2 O R C X Nu sp 3 R C O + X Nu sp2 • Es handelt sich um einen Additions-Eliminierungs-Mechanismus. • Die Reaktion kann durch Säuren katalysiert werden: Protonen-Katalyse Darstellung von Carbonsäurechloriden Es entstehen nur gasförmige Nebenprodukte. R C O OH + SOCl2 Thionylchlorid R C O Cl + SO 2 + HCl 211 Reaktionen von Säurechloriden + H2 O R C O + HCl OH R´ OH R C O Cl H2 N R´ R C O + HCl O R´ Ester R C O + HCl NH R´ Amid R C O O Na O O R C O C R + Na Cl Anhydrid Säurechloride sind reaktive Acylierungs-Reagenzien. 212 Carbonsäureanhydride H3C C O O O C O H3C C O Essigsäureanhydrid Acetanhydrid C OH OH C Phthalsäure C ∆T - H2O ∆T - H2O O O Phthalsäureanhydrid O O H3C C OH OH Salicylsäure + H3C C O O O Maleinsäureanhydrid O Synthese von Aspirin O C Maleinsäure O O O OH OH O C OH O + H3C C O C CH 3 Ester O Acetylsalicylsäure ASS OH 213 Carbonsäureester Veresterung von Carbonsäuren O + R´ OH R C O H + H OH R C OH O R´ Gleichgewichtsreaktion: Das Gleichgewicht lässt sich durch Abdestillieren von H2O zur Ester-Seite verschieben. Die Reaktion wird durch starke Säuren katalysiert. Eigenschaften von Carbonsäureestern Einfache Ester sind in der Regel flüssig und haben relativ niedrige Siedepunkte. Z.B. CH3-CO2-C2H5 (“Essigester”): Sdp. 77° C, Schmp. –84° C. Sie sind in Wasser nicht löslich. Verwendung als Lösungsmittel (Lacke). Ester besitzen einen angenehm fruchtartigen Geruch. Sie sind Aroma- und Duftstoffe. Sie kommen verbreitet in Pflanzen, Blüten und Früchten vor. Ester Aroma Ester Ameisensäureethylester Rum Aroma Buttersäuremethylester Apfel Essigsäure-n-butylester Orange Buttersäureethylester Ananas Essigsäureisobutylester Banane Buttersäureisoamylester Birne 214 Verseifung von Estern Ester-Hydrolyse (Verseifung) O + Na OH R C O R´ O O Na + OH O R C OR´ OH + HO R´ R C Neutralisation O R C + OH Säure + O R´ Base Mechanismus: Nucleophile Substitution Seife: Alkali-Salz einer Fettsäure 215 Fette und Seifen Na + -OOC R CH 2 OH CH 2 O C R O CH O C R´ + 3 NaOH O CH 2 O C R´´ O Fett (Triglycerid) CH OH ++ Na OOC R´ Na + -OOC R´´ CH 2 OH Glycerin Seife COO(-) Na (+) hydrophil Lipophil bzw. hydrophob O 2 R C O 2 Na O wasserlöslich + Ca 2+ R C O Ca 2+ + 2 Na+ 2 wasserunlöslich In "hartem" Wasser sind Seifen unwirksam. Waschmittel und Detergenzien enthalten lineare, unverzweigte Alkansulfonate, die biologisch abbaubar sind. Die Salze reagieren neutral ⇒ Neutralseife SO3 K+ Ca2+- und Mg2+- Salze sind wasserlöslich.216 Wirkung von Tensiden Mizelle Fett unlöslich in H2O Seife löslich in H2O Fett 217 löslich gemacht mit Seife in H2O