2 Elementaranalyse zur Bestimmung der Verhältnisformeln
Werbung

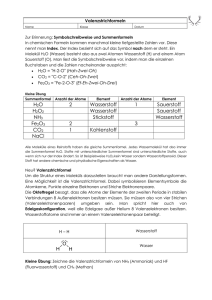
24 Analytisch-praktische Arbeitstechniken und Anwendungsbeispiele 2 Elementaranalyse zur Bestimmung der Verhältnisformeln organischer Verbindungen 2.1 Verhältnis-, Molekül- und Strukturformel Im vorangegangenen Abschnitt wurden einfache Methoden zur Identifizierung organischer Verbindungen vorgestellt. In der Laborpraxis und v. a. bei der Untersuchung neu entdeckter Verbindungen reichen diese oft nicht aus. Benötigt werden zusätzliche Verfahren, mit deren Hilfe Verhältnisformeln, Molekülformeln und zuletzt auch Strukturformeln bestimmt werden können. Die Verhältnisformel gibt nur das Atomzahlverhältnis in den Molekülen der Verbindung an. Der Molekülformel lässt sich die Anzahl der Atome in den Teilchen der Substanz entnehmen und die Strukturformel zeigt schließlich, wie diese Atome miteinander verknüpft sind. Eindeutig identifiziert ist eine Substanz nur dann, wenn auch ihre Strukturformel bekannt ist. Was man unter diesen Formeln versteht, kann anhand der Ethansäure (Essigsäure) verdeutlicht werden: H O CH2O C2H4O2 H Verhältnisformel Molekülformel Strukturformel C C H OH 2.2 Ermittlung der Massenanteile Quantitative Bestimmung von Kohlenstoff, Wasserstoff und Sauerstoff Zur Ermittlung der Verhältnisformel ist eine quantitative Bestimmung der chemisch gebundenen Elemente erforderlich. Dabei muss man zunächst feststellen, wie groß der Massenanteil der chemisch gebundenen Elemente in der untersuchten Verbindung ist. Die Grundlagen solcher Analysen wurden u. a. von Justus von LIEBIG (1803 –1873) erarbeitet: Man oxidiert eine genau abgewogene Portion der zu untersuchenden Verbindung in einer geschlossenen Apparatur im Sauerstoffstrom und zusätzlich mit Kupferoxid, wobei v. a. Kohlenstoffdioxid und Wasserdampf entstehen. Diese werden durch zwei verschiedene Absorptionsmittel gebunden und mit einer Analysenwaage quantitativ bestimmt. Am häufigsten ist der Fall, dass die Verbindung nur die Elemente Kohlenstoff, Wasserstoff und Sauerstoff enthält. Analysengeräte arbeiten auch heute noch nach dem gleichen Grundprinzip, sind aber weitgehend automatisiert worden. Elementaranalyse zur Bestimmung der Verhältnisformeln organischer Verbindungen 25 Verbrennungsrohr Wasserkonverter Helium- und Sauerstoffstrom Reaktionsrohr Kühlfalle zum Gaschromatographen Abb. 2: Prinzip eines CH-Analysators zur Bestimmung des Massenanteils der Elemente Kohlenstoff und Wasserstoff. Eine Probe mit einer Masse von weniger als 3 mg reicht heute zur Bestimmung aus. Sie wird im Verbrennungsrohr im Sauerstoffstrom oxidiert. Das angeschlossene Reaktionsrohr ist mit Kupferoxid gefüllt, damit eine vollständige Oxidation zu Kohlenstoffdioxid und Wasser gewährleistet wird. Der angeschlossene Wasserkonverter enthält Calciumcarbid, das aus Wasserdampf den Kohlenwasserstoff Ethin bildet, der sich leichter quantitativ bestimmen lässt als Wasser. Aufgabe 7 Formulieren Sie eine Reaktionsgleichung für die Oxidation von Glucose mit Kupfer(II)-oxid zu Kohlenstoffdioxid und Wasser und eine Reaktionsgleichung für die Bildung von Ethin aus Calciumcarbid und Wasser. Alle Verbrennungsprodukte der vollständigen Oxidation werden zunächst in der Kühlfalle mit flüssigem Stickstoff ausgefroren. Beim anschließenden Erwärmen verdampfen sie. Ein Gaschromatograph trennt sie auf und bestimmt sie schließlich quantitativ (siehe S. 44). Als Analysenergebnis erhält man die Massenanteile der chemisch gebundenen Elemente w (Kohlenstoff) und w (Wasserstoff) der Verbindung. Da Sauerstoff und Kupferoxid zur Oxidation benutzt worden sind, muss der Massenanteil des chemisch gebundenen Sauerstoffs w (Sauerstoff) zuletzt durch Differenzbildung berechnet werden. Beispiel Bei der Untersuchung einer Verbindung der Elemente Kohlenstoff, Wasserstoff und Sauerstoff im Elementaranalysegerät ergaben sich folgende Massenanteile: w(Kohlenstoff) = 39,9 %, w(Wasserstoff) = 6,7 % Welche Verhältnisformel besitzt diese Verbindung? 26 Analytisch-praktische Arbeitstechniken und Anwendungsbeispiele Bearbeitungsmöglichkeit Die Massenanteile aller gebundenen Elemente müssen zusammen 100 % ergeben: w(O) = 100 % – [w(C) + w(H)] = 53,4 % Um aus den Massen eine Information über die Anzahl der gebundenen Teilchen zu erhalten, benötigt man die Stoffmengen. Man erhält sie für jedes Element, indem man die Masse durch die entsprechende molare Masse dividiert. Für eine Portion der Analysensubstanz mit der Masse m = 100 g ergeben sich folgende Werte: 1. Schritt: Berechnung des Massenanteils w(Sauerstoff) durch Differenzbildung 2. Schritt: Berechnung der Massen und der Stoffmengen der gebundenen Elemente Kohlenstoff, Wasserstoff und Sauerstoff 39,9 g = 3,33 mol 12 g ⋅ mol −1 6,7 g m(Wasserstoff) = 6,7 g und n(Wasserstoff) = = 6,70 mol 1 g ⋅ mol −1 53, 4 g m(Sauerstoff) = 53,4 g und n(Sauerstoff) = = 3,34 mol 16 g ⋅ mol −1 m(Kohlenstoff) = 39,9 g und n(Kohlenstoff) = Da die gleiche Stoffmenge in jedem Fall die gleiche Teilchenzahl bedeutet, ist das Problem gelöst. Die Verhältnisformel lautet C3,3H6,7O3,3. Gebrochene Formelindizes sind allerdings nicht üblich. Daher dividiert man zuletzt alle Indizes durch den kleinsten in dieser Formel vorkommenden Index und erhält die gesuchte Verhältnisformel CH2O. 3. Schritt: Angabe der Verhältnisformel in der üblichen Schreibweise Hinweis: Bei der Substanz könnte es sich z. B. um Methanal (Formaldehyd) mit der Molekülformel CH2O handeln. Glucose mit der Molekülformel C6H12O6 , Ribose mit der Molekülformel C5H10O5 und Ethansäure mit der vereinfachten Strukturformel CH3COOH besitzen die gleiche Verhältnisformel. Aufgabe 8 Die folgende Abbildung zeigt eine einfache Apparatur zur Durchführung einer Elementaranalyse im Labor: 1 1 2 O2 Heizvorrichtung für Wasser für Kohlenstoffdioxid Absorptionsgefäße Abb. 3: Einfache Apparatur zur Elementaranalyse organischer Verbindungen. Elementaranalyse zur Bestimmung der Verhältnisformeln organischer Verbindungen 27 Zwischen Quarzwolle (1) befindet sich in einem Gefäß („Schiffchen“) eine Portion einer leicht flüchtigen Verbindung der Elemente Kohlenstoff, Wasserstoff und Sauerstoff mit der Masse m = 11,5 g. Sie wird vorsichtig im Sauerstoffstrom erhitzt. Ihre Dämpfe werden am Kupferoxid (2) zu Kohlenstoffdioxid und Wasserdampf oxidiert. Durch Wiegen der Absorptionsrohre vor und nach dem Versuch wurde festgestellt, dass 22 g Kohlenstoffdioxid und 13,5 g Wasser entstanden sind. a Berechnen Sie die Verhältnisformel der unbekannten Substanz. b Informieren Sie sich, welche Stoffe zur Absorption von Wasserdampf und Kohlenstoffdioxid verwendet werden könnten. c Welche Funktion hat die Quarzwolle vor und nach der Analysensubstanz? Aufgabe 9 Als Konservierungsstoff für Lebensmittel wird der Ethylester der p-Hydroxybenzoesäure verwendet: O HO C O C2H5 Ethylester der p-Hydroxybenzoesäure Berechnen Sie die Massen der entstehenden Portionen von Kohlenstoffdioxid und Wasser, wenn bei der Elementaranalyse 10 g dieses Esters im Sauerstoffstrom oxidiert werden. Bestimmung von Stickstoff in organischen Verbindungen Neben den Elementen Kohlenstoff, Wasserstoff und Sauerstoff enthalten viele organische Verbindungen, z. B. die Aminosäuren, noch chemisch gebundenen Stickstoff. Bei der Oxidation mit Sauerstoff und erhitztem Kupferoxid entstehen daher neben elementarem Stickstoff auch Stickstoffoxide. Um sie wieder zu Stickstoff zu reduzieren, werden die Verbrennungsgase zusätzlich noch über erhitztes Kupfer geleitet. Danach liegt der gesamte, in der Analysensubstanz ursprünglich gebundene Stickstoff in elementarer Form vor und kann neben den anderen Verbrennungsprodukten quantitativ bestimmt werden. Aufgabe 10 Zur Ermittlung der Verhältnisformel einer Verbindung, die außer den Elemen- ten Kohlenstoff, Wasserstoff und Sauerstoff auch noch Stickstoff enthält, müssen die Verbrennungsgase vor der Untersuchung im Gaschromatographen zusätzlich über erhitztes Kupfer geleitet werden. Welche Reaktionen laufen am erhitzten Kupfer ab? 28 Analytisch-praktische Arbeitstechniken und Anwendungsbeispiele Aufgabe 11 Die Elementaranalyse einer in Proteinen vorkommenden Aminosäure ergab folgende Massenanteile: w (Kohlenstoff) = 32,00 % w (Wasserstoff) = 36,67 % w (Stickstoff) = 18,67 % w (Sauerstoff) = 42,66 % Welche Verhältnisformel ergibt sich aus diesen Werten? Um welche Aminosäure könnte es sich handeln? Betrachten Sie dazu eine Tabelle der in Proteinen vorkommenden Aminosäuren. Auf den Punkt gebracht • Die Ermittlung der Verhältnisformel einer organischen Verbindung gehört zu den wichtigsten Methoden der organischen Chemie. Meist müssen dabei nur die Elemente Kohlenstoff und Wasserstoff quantitativ bestimmt werden. • Bei diesem Verfahren wird eine genau abgewogene Portion der Analysensubstanz unter Bildung von Kohlenstoffdioxid und Wasser vollständig oxidiert. Die Massen der Verbrennungsprodukte werden bestimmt. • Moderne Analysengeräte liefern die Massenanteile der in der Substanz chemisch gebundenen Elemente direkt. Aus ihnen können die Indizes der Atome in der Verhältnisformel berechnet werden, wozu nur noch die molaren Massen der Elemente benötigt werden.