Journal-Club - BIOspektrum
Werbung

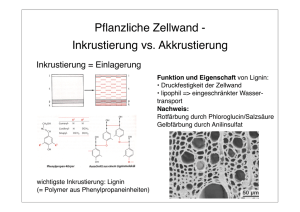
Rundschau 248 Journal-Club Endocannabinoid-Terminase, eine gewendete Malonamidase mit Lothar Jaenicke Amidierte Lipide, wie das Anandamid, sind endogene Signalmoleküle im Zentralnervensystem. Anandamid bindet an den zentralen Cannabinoid-Rezeptor CB1, einen lipophilen, heterotrimeren, G-Protein-gekoppelten Rezeptor, aktiviert z.B. durch das lipophile ∆9Tetrahydrocannabinol. Diese Membranrezeptoren sind dadurch ausgezeichnet, dass sie die Lipid-Messenger kanalisieren, die eigentlich leicht in die Membran hinein diffundieren oder durch sie hindurch permeieren. Modulation von Amplitude und Dauer der Fettsäureamid-Signale geschieht durch eine membranassoziierte Fettsäure-Amidhydrolase (FAAH) aus dem Clan Wasserstoffgas vom Pylorus ernährt Helicobacter Wasserstoffgas, das bei bakteriellen Gärungen frei wird, ist eine Energiequelle für Commensalen, die mit einer membrangebundenen Hydrogenase ausgestattet sind, durch die die Elektronen aus H2-Gas in eine elektrochemische Kette von Hämoprotein-Elektronenträgern eingeschleust wird. J.W. OLSON und R.J. MAIER, Science 298 (2002) 1788–1790, zeigen, dass solche Ketten nicht nur im Verdauungstrakt von Schaben und Termiten vorkommen, sondern auch in unserem eigenen. Helicobacter pylori siedelt auf der sauren Magenschleimhaut, einem tatsächlich nährstoffarmen Milieu, und erzeugt dort pathogene Veränderungen bis hin zu Magengeschwür und -krebs. Die Magenschleimhaut bildet erhebliche Mengen H2, das normalerweise mit der Atemluft ausgeschieden wird. H. pylori hat die Enzym-Ausstattung konstitutiv, um dieses zu nutzen. Bei Mäusen ist die Magen-Konzentration von H2 10 bis 50mal höher als die Affinität der Hydrogenase von H. pylori, sodass sie immer gesättigt ist; darüber hinaus aber induziert das Bakterium die H2-Bildung und seine eigenen Hydrogenase in positiver Koppelung. Eine Defektmutante im Enzym dagegen kümmert und kann die Schleimhaut nicht besiedeln. Es scheint sogar möglich zu sein, aus der H2-Konzentration der Atemluft auf die Besiedelung mit H. pylori zu schließen. der Amidase-Signatur (AS)-Serinhydrolasen, die aber eine eigentümliche katalytische Triade mit S/S/K im Aktiven Zentrum enthält. Ihr nahe verwandt ist die Malonamidase MAE2 aus dem N2-fixierenden Bakterium Bradyrhizobium japonicum (S. SHIN et al., EMBO J. 21 (2002) 2509 – 2510), von der sie sich auch nach den Untersuchungen von M. H. BRACEY et al.; B.J. CRAVATT, Science 298 (2002) 1793–1796, durch Umfaltungen ohne größere Änderungen im katalytischen Mechanismus herleiten lässt. Die um 29 Aminosäuren am N-Terminus verkürzte FAAH aus Rattenhirn wurde in E. coli exprimiert, das Protein kristallisiert und seine Struktur auf 2.8 Das Spezifische der Knoblauchzehe Knoblauch (Allium sativum) gilt seit der Antike als Wunderdroge – vermutlich zum Teil wegen seines penetranten, alles vertreibenden Geruchs, aber doch auch objektiv pharmakologisch von Interessenten verbürgt – man weiß nur nicht weshalb nach Maß und Zahl. Die aktiven schwefelhaltigen Komponenten aus der Gruppe der Cystein-bürtigen Dithiine. Allylsulfide und Ajoene leiten sich vom Thiosulfinat Allicin ab, dem alkylierten Cysteinsulfoxid, das seinerseits durch die Wirkung der Allinase (EC 4.4.1.4) aus den CysteinDerivaten gebildet wird: Es ließ sich reinigen und kristallisieren. Seine Struktur ist von verschiedenen Seiten beschrieben worden, zuletzt von E.B. KOSTNER, R. HILGENFELD und M.S. WEISS (Archives Biochem. Biophys. 402 (2002) 192 – 200; s.a. L. J. W. SHIMON et al., F. FROLOW, Acta Crystallogr. Ser. D 58 (2002) 1335 – 1337), wobei, neben vier mutmaßlichen Glycosylierungs-Asparaginen eine EGF-artige Domäne erkannt wurde. Dies wird nun von E. B ARTHOLOMEUS -K UETTNER , R.HILGENFELD und M.S. WEISS (J. Biol. Chem. 277 (2002) 46402 – 46407) bestätigt, allerdings Å Auflösung bestimmt. Sie ist dimer in Lösung und als Kristallisat mit einer Berührungsfläche zwischen den Untereinheiten von 1560 Å2. Der Innenkern ist durch ein gedrehtes β-Faltblatt charakterisiert, das aus 11 Strängen besteht und von 24 α-Helices unterschiedlicher Länge umgeben ist. Ein Tunnel, der vorwiegend durch hydrophobe Reste ausgekleidet ist, führt von außen zur Lipid (Arachidonsäure)-Bindestelle und findet sich ähnlich auch in der löslichen cytosolischen MAE2. Die beiden Enzyme lassen sich folgendermaßen voneinander ableiten: Das Cytosol-Enzym MAE2 dissoziiert, und das Monomere faltet sich zu einer neuen Symmetrie für die nachfolgende erneute, aber nun lipophile Dimerisierung. Das Monomer lagert sich in die Membran, bildet den Tunnel aus, dann die hydrophobe Bindetasche und dimerisiert zur FAAH; die einzelnen Stufen sind reversibel. Es ist ein eindrucksvolles Beispiel, wie ein lösliches Mitglied eines großen Enzym-Clans sich adaptiert, um eine Spezialaktivität aufzunehmen, indem es bestimmte neue Faltungsmodule erwirbt, ohne dass das katalytische Zentrum oder die Faltungsarchitektur schwerwiegend angegriffen werden. Zwischen Aktivem Zentrum und Zelloberfläche entsteht ein direkter Zugang, sodass der lipide Fettsäureamid-Signalstoff nicht durch das wässrige Cytoplasma vom Ort der Wirkung zu dem des Abbaus transportiert zu werden braucht. (L − Cystein) →→ CH2 = CH − CH2 − S(O) − CH2 − CH(NH2 )COOH Alliin Alliinase → CH2 = CH − CH2 − S(O) − S − CH2 − CH = CH2 Allicin Das dimere Pyridoxalphosphat-Enzym der Klasse I ist in den Vakuolen der Knoblauchzehen enthalten, spaltet die Cβ-SBindung von Cystein-SulfoxidDerivaten und dient möglicherweise der Herbivoren-Abwehr. bleibt die Frage, ob daraus größeres Verständnis für den Reaktionsmechanismus abgeleitet werden kann oder ob es sich um eine entwicklungsgeschichtliche Mutwilligkeit handelt. BIOspektrum · 3/03 · 9. Jahrgang Rundschau 250 Dehydrogenasen aller drei Reiche sind zugleich Ribonucleasen Dehydrogenasen (DH) und andere Stoffwechselenzyme können RNA binden und damit in die Proteinsynthese eingreifen, sei es durch Blockieren oder durch Spalten von tRNA oder mRNA, Ribozymen oder viralen RNA-Kontrollelementen, sei es im RNA-Transport oder als RNA-Schutzproteine (Chaperones). Glycerinaldehydphosphat (GAP)DH bindet darüber hinaus auch Einzelstrang-DNA. Es liegt nahe, als Affinitätsstelle die Nucleotid-bindende Rossmann-Faltung anzuvisieren, die auch in anderen DH enthalten und wohl ein entwicklungsgeschichtlicher Fingerzeig ist. Aber so einfach ist es wieder nicht. Bisher wurden diese Dinge an bakteriellen und eukaryotischen GAPDHs eingehender untersucht. E. EVGENIEVA-HACKENBERG, E. SCHLITZ und G. KLUG weiten dies nun auf das thermophile Archaeon Desulfovibrio solfataricus aus (J. Biol. Chem. 277 (2002) 46145 – 46150). Sie reinigten aus Zellextrakt-Fraktionen mit RNAse-Aktivität zwei beieinander bleibende Proteine, die als hypothetische DH’s, dann als GAPDH und Aspartatsemialdedyd-DH identifiziert wurden. Bei weiteren Untersuchungen wurde festgestellt, dass GAPDH auch aus den anderen beiden Reichen der Organismenwelt nicht nur RNA-Bindefähigkeit, sondern auch RNASpaltungsfähigkeit besitzt. Das Archaeen-Enzym hydrolysiert Pyr-Ado- und Ado-Pyr-Bindungen, hat sein Temperaturoptimum bei 60 °C und benötigt 5 µM Mg2+. Sein Aktives Zentrum befindet sich in den ersten 73 Aminosäuren des N-Terminus, in dessen vorderen zwei Dritteln auch die erste Mononucleotid-Bindestelle der Rossmann-Faltung liegt. Jedoch wird die RNA-Spaltung selbst bei 200 µM NAD(P)H oder ATP nicht vermindert. Damit sind Konkurrenzen um die charakteristische DH-Faltung wenig wahrscheinlich, sondern an der RNAse-Wirkung wohl andere, davon unterschiedene Aminosäurereste beteiligt. Bei genauer Untersuchung mit feineren Sonden stellt sich zunehmend heraus, dass mehrschichtige Netze von Protein/Protein- und Protein/Nukleinsäure-Wechselwirkungen im Funktionsgeschehen viel häufiger sind als bisher angenommen. Proteine, von denen zunächst nur eine Stoffwechselaktivität oder -katalyse bekannt war, nehmen an verschiedenen Zellvorgängen teil und sind multifunktionell, entweder als Kata- Jasmonate stellen die Weichen ihrer Biosynthese Die Eicosanoide der Tiere (die „Zoo-oxylipine“) sind Mediatoren zahlreicher physiologischer zellulärer Vorgänge. Sie entstehen durch Oxygenierung und Cyclooxygenierung der polyungesättigten Eikosansäuren, z.B. der Arachidonsäure aus den Membranlipiden. Pflanzen haben diese nicht, sondern an ihrer statt die Octadecensäuren Linolund Linolensäure. Aber auch diese sind Ausgangssubstanzen für Signalstoffe der Pflanze in ihrer Biozönose, vor allem der Jasmonate, 5’-Pentenyl-substituierten Pentan-4-on-essigsäuren, die in vielen Abwehr- und Entwicklungs-bezogenen Vorgängen als Signalkettenglieder mitwirken. Die Synthese dieser Phytooxylipine beginnt mit der Hydroperoxydierung der Linolund Linolensäure in Position 9 oder 13 durch die pflanzliche Lipoxigenase. Ihr folgen eine Oxepin-Cyclisierung des 13Hydroperoxids durch die Allenoxid-Synthase, AOS, und weitere Umwandlungen durch eine Reihe dem Cytochrom P450 nahestehender Enzyme aus der CYP74-Familie der Cytochrome: Hydroperoxid-Lyase (HPL), Divinylether-Synthase (DES), die alle, im Gegensatz zum P450, weder molekularen Sauerstoff noch eine NADPHabhängige Reduktase brauchen, sondern die HydroperoxidGruppe sowohl als Oxidans, als auch als Reduktans verwenden. Aus 13-Hydroperoxy-Linolensäure entsteht dadurch die Pflanzen-Signalstoff-Familie der Jasmonate – aus der ebenfalls Lipoxigenase-katalysiert gebildeten 9-Hydroperoxi-Linolensäure die α-Ketol- und γ-Ketol-oxophytoensäuren, über deren Funktion noch nichts bekannt ist. A. ITOH et al., G.A. HOWE (J. Biol. Chem. 277 (2002) 46051 – 46058) beschreiben und charakterisieren nun eine cDNA, die die AOS aus Tomaten (S. lycopersicum = L) encodiert. Das rekombinante Protein bildet schließlich über die Vinyl-Epo- xide aus 9-Hydroperoxy-C18En-säuren die Ketol-, aus den 13-Hydroperoxysäuren die Cyclopentanon-Phytooxylipine. LAOS wird vornehmlich in den Wurzeln exprimiert. Pflanzen, die einen Defekt in der Jasmonat-Signalisierung tragen, enthalten das Enzym nicht. Kinetische Messungen zeigen L-AOS gegen die 9-Hydroperoxide 10mal aktiver als gegen die 13Homologen. Ob dieser Reaktionsweg mit dem der Salicylate in Wechselbeziehung steht, wie der der Cyclooxigenasen in der Eicosanoid-Synthese der Tiere, ist eine naheliegende, aber offene Frage; man kennt den Antagonismus von Jasmonat- und Salicylat-Signalen in der „Sprache der Flora“. Die AOS stellt nach diesen Ergebnissen im Stoffwechsel der Lipoxigenase-bürtigen Hydroperoxide in der Wurzel die Weiche zu den offenen oder cyclisierten Phytooxylipinen unter dem regulierenden Einfluss der Jasmonate. lysatoren oder als Struktur- und Schutz-Partner, wie die Glykolyse-DH’s und -Isomerasen (M. A. STROVER, Biochim. Biophys. Acta 1432 (1999) 159 – 184) oder bei E. coli die Enolase als Komponente des Abbau-Komplexes „Degradasom“ (B. PY, C.F. HIGGINS , H.M K RISCH , A.J. C AR POUSIS, Nature 381 (1996) 169– 172). Die kleinste chymotryptische Proteinase: 21 kDa mit Triade Arteriviren (AV- je nach Herkunft E vom Pferd; S vom Schwein) sind tierpathogene RNA-Viren mit Proteinhülle. Das AV-Replicase-Gen encodiert zwei große vieldomänige Vorläufer-Polypeptide, die durch eine nicht-Strukturprotein (nsp)Protease von 21kDa des Virus zerlegt werden. I.H. BARRETTENG et al., M.N.G. JAMES (J. Biol. Chem. 277 (2002) 39960 – 39966) haben die Struktur dieser kleinsten chymotraptischen Faltung bei EAV-nsp4 durch Röntgenstrukturanalyse aufgeklärt. Sie enthält die kanonische Triade zwischen Ser-120, His-39 und Asp-65, dazu eine C-terminale bewegliche α/β-Domäne, die möglicherweise etwas mit dem Binden an die Substrat-Polypeptide zu tun hat. In der asymmetrischen Einheit nimmt das Oxyanion entweder eine gefaltete, inaktive Form ein oder es entfaltet sich zu der üblichen Konformation und ist dann aktiv. Das könnte eine neuartige Möglichkeit zu Regelung der Proteolyse-Aktivität darstellen. BIOspektrum · 3/03 · 9. Jahrgang Rundschau 252 Alleine zu empfindlich – gemeinsam trotzen sie der Hitze Symbiose zwischen Pflanzen und Pilzen kann für beide Partner eine erhöhte Thermotoleranz bewirken, die sie alleine nicht haben. Dies zeigten R.S. REDMAN et al., R.J. RODRIGUEZ (Science 298, (2002), 1581) mit Dichanthelium leguminosum-Pflanzen aus dem Lassen Volcanic und dem Yellowstone National Park (YNP), die in Böden mit jahreszeitlichen Temperaturschwankungen von 20 °C bis 50 °C wachsen. Von den Oberflächen und Samenschalen dieser Pflanzen isolierten sie einen pilzlichen Endophyten, der wahrscheinlich ein bisher unbekannter Vertreter der Gattung Curvularia ist. Axenisch kultivierter Curvularia spec. war bei Temperaturen von 40 °C und darüber nicht lebensfähig. D. leguminosum-Pflanzen, die ohne Endosymbionten kultiviert wurden, bekamen bei Erhitzung der Wurzeln auf 50 °C Chlorosen, welkten und starben bei 65 °C komplett ab. Im Gegensatz dazu überlebten die symbiontischen Pflanzen eine drei Tage lang konstante Temperatur von 50 °C und sogar Temperaturen von zeitweise bis zu 65 °C. Von diesen Pflanzen konnte der Endosymbiont reisoliert werden, auch er überstand also in der Symbiose die Hitze. Ohne Tem- peraturstress zeigten sich keine Wachstumsunterschiede zwischen den beiden Versuchsgruppen. In einem Feldversuch im YNP waren die symbiontischen Pflanzen nach einem Jahr Kultur generell besser entwickelt, und in Erde mit Temperaturen über 40 °C überlebten Pflanzen ohne Endosymbionten nicht. Je höher die Temperaturen waren, desto stärker war der positive Effekt der Symbiose sichtbar. Wie die Thermotoleranz der beiden Symbiosepartner entsteht, ist noch nicht bekannt. Johanna Schmitt, Marburg Das Rätsel der Lignifizierung und der Golgi-Apparat im Xylem Die Lignifizierung der pflanzlichen Zellen ist trotz intensiver Forschung noch immer Gegenstand kontroverser Diskussion. A.L. SAMUELS et al. (Planta 216 (2002), 72–82) untersuchten jetzt an Pinus contorta var. latifolia die Zellstruktur während der Entwicklung vom Kambium zum ausdifferenzierten Xylem. Außerdem bestimmten sie die Lokalisation von Schlüsselenzymen zur Bildung der Sekundären Zellwand und der anschließenden Lignifizierung. In den sich entwickelnden Tracheiden fielen vor allem ungewöhnliche Golgi-Strukturen auf, die in den dünnwandigen Kambiumzellen nicht vorhanden waren. Diese Golgi-Apparate hatten ein sehr ausgeprägtes verzweigtes trans-Golgi-Netzwerk (TGN) mit zahlreichen großen, traubenartig angeordneten assoziierten Vesikeln und blieben während der ganzen Zeit der Xylem-Bildung bis zum programmierten Zelltod erhalten. Sie traten kurz vor der ersten sichtbaren Lignifizierung auf, die in der Mittellamelle, den Zellecken und den Hoftüpfeln stattfand. Mit der Plasmamembran fusionierende Golgi-Vesikel waren ebenfalls vorhanden, über die Zellwandbestandteile und -enzyme aus der Zelle ausgeschleust werden können. Im sich entwickelnden Xylem war die zur Bildung von Hemicellulosen notwendige Mannanase in der Sekundären Zellwand sowie den trans-GolgiZisternen und -Vesikeln nachweisbar, aber nicht im verzweigten TGN. Coniferin-β-Glucosidase als Enzym der Lignifizierung war nur in den Zellwänden vorhanden, aber nicht im Cytoplasma, den Golgi-Zisternen und -Vesikeln oder der primären Zellwand, Die Frage, ob der Golgi-Apparat außer Polysacchariden auch Lignin-Vorstufen in die Zellwand liefert, ist noch offen. Möglicherweise sind die ungewöhnlichen verzweigten Bereiche des TGN dafür verantwortlich, da hier die Mannanase fehlte. Wie die Phenylpropan-Monomere in der Zellwand zum Lignin polymerisieren, ist ebenfalls noch ungeklärt. Die frühe Einlagerung von Lignin in der Mittellamelle und den Zellecken noch während des Aufbaus der Sekundären Zellwand könnte eine Starterfunktion haben. Wenn die Hauptmenge an Coniferin dann aus der absterbenden Zelle austreten würde, könnte die Coniferin-β-Glucosidase in der Zellwand den Coniferylalkohol freisetzen, der anschließend zur Lignin-Matrix polymerisieren würde. Überexprimierte D-Glutamat-Racemase sucht sich Arbeit als Gyrase-Hemmer Bakterienzellwände enthalten Vernetzungen, um die Mureinketten zusammenzuhalten, sonst wachsen die Bakterien in langen Fäden. In den Brücken ist D-Glutaminsäure enthalten, die durch die Pyridoxalphosphat-freie Glutamat-Racemase bereitgestellt wird. Das zugehörige Gen, murI bei Escherichia coli (sein Produkt MurI) , ist in Bakterien ubiquitär, wenn auch nur in kleiner Menge. Seine Funktion ist strikt kontrolliert, und eine Untersuchung von M. ASHIUCHI et al. (J. Biol. Chem. 277 (2002) 39070 – 39073) zeigt, dass Überexpression das Zellwachstum unterdrückt, indem sich das Protein eine neue Betätigung sucht (die vielleicht auch eine physiologische ist), nämlich die DNA-Gyrase zu hemmen, sodass die Zellen ihre DNA nicht mehr in Supercoils legen können und die DNA essentieller Plasmide so verfestigt wird, dass sie sich nicht mehr teilen. Ob diese Kreuzreaktivität des murI-Genprodukts im Aminosäure- und im NucleinsäureStoffwechsel, interessant, wie sie ist, tatsächlich eine physiologische Neuigkeit ist, oder eine Vergiftung durch Überdosis und Dysregulation, bleibt zu klären. Johanna Schmitt, Marburg BIOspektrum · 3/03 · 9. Jahrgang