Labor Dr. med. Knechten und Partner
Werbung

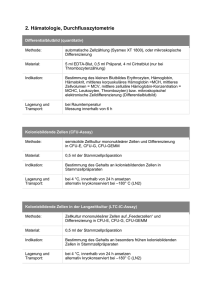
Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG 1a) Präanalytik: Allgemeine Hinweise Alle in diesem Verzeichnis aufgeführten Untersuchungen können über unser Laboratorium bezogen werden. Darüber hinaus sind weitere Untersuchungen möglich, die aus Gründen der Übersichtlichkeit hier nicht aufgeführt wurden. Untersuchungen, die aus methodischen oder technischen Gründen, nicht selbst durchgeführt werden, sind in diesem Verzeichnis mit einem * und auf den Befunden mit der Bezeichnung "Externes Labor" gekennzeichnet. Die Adresse der entsprechenden Laboratorien werden auf Anfrage mitgeteilt. Einsendermaterial Folgende Materialien stellen wir auf Anforderung kostenlos zur Verfügung. Bitte beachten Sie die Angaben zur Probengewinnung. Die korrekten Primärröhrchen und die Einhaltung der Angaben zur Probengewinnung und weiteren Bearbeitung sind im Interesse einer sicheren Diagnostik unbedingt erforderlich: • EDTA-Primärröhrchen (BD Vacutainer) • Serum-Röhrchen • PCR-Tubes (molekulargenetische Analysen) • Transferpipetten (molekulargenetische Analysen) • LDT-Nummernkreise • Versandbeutel • Transportkisten • Sicherheitshüllen für Probengefäße • Spezielle Anforderungsscheine o Genotypische HIV-Resistenzanalyse o Tropismusanalyse o Kassenanträge für HBV + HCVResistenzanalyse o Einwilligungserklärung entsprechend Gendiagnostikgesetz Die Abteilung Versand koordiniert dabei die Versorgung der Praxen mit den benötigten Versandmaterialien und ist unter der Telefonnummer 0241 47097-13 zu erreichen. Probengewinnung Die Probenvorbereitung ist eine der routinemäßigsten, aber auch kritischsten Handhabungen, um genaue Ergebnisse im Labor zu (Version 1 / 12.2015) gewährleisten. Eine unsachgemäße Bearbeitung der Proben kann unplausible Ergebnisse zur Folge haben und die Funktion von Diagnoseinstrumenten beeinträchtigen. Bei allen Arbeitsschritten mit Probenmaterialien sind Einmalhandschuhe zu tragen. Zur Probenentnahme müssen, je nach Untersuchungsart, die empfohlenen Primärröhrchen verwendet werden (s. Untersuchungsmaterial). Füllen Sie das Blutentnahmeröhrchen vollständig. Zu wenig Blut bedeutet zu viel Antikoagulans, was sich auf die Qualität der Probe auswirken kann. Alle Röhrchen mit Zusatzstoff sind sofort nach der Blutentnahme zu mischen. Plasmaröhrchen 10 mal invertieren, Serumröhrchen 5 mal. Ungenügendes Mischen der Röhrchen mit Antikoagulans kann zur Bildung von Mikrogerinnsel führen. Die meisten Serumröhrchen benötigen mindestens 30 Minuten bis zu einer vollständigen Gerinnung. Falls Zentrifugierschritte notwendig sind, sind horizontale Rotoren festen Winkelrotoren vorzuziehen. Zur Überführung einer Probe in ein Sekundärröhrchen die Probe immer pipettieren und eine kleine Menge oben auf dem Blutkuchen lassen. Dieser Arbeitsschritt muss bei molekularbiologischen Untersuchungen mit sterilen Einmalpipetten durchgeführt werden. Nach molekularbiologischen Analysen werden die Proben, sofern haltbar, für einen Monat in unserem Labor gelagert. In dieser Zeit können Nachanalysen angefordert werden. Probenbeschriftung Die Identität einer Probe muss zur Bearbeitung eindeutig sein. Dazu muss das Probengefäß mit Namen und Vornamen gekennzeichnet sein. Der Überweisungsschein fungiert gleichzeitig als Anforderungsschein. Ausnahme sind genotypische Analysen und Medikamenten-spiegelmessungen. Der Überweisungsschein von Kassenpatienten muss entsprechend der EBM–Richtlinien ausgefüllt sein. Bei Anforderungsscheinen von Privat-versicherten sollten folgende Angaben vorliegen: Stammdaten des Patienten (Name, Geburtsdatum, Adresse), Krankenver-sicherung, Einsenderstempel und die angeforderte Laborleistung. Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Bei allen Anforderungen sollte das Abnahmedatum mit Uhrzeit enthalten sein. Für die genotypische Resistenz- oder Tropismusanalyse oder der Medikamentenspiegelmessung sollten die zur Verfügung gestellten Anforderungsscheine zusätzlich ausgefüllt werden. Serum-Monovetten haben ein Füllungsvolumen von 7,5 oder 9 ml. Bitte beachten Sie: Die Volumenangaben im Leistungsverzeichnis beziehen sich immer auf das benötigte Serumvolumen. Dies entspricht in etwa nur der Hälfte des Vollblutvolumens. 1b) Probentransport: EDTA-Plasma Ein schneller Probentransport ist einer Lagerung vorzuziehen. Bitte beachten Sie die Einhaltung der Lagerungsund Transporthinweise. Nur ordnungsgemäß verpackte Proben dürfen, entsprechend der Vorgaben des Amtes für Arbeitsschutz, befördert werden. Bitte achten Sie darauf, dass sich alle Proben in einer Schutzhülle befinden. Gefrorene Proben müssen beim Einpacken durchgefroren sein. Unser regionaler Transportdienst kann am Tag der Blutentnahme bis 10:00 Uhr angefordert werden. Untersuchungsmaterial, das nicht mit unserem regionalen Transportdienst abgeholt werden kann, wird von einem nationalen Transportdienst befördert. Hierzu muss der Transportdienst am Tag vor der Blutentnahme bis 18:00 Uhr angefordert werden. Beide Transportdienste können unter der Telefonnummer 0241 47097-13 angefordert werden. Es findet kein Probentransport Wochenende oder über Feiertage statt. über das Achtung: Anforderungsschein und Probenmaterial immer zur Versendung zusammen verpacken Untersuchungsmaterial Serum Der von den Gerinnungsfaktoren befreite flüssige Anteil des Blutes, der entsteht, wenn geronnenes Blut zentrifugiert wird, bezeichnet man als Serum. Probengewinnung: 30 bis maximal 60 Minuten nach der Blutentnahme wird das Vollblut während 20 Minuten bei 3.000 UpM zentrifugiert. Anschließend wird der Überstand (=Serum) in ein neutrales Röhrchen Versandröhrchen) pipettiert. (Version 1 / 12.2015) Wird frisches Vollblut durch Zusatz von beispielsweise EDTA an der Gerinnung gehindert, entsteht kein Koagel. Die Zellen bleiben einzeln im Plasma (=flüssiger Anteil des Blutes) welches noch alle Gerinnungsfaktoren enthält. Probengewinnung: Blut nach Entnahme durch mehrfaches Kippen des Primärröhrchens mit dem EDTA vermischen. Anschließend wird das EDTAVollblut während 20 Minuten bei 3.000 UpM zentrifugiert. Der Überstand (=EDTA-Plasma) wird in ein neutrales Röhrchen (Versandröhrchen) pipettiert. EDTA-Monovetten gibt es in verschiedenen Größen. Sind mehrere Parameter aus EDTA-Plasma angefordert, sollte beachtet werden, dass bei Abnahme von 2,7 ml EDTA-Blut etwa nur 1,3 ml Plasma gewonnen werden können. Bei molekulargenetische Untersuchungen (z.B. quantitative HIV-PCR, Resistenzanalyse, etc.) muss jeweils ein eigenes EDTA-Primärröhrchen verwendet werden, das für keine andere Bestimmung vorgesehen ist. Damit wird eine mögliche Kontamination verhindert. Falls das Untersuchungsmaterial (EDTA-Vollblut) nicht am Tag der Blutentnahme oder spätestens binnen 24 Stunden bei uns eintreffen kann, muss es bei dem einsendenden Arzt am Tag der Blutentnahme zentrifugiert werden. Anschließend wird das EDTA-Plasma mittels einer sterilen Pasteurpipette in sterile, dafür vorgesehene Sekundärgefäße (PCR-Tube) überführt und bis zur Abholung tiefgefroren. EDTA-Blut Probengewinnung: Blut nach Entnahme durch mehrfaches Kippen des Primärröhrchens mit dem EDTA vermischen. Das Untersuchungs-material ist bis zur Abholung bei Raum-temperatur im Dunkeln zu lagern. Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Die häufigste Anwendung für EDTA-Blut ist die Beurteilung der Zellen sowohl im herkömmlichen Blutbild maschinell/mikroskopisch als auch in den neueren Methoden der Zelltypisierungen, z. B. im Rahmen einer HIV-Erkrankung. Die Zellen sind in dieser Umgebung nur begrenzt stabil. EDTA-Blut, das älter als 24 Stunden ist, sollte daher nicht mehr für eine Beurteilung der Zellen herangezogen werden. Tieffrieren zerstört die Zellen und macht eine Bestimmung der o. g. Parameter unmöglich! Zur Quantifizierung oder Charakterisierung von Viren mit molekulargenetischen Methoden wird meist EDTA-Plasma verwendet (Ausnahme EDTAVollblut bei HIV-Tropismusanalyse aus proviraler DNA). Falls am Ort der Blutentnahme keine Möglichkeiten zur Zentrifugation, zur sterilen Überführung des EDTA-Plasmas in Sekundärröhrchen (PCR-Tube) oder zur Lagerung bei -20°C bestehen, muss das EDTA-Vollblut spätestens binnen 24 Stunden nach der Blutentnahme bei uns eintreffen. 4,4-5,9 4,1-5,4 10e6/µl RBC: 40-53 36-48 % HCT: 3,9-10,1 4,0-11,2 10e3/µl WBC: 17-47 17-47 % Lym: 40-75 40-75 % Neu: 150-346 168-405 10e3/µl PLT: *Referenzbereiche für Kinder: siehe Befundbericht Indikation: Anämien, Infektionen, Intoxikationen, Kollagenosen, Leukämien und andere hämatologische Systemerkrankungen, maligne Tumoren, Kontrolle von Therapien (Bestrahlung, Chemotherapie) Ermittlung der Leukozyten und Lymphozytenzahl zur Berechnung der Absoluten Lymphozytensubpopulationen mittels Durchflusszytometrie. Durchführung: täglich Messunsicherheit Jedes quantitative Messergebnis unterliegt einer gewissen analysenspezifischen Ungenauigkeit. Die Streuung der Messwerte um den wahren Wert herum wird als Messunsicherheit bezeichnet. Die Messunsicherheiten der verwendeten Analysenverfahren können Ihnen auf Anfrage jederzeit gerne zur Verfügung gestellt werden. Die Qualitätssicherung der Messergebnisse erfolgt gemäß den Anforderungen nach Rilibäk. 2) Leistungsverzeichnis BLUTBILD: Methode: Opto-photometrische Messung Material: 3 ml EDTA-Blut Präanalytik: EDTA-Monovette nach der Abnahme durch Schwenken gründlich mischen und bei Raumtemperatur lagern. Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden. Referenzbereiche (>= 18 Jahre): HGB: (Version 1 / 12.2015) Männer Frauen Einheit 13,5-17,8 11,5-16,0 g/dl LYMPHOZYTEN-DIFFERENZIERUNG (Immunstatus): Immunphänotypisierung Lymphozyten von Methode: Durchflusszytometrie Material: 7 ml EDTA-Blut (Lagerung bei 2025°C) Präanalytik: EDTA-Monovette nach der Abnahme durch Schwenken gründlich mischen und bei Raumtemperatur lagern. Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden. Zur Ermittlung der quantitativen Zellpopulationen ist die gleichzeitige Bestimmung der Leukozyten erforderlich (s. Blutbild). Referenzbereiche (> 16 Jahre) Lymphozytensubpopul Absolut Relativ ationen (Zellen/µl) (%) T-Lymphozyten (CD3+) 700 - 2460 57 - 87 T-Helferzellen 421 - 1601 33 - 60 (CD3+CD4+) Zytotoxische T-Zellen 226 - 931 12 - 39 (CD3+CD8+) Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG B-Lymphozyten (CD368 - 567 CD19+) Natürliche Killerzellen 91 - 567 (CD3-CD16+56+) CD38 aktivierte CD8+ T26 - 370 Zellen HLA-DR aktivierte CD8+ 6 - 224 T-Zellen 4 - 25 4 - 28 8 - 50 1 - 26 weitere Marker auf Anfrage Referenzbereiche für weitere Marker und für Kinder siehe Befundbericht. Indikation: Unser Hauptanwendungsgebiet ist die Bestimmung bzw. Charakterisierung von Lymphozytensubpopulationen zur Verlaufs- und Therapiekontrolle einer HIV-Infektion. Ein Immunstatus beinhaltet T-Lymphozyten, THelferzellen, Zytotoxische T-Zellen, BLymphozyten und Natürliche Killerzellen. Ergänzende Analysen beinhalten beispielsweise Aktivierungsmarker. Weiterhin ist die Bestimmung u. a. indiziert bei Tumorerkrankungen, Autoimmunerkrankungen, lymphoproliferativen Erkrankungen. Durchführung: täglich HIV (HUMANES IMMUNDEFIZIENZ –VIRUS): HIV-Antigene sind 1 bis 3 Wochen vor der Serokonversion nachweisbar. Sensitivster Marker ist die HIV Viruslastbestimmung. Kinder von HIV-positiven Müttern sind bei der Geburt immer seropositiv. Durchführung: täglich. HIV-1 Viruslastbestimmung (quantitative HIV-PCR) Methode: quantitative real-time RT-PCR Material: 7 ml EDTA-Blut oder 3ml EDTAPlasma Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT. Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren Messbereich: 40 – 10.000.000 Kopien/ml Indikation: Überwachung der Krankheitsprogression oder Therapieüberwachung bei HIVInfektion Behandlungsziel: Langanhaltende Senkung der Viruslast unter die Nachweisgrenze von 50 Kopien/ml Häufigkeit der Viruslastbestimmung: Kontrollmessungen alle drei bis vier Monate. Kürzere Abstände bei Behandlungsentscheidungen. Durchführung: täglich HIV-1/2 Suchtest (Anti-HIV 1/2 und p24-Antigen) Methode - 1: ECLIA (ElectroChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Hinweis: ein positiver Befund muss immer durch einen Bestätigungstest (Westernblot*) überprüft werden. Referenzbereich: negativ Indikation:Verdacht auf eine HIV Infektion Erregermeldung: positive bestätigte Ergebnisse werden durch das Untersuchungslabor anonym an das Robert Koch Institut gemeldet Inkubationszeit: HIV-Antikörper lassen sich in der Regel 4-5 Wochen nach dem Infektionsrisiko nachweisen. In manchen Fällen kommt es zur verzögerten Antikörperbildung. (Version 1 / 12.2015) HIV-2 Viruslastbestimmung* (quantitative HIV-PCR) Methode: quantitative Real-time PCR Material: 7ml EDTA-Blut oder 3 ml EDTAPlasma Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT. Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma zentrifugieren und einfrieren Messbereich: 100 – 1.000.000 Kopien/ml Indikation: Überwachung der Krankheitsprogression oder Therapieüberwachung bei HIV-2 Infektion Behandlungsziel: Langanhaltende Senkung der Viruslast unter die Nachweisgrenze Häufigkeit der Viruslastbestimmung: Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Kontrollmessungen alle drei bis vier Monate. Kürzere Abstände bei Behandlungsentscheidungen. Durchführung: bei Bedarf HIV-1 genotypische Resistenzbestimmung Methode: RT-PCR, Sequenzierung n. Sanger Material: 7 ml EDTA-Blut oder 3 ml EDTAPlasma Minimale Viruslast: 100 HIV-1 RNA Kopien/ml Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren Genbereiche: Protease und Reverse Transkriptase Integrase gp41 V3-loop im gp120 Indikation: Detektion resistenzrelevanter Mutationen zur Therapieoptimierung Behandlungziel: Langanhaltende Senkung der Viruslast unter die Nachweisgrenze von 50 Kopien/ml Anforderung: bei Bekanntwerden der Infektion oder vor initialem Therapiebeginn, nach Therpieversagen. Mit speziellem Anforderungsschein. Durchführung: zwei bis dreimal wöchentlich Formular: unter dem Menüpunkt: Service Indikation: Bestimmung der diversen HIV-1 Subtypen (A, B,C D, F, G, H, J, K und CRFs wie AE, AG, …) Behandlungsziel: Langanhaltende Suppression der Viruslast Anforderung: Bei Bedarf Die genotypische Subtypbestimmung bei HIV ist zurzeit keine GKV-Leistung Hinweis: Wird automatisch bei der Resistenzanalyse durchgeführt und angegeben Methode: RT-PCR, Sequenzierung n. Sanger Material: 7 ml EDTA-Blut oder 3 ml EDTAPlasma Minimale Viruslast: 100 Kopien / ml Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren Messbereich: gp120 V3-loop Indikation: Bestimmung des Tropismus (CCR5, CXC-R4, dual oder misch-trop) Behandlungsziel: Langanhaltende Suppression der Viruslast Anforderung: zeitnah vor Therapiebeginn oder bei Therapieversagen Durchführung: zweimal wöchentlich Formular: unter dem Menüpunkt: Service HIV-1 Subtypbestimmung Methode: RT-PCR, Sequenzierung n. Sanger Material: 7 ml EDTA-Blut oder 3 ml EDTAPlasma Minimale Viruslast: 100 Kopien / ml Separate Röhrchen nur für diese Bestimmung Lagerung: EDTA-Blut: Lagerung bei RT Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren Genbereich: Protease und Bereiche der Reversen Transkriptase (Version 1 / 12.2015) Genotypische HIV-Tropismusanalyse bei nachweisbarer Viruslast Genotypische HIV-Resistenz- oder Tropismusanalyse aus proviraler DNA Methode: PCR, Sequenzierung nach Sanger Material: 7 ml EDTA-Blut (KEIN EDTAPlasma!) Keine nachweisbare Viruslast oder Viruslast < 100 Kopien/ml Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden Messbereich: entspricht dem Bereich der viralen Messung Indikation: Bestimmung der Resistenz oder des Tropismus Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Behandlungsziel: Langanhaltende Suppression der Viruslast Anforderung: zeitnah vor Therapiebeginn oder bei Therapieversagen Durchführung: zweimal wöchentlich Formular: unter dem Menüpunkt: Service HEPATITIS B - VIRUS: HBV Antikörper Antikörpernachweis: Anti HBc lgM und lgG HEPATITIS A VIRUS: HAV-Antikörper (Anti HAV) Methode: ECLIA (ElectroChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: Verdacht auf e. akute Hepatitis A Überprüfung des Impfschutzes nach Hepatits A Impfung Erregermeldung: Für die akute Hepatitis A besteht nach IfSG eine Meldepflicht Inkubationszeit: Anti-HAV-Antikörper sind in der Regel nach 12 – 40 Tage nachweisbar. Hinweis: bei einem positivem Anti-HAV (IgM/IgG gesamt) Suchtest sollte der Ver-dacht auf eine Akutinfektion durch die Bestimmung des HAV-IgM bestätigt werden. IgM- Antikörper verschwinden i. A. nach drei bis sechs Monaten, während IgG Antikörper meist lebenslang persistieren und eine Immunität anzeigen Durchführung: wöchentlich HAV RNA HAV-PCR) Nachweis* (qualitative Methode: PCR Material: 7 ml EDTA-Blut oder 3ml EDTAPlasma. Separate Röhrchen nur für diese Bestimmung oder Stuhlröhrchen Präanalytik: EDTA-Blut: Lagerung bei RT. Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma zentrifugieren und einfrieren Messbereich: negativ Indikation: Verdacht auf e. akute Hepatitis A Erregermeldung: Für die akute Hepatitis A besteht nach IfSG eine Meldepflicht Durchführung: nach Bedarf (Version 1 / 12.2015) Methode: ECLIA (ElectroChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: Verdacht auf eine frische, chronische o. ausgeheilte Hepatitis B Infektion Erregermeldung: s. anti HBc lgM Inkubationszeit: Nachweis frühestens eine Woche nach Übertragung Hinweis: langjährige (bis lebenslange) Persistenz. Durchführung: wöchentlich Anti-HBc IgM* Methode: CLIA (ChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: Verdacht auf eine akute Hepatitis B Infektion Erregermeldung: Dem Gesundheitsamt wird gemäß §7 Abs.1Nr.20IfSG der direkte oder indirekte Nachweis von Hepatitis-B-Virus, soweit er auf eine akute Infektion hinweist, namentlich gemeldet. Inkubationszeit: Der Nachweis von HBc-IgMAK spricht in der Regel für eine kürzliche HBVInfektion <6 Monate. Bei akuter HBV-Infektion sind hohe HBc-IgMTiter zu erwarten. Persistenz bis zu 12 Monaten. Hinweis: Persistenz bis zu 12 Monaten. In geringerer Konzentration können HBc-IgM-AK auch bei Exazerbation einer chronischen HBVInfektion auftreten Durchführung: wöchentlich Anti-HBe* Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Methode: CLIA (ChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: Infektionsstatus bei HBV-Infektion, Verlaufskontrolle bei HBV-Infektion Hinweis: Wenn Anti-HBe nicht innerhalb von 6 Monaten nach einer Infektion im Blut nachweisbar ist, deutet dies auf einen chronischen Verlauf der Infektion hin. Die HBeSerokonversion stellt ein Zielkriterium der antiviralen Therapie dar. Achtung: Bei Infektion mit seltenen HBV-Escape-Mutanten kann kein Anti-HBe gebildet werden Durchführung: wöchentlich Anti-HBs Methode: ECLIA (ElectroChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: Durchgemachte HBV-Infektion Impfstatus Hinweis: zusammen mit Anti-HBc Parameter für eine immunologische Kontrolle ohne vorhandenes Anti-HBc meist Parameter für Impfschutz Immunität nach einer Impfung liegt bei einem Messwert von >10 IU/ml vor. > 100 U/ml Impfschutz vorhanden < 100 U/ml Auffrischung empfohlen Durchführung: wöchentlich Inkubationszeit: Nachweis etwa 1-10 Wochen nach Übertragung. Frühseter diagnostischer Marker Hinweis: Bei Persistenz > 6 Monate liegt eine chronische Infektion vor Der Verlust von HBsAntigen spricht in Verbindung mit dem Auftreten von HBs- AK für eine ausgeheilte (immunologisch kontrollierte) Infektion. Zur Beurteilung der Virusaktivität sowie hinsichtlich der Therapieindikation ist die Untersuchung auf HBV-DNA zu empfehlen. 510 % der HBV-Infektionen sind HBs-Antigen negativ! Durchführung: wöchentlich HBe-Antigen* Methode: CLIA (ChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: Infektionsstatus bei HBV-Infektion, Verlaufskontrolle bei HBV-Infektion, Therapiemonitoring, Therapieprognose Inkubationszeit: Nachweis etwa 1-10 Wochen nach Übertragung. Hinweis: HBe-Antigen weist in der Regel auf eine hohe Virusreplikation hin. Fehlendes HBe-Antigen schließt jedoch eine hohe Replikationsrate nicht aus (PräcoreMutation). Achtung: Bei Infektion mit seltenen HBVEscape-Mutanten kann kein HBe-Antigen nachgewiesen werden. Durchführung: wöchentlich HBs-Antigen* (qualitativ)* Methode: CLIA (ChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: Akute oder chronische HBVInfektion, Mutterschaftsvorsorge Erregermeldung: Dem Gesundheitsamt wird gemäß §7 Abs.1Nr.20IfSG der direkte oder indirekte Nachweis von Hepatitis-B-Virus, soweit er auf eine akute Infektion hinweist, namentlich gemeldet. (Version 1 / 12.2015) HBV Viruslastbestimmung (quantitative HBV-PCR) Methode: quantitative Real-time PCR Material: 7 ml EDTA-Blut oder 3ml EDTAPlasma Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT. Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma zentrifugieren und einfrieren Referenzbereich: negativ Messbereich: 10 – 1.000.000.000 IU/ml Indikation: Differentialdiagnose akute oder ausgeheilte Hepatitis B; Therapiemarker Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Erregermeldung: Dem Gesundheitsamt wird gemäß §7 Abs.1Nr.20IfSG der direkte oder indirekte Nachweis von Hepatitis-B-Virus, soweit er auf eine akute Infektion hinweist, namentlich gemeldet. Diagnosemeldung erfolgt durch den behandelnden Arzt. Behandlungsziel: Serokonversion oder langanhaltende Suppression der Viruslast. Hinweis: Viruslastbestimmung: bei positivem Antikörpernachweis, vor Beginn einer Therapie, 4 und 12 Wochen nach Therapiebeginn und anschließend in 3 Monatsabständen bis zur etwaigen langanhaltenden Serokonversion. Durchführung: wöchentlich Messbereich: Polymerasegen Indikation: Bestimmung des Genotyp von Hepatitis B (A, B,C, D, … Behandlungsziel: Langanhaltende Suppression der Viruslast, Serokonversion Hinweis: Anforderung: vor Therapiebeginn (insbesondere mit Interferon) Die Genotypisierung bei HBV ist zurzeit keine GKV-Leistung Durchführung: auf Anfrage HEPATITIS D VIRUS: HBV genotypische Resistenzbestimmung Methode: PCR, Sequenzierung nach Sanger Material: 7 ml EDTA-Blut oder 3 ml EDTAPlasma Minimale Viruslast: 300 HBV-DNA IU/ml Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren Genbereich: Polymerase Indikation: Detektion resistenzrelevanter Mutationen zur Therapieoptimierung Behandlungsziel: Langanhaltende Senkung der Viruslast unter die Nachweisgrenze von 10 IU/ml Hinweis: Anforderung: nach Therapieversagen, bei Verdacht auf primärresistenten Viren Die genotypische Resistenzbestimmung bei HBV ist zurzeit keine GKV-Leistung Durchführung: auf Anfrage HBV Genotypisierung Methode: Realtime PCR Material: 7 ml EDTA-Blut oder 3ml EDTAPlasma Minimale Viruslast: 300 HBV-DNA IU/ml Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren (Version 1 / 12.2015) HDV-Antikörper (Anti HDV)* Methode: CLIA (ChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: bei jeder Hepatitis-B-Neudiagnose, bei bisher fehlender Testung bei bekannter HBV-Infektion sowie bei Exazerbation einer chronischen Hepatitis B. Verdacht auf eine Infektion mit Hepatitis D Erregermeldung: namentliche LaborMeldepflicht gem. IfSG bei direktem und indirektem Erregernachweis! Hinweis: Beim Hepatitis-D-Virus handelt es sich um ein defektes Virus: Für die Produktion infektiöser Viruspartikel ist das Hepatitis-BVirus-Hüllprotein (HBs-Antigen) erforderlich, so dass eine HDV-Infektion ausschließlich in Verbindung mit einer HBV-Infektion vorkommt ein positiver Befund muss immer durch einen Bestätigungstest (Direktnachweis über HCVRNA) überprüft werden. Der direkte Erregernachweis erlaubt eine Differenzierung zwischen aktiver und ausgeheilter HCV-Infektion. Bei negativem Virusnachweis sollte gegebenenfalls die Untersuchung im Abstand von 3-6 Monaten untersucht werden. Durchführung: wöchentlich HEPATITIS C VIRUS: HCV-Antikörper Nachweis Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Methode: ECLIA (ElectroChemiLumineszenzImmunoAssay) Material: 1 ml Serum (Lagerung bis zur Abholung bei 4°C) Referenzbereich: negativ Indikation: akute, chronische oder früher abgelaufene Infektion Erregermeldung: positive bestätigte Erstbefunde werden durch das Untersuchungslabor an das zuständige Gesundheitsamt gemeldet. Inkubationszeit: HCV-Antikörper werden in der Regel 6 - 9 Wochen, in seltenen Fällen erst 6 Monaten nach der Infektion nachweisbar. Hinweis: ein positiver Befund muss immer durch einen Bestätigungstest (Direktnachweis über HCV-RNA) überprüft werden. Der direkte Erregernachweis erlaubt eine Differenzierung zwischen aktiver und ausgeheilter HCV-Infektion. Bei negativem Virusnachweis sollte gegebenenfalls die Untersuchung im Abstand von 3-6 Monaten untersucht werden. Bei Neugeborenen ist zu beachten, dass maternale HCV-AK bis zu 18 Monate nachweisbar bleiben können. Der Ausschluss einer vertikalen Transmission erfolgt mittels HCV-PCR. Durchführung: wöchentlich HCV Viruslastbestimmung (quantitative HCV-PCR) Methode: quantitative Real-time PCR Material: 7 ml EDTA-Blut oder 3ml EDTAPlasma Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut, Lagerung bei RT. Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden. EDTA-Plasma zentrifugieren und einfrieren Referenzbereich: Negativ Messbereich: 12 – 100.000.000 IU/ml (Umrechnungsfaktor: 1 IU ≈ 2,6 Kopien/ml) Indikation: Differentialdiagnose akute oder ausgeheilte Hepatitis C; aktive HCV, Therapiemarker, neonatale Infektion Erregermeldung: namentliche Meldung durch das Labor an das Gesundheitsamt, wenn keine chronische Infektion bekannt ist. Diagnosemeldung erfolgt durch den behandelnden Arzt. (Version 1 / 12.2015) Inkubationszeit: HCV-RNA lässt sich in der Regel 2-3 4 Wochen nach dem Infektionsrisiko nachweisen. Hinweis: Behandlungsziel: keine nachweisbare HCV-RNA (Eradikation). Deshalb soll die HCV RNA vor Therapie-beginn, unter Therapie und bei Therapieende durchgeführt werden. Von einer Heilung ist auszugehen, wenn drei Monate nach Therapieende keine HCV-RNA mehr nachweisbar ist. Bei serologischem Nachweis einer HCVInfektion und negativer HCV-PCR sollte aufgrund der Möglichkeit einer diskontinuierlichen Replikationsaktivität eine Kontrolluntersuchung nach 6-12 Monaten durchgeführt werden. Durchführung: 3 x pro Woche HCV Genotypisierung Methode: Realtime PCR Material: 7 ml EDTA-Blut oder 3ml EDTAPlasma Nachweisbare Viruslast! Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren Messbereich: 5’UTR Indikation: Bestimmung des Genotyp von Hepatitis C (1a, 1b, 2, 3, 4, 5, 6) Behandlungsziel: Heilung. . Die HCV-Genotypisierung spielt eine wichtige Rolle bei der Therapieplanung (Therapiedesign, Therapiedauer). Hinweis: Anforderung: vor Therapiebeginn. Bei Verdacht auf Reinfektion Durchführung: auf Anfrage HCV genotypische Resistenzbestimmung Methode: PCR, Sequenzierung nach Sanger Material: 7 ml EDTA-Blut oder 3 ml EDTAPlasma Minimale Viruslast: 100 HCV-RNA IU/ml Separate Röhrchen nur für diese Bestimmung Präanalytik: EDTA-Blut: Lagerung bei RT Labor Dr. med. Knechten und Partner Diagnostisches Labor für HIV und Hepatitis-Viren LEISTUNGSKATALOG Abholung am Tag der Blutentnahme, spätestens binnen 24 Stunden EDTA-Plasma: zentrifugieren und einfrieren Genbereich: NS3A4, NS5A, NS5B Indikation: Detektion resistenzrelevanter Mutationen zur Therapieoptimierung Behandlungsziel: Langanhaltende Senkung der Viruslast unter die Nachweisgrenze von 12 IU/ml mit Ausheilung. Anforderung: Nach Therapieversagen; bei Verdacht auf primärresistenten Viren; mit speziellem Anforderungsschein. Die genotypische Resistenzbestimmung bei HCV ist zurzeit keine GKV-Leistung Durchführung: auf Anfrage Informationen zu anderen Parametern erhalten Sie auf Anfrage ([email protected]) HLAB5701* HIV-Medikamentenspiegelmessung * Pharmakogenomik * Partnerlabor (Version 1 / 12.2015)