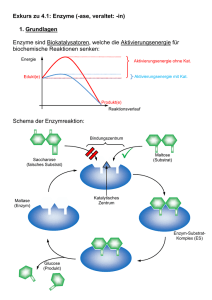
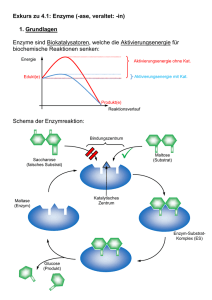
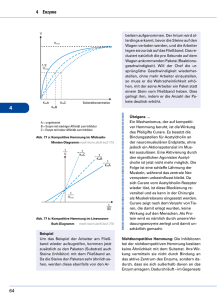
Seite als PDF downloaden - Max-Planck
Werbung

Jahrbuch 2003/2004 | Betz, Heinrich; Müller, Ulrike | Molekulare Analyse der synaptischen Hemmung Molekulare Analyse der synaptischen Hemmung Molecular analysis of synaptic inhibition Betz, Heinrich; Müller, Ulrike Max-Planck-Institut für Hirnforschung, Frankfurt am Main Korrespondierender Autor E-Mail: [email protected] Zusammenfassung Die Aktivitäten des Nervensystems w erden durch das präzise Zusammenspiel von erregenden und hemmenden Impulsen bestimmt. Die Abteilung Neurochemie erforscht die molekularen Mechanismen, w elche Hemmung an zentralnervösen Schaltstellen zw ischen Nervenzellen vermitteln. Dabei gilt ein besonderes Interesse der Funktion von Membranproteinen, w elche Hemmung durch die Aminosäure Glyzin vermitteln oder regulieren. Im Berichtsjahr konnten durch die Herstellung von Mausmutanten für spezifische Subtypen von sog. Glyzintransportern und Glyzinrezeptoren w ichtige Funktionen bei der Hemmung motorischer und Schmerzempfindungen übertragender Schaltkreise identifiziert w erden. Die erhaltenen Befunde sind für die Entw icklung neuer Neuropharmaka w ichtig. Summary The proper functioning of the nervous system requires a precise interplay of excitatory and inhibitory nerve impulses. Our department investigates the molecular mechanisms of synaptic inhibition in the central nervous system. A particular focus are studies on the function of membrane proteins w hich mediate or regulate inhibition by the amino acid glycine. By generating mouse mutants for specific subtypes of glycine transporters and glycine receptors, important functions of these proteins in the inhibition of motor and pain pathw ays could be identified. Our results are important for the development of new neuroactive drugs. Die Aminosäure Glyzin ist neben der γ-Aminobuttersäure (GABA) die w ichtigste hemmende Überträgersubstanz (Neurotransmitter) im zentralen Nervensystem. Glyzin w ird in Nervenendigungen in kleinen sog. synaptischen Vesikeln gespeichert und bei Erregung an den Schaltstellen zw ischen Nervenzellen, den Synapsen, auf Zielneurone ausgeschüttet. Dort bindet es an spezifische Glyzinrezeptoren, w elche porenartige Ionenkanäle in der Zellmembran von Neuronen ausbilden. Nach Bindung des Transmitters Glyzin öffnet sich der RezeptorKanal, und Chlorid-Ionen strömen in die Zelle ein. Dieser Ionenfluss hemmt die Nervenreizleitung und dämpft das "Feuern" der Neurone. Nach der Rezeptorbindung w ird Glyzin durch hochaffine Transportsysteme, die sog. Glyzintransporter, in die Nervenendigung bzw . umliegenden Gliazellen aufgenommen und so der Übertragungsvorgang beendet. Für Glyzin sind im Zentralnervensystem von Säugetieren zw ei verschiedene Transporterproteine bekannt. Das eine (GlyT1) ist in den die Nervenzellen umgebenden Stütz- oder Gliazellen lokalisiert, das zw eite (GlyT2) © 2004 Max-Planck-Gesellschaft w w w .mpg.de 1/4 Jahrbuch 2003/2004 | Betz, Heinrich; Müller, Ulrike | Molekulare Analyse der synaptischen Hemmung hochspezifisch in Hemmung vermittelnden Interneuronen des Rückenmarks und Hirnstamms exprimiert. Um die spezifischen Funktionen dieser Glyzintransporter präziser zu erhellen, w urden Mauslinien entw ickelt, in denen die GlyT1- bzw . GlyT2-Gene inaktiviert sind. Diese Mauslinien stellen Tiermodelle für zw ei seltene neurologische Erbkrankheiten des Menschen dar, die so genannte Glyzinenzephalopathie, w elche zu einer schw eren Störung der Hirnentw icklung und Tod im frühen "Schreckkrankheit", deren schw ere Kindesalter Formen ebenfalls führt, und die hereditäre Hyperekplexie oder mit frühem Kindstod einhergehen können. Die Untersuchung der Mutantentiere ergab, dass GlyT1 hauptsächlich für die Terminierung der glyzinergen Neurotransmission verantw ortlich ist, w ährend GlyT2 die W iederaufnahme von Glyzin in die vorgeschaltete Nervenendigung vermittelt und dadurch die Bereitstellung von Glyzin für neue Übertragungsvorgänge sichert. Somit haben gliale und neuronale Transporter unterschiedliche Funktionen. Die an den Glyzintransporter-defizienten Mauslinien gew onnenen Erkenntnisse sind für die Entw icklung neuer therapeutischer Ansätze von Bedeutung. Das GlyT1-Protein z. B. gilt derzeit als eines der w ichtigsten Zielmoleküle für die Entw icklung neuer bei Schizophrenie w irksamer Pharmaka. Die genauen Ursachen dieser häufigsten psychiatrischen Erkrankung sind bisher ungeklärt. In Tierversuchen und klinischen Studien an Schizophreniepatienten konnte aber gezeigt w erden, dass die verbesserte Aktivierung des Glyzin-abhängigen erregenden NMDA-Rezeptors durch direkte Glyzinsubstitution oder pharmakologische Hemmung der GlyT1vermittelten Glyzinaufnahme typische Symptome der Schizophrenie deutlich reduziert. Etliche Forschungslabors in Pharmafirmen suchen deshalb nach klinisch nutzbaren Inhibitoren von GlyT1, da solche Stoffe für die Behandlung von Psychosen vielversprechend erscheinen. Die jetzt durch Geninaktivierung erhaltenen Befunde lassen vermuten, dass derartige Therapieansätze möglicherw eise mit erheblichen Nebenw irkungen behaftet sind, da GlyT1 vitale Funktionen an hemmenden Synapsen im Hirnstamm hat. In neugeborenen GlyT1-defizienten Tieren führt die verminderte Glyzinaufnahme zu einer verstärkten Aktivierung hemmender Rezeptoren, w odurch es zu einer lethalen Suppression des Atemrhythmus kommt. In Zusammenarbeit mit der Arbeitsgruppe Müller, der Abteilung Neuroanatomie und vielen Kollegen aus dem In- und Ausland gelang außerdem bei Arbeiten an einem Subtyp des inhibitorischen Glyzinrezeptores, GlyRα3, die Identifikation eines bisher nicht bekannten Steuermechanismus bei der Schmerzverarbeitung. Mithilfe genetisch veränderter Mäuse konnte jener molekulare Signalw eg aufgeklärt w erden, der bei Entzündungen zu einer verstärkten Schmerzreizleitung vom Rückenmark zum Gehirn führt. Entzündungsreaktionen, die als Folge einer Gew ebeverletzung entstehen können, gehen typischerw eise mit einer erhöhten Empfindlichkeit gegenüber Schmerzen einher. Hierbei führen Reize, die bereits unter Normalbedingungen als schmerzhaft empfunden w erden, zu einer massiv verstärkten Schmerzreaktion (Hyperalgesie), und an sich neutrale Reize, w ie beispielsw eise leichte Berührungen, können heftige Schmerzen auslösen (Allodynie). Diese inflammatorische Sensitisierung gegenüber Schmerzreizen ist z. T. auf eine erhöhte Erregbarkeit der peripheren Nervenzellen zurückzuführen. Forschungsarbeiten der letzten Jahre zeigen aber, dass auch Nervenzellen des Rückenmarks durch entzündliche Prozesse empfindlicher w erden. Hierbei spielen Prostaglandine, eine Klasse von Botenstoffen, die w ährend Entzündungsreaktionen ausgeschüttet w erden, eine zentrale Rolle. So beruht die W irkungsw eise von Schmerzmitteln w ie Aspirin auf der Hemmung der Prostaglandin-Synthese. Interessanterw eise w erden Prostaglandine, insbesondere der Subtyp E2 (PGE2), nicht nur von Zellen in der unmittelbaren Umgebung des Entzündungsherdes produziert, sondern auch im Rückenmark steigt der Prostaglandin-Spiegel massiv an. Das eingehende Schmerzsignal w ird somit im Rückenmark über eine PGE2-abhängige Signalkaskade nochmals verstärkt. Diese Verstärkung erfolgt in den oberflächlichen Schichten des Rückenmarks, dem dorsalen Horn. Dieses ist die zentrale Schaltstelle zw ischen schmerzempfindlichen Nervenfasern der Peripherie und nachgeschalteten Nervenzellen, die das Signal dann zum Gehirn w eiterleiten. © 2004 Max-Planck-Gesellschaft w w w .mpg.de 2/4 Jahrbuch 2003/2004 | Betz, Heinrich; Müller, Ulrike | Molekulare Analyse der synaptischen Hemmung Ziel der Arbeit w ar ursprünglich, die Funktion des GlyRα3-Subtyps zu verstehen. Hierzu w urden Gew ebeschnitte des Rückenmarks von Mäusen mit Fluoreszenz-markierten Antikörpern gegen GlyRα3 inhibiert (v g l. Abb. 1). Diese Versuche ergaben für GlyRα3 eine spezifische Lokalisation im dorsalen Horn des Rückenmarks, w as auf eine mögliche Funktion des Rezeptors in der Schmerzreizleitung hinw ies. Aus elektrophysiologischen Untersuchungen der Arbeitsgruppe von Hanns-Ulrich Zeilhofer von der Universität Erlangen-Nürnberg w ar bekannt, dass die Nervenimpulsleitung von Neuronen des dorsalen Horns durch Prostaglandine moduliert w ird und dass hierbei Glyzin-Rezeptoren beteiligt sind. Mithilfe von genetisch modifizierten Mäusen, in denen das Gen für GlyRα3 inaktiviert w urde, w urden in Zusammenarbeit mit Zeilhofer gezeigt, dass spezifisch die α3-Isoform des Glyzinrezeptors von Prostaglandinen moduliert w ird und diesen Rezeptoren damit eine Schlüsselfunktion in der inflammatorischen Schmerzsensitisierung zukommt. Eine im m unhistoche m ische Fä rbung de s R ück e nm a rk s m it Antik örpe rn ge ge n GlyR α3 (grün) und Ge phyrin (rot) ze igt die spe zifische Lok a lisa tion von GlyR α3 im dorsa le n Horn. © P rof. He inz W ä ssle So zeigten elektrophysiologische Messungen an Rückenmarksschnitten von GlyRα3-defizienten Tieren nicht die typische Hemmung der Glyzin-abhängigen Nervenreizleitung. Um herauszufinden, w elche Rolle GlyRα3 in der physiologischen Schmerzantw ort hat, w urde die Schmerzempfindlichkeit von GlyRα3-defizienten mit der von normalen Mäusen verglichen. Beide Tiergruppen reagierten in gleicher Weise auf akute Schmerzreize. W urde jedoch zunächst eine Entzündungsreaktion, zum Beispiel durch Injektion einer irritierenden Substanz in die Pfote induziert, so blieb die hierdurch in normalen Mäusen ausgelöste, langanhaltende Schmerzsensitisierung in den GlyRα3-defizienten Tieren aus. Zusammenfassend zeigen diese Versuche, dass die Hemmung von GlyRα3 essentiell ist für die nach Entzündungen gesteigerte Schmerzreizleitung durch Rückenmarksneurone. Auf molekularem Niveau löst die Bindung des Prostaglandins PGE2 an Zelloberflächenrezeptoren die Aktivierung einer Signalkaskade aus, die zur Übertragung von Phosphatgruppen auf GlyRα3 führt (vgl. Abb. 2). Hierdurch w ird der Rezeptor inaktiviert und kann seine hemmende W irkung auf die Schmerzreizleitung nicht mehr ausüben. Letztlich führt dies zu einer gesteigerten Aktivität der Rückenmarksneurone, das Schmerzsignal w ird somit stärker. Die Entw icklung von Substanzen, w elche diesen Signalw eg unterbinden, könnte zu neuen Therapien für chronische Schmerzzustände führen. © 2004 Max-Planck-Gesellschaft w w w .mpg.de 3/4 Jahrbuch 2003/2004 | Betz, Heinrich; Müller, Ulrike | Molekulare Analyse der synaptischen Hemmung Bindung von Glyzin a n de n GlyR α3 führt norm a le rwe ise zum Einstrom von C hloridione n und da m it zur He m m ung de r Ne rve nre izle itung. In Ge ge nwa rt de s P rosta gla ndins P GE2 k om m t e s zur P hosphorylie rung und Ina k tivie rung de s R e ze ptors GlyR α3. Die se Block a de e rle ichte rt die ne urona le Ak tivie rung und Schm e rzre izle itung. © P D Dr. Ulrik e Mülle r © 2004 Max-Planck-Gesellschaft w w w .mpg.de 4/4