Anhang 13: Patienteninformation und Einverständniserklärung:
Werbung

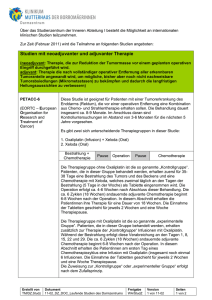
Anhang 13: Patienteninformation und Einverständniserklärung: PHASE-II-STUDIE ZUR ADJUVANTEN RADIOCHEMOTHERAPIE MIT EINER KOMBINATION AUS 5-FLUOROURACIL/ CISPLATIN/DOCETAXEL UND BESTRAHLUNG BEI PATIENTEN MIT KOMPLETT RESEZIERTEM MAGENKARZINOM (R0) IM STADIUM II BIS IV (M0) Sehr geehrte Patientin, sehr geehrter Patient, Sie sind darüber informiert worden, dass Sie an einem Magenkarzinom leiden. Dieses wurde vor kurzem operiert. Allerdings können trotz der Operation einige Tumorzellen im Körper zurückgeblieben sein, die ein Wiederauftreten der Erkrankung verursachen könnten. Daher besteht, abhängig von der genauen Tumorgröße und/oder des Befalls von Lymphknoten, ein Risiko von bis zu 70%-80% für das Wiederauftreten der Erkrankung. In der Vergangenheit ist daher untersucht worden, ob sich durch eine zusätzliche Chemotherapie oder Strahlenbehandlung eine Verringerung dieses Risikos erreichen lässt. Mehrere dieser Studien zeigen widersprüchliche Ergebnisse. Neue Untersuchungsergebnisse aus den USA allerdings zeigen, dass durch eine zusätzliche, kombinierte Chemo-/Strahlentherapie sich das Risiko einen Rückfall zu erleiden möglicherweise deutlich reduzieren lässt. Wir möchten Ihnen daher die Teilnahme an einer Studie anbieten, in der sie zusätzlich zur Operation noch eine Chemotherapie und Strahlenbehandlung erhalten. Wir hoffen damit, eventuell im Körper verblieben Tumorzellen zu zerstören und das Risiko für ein Wiederauftreten der Erkrankung zu senken. Ziel der Untersuchung ist zum einen die Prüfung der Verträglichkeit und zum anderen die Analyse der Wirksamkeit der im folgenden erklärten Kombination aus Chemotherapie und Bestrahlung. Dabei erhalten Sie eine Nachbehandlung, die aus drei Therapieblöcken besteht. Zunächst werden zwei Zyklen alleinige Chemotherapie verabreicht, gefolgt von einer Strahlentherapie plus Chemotherapie (5-FU), und im Anschluss daran folgen wieder zwei identische Zyklen der alleinigen Chemotherapie. Chemotherapie: In der Behandlung des Magenkarzinoms ist 5-Fluorouracil (5-FU) eines der wichtigsten Medikamente. 5-FU ist seit langem für die Behandlung des Magenkarzinoms in Deutschland zugelassen. Cisplatin ist ein bekanntes, für die Therapie verschiedener Tumoren in Deutschland zugelassene Substanz, über deren Anwendung weitreichende Erfahrungen vorliegen. Cisplatin ist in Deutschland nicht für die Therapie des Magenkarzinoms zugelassen. Studien haben aber gezeigt, daß Cisplatin auch bei Tumorerkrankungen des Magens zu den wirksamsten Medikamenten gehört. ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 12 von 37 05.03.2004 Um die Ergebnisse der Chemotherapie zu verbessern, haben wir 5-FU, und Cisplatin mit einem weiteren Medikament, Docetaxel kombiniert. Docetaxel ist ein bekanntes, für die Therapie von Brustund Lungenkrebs in Deutschland zugelassene Substanz, über deren Anwendung weitreichende Erfahrungen vorliegen. Docetaxel ist in Deutschland noch nicht für die Therapie des Magenkarzinoms zugelassen. Studien haben aber gezeigt, dass Docetaxel auch bei Tumorerkrankungen des Magens zu den wirksamsten Medikamenten gehört. Bei der Ihnen vorgeschlagenen Behandlung wird eine Kombinationstherapie bestehend aus Docetaxel und 5-FU/Cisplatin eingesetzt. Diese Kombination wurde bereits im Rahmen einer großen Untersuchungen bei Patienten mit metastasiertem Magenkarzinom geprüft und es konnte eine gute Wirksamkeit gezeigt werden. Daraus resultiert unsere berechtigte Hoffnung, dass diese Therapie auch in Ihrer Situation wirksam ist und eventuell zurückgebliebene Tumorzellen zerstören könnte. Die Basis der Therapie ist eine 4-taegige Dauerinfusion von 5-FU in einer Dosierung von 750 mg/m² Körperoberfläche (KO) taeglich, das entspricht bei 75 kg Körpergewicht und 175 cm Körpergröße 1425 mg Gesamtdosis. Cisplatin (75 mg/m² KO -das entspricht bei 75 kg Körpergewicht und 175 cm Körpergröße 142 mg Gesamtdosis- als 60-Minuten-Infusion) und Docetaxel (65 mg/m² KO -das entspricht bei 75 kg Körpergewicht und 175 cm Körpergröße 124 mg Gesamtdosis- als 60-MinutenInfusion) werden jeweils nacheinander am Tag 1 der Chemotherapie gegeben. Nach den 4 Therapietagen wird 3 Wochen pausiert. Dies entspricht einem Behandlungszyklus. Es werden zunaechst 2 dieser Zyklen durchgefuehrt. Daran anschließend wird die Strahlenbehandlung durchgeführt. Zur Bestrahlung wird parallel täglich eine 24-Stunden Infusion des Medikaments 5-FU (225 mg/m²) verabreicht. Danach folgen zwei weitere Zyklen Chemotherapie, die genau wie die Zyklen vor der Strahlentherapie aufgebaut sind. Diese Chemotherapie wird in der Regel ambulant appliziert. Voraussetzung für die Durchführung der Therapie ist die operative Anlage eines venösen Dauerverweilsystems (PORT), über das die Chemotherapie verabreicht werden kann, aber auch Blutentnahmen möglich sind. Dieses Verweilsystem wird in einer Kurznarkose implantiert. Über mögliche Risiken dieses Standardeingriffs wird Sie der Chirurg gesondert aufklären. Während der Therapie können Dosisanpassungen und Therapieverzögerungen notwendig sein. Die Gabe einer geringeren Medikamentendosis nach Beurteilung durch Ihren Arzt bedeutet dann jedoch nicht, dass Sie weniger wahrscheinlich auf diese Therapie ansprechen, sondern zeigt vielmehr die individuell unterschiedliche Verträglichkeit einer solchen Therapie. Es ist deshalb sehr wichtig, dass Sie den behandelnden Arzt über mögliche Nebenwirkungen unterrichten, damit eine sichere und wirksame Therapie gewährleistet werden kann. Andere Medikamente als vom Studienarzt angeordnete, dürfen nicht ohne Absprache eingenommen werden. Dies gilt selbstverständlich nicht in Notfällen. ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 13 von 37 05.03.2004 Die Chemotherapie kann zu folgenden möglichen Nebenwirkungen führen: 1. Eine Verringerung der Zellen im Blut, so dass ein höheres Risiko bezüglich Blutarmut (Anämie), Infektionen und Blutungskomplikationen während der Therapie auftreten kann. Regelmäßige Blutbildkontrollen lassen diese Veränderungen rechtzeitig erkennen. Solche Veränderungen können auch zur Dosisreduktion oder Therapieverschiebung führen oder die Gabe von Bluttransfusionen notwendig machen. 2. Übelkeit und Erbrechen, verbunden mit Appetitlosigkeit und Durchfall. Hierfür werden Sie vorbeugende Medikamente erhalten. 3. Vorübergehender Haarausfall (Haare wachsen nach Therapieende wieder nach). 4. Selten kann es zu allergischen Reaktionen auf die Medikamente kommen (Hautausschlag, Atemnot, Blutdruckabfall, allergischer Schock). 5. Hautausschlag mit Rötung der Handflächen und Fußsohlen, Entzündung der Mund-RachenSchleimhäute, Schädigung der Finger- und Zehnnägel. 6. Durchfall. 7. Schädigung der Nerven (Kribbeln und Pelzigkeitsgefühl v.a. an den Fingerspitzen) 8. Schädigung des Gehörs (Ohrgeräusch, schlechteres Hören für hohe Töne, Schwindel) und der Nierenfunktion durch Cisplatin 9. Muskel- und Gelenkschmerzen 10. Nebenwirkungen am Herzen (sehr selten), wie z.B. Herzmuskelschäden und an der Leber (Leberwerterhöhung) 11. Durch die Kombination von mehreren Chemotherapiemedikamenten können Nebenwirkungen verstärkt auftreten. Insgesamt sind schwere Nebenwirkungen selten. Da sich die bei diesem Behandlungsprotokoll eingesetzten Medikamente teilweise als schädigend für den Fötus erwiesen haben, sollte eine Schwangerschaft vermieden werden. Grundsätzlich sollte vor Therapiebeginn ein Schwangerschaftstest durchgeführt und während der Chemotherapie medizinisch anerkannte Verhütungsmaßnahmen eingehalten werden. Alle Nebenwirkungen bilden sich in der Regel nach Absetzten der Medikamente zurück und lassen sich auch gut medikamentös behandeln. Strahlentherapie: Zweck der Strahlenbehandlung Zweck der Strahlenbehandlung ist es, verbliebene krankhaft veränderte Zellen zu zerstören, um ihr weiteres Wachstum und ihre Ausbreitung zu verhindern. Ob wir dieses Ziel erreichen, hängt vor allem ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 14 von 37 05.03.2004 von der Strahlenempfindlichkeit der kranken Zellen, aber auch von der Strahlenverträglichkeit des umgebenden gesunden Körpergewebes ab. Vorbereitung der Strahlenbehandlung Nach einer eingehenden körperlichen Untersuchung und nach Spezialuntersuchungen (z.B. Röntgenuntersuchung, Ultraschall, Computertomografie) legt der Arzt zunächst das Zielgebiet fest, das bestrahlt werden soll. Ein spezielles Röntgengerät (Therapie-Simulator) hilft uns, eine genaue Einstellung für die spätere Bestrahlungsregion zu finden. Um das gesunde Gewebe zu schonen, wählen wir unter Unständen verschiedene Einstrahlrichtungen. Dann zeichnen wir die Eintrittspunkte sowie die Einfallsrichtungen der Strahlenbündel auf der Haut auf. Diese Markierungen dürfen keinesfalls entfernt werden; sie gewährleisten, dass Sie jedesmal an exakt derselben Stelle bestrahlt werden. Die Gesamtbestrahlungsmenge (Dosis) im Zielgebiet, die Tagesmenge, die dafür erforderliche Bestrahlungszeit sowie die Zahl der Bestrahlung werden durch Arzt und Physiker mit modernen Rechenmethoden festgelegt. Eine erfolgreiche und schonende Behandlung erfordert eine exakte Planung. Dazu kann ein Zeitaufwand von bis zu mehreren Tagen erforderlich sein. Dieses Vorgehen dient Ihrer Sicherheit. Bei den Röntgenuntersuchungen werden die Strahlenschutzvorschriften beachtet. Durchführung der Bestrahlung Vom Arzt und seinen Mitarbeitern werden Sie so auf dem Bestrahlungstisch gelagert, wie es für die Bestrahlung am günstigsten ist. Bitte sagen Sie es uns, wenn es Ihnen unbequem wird. Während der Bestrahlung bleiben Sie bitte ruhig in der angeordneten Stellung. Die Bestrahlung selbst ist schmerzlos und dauert wenige Minuten. Nebenwirkungen der Strahlenbehandlung Wir achten darauf, dass die Behandlung so schonend wie möglich durchgeführt wird. Trotz ihrer sorgfältigen Planung und Durchführung sind Nebenwirkungen jedoch nicht immer zu vermeiden. Der Arzt kann sie mit Medikamenten lindern. Müdigkeit und leichte Übelkeit (sogenannter Strahlenkater) als unmittelbare Folgen der Strahlenbehandlung sind heute schwächer und seltener als früher. Doch ist häufiger damit zu rechnen, wenn ein großer Teil des Bauches bestrahlt wird und die Leber und Dünndarm teilweise oder ganz im Bestrahlungsfeld liegt. Meistens tritt Übelkeit nur während der ersten Bestrahlungstage auf und zwar 3 bis 4 Stunden nach der Bestrahlung. Erbrechen ist selten. Auf jeden Fall helfen wir dann mit Medikamenten. ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 15 von 37 05.03.2004 Manchmal kommt es im Verlauf der Bestrahlung zu Blähungen und Durchfällen. Ganz selten können schmerzhafte Darmkrämpfe, Schleim- und Blutabgänge, Geschwüre, Blutungen oder eine Nahtinsuffizienz auftreten; wir werden dann die Bestrahlung unterbrechen. Alle diese Begleiterscheinungen bilden sich meist nach Bestrahlungsabschluss oder unter medikamentöser Behandlung vollständig zurück. Werden bei der Vorbereitung der Strahlenbehandlung Röntgenkontrastmittel verwendet, kann es in seltenen Fällen zu Überempfindlichkeitsreaktionen im Bereich von Kreislauf, Nieren und Nerven kommen. Schwere, lebensbedrohliche Zwischenfälle sind extrem selten. An Spätfolgen können auftreten: - länger anhaltende Verdauungsstörungen (Völlegefühl, Blähungen, Neigung zu Durchfällen) - selten dauerhafte Verklebungen, Fisteln und Verengungen von Darmschlingen, die eine Operation notwendig machen können - ganz selten Schwellungen und Verhärtungen des Unterhautgewebes, Hautverfärbungen - Wundheilungsstörungen bei späteren Operationen oder Verletzungen im bestrahlten Gebiet - selten Nierenschrumpfung, eventuell mit Nierenfunktionsverlust und Bluthochdruck - Venenverschlusskrankheit der Leber - extrem selten Lähmungen infolge von Vernarbungen im Rückenmark oder im Nervengeflecht; die schwersten Zwischenfälle, unvollständige und vollständige Querschnittslähmung, sind inzwischen so selten geworden, dass dazu nicht einmal statistisches Zahlenmaterial existiert. Wenn bei Frauen die Eierstöcke mitbestrahlt werden, kommt es fast immer zur Unfruchtbarkeit (Ausbleiben der Monatsblutung, Beginn der Wechseljahre). Es ist nicht auszuschließen, dass das natürliche Risiko, an einer Zweitgeschwulst zu erkranken, durch die Bestrahlung erhöht wird. Gleichzeitig zur Bestrahlung wird an allen Bestrahlungstagen eine kontinuierliche Infusion über 24h mit dem Chemotherapeutikum 5-Fluorouracil durchgeführt werden. Dieses Medikament haben Sie bereits im Rahmen des ersten Zyklus der alleinigen Chemotherapie erhalten. Durch die kontinuierliche Infusion über jeweils 5 Tage kann es bei einigen Patienten zu verstärkter Übelkeit, Appetitlosigkeit, Erbrechen und Durchfällen kommen. Diese Nebenwirkungen versuchen wir durch die vorsorgliche Gabe von Medikamenten zu vermeiden. Es ist dennoch nicht auszuschließen, dass durch die gleichzeitige Gabe von Chemotherapie und Strahlentherapie verstärkt Nebenwirkungen auftreten. Aufgrund der bisher vorliegenden Informationen kann man jedoch annehmen, dass der Nutzen der Therapie das Risiko, eventuell Komplikationen zu erleiden, zu überwiegen scheint. Falls trotz intensiver Begleittherapie mit Flüssigkeit, Antiemetika und hochkalorischer Ernährung diese Beschwerden nicht zu beherrschen sind, wird die Bestrahlung und Chemotherapie pausiert. ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 16 von 37 05.03.2004 Regelmäßige Laborkontrollen werden zur Erkennung einer Infektanfälligkeit oder Entgleisung von Blutwerten durchgeführt. Im Rahmen dieser Studie werden eine Reihe von Untersuchungen wie Röntgenaufnahmen, Computertomographie, Ultraschall, Hörprüfung und Blutbildkontrollen notwendig sein. Diese Untersuchungen werden jedoch im selben Umfang durchgeführt werden, wie bei jedem anderen Patienten, der eine Chemotherapie erhält. Zusätzliche Belastungen durch die Teilnahme an der Studie entstehen für Sie nicht. Die entsprechenden Vorschriften zum Strahlenschutz werden selbstverständlich beachtet. Um zusätzliche feingewebliche Untersuchungen durchführen zu können, möchten wir von dem pathologischen Institut, in dem Ihr Tumor untersucht wurde, Gewebeproben Ihres Magentumors anzufordern. Wir bitten Sie hierzu um Ihre Zustimmung. Diese Untersuchungen dienen ausschließlich dazu Tumormerkmale zu bestimmen, die möglicherweise eine Vorhersage des Krankheitsverlaufes erlauben oder einen Einfluss auf die Wirkung der Chemotherapie bzw. das Behandlungsergebnis haben könnten. Damit ist es in Zukunft eventuell möglich, bereits anhand des Magentumorpräparates eine genauere Aussage zu treffen, welche Patienten die zusätzliche Behandlung benötigen und welche Therapie am erfolgversprechensten ist. Genetische Untersuchungen werden nicht durchgeführt. Diese Untersuchungen sind für Sie mit keinem zusätzlichen Aufwand oder Belastungen verbunden. Nach Durchführung der Untersuchungen werden die Präparate an das jeweiligen pathologische Institut, bei dem die Erstuntersuchung durchgeführt wurde, zurückgesandt. Sie können diesem Teilaspekt der Studie in der Einverständniserklärung separat zustimmen. Sie können aber auch ohne Zustimmung zu siesen zusätzlichen Untersuchungen am Behandlungsteil der Studie teilnehmen. Alle Ergebnisse der Tumorauswertung werden nur in anonymisierter Form ausgewertet. Sie stehen unter keinem Zwang an dieser Studie teilzunehmen. Falls Sie Ihre Zustimmung geben, werden wir Sie über jede Neuigkeit, welche Ihre Zustimmung an der Teilnahme beeinflussen könnte, informieren. Es steht Ihnen jederzeit frei, ohne Angaben von Gründen, die Teilnahme an dieser Studie zu beenden. Falls es sich zeigt, dass die Erkrankung trotz der Therapie wieder auftritt, wird die begonnene (Studien-) Therapie nicht mehr fortgeführt und Ihr behandelnder Arzt wird mit Ihnen über andere Behandlungsmöglichkeiten sprechen. Ihre Unterlagen werden streng vertraulich behandelt. Zur Dokumentation und Auswertung der Studie ist es jedoch notwendig, dass einige Ihrer Daten von an der Studie beteiligten Ärzten, Mitarbeiter der Studienzentrale aber auch von Behörden zur Dokumentation und Überprüfung der Richtigkeit der Dokumentation eingesehen werden. Die Einsicht in Ihre Krankenakte zur Überprüfung der Daten ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 17 von 37 05.03.2004 erfolgt selbstverständlich unter Wahrung des Datenschutzes. Sie müssen aber hierzu den Arzt von seiner Schweigepflicht entbinden. Die Weitergabe Ihrer Daten an Dritte erfolgt nur in anonymisierter Form und im erforderlichen Umfang (z.B. wissenschaftliche Veröffentlichung). Bitte zögern Sie nicht, weitere Informationen jetzt oder in Zukunft einzufordern und Fragen zu stellen. Es wurde eine Versicherung bei der HDI Industrie Versicherung AG, Niederlassung Nürnberg, Dürrenhofstr. 6, 90402 Nürnberg, Ansprechpartner Frau Silke Reindl, Telefon (0911) 20 12 – 238, Telefax (0911) 20 12 – 336, Email [email protected] (Versicherungsnummer: HDI 85-40348603014-390) für alle an dieser Studie teilnehmenden Patienten abgeschlossen. Der Versicherungsschutz gilt für alle im Rahmen des Studienprotokolls vorgenommenen Handlungen und verabreichten Arzneimittel für die Dauer der Studie, sowie Gesundheitsschäden, die spätestens 5 Jahre nach Abschluss der Behandlung auftreten sollten. Die maximale Versicherungssumme beträgt Euro 500 000,- pro Patient. Um den Versicherungsschutz nicht zu gefährden, ist es notwendig, einige Bedingungen einzuhalten. Sie dürfen sich während der Studienteilnahme –außer im Notfall- einer anderen medizinischen Behandlung nur nach Absprache mit dem Prüfarzt unterziehen. Sie dürfen während der Teilnahme an dieser klinischen Studie (30 Tage vor Beginn und 30 Tage nach Abschluß der Studienteilnahme) an keiner weiteren klinischen Studie teilnehmen (da ansonsten der Versicherungsschutz gefährdet ist). Jede Verschlechterung Ihres Gesundheitszustandes, die als Folge der klinischen Prüfung eingetreten sein könnte, muß unverzüglich der Versicherung oder dem Prüfarzt angezeigt werden, damit durch diesen eine Meldung an die Versicherung erfolgen kann. Sie müssen alle zweckmäßigen Maßnahmen treffen, die der Aufklärung der Ursachen oder des Umfanges eines Schadens sowie dessen Minderung dienen. Eine parallele Teilnahme an anderen Studien kann in einem Versicherungsfall zu Problemen führen und ist daher nicht gestattet. Im Falle eines Todesfalles muß die Versicherung unverzüglich benachrichtigt werden. Eine Wegeunfallversicherung besteht nicht. Herzlichen Dank für Ihr Interesse an dieser Studie. ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 18 von 37 05.03.2004 PHASE-II-STUDIE ZUR ADJUVANTEN RADIOCHEMOTHERAPIE MIT EINER KOMBINATION AUS 5-FLUOROURACIL/ CISPLATIN/DOCETAXEL UND BESTRAHLUNG BEI PATIENTEN MIT KOMPLETT RESEZIERTEM MAGENKARZINOM (R0) IM STADIUM II BIS IV (M0) EINVERSTÄNDNISERKLÄRUNG: Ich hatte ausreichend Gelegenheit, die Patienteninformation zu lesen und Fragen zu stellen. Meine Fragen wurden ausführlich beantwortet. Ich bin mit der Behandlung in Rahmen der Studie und der Auswertung der Therapieergebnisse in anonymisierter Form einverstanden. Meine Unterlagen werden streng vertraulich behandelt. Zur Dokumentation und Auswertung der Studie ist es notwendig, dass einige meiner Daten von an der Studie beteiligten Ärzten, Mitarbeiter der Studienzentrale aber auch von Behörden zur Dokumentation und Überprüfung der Richtigkeit der Dokumentation eingesehen werden. Die Weitergabe, Speicherung und Auswertung dieser studienbezogenen Daten erfolgt nach gesetzlichen Bestimmungen und setzt vor Teilnahme an der Studie folgende Einwilligung voraus: 1. Ich erkläre mich damit einverstanden, dass im Rahmen dieser Studie erhobene Daten/Krankheitsdaten auf Fragebögen und elektronischen Datenträgern aufgezeichnet und ohne Namensnennung weitergegeben werden an a. den Auftraggeber der Studie zur wissenschaftlichen Auswertung; Prof. Dr. C. Bokemeyer, Med. Klinik II, Universitätsklinik Tübingen, Otfried-Müller-Str. 10, 72076 Tübingen b. die zuständige Überwachungsbehörde oder Bundesoberbehörde zur Überprüfung der ordnungsgemäßen Durchführung der Studie. 2. Außerdem erkläre ich mich damit einverstanden, dass ein autorisierter und zur Verschwiegenheit verpflichteter Beauftragter des Auftraggebers, der zuständigen inländischen Überwachungsbehörde oder der zuständigen Bundesoberbehörde in meine beim Prüfarzt vorhandenen personenbezogenen Daten Einsicht nimmt, soweit dies für die Überprüfung der Studien notwendig ist. Für diese Maßnahmen entbinde ich den Prüfarzt von der ärztlichen Schweigepflicht. Die Einsicht in meine Krankenakte zur Überprüfung der Daten erfolgt selbstverständlich unter Wahrung des Datenschutzes. Die Weitergabe meiner Daten an Dritte erfolgt nur in ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 19 von 37 05.03.2004 anonymisierter Form und im erforderlichen Umfang (z.B. wissenschaftliche Veröffentlichung). Es ist mir bewusst, dass ich jederzeit und ohne Angabe von Gründen von der Studie zurücktreten kann und dies meine weitere Therapie nicht beeinflussen wird. Über die, für die Studienteilnehmer abgeschlossene Versicherung und die daraus für mich resultierenden Verpflichtungen wurde ich ausreichend informiert. Eine parallele Teilnahme an anderen Studien ist mir nicht gestattet. Der Untersuchung der vorhandenen pathologischen Präparate meines Magentumors stimme ich zu (bitte entsprechend ankreuzen) nicht zu ------------------------------------------------------------------------------------------------------------------------Ort, Datum Unterschrift des Patienten ------------------------------------------------------------------------------------------------------------------------Ort, Datum Unterschrift des aufklärenden Arztes/Onkologie ------------------------------------------------------------------------------------------------------------------------Ort, Datum Unterschrift des aufklärenden Arztes/Strahlentherapie ---------------------------------------------------------------------------------------------------------------------------------------Amendment 5 adjuvante Therapie Magen Seite 20 von 37 05.03.2004