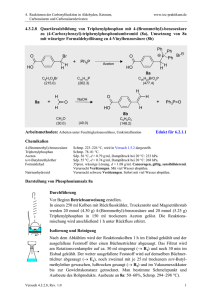
Reaktionen in der Organischen Chemie 4: Alkohole, Aldehyde
Werbung
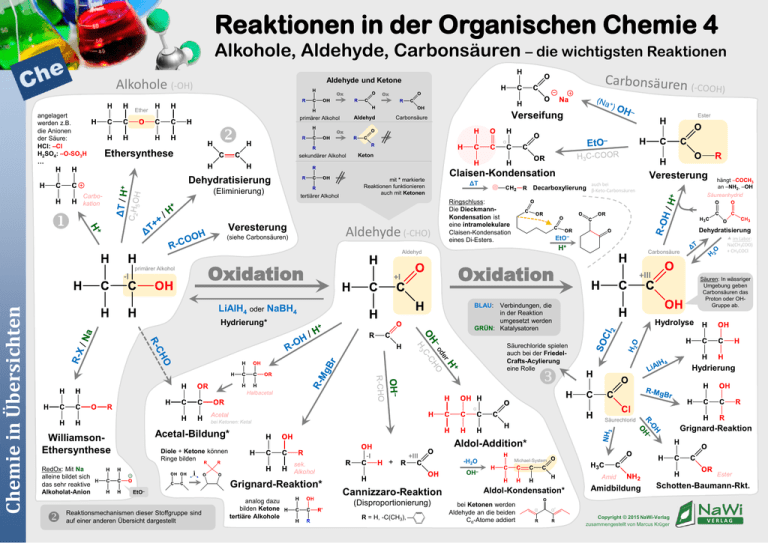
Reaktionen in der Organischen Chemie 4 Alkohole, Aldehyde, Carbonsäuren – die wichtigsten Reaktionen Aldehyde und Ketone Alkohole (-OH) angelagert werden z.B. die Anionen der Säure: HCl: –Cl H2SO4: –O-SO3H … Ox Ox Ether Aldehyd primärer Alkohol α sekundärer Alkohol Dehydratisierung (Eliminierung) tertiärer Alkohol Veresterung Keton mit * markierte Reaktionen funktionieren auch mit Ketonen Aldehyde (-CHO) (siehe Carbonsäuren) Claisen-Kondensation ΔT primärer Alkohol Chemie in Übersichten Oxidation Veresterung Decarboxylierung Ringschluss: Die DieckmannKondensation ist eine intramolekulare Claisen-Kondensation eines Di-Esters. auch bei β-Keto-Carbonsäuren Dehydratisierung H+ im Labor: Na(CH3COO) + CH3COCl Carbonsäure Oxidation +I +III Verbindungen, die in der Reaktion umgesetzt werden GRÜN: Katalysatoren Säuren: In wässriger Umgebung geben Carbonsäuren das Proton oder OHGruppe ab. BLAU: LiAlH4 oder NaBH4 Hydrierung* hängt –COCH3 an –NH2, –OH Säureanhydrid EtO– Aldehyd -I Ester Ox Ethersynthese Carbokation Verseifung Carbonsäure Hydrolyse Säurechloride spielen auch bei der FriedelCrafts-Acylierung eine Rolle Hydrierung Halbacetal α Acetal Säurechlorid bei Ketonen: Ketal RedOx: Mit Na alleine bildet sich das sehr reaktive Alkoholat-Anion Grignard-Reaktion Acetal-Bildung* WilliamsonEthersynthese Aldol-Addition* Diole + Ketone können Ringe bilden EtO– Reaktionsmechanismen dieser Stoffgruppe sind auf einer anderen Übersicht dargestellt -I sek. Alkohol Grignard-Reaktion* analog dazu bilden Ketone tertiäre Alkohole + +III -H2O Michael-System OH– Cannizzaro-Reaktion (Disproportionierung) R = H, -C(CH3), Ester Amid Aldol-Kondensation* bei Ketonen werden Aldehyde an die beiden Cα-Atome addiert α Amidbildung Schotten-Baumann-Rkt. α' Copyright © 2015 NaWi-Verlag zusammengestellt von Marcus Krüger VERLAG Reaktionen in der Organischen Chemie 4a Die Carbonylgruppe δAuch Ketone geben das H am Cα -Atom in basischer Lösung ab. Es kommt hier zur Keto-Enol-Tautomerie: δ+ δ- α OH– Keton δ+ H+ Enolat-Ion OH– H+ Die säurekatalysierte Acetalbildung δ- Bei Ketonen ist der elektronenziehende Effekt der Carbonylgruppe noch etwas größer als bei Aldehyden. kann Elektrophile angreifen, z.B. H+ in saurer Umgebung δ+ Angriff von Nukleophilen möglich, z.B. OH– , C– oder H– (von LiAlH4 / NaBH4) da der EN-Unterschied bei HO größer ist als bei CO, ist der Sauerstoff der OH-Gruppe „etwas negativer“ als der der ORGruppe H+ geht an OH-Gruppe Regeneration des Katalysators δ- starke Basen entfernen hier ein H+ Enol H+ δ+ Angriffspunkte bei Aldehyden und Ketonen H+ - H+ R-OH Regeneration des Katalysators Halbacetal R-OH - H2O Die basenkatalysierte Aldol-Reaktion Chemie in Übersichten - H+ Vollacetal δδ+ OH– δ+ Die basenkatalysierte Cannizzaro-Reaktion (bei tertiärem Cα) Aldol-Addition Regeneration des Katalysators δ+ δ- - OH– H– Regeneration des Katalysators - OH– +III OH– OH– an Cα darf kein H vorhanden sein, da es sonst zur Deprotonierung kommt (s. Aldol-Reaktion) δ+ Die Cannizzaro-Reaktion ist eine Disproportionierung. Regeneration des Katalysators Aldol-Kondensation (besonders bei hohen Temperaturen) δδ+ -I - OH– Die Aldol-Addition kann auch säurekatalysiert stattfinden: δ- H+ δ+ - H+ Regeneration des Katalysators auch hier kann im Anschluss eine Aldol-Kondensation erfolgen Copyright © 2015 NaWi-Verlag zusammengestellt von Marcus Krüger VERLAG Reaktionen in der Organischen Chemie 4b Die Carboxylgruppe Angriffspunkte bei Carbonsäureestern Angriffspunkte bei Carbonsäuren δ- δ- kann Elektrophile angreifen, z.B. H+ in saurer Umgebung δ+ δ+ Angriff von Nukleophilen möglich, z.B. OH– oder C– im Basischen wird H+ abgegeben, es bilden sich Salze wie Na(CH3COO) basische Alkoholat-Ionen wie EtO– entfernen hier ein H+ da der EN-Unterschied bei HO größer ist als bei CO, ist der Sauerstoff der OH-Gruppe „etwas negativer“ als der der ORGruppe H+ geht an OH-Gruppe Die säurekatalysierte Veresterung (Fischer-Veresterung) δ- H+ δ+ - H2O H+ - H+ - H+ R-OH Chemie in Übersichten Regeneration des Katalysators Die Verseifung (irreversibel) δ+ δ- Regeneration des Katalysators Die Claisen-Kondensation Bei starker Erhitzung kommt es hier zur Decarboxylierung (Abspaltung des grauen Bereichs) EtO– OH– - OR– β-Ketoester -OR– ΔT δ+ - H+ Na+ EtO– Die Säure gibt das Proton ab. Eine Veresterung mit NaOH liefert Kernseife, eine Veresterung mit KOH liefert Schmierseife. Die Dieckmann-Kondensation: Intramolekulare Claisen-Kondensation eines Di-Esters. - OR– δ+ (Foto: Graf Foto / CC BY-SA 3.0) Copyright © 2015 NaWi-Verlag zusammengestellt von Marcus Krüger VERLAG