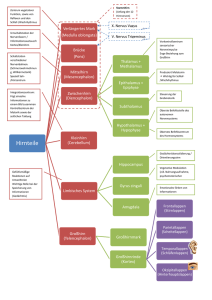
Basalganglien: Struktur, Funktion, Symptome 23.7
Werbung

23 Sensomotorische Systeme: Körperhaltung und Bewegung gungsarmut (Akinese) und Steifheit (Rigor). Eine Therapie der Chorea Huntington ist bisher nicht möglich. U.a. werden Vitaminpräparate eingesetzt, um die GABA/Enkephalin-Neurone vor oxidativem Stress zu schützen und so den Krankheitsverlauf zu verlangsamen. Der Symptomatik des Ballismus (proximal betonte ausfahrende Schleuderbewegungen) liegt eine Schädigung des Nucleus subthalamicus oder seiner efferenten Bahnen zugrunde. Die Bezeichnung „Ballismus“ stammt ursprünglich von der Ähnlichkeit dieser unfreiwilligen Bewegungen mit Wurfbewegungen. Häufig tritt die Erkrankung nur einseitig auf (Hemiballismus) und es sind nur die kontralateralen Extremitäten betroffen. Durch die Schädigung des Nucleus subthalamicus werden die hemmenden Neurone der Pars interna des Globus pallidus nicht mehr aktiviert (Abb. 23.20 C). Auch dies führt letztlich dazu, dass die thalamokortikale Verbindung für andere erregende Eingänge geöffnet wird (Abb. 23.20 C). Dystonien gehen mit langsamen Steigerungen des Muskeltonus einher, die zu abnormen Bewegungen und bizarren Haltungen führen. Sie äußern sich durch Verkrampfungen und Fehlhaltungen, z. B. des Kopfes (sog. Torticollis), und sind von den Betroffenen nicht unterdrückbar. Auch wenn die genauen Ursachen von Dystonien nicht bekannt sind, so führt häufig die wiederholte lokale Injektion von Botulinumtoxin (s. Kap. 4.1.4, S. 110) zur erfolgreichen Therapie. Den Dystonien verwandt sind Athetosen, unwillkürliche, langsame, wurm- oder schraubenförmige, ausfahrende Bewegungen von Händen oder Füßen, die meist mit einer Gelenküberdehnung einhergehen. Ursache ist häufig eine perinatale Schädigung des Striatums, wodurch die hemmende Wirkung auf die Willkürmotorik gestört ist. Eine Therapie ist noch nicht bekannt. Zusammenfassung Kap. 23.6 Basalganglien: Struktur, Funktion, Symptome Die Basalganglien und das Kleinhirn sind parallele subkortikalmotorische Systeme, die in die Verarbeitung komplexer motorischer Information eingebunden sind. Sie erhalten Eingänge von assoziativen und sensomotorischen Kortexarealen und projizieren in erster Linie zu motorischen Rindenfeldern. Funktionell sind beide Strukturen mit der Planung und Programmierung komplexer Bewegungen befasst. Das Kleinhirn ist außerdem für die ordnungsgemäße Durchführung und Koordination von Bewegungen sowie die Kontrolle der Körperhaltung verantwortlich. Die Basalganglien sind kein extrapyramidales System. Die Basalganglien bestehen aus ▬ dem Striatum (Nucleus caudatus, Putamen, Nucleus accumbens), ▬ dem Globus pallidus (Pallidum), ▬ der Substantia nigra (Pars compacta, Pars reticulata) und ▬ dem Nucleus subthalamicus. Die Eingänge in die Basalganglien verlaufen über das Striatum und stammen aus dem gesamten Kortex. Projektionsneurone des Striatums integrieren in geordneter Weise synaptische Eingänge. Die Ausgangsstationen werden von hemmenden 23.7 Kleinhirn: Struktur, Funktion, Symptome 23.7.1 Funktionelle Anatomie des Kleinhirns Das Kleinhirn (Cerebellum) ist ein Anteil des Metencephalons (Hinterhirn) und hat sich phylogenetisch vor allem in den lateralen Abschnitten stark vergrößert (bei 10 % des Volumens enthält es über 50 % der Neurone des Gehirns). Das Kleinhirn erfüllt wichtige Aufgaben bei der Steuerung der Motorik und ist an der Koordination, Feinabstimmung, unbewussten Planung und dem motorischen Lernen beteiligt. Es fungiert eher als Monitor und Modulator von Bewegungen, nicht als Initiator. Die Aufgabe des Kleinhirns ist Neuronen des Globus pallidus pars interna und der Substantia nigra pars reticulata gebildet, welche in die motorischen Thalamuskerne projizieren. Von dort erfolgt eine erregende Weiterleitung der Aktivität in den Kortex. Kortiko-thalamo-kortikale Rückkoppelungssysteme sind funktionsspezifisch und steuern skelettmotorische, okulomotorische, kognitive und limbische Funktionen. Disinhibition und eine daraus resultierende Erregbarkeitserhöhung von Neuronen ist das Funktionsprinzip im direkten und im indirekten Basalganglienweg. Dopamin beeinflusst den Zugang zum direkten und indirekten Weg. Den verschiedenen Rückkoppelungssystemen entsprechend können bei Erkrankungen der Basalganglien skelett- und okulomotorische, assoziativ-kognitive und emotionale Funktionen gestört sein. Motorische Störungen äußern sich als Hypokinesen (Morbus Parkinson infolge einer Degeneration von dopaminergen Neuronen in der Substantia nigra, Störung des direkten Basalganglienwegs), Hyperkinesen (Chorea Huntington infolge einer Degeneration von GABA/Enkephalin-Neuronen im Striatum, Störung des indirekten Basalganglienwegs) oder Dystonien, u. U. verbunden mit abnormem Muskeltonus. vor allem eine Feinabstimmung der Motorik, sprich eine Hemmung überschwänglicher „Grobmotorik“. Ähnlich wie im Cerebrum (Großhirn) so bezeichnet man auch beim Kleinhirn die nach außen gewandte, nervenzellhaltige Schicht als Kortex (Kleinhirnrinde) und die nur aus Faserverbindungen bestehende, innen liegende Schicht als weiße Substanz. Die bilateral angelegten Ansammlungen von Nervenzellen in der weißen Substanz werden als Kleinhirnkerne bezeichnet (Abb. 23.23): Nucleus fastigii, Nucleus interpositus, Nucleus dentatus. Das Kleinhirn lässt sich anatomisch, phylogenetisch oder funktionell gliedern, wobei sich die nach diesen Einteilungsweisen entsprechenden Begriffe teilweise überlappen. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 792 23.7 Kleinhirn: Struktur, Funktion, Symptome Funktionell-anatomische Aspekte. Das Vestibulozerebellum, das weitgehend dem Lobus flocculonodularis entspricht, erhält Eingänge vom Vestibularsystem (Axone von N. VIII und aus den Vestibulariskernen) und projiziert zu den Vestibulariskernen. Funktionell kontrolliert dieser Teil Augenbewegungen (s. Kap. 21.3.2, S. 714 ff.), deren Abstimmung mit der Stellung von Kopf und Hals, sowie das Gleichgewicht (s. Kap. 20.3, S. 700 ff.). Das Spinozerebellum besteht aus Vermis und Pars intermedia, erhält somatosensorische Information aus dem Rückenmark und projiziert auf den Nucleus fastigii und den Nucleus interpositus. Allerdings projiziert auch die Großhirnrinde in die Pars intermedia, d. h. das Spinozerebellum ist nicht rein spinal verschaltet. Im Spinozerebellum wird die Information aus den Effe- A B motorischer Thalamus pontine Kerne tiefe zerebelläre Kerne Sensomotorische Systeme Zerebrozerebellum spinale Eingänge Spinozerebellum Nucleus fastigii Nucleus Deiters Lobus anterior mediale deszendierende Systeme Pars intermedia Nucleus interpositus laterale Hemisphäre Zerebrozerebellum Vermis pontine Eingänge laterale deszendierende Systeme Ausführung Lobus posterior Nucleus dentatus Lobus flocculonodularis vestibuläre Eingänge M1, prämotorischer Kortex Vestibulariskerne Nodulus Vestibulozerebellum Abb. 23.23 Funktionelle Anatomie des Zerebellums. A Schematische Darstellung der Anordnung tiefer zerebellärer Kerne, pontiner Kerne und des motorischen Thalamus im Sagittalschnitt. B Entsprechend der spinalen, pontinen und vestibulären Eingänge (links) Einteilung in Vestibulo-, Spino- und Zerebrozerebellum (zusätzliche visuelle Eingänge im Vermis des rostralen Hinterlappens nicht dar- Gleichgewicht Okulomotorik Planung Programm gestellt). Efferente Projektionen und motorische Funktionen (rechts): über mediale Kerne und Deiters zu medialen, über Interpositus zu lateralen absteigenden Systemen (Ausführung von Bewegungen); über Dentatus zum Motorkortex (Programmierung von Bewegungen); über Vestibulariskerne zum Gleichgewichtssystem (Regulation von Gleichgewicht und Augenbewegungen). 23 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Makroanatomie. Ein Lobus anterior cerebelli (Vorderlappen) kann vom großen Lobus posterior cerebelli (Hinterlappen) und dieser vom relativ kleinen Lobus flocculonodularis („Flöckchen-Knötchen-Lappen") abgegrenzt werden (Abb. 23.23). Zwei parasagittale Furchen trennen einen zentralen Streifen, den Vermis cerebelli (Wurm), von den paarigen Kleinhirnhemisphären. Bei letzteren unterscheidet man auf jeder Seite einen großen lateralen Teil und eine schmale, an den Wurm grenzende Pars intermedia. Der Vermis und die beiden Hemisphärenabschnitte projizieren jeweils auf unterschiedliche zerebelläre Kerne und damit auf unterschiedliche efferente Systeme; insofern hat die sagittale Einteilung auch funktionelle Bedeutung (vgl. Abb. 23.25). 793 23 Sensomotorische Systeme: Körperhaltung und Bewegung renzen und Afferenzen so abgeglichen, dass die gesendeten Kommandos der tatsächlichen augenblicklichen Lage der Extremitäten entsprechen und ständig fein an die neue Lage angepasst werden. Hierunter fällt auch die für das Sprechen notwendige feine Abstimmung der beteiligten mimischen und Kehlkopfmuskulatur. Den weitaus größten Teil bildet beim Menschen das Zerebrozerebellum. Eingänge laufen über pontine Kerne und entstammen dem Großhirn, vor allem den prämotorischen Zentren im Frontallappen (prämotorischer Kortex und supplementärmotorisches Areal). Im Zerebrozerebellum entstehen grobe Bewegungsentwürfe, die anschließend in anderen Regionen und in Rückkopplungsschleifen weiter entwickelt, fein abgestimmt, korrigiert und koordiniert werden. Die Ergebnisse dieser Berechnungen gehen zum Thalamus, wo sie u. a. mit den Ergebnissen der Basalganglien integriert und zum primären und supplementärmotorischen Kortex (Areae 4, 6) weitergeleitet werden. 23.7.2 Feinstruktur und synaptische Verschaltung der Kleinhirnrinde Die Kleinhirnrinde weist einen sehr regelmäßigen Aufbau in funktionellen Modulen auf, so dass in allen Abschnitten die Verarbeitung von Information nach ähnlichen Prinzipien erfolgen kann. Die Kleinhirnrinde weist drei Schichten auf, die jeweils eine charakteristische Auswahl von fünf verschiedenen Neuronentypen enthalten (Abb. 23.24 A). Die außen gelegene Molekularschicht (Stratum moleculare) enthält hemmende (GABAerge) Interneurone, die als Sternund Korbzellen bezeichnet werden. Zudem sind in der Molekularschicht die weit verzweigten Dendriten der Purkinje-Zellen und die aufsteigenden Axone der Körnerzellen (Parallelfasern) eingelagert. Darunter schließt sich die Purkinjezellschicht (Stratum ganglionare) mit den großen Purkinje-Zellen an. Die GABAergen Purkinje-Zellen stellen den einzigen Ausgang der Kleinhirnrinde dar. Ihre Axone ziehen durch die weiße Substanz zu den zerebellären Kernen und dem lateralen Vestibulariskern (Nucleus Deiters). Die Körnerzellschicht (Stratum granulosum) enthält die Körnerzellen (mit 5 × 1010 größte homogene Neuronenpopulation des ZNS) als einzige exzitatorische (glutamaterge) Zelle der Kleinhirnrinde und als Ursprung der Parallelfasern. Die GABAergen Golgizellen in der gleichen Schicht hemmen die Körnerzellen. Die Afferenzen in das Kleinhirn stammen aus dem Rückenmark, dem Hirnstamm und dem Neokortex. Die spezifischen Eingangssignale der Kleinhirnrinde wirken erregend und entstammen zwei unterschiedlichen Quellen (Abb. 23.24 A). 1. Kletterfasern entspringen der Oliva inferior (Tractus olivocerebellaris) und „klettern“ an den Dendritenbäumen der Purkinje-Zellen in die distalen Bereiche, in denen sie mit den Dornen der Dendriten (spines) erregende synaptische Verbindungen eingehen. Eine einzelne Kletterfaser bildet etwa 200 erregende Synapsen pro Purkinje-Zelle. Der Kletterfaser-Input ist stark erregend und führt fast immer zur Aktionspotenzial-Entladung einer PurkinjeZelle. Der Kletterfasereingang ist relativ niederfrequent (1 – 3 Hz) aktiv. 2. Moosfasern entstammen unterschiedlichen Hirnstammkernen (Tractus vestibulocerebellaris) und dem Rückenmark (Tractus spinocerebellaris anterior und posterior). Sie vermitteln Information aus der Peripherie und Großhirnrinde (Tractus cortico-ponto-cerebellaris) und aktivieren relativ hochfrequent (50 – 100 Hz) tonisch die glutamatergen Körnerzellen, die ihrerseits über ihre Axone, die Parallelfasern, Purkinje-Zellen erregen. Eine exzitatorische Parallelfaser hat jeweils nur eine Synapse pro Purkinje-Zelle und die Auslösung eines Aktionspotenzials einer Purkinje-Zelle über den Parallelfaser-Eingang benötigt erhebliche räumliche Summation. Eine Purkinje-Zelle hat synaptische Kontakte mit nur einer Kletterfaser; hingegen konvergieren auf sie etwa 100 000 Parallelfasern. Die Moosfaser- und Kletterfaser-Afferenzen vermitteln Information über somatosensorische Abläufe (proprio- und exterozeptiv), aber auch über die Aktivität spinaler Interneurone. Neben diesen beiden spezifischen Eingängen projizieren modulierende Afferenzen aus den Raphekernen (Transmitter: Serotonin) und dem Locus coeruleus (Transmitter: Noradrenalin) in das Kleinhirn (Abb. 23.24 B). Der bevorzugte Modus der Informationsverarbeitung im Kleinhirn ist die GABAerge Inhibition. Purkinje-Zellen, deren Axone die einzigen Efferenzen der Kleinhirnrinde darstellen, benutzen GABA als Transmitter und hemmen die tonisch entladenden Neurone der Kleinhirnkerne (Abb. 23.24 B). Hemmende Interneurone werden direkt oder indirekt vor allem über den Moosfaser-Weg aktiviert. Golgizellen werden über den Moosfaser-Eingang aktiviert und hemmen die Körnerzellen. Diese Feedbackhemmung bewirkt, dass Purkinje-Zellen durch den Moosfaser-Eingang nur kurzfristig erregt werden und generiert ein zeitliches Aktivitätsmuster im Kleinhirn. Die Stern- und Korbzellen werden über die Parallelfasern der Körnerzellen aktiviert (Vorwärtshemmung der Purkinje-Zellen). Während die Korbzellen somanahe GABAerge Synapsen an den Purkinje-Zellen bilden, innervieren die Sternzellen die somafernen Dendritenbereiche. Axonkollateralen der Korbzellen laufen senkrecht zu den Parallelfasern und parallel zu den Dendritenbäumen der Purkinje-Zellen. Werden sie aktiviert, hemmen sie über ca. 1 mm beidseits in der Sagittalebene lateral gelegene Purkinje-Zellen (laterale Hemmung). Diese laterale Hemmung fokussiert die Erregung auf die zentral liegenden Purkinje-Zellen. Stern- und Korbzellen generieren so ein räumliches Aktivitätsmuster im Kleinhirn. Diese Mikroarchitektur in der synaptischen Verschaltung tritt in Form gleichartiger Module im gesamten Kleinhirn auf. Die Organisation dieser Module weist entsprechend der afferenten Information und der efferenten Projektion eine somatotope Gliederung auf („Homunkulus“). Nicht nur in der Kleinhirnrinde, sondern auch in jedem Kern existieren mehrere sensomotorische Homunkuli. Die Verschaltung des Moosfaser/Parallelfaser-Wegs bedeutet, dass Purkinje-Zellen zunächst erregt und anschließend durch die Korb- und Sternzellen gehemmt werden. Dieses Zeitmuster von Erregung/Hemmung wird von den GABAergen Purkinje-Zellen als Hemmung/Disinhibition an die Neurone der Kleinhirnkerne weitergegeben und kann sich z. B. auf spinaler Ebene auswirken. Die Aufgabe der PurkinjeZellen besteht also in einer Hemmung überschwänglicher Motorik. Die Purkinje-Zelle wird wiederum von den Korbund Sternzellen gehemmt, damit überhaupt Bewegung stattfinden kann. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 794 23.7 Kleinhirn: Struktur, Funktion, Symptome Parallelfasern 795 Molekularschicht Purkinje-Zelle Sternzelle Purkinjezellschicht Körnerzellschicht weiße Substanz Golgizelle B Parallelfasern Glut Moosfaser A Sternzelle Kletterfaser GABA GABA PurkinjeZelle Kleinhirnkern ACh? Pons, Rückenmark, Vestibularsystem Korbzelle GABA Kletterfaser Asp Golgizelle Körnerzelle untere Olive GABA Zelle der Kleinhirnkerne 5HT NA Asp 1 3 Hz Moosfasern ACh? 50100Hz Transmitter: exzitatorisch inhibitorisch Abb. 23.24 Zelluläre Organisation und synaptische Verschaltungen im Zerebellum. Schichtförmiger Aufbau der Kleinhirnrinde (Molekular-, Purkinjezell- und Körnerschicht) mit Anordnung von fünf Zelltypen (Purkinje-, Körner-, Golgi-, Stern- und Korbzellen) und zwei 23.7.3 Extrazerebelläre Projektionen und motorische Funktionen Die hemmenden Purkinje-Zellen stellen den einzigen Ausgang der Kleinhirnrinde dar. Sie projizieren topographisch über die Kleinhirnkerne und den Nucleus vestibularis lateralis (Deiters-Kern) in verschiedene Gebiete des ZNS, wobei Vermis, Pars intermedia und laterale Hemisphären (Abb. 23.23) parallel unterschiedlich verschaltet sind (Abb. 23.25). Der Vermis des Vorderlappens ist mit den zugehörigen Kernen in die spinale Stützmotorik integriert (Abb. 23.25 A). Über den Tractus spino-cerebellaris aufsteigende Information und über den Tractus reticulospinalis und Tractus vestibulospinalis absteigende Effekte bilden ein peripheres Rückkopplungssystem. Damit wird Information über die Körperhaltung unmittelbar in Aktivitäten von untere Locus Raphe- coeruleus Olive Kerne Pons, Rückenmark, Vestibularsystem Afferenzen (Moos- und Kletterfasern). B Synaptische Verschaltung von Parallelfasern und einer Kletterfaser sowie monoaminerge Projektionen. Transmitter wie angegeben, ⊖ = hemmende, ⊕ = erregende Wirkung. Bahnen umgesetzt, die die axiale Muskulatur kontrollieren und damit Körperhaltung, Muskeltonus und stützmotorische Bewegungen nahezu reflektorisch steuern. In enger Zusammenarbeit mit dem Vestibulozerebellum wird das Gleichgewicht gesichert und die Okulomotorik in Zusammenhang mit Körperhaltung (s. Kap. 20.3, S. 700 ff.) und Auge-Kopf-Koordination (s. Kap. 21.3, S. 714 ff.) reguliert. Die Pars intermedia ist im peripheren Teil ähnlich verschaltet (Abb. 23.25 B). Hinzu kommt eine zentrale Schleife mit dem Motorkortex. Sie ermöglicht der Pars intermedia eine Komparatorfunktion: die Pars intermedia erhält über Kollateralen vom Motorkortex eine „Kopie“ des endgültigen Bewegungsprogramms (= Efferenzkopie) und über spinozerebelläre Trakte die Information über die Durchführung der Bewegung. So werden Absicht (Soll) und Wirklichkeit (Ist) verglichen und Differenzen (= Fehlersignale) führen zur 23 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Körnerzelle Sensomotorische Systeme Korbzelle 23 Sensomotorische Systeme: Körperhaltung und Bewegung Kurskorrektur. Dies ist für die Kombination von Stütz- und Zielmotorik wesentlich, aber auch eine Zusammenarbeit mit der lateralen Hemisphäre ist möglich. Die lateralen Hemisphären sind Bestandteil von Verbindungen zwischen assoziativen Kortexarealen und dem Motorkortex (Abb. 23.25 C). Der Bewegungsplan des Assoziationskortex wird in den lateralen Abschnitten des Kleinhirns (parallel zu den Basalganglien) in motorische Programme umgesetzt und über den ventrolateralen Thalamus an den Motorkortex zur Ausführung übermittelt. Alle zum zerebralen Kortex laufenden Bahnen werden im Thalamus umgeschaltet, wo die Informationen auch aus anderen motorischen Zentren (Basalganglien) integriert werden. Diese Kleinhirnabschnitte sind entscheidend für den korrekten Ablauf schneller, ballistischer Zielbewegungen, die keinen zeitlichen Spielraum für Rückkoppelungen bieten. Ein derartiges motorisches Programm ist zum Beispiel beim DartSpiel erforderlich, wenn der Pfeil auf eine Zielscheibe geworfen wird. 23.7.4 Motorisches Lernen Als motorisches Lernen wird der Erwerb einer motorischen Fertigkeit bezeichnet. Während des Lernvorgangs werden die Bewegungen zunehmend schneller und gleichmäßiger, während sie anfangs langsam und unter erhöhter somato- A sensorischer und/oder visueller Kontrolle erfolgten. Am motorischen Lernen sind der motorische Kortex, die supplementär motorische Area, die Basalganglien und das Kleinhirn beteiligt. Neue Befunde zeigen, dass beim Menschen das Kleinhirn eine wichtige Funktion beim impliziten Lernen und damit beim prozeduralen Gedächtnis hat (Gedächtniskategorien, s. Kap. 25.5.1, S. 828 ff.). Gut trainierte, automatisierte Bewegungsabläufe, die ohne Beteiligung der Großhirnrinde ablaufen, sind im Kleinhirn gespeichert. Beispiele dafür sind die Koordination der Gesichtsmuskulatur beim Sprechen und die Bewegung der Finger beim Klavierspielen, aber auch die anfangs komplizierte Koordination vieler Körperteile beim Skifahren. Das Erlernen vieler motorischer Abläufe erfolgt in den ersten Lebensjahren, begleitet von strukturellen Änderungen im zentralen Nervensystem (z. B. Myelinisierung des Kortikospinaltrakts). Andere motorische Abläufe werden durch Konditionierung oder Training verändert (Geschicklichkeitsspiele). Das am besten untersuchte Modell für motorisches Lernen ist die klassische Konditionierung des Lidschlussreflexes (Kornealreflex). Dieser Fremdreflex dient dem Schutz des Auges und wird durch einen mechanischen Reiz auf die Kornea ausgelöst. Durch wiederholte Paarung dieses Reizes mit einem akustischen Signal kann dieser Reflex so konditioniert werden, dass ein Lidschluss auch durch den akustischen Reiz allein ausgelöst wird. Das Zerebellum und die untere Olive B Tractus spinocerebellaris Area 4,M1 Pons Vermis Kortex Nucleus fastigii Nucleus Deiters Tractus spinocerebellaris Pons Rückenmark Stützmotorik. Okulomotorik laterale Hemisphären Rezeptoren Abb. 23.25 Schema zur funktionellen Bedeutung des Zerebellums für Stützmotorik, geregelte Zielmotorik und ballistische Bewegungen. A Neuronaler Regelkreis der Köperhaltung. Verbindung vom Nucleus fastigii zum Motorkortex (nur geringgradig zu Neuronen des ventralen Tractus corticospinalis) sowie Zusammenhänge mit Okulo- Thalamus Kortex Nucleus dentatus Nucleus ruber Tractus rubro-spinalis Tractus vestibulo-spinalis Rückenmark propriozeptive Rezeptoren in Haut und Muskel Thalamus Area 6,4 Assoziationskortex Nucleus interpositus Formatio reticularis Tractus reticulo-spinalis Pars intermedia Kortex C Nucleus ruber Tractus rubro-spinalis Tractus corticospinalis lateralis Stütz- und Zielmotorik Rückenmark Rezeptoren Tractus corticospinalis lateralis schnelle, ballistische Zielbewegungen motorik nicht dargestellt. B Eingänge vom Motorkortex (M1, Area 4) ermöglichen über Pars intermedia Zielmotorik, die über periphere Rückkopplung geregelt werden kann. C Zuströme von Assoziationsarealen zu den Hemisphären/Dentatus werden in Programme für ballistische, nicht rückgekoppelte Bewegungen umgesetzt. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 796 Der japanische Neurophysiologie Masao Ito war ganz entscheidend an der Aufklärung der zellulären Mechanismen des vestibulookulären Reflexes beteiligt. Weiterhin entdeckte er im Jahre 1982 im Zerebellum eine neue Form synaptischer Plastizität, die als Langzeit-Depression (long-term depression, LTD; vgl. Kap. 25.6.2, S. 836 f.) bezeichnet wird. Ito und Mitarbeiter konnten zeigen, dass das durch Stimulation der Parallelfasern ausgelöste EPSP in Purkinje-Zellen langfristig verkleinert ist, wenn zuvor der Kletterfaser- und Parallelfaser-Input gleichzeitig stimuliert wurde (vgl. Abb. 23.24 B). Diese Input-spezifische Form der LTD beruht auf eine sog. Internalisierung von Glutamat-Rezeptoren an der Parallelfasersynapse auf die Purkinje-Zelle. Es stehen folglich weniger Glutamat-Rezeptoren an der postsynaptischen Membran zur Verfügung und das EPSP weist dadurch eine kleinere Amplitude auf. 23.7.5 Kleinhirnläsionen und zerebelläre Funktionsstörungen In Anlehnung an die oben genannten Funktionen des Kleinhirns kommt es bei Patienten mit Kleinhirnläsionen zu definierten zerebellären Funktionsstörungen. Gemeinsam ist allen das gestörte Zusammenspiel von Muskelgruppen, insbesondere bei Bewegungen, die mehrere Gelenke betreffen. Als Haupt- symptom zerebellärer Läsionen tritt eine Rumpf-, Stand- und Gangataxie auf, die sich aufgrund mangelnder Kontrolle des Körpergleichgewichts und zusätzlich gestörter Bewegungskoordination der Beine manifestiert. Häufig ist der Muskeltonus herabgesetzt und die Muskulatur ist schneller ermüdbar. Weiterhin können Dysmetrie (fehlende Zielgenauigkeit von willkürlichen Bewegungen), Intentionstremor (Wackeln bei Zielbewegungen), Dysarthrie (Sprechstörungen) und Nystagmus auftreten. Im Akutstadium sind besonders ein abgeschwächter Muskeltonus und Hyperreflexie auffällig. Als Ursachen für Kleinhirnläsionen sind zerebrovaskuläre oder entzündliche Erkrankungen, Tumoren, toxische Schädigungen (z. B. Alkoholintoxikation) und metabolische Störungen zu nennen. Tab. 23.2 ordnet die wichtigsten Symptome den betroffenen Kleinhirnregionen zu (vgl. Abb. 23.23). Bei Läsionen des Vestibulozerebellums tritt ein Nystagmus und durch eine Dysfunktion der Stützmotorik eine Rumpfataxie auf. Eine Läsion der medianen (vermalen) Zone des Spinozerebellums kann eine Stand- und Gangataxie verursachen (Abb. 23.25 A), die sich beim Patienten durch einen unsicheren, wankenden Stand und Gang äußert. Wenn die intermediären oder paravermalen Zonen des Spinozerebellums betroffen sind (Abb. 23.25 B), dominieren Defizite in der Kontrolle und Koordination der Bewegungsdurchführung, wie Intentionstremor, Dysarthrie, Hypermetrie (über das Ziel hinausschießende Bewegungen), Dysmetrie (am Ziel vorbei treffende Bewegungen) und Dysdiadochokinese (Verminderung der Fähigkeit, schnelle und abwechselnde antagonistische Bewegungen durchzuführen, wie die Handfläche schnell auswärts und einwärts zu drehen). Eine Schädigung des Zerebrozerebellums (laterale Hemisphären) verursacht Defizite in der Bewegungsplanung (Abb. 23.25 C), sodass der Einsatz einzelner Muskeln nicht aufeinander abgestimmt ist und somit nicht synergistisch verläuft (Asynergie). Tab. 23.2 Zerebelläre Verbindungen, Funktionen und Funktionsstörungen Funktionelle Anatomie; Phylogenese Eingang/Ausgang Vestibulo-Zerebellum: Lob. Vestibularapparat/Vestibuflocculonodularis; Archi-Ze- lariskerne, tektospinal rebellum Funktion Erregungskreis Symptomatik Kontrolle vestibulo-okulärer Reflex sowie Kopf- und Halsstellung, Gleichgewicht reflektorisch Störungen von Okulomotorik und Gleichgewicht: Rumpf- und Standataxie (posturaler Tremor, visuell nicht kompensierbar). peripher (zentral) Störung der Stützmotorik: Stand- und Gangataxie, visuell kompensierbar. Spino-Zerebellum: Vermis anterior; Archi/Paläo-Zerebellum Vestibularapparat, Proprio- Kontrolle Stützmotorik, zeption Hals, Rumpf, pro- axialer und proximaler ximale Extremitäten/Fasti- Muskelgruppen gius und Deiters, ventromediale Systeme, M 1, ventraler Kortikospinaltrakt Spino-Zerebellum: Pars intermedia; Paläo-Zerebellum Somatosensorik Extremitä- Kontrolle distaler Muskeln, peripher/ zentral ten, Efferenzkopie M 1/In- Regelung Zielmotorik, terpositus, dorsolaterale Kurskorrektur Systeme, M 1, lateraler Kortikospinaltrakt Zerebro-Zerebellum: latera- Assoziationskortex über le Hemisphären; NeoBrückenkerne/ Dentatus, Zerebellum Area 6, 4, lateraler Kortikospinaltrakt Programme und Timing Zielmotorik und Ballistik zentral Störung Zielmotorik : Extremitätenataxie, Asynergie, Dysarthrie. Beginn Eingelenkbewegung verzögert (M 1 zeitlich gestört). Störung Zielmotorik: Extremitätenataxie, Dysdiadochokinese, Dysmetrie, Asynergie. Beginn und vorausschauende Abstimmung Mehrgelenkbewegung gestört. 23 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. sind an diesem erlernten motorischen Reflex zentral beteiligt. Ein weiteres gut untersuchtes Beispiel für motorisches Lernen ist der vestibulookuläre Reflex, mit dessen Hilfe das Auge selbst bewegte Objekte bei Kopfbewegungen fixieren kann. Mit einer gesichtsfeldverändernden Prismenbrille wird der Reflex zunächst unterdrückt; nach einiger Zeit aber erholt er sich. Dieser Lernvorgang ist an die Intaktheit des Vestibulozerebellums gebunden. Diese Befunde belegen, dass das Kleinhirn beim motorischen Lernen eine wichtige Aufgabe erfüllt. Entsprechend treten nach Kleinhirnläsionen Defizite beim motorischen Lernen und bei sensomotorischen Adaptationsprozessen auf. 797 Sensomotorische Systeme 23.7 Kleinhirn: Struktur, Funktion, Symptome 23 Sensomotorische Systeme: Körperhaltung und Bewegung Zusammenfassung Kap. 23.7 Kleinhirn: Struktur, Funktion, Symptome ▬ Das Kleinhirn besteht aus Kortex, weißer Substanz und den drei Kleinhirnkernen Nucleus fastigii, interpositus und dentatus. Das Kleinhirn kann anatomisch-funktionell in die drei Bereiche Vestibulozerebellum (Kontrolle von Augenbewegungen, Kopf- und Halsstellung und Gleichgewicht), Spinozerebellum (Integration von somatosensorischer Information, Kontrolle des Sprechapparats) und Zerebrozerebellum (Entstehung von groben Bewegungsentwürfen) eingeteilt werden. Der Kortex des Zerebellum ist in drei Schichten angeordnet: Molekular-, Purkinjezell- und Körnerzellschicht. Die Eingänge in das Zerebellum stammen aus dem Rückenmark, Hirnstamm und Neokortex und wirken exzitatorisch. GABA ist der Transmitter der zerebellären Kortexneurone mit Ausnahme der glutamatergen Körnerzellen. Im Kleinhirn ist aufgrund spinaler und kortikaler Informationszuflüsse der gesamte Körper sensomotorisch mehrfach repräsentiert (Homunkuli). Das Kleinhirn ist für den präzisen zeitlich-räumlichen Einsatz von Muskeln und Muskelgruppen zuständig. Dazu entwickelt es zeit- und ortsabhängige Erregungsmuster. Diese Muster dienen dazu, die Aktivität verschiedener Muskelgruppen aufeinander und auf die Erfordernisse der Bewegung abzustellen. Zum Weiterlesen … 1 Altenmüller E, Wiesendanger M, Kesselring J. Music, Motor Control and the Brain. Oxford: Oxford University Press. 2006. 2 Bear MF, Connors BW, Paradiso MA. Neuroscience. Exploring the Brain. 3rd ed. Philadelphia: Lippincott Williams & Wilkins; 2007. 3 Kandel ER, Schwartz JH, Jessel TM. Principles of Neural Science. 4th ed. New York: McGraw-Hill; 2000. 4 Kornhuber HH. Cerebral cortex, cerebellum, and basal ganglia: An introduction to their motor functions. In: Schmitt FO, Warden FG (eds.). The Neurosciences, 35 d Study Program. Cambridge, Mass.: MIT Press; 1984: 267-280. 5 Shepherd GM. The Synaptic Organization of the Brain. 5th ed. Oxford: Oxford University Press. 2004. 6 Squire LR et al. Fundamental Neuroscience. 3rd ed. San Diego: Academic Press; 2008 ▬ ▬ Ausgänge aus dem Zerebellum wirken inhibitorisch. Zytoarchitektur und Verschaltungsprinzipien sind in allen Abschnitten des Zerebellums gleichartig, was nahelegt, dass generell das gleiche Arbeitsprinzip eingesetzt wird. Separate Abschnitte kontrollieren Augenbewegungen, Stütz- und Zielmotorik sowie ballistische Abläufe. Das Kleinhirn ist afferent und efferent mit motorisch aktiven Strukturen in Form von Rückmeldekreisen, aber auch von Neuronenketten verknüpft. Mit zunehmender Bedeutung der neurologischen Rehabilitation werden vermehrt die Grundlagen motorischen Lernens untersucht. Dabei fand das Kleinhirn besonderes Interesse, auch wenn motorisches Lernen, ähnlich wie das Gedächtnis, wahrscheinlich an keine spezielle ZNS-Struktur, d. h. an kein „Lernzentrum“, gebunden ist. Zerebelläre Funktionsstörungen infolge von Kleinhirnläsionen äußern sich als Instabilität von Haltung und Bewegung (Ataxie). Gemäß der funktionellen Anatomie des Kleinhirns sind die Okulomotorik, die Stabilisierung von Gleichgewicht und Körperhaltung, die Abstimmung von Haltung und Bewegung sowie die Zielmotorik betroffen. … und noch weiter 7 Adams RD, Victor M. Principles of Neurology. 6th ed. New York: McGraw-Hill; 2000. 8 Freund HJ. Somatosensory and motor disturbances in patients with parietal lobe lesions. Adv Neurol. 2003; 93: 179-193. 9 Galvan A, Wichmann T. GABAergic circuits in the basal ganglia and movement disorders. Prog Brain Res 2007; 160: 287-312. 10 Ito M. Cerebellar circuitry as a neuronal machine. Prog Neurobiol 2006; 78: 272-303. 11 Jonas P, Bischofberger J, Sandkühler J. Corelease of two fast neurotransmitters at a central synapse. Science 1998; 281: 419-424. 12 Llinás R, Ribary U, Jeanmonod D, Mitra PP. Thalamocortical dysrhythmia: A neurological and neuropsychiatric syndrome characterized by magnetoencephalography. PNAS. 1999; 96: 15 222 – 15 227. 13 Meyer-Lindenberg A, Miletich RS, Kohn PD, Esposito G, Carson RE, Quarantelli M, Weinberger DR, Berman KF. Reduced prefrontal activity predicts exaggerated striatal dopaminergic function in schizophrenia. Nat Neurosci. 2002; 5: 267-271. 14 Nicola SM, Surmeier DJ, Malenka RC. Dopaminergic modulation of neuronal excitability in the striatum and nucleus accumbens. Ann Rev Neurosci. 2000; 23: 185 – 215. 15 Reichmann H (ed.). Future therapy in idiopathic Parkinsonʼs disease. J Neurol. 2003; 250: Suppl 1 16 Thach WT, Goodkin HP, Keating JG. The cerebellum and the adaptive coordination of movement. Ann Rev Neurosci. 1992; 15: 403442. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 798