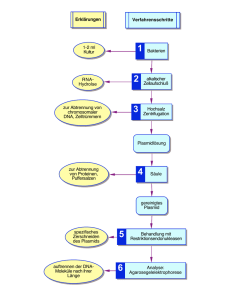
Versuch 2: Zentrifugation
Werbung

VERSUCH 2: ZENTRIFUGATION THEORETISCHE GRUNDLAGEN DIE AUFTRIEBSKRAFT (GESETZ DES ARCHIMEDES) Ein Körper, der in eine Flüssigkeit eingetaucht wird, zeigt einen scheinbaren Gewichtsverlust. Die Ursache ist eine Kraft, die der Gravitationskraft FG (= Gewichtskraft) entgegenwirkt: die Auftriebskraft FA. Mit zunehmender Tiefe nimmt der hydrostatische Druck in einer Flüssigkeit zu, daher wirkt auf einen in die Flüssigkeit gebrachten Körper auf seine Oberseite ein geringerer Druck als auf seine Unterseite. Diese Druckdifferenz bewirkt den Auftrieb, wie sich an einem rechtwinkeligen Körper mit der Höhe ∆ h zeigen lässt (Abb. 10). Allgemein gilt für den hydrostatischen Druck p: p= ρ L gh h = Höhe, Entfernung von der Oberfläche ρL = Dichte der Flüssigkeit g = Erdbeschleunigung (= 9,81 ms-2) FA ∆h FG Abb. 10: Auftriebskraft FA Auf die Oberseite des Körpers in Abb. 10 wirkt der hydrostatische Druck: punten = ρ L g h2 und auf die Unterseite: punten = ρ L g h2 Da h1 < h2 ist auch p oben < p unten. Es ergibt sich ein resultierender Druck ∆p, der nach oben gerichtet ist ∆ p = punten − poben = ρ L g ( h2 − h1 ) = ρL g∆h 29 VERSUCH 2: ZENTRIFUGATION Die Fläche A des Körpers bestimmt mit dem Druck die resultierende Kraft FA (Auftriebskraft, da nach oben gerichtet) uur FA = A ∆ p = ρ L g A∆ h Das Volumen der verdrängten Flüssigkeit ist gleich groß wie das des eintauchenden Körpers, nämlich V = A.∆h Die Masse der verdrängten Flüssigkeit ist daher mL = ρ L A ∆ h . Die Gravitationskraft FG der verdrängten Flüssigkeit (FG = mL g) ist also dem Betrag nach, aber nicht in der Richtung, gleich der statischen Auftriebskraft FA : FA = − ρ L g VL = − mL g SEDIMENTATION Ein Körper sinkt (sedimentiert) in einer Flüssigkeit, wenn die auf ihn wirkende Gravitationskraft FG größer ist als die Auftriebskraft FA. Eine solche Sedimentation erfolgt immer dann, wenn die Dichte des Körpers größer ist als die Dichte des Lösungsmittels. Dieser Zusammenhang lässt sich ebenfalls aus dem Archimedischen Gesetz herleiten: In der Flüssigkeit wirkt auf eine Partikel der Masse mp die Gravitationskraft FG FG = mp g und die Auftriebskraft FA, die der Gravitationskraft entgegengesetzt ist: FA = mL g Da das Volumen Vp = mp ρp des eingetauchten Körpers und das Volumen VL = mL der von ihm ρL verdrängten Flüssigkeit gleich sind, folgt: Vp = VL mp ρp = mL ρL mL = m p ρL ρp Die Sedimentationskraft FS ergibt sich aus der Summe von Gravitations- und Auftriebskraft, die einander entgegengerichtet sind. uur uur uur FS = FG + FA = m p g − mL g Es folgt: 30 PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE uur FS = mp g − mL g = mp g − mp ρL g ρp ρ = mp g 1 − L ρ p Diese Sedimentationskraft FS bewirkt Sedimentationsgeschwindigkeit v = das Absinken eines Teilchens mit der dx . Anfänglich ist diese Bewegung beschleunigt, wobei mit dt zunehmender Geschwindigkeit die Reibungskraft FR = f dx proportional ansteigt. Sobald die dt Reibungskraft gleich der Sedimentationskraft ist, stellt sich eine gleichförmige Bewegung (Sedimentationsgeschwindigkeit) ein. FR = FS f dx ρ = mp g 1 − L dt ρ p Der Proportionalitätsfaktor f = 6 π η r ist der Reibungskoeffizient für kugelförmige Moleküle mit dem Radius r (Stokes). η = Viskosität des Lösungsmittels. dx mp g ρ = 1 − L dt 6π η r ρp ρ pVg ρ = 1 − L 6π η r ρp Vg = ρL− ρp 6π η r ( Aus der Sedimentationsgeschwindigkeit ) dx lässt sich also die mittlere Masse der Partikel dt ermitteln. Für das Verhalten einer Partikel im Lösungsmittel gilt: ρ L = ρ P FS = 0 Schweben (Gleichgewicht) ρ L < ρ P FS > 0 Sinken (Sedimentation) ρ L > ρ P FS < 0 Steigen (Auftrieb) Partikel sedimentieren also immer dann, wenn sie eine relativ größere Dichte besitzen als das Lösungsmittel, sie reichern sich also in Bodennähe an. Eine höhere Partikelkonzentration wird durch Diffusionsbewegungen begrenzt, so dass mit der Sedimentation nur dann Material 31 VERSUCH 2: ZENTRIFUGATION angereichert wird, wenn die Diffusionsgeschwindigkeit wesentlich geringer ist als die Sedimentationsgeschwindigkeit. Im Schwerefeld der Erde ist dies für große Partikel wie z.B. bei der Blutsenkung der Fall, kleine Partikel können jedoch auch angereichert werden, wenn die Gravitationskraft entsprechend vergrößert wird. DIE ZENTRIFUGALKRAFT ALLGEMEINES dϕ um ein Zentrum 0 im Abstand r rotierender dt Ein mit konstanter Winkelgeschwindigkeit ω = Körper der Masse m (Bahngeschwindigkeit v =ω r) erfährt eine zum Zentrum hin gerichtete Radial- oder Zentripetalbeschleunigung a: az = ω 2 r Für einen mit dem System rotierenden Beobachter bewegt sich der Körper beschleunigt radial nach außen. Auf den Körper wirkt die radial nach außen gerichtete Zentrifugalkraft FZ: Fz = m az = mω 2 r Zwischen der Bahngeschwindigkeit v und der Winkelgeschwindigkeit ω besteht folgender Zusammenhang: v= ωr für ω = konst. gilt: ω = 2π ν = 2π Upm 60 Upm = ν = Umlauffrequenz TRENNUNG VON TEILCHEN IN EINER Umdrehungen pro Minute ZENTRIFUGE In einer Zentrifuge bewegt sich eine Partikelsuspension mit konstanter Winkelgeschwindigkeit auf einer Kreisbahn. Dabei wirkt auf eine Partikel der Masse mP die Zentrifugalkraft FZ : Fz = mp ω 2 r Die Partikel der Masse mP verdrängt Flüssigkeit der Masse mL. Dies bewirkt eine Auftriebskraft FA, die dem Betrag nach gleich, der Richtung nach aber entgegengesetzt der Zentrifugalkraft auf die verdrängte Flüssigkeitsmasse mL ist: FA = mL ω 2 r 32 PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE Die Sedimentationskraft FS ergibt sich wiederum aus der Summe von Zentrifugalkraft FZ und Auftriebskraft FA. FS = FZ − FA ρ = mp 1 − L ω 2 r ρ p Unter der Wirkung der Resultierenden FZ + FA bewegt sich die Partikel mit der Geschwindigkeit dr in radialer Richtung und wird dabei durch den Reibungswiderstand der umgebenden dt Flüssigkeit abgebremst. Die Reibungskraft FR = f dr dt ist wiederum der bewegenden Kraft entgegengerichtet. Für stationäre Sedimentation lautet das Kräftegleichgewicht: FZ + FA + FR = 0 ω 2 r mp − ω 2 r mL − f (m DER G p ) dr = 0 dt − mL ω 2 r = f dr dt - WERT Fällt ein Körper frei, d.h. wirkt auf ihn lediglich die Gravitationskraft FG, so fällt er mit der Fallbeschleunigung g, die durch die Erdanziehung hervorgerufen wird. g= FG mp In unseren geographischen Breiten ist g = 9,81 m/s2. In Zentrifugen werden durch Erhöhen der Umlauffrequenz höhere Beschleunigungswerte erreicht, wodurch schnellere Sedimentation erfolgt. Die sich ergebenden Werte bezieht man auf 'ein g' und spricht von einer Zentrifugation bei 'x × g'. Beispiel: ν= 100 Umdrehungen pro Sekunde; r = 0,1 m Abstand vom Drehzentrum 33 VERSUCH 2: ZENTRIFUGATION ω = 2π ν = 2 ⋅ 3, 142 ⋅ 100 s− 1 = 6, 28 × 10 2 s− 1 a= ω 2r = 39, 44 × 10 4 s− 2 ⋅ 0,1m =39, 44 × 10 3 m 2 s Das entspricht : 39440 m s2 = 4020 × g 9, 81 m 2 s DIE SVEDBERG - KONSTANTE Theodor Svedberg, ein schwedischer Chemiker, konstruierte 1925 erstmals als Hilfsmittel für seine Untersuchungen über Kolloide eine Ultrazentrifuge. Mit ihr bestimmte er die Masse von Riesenmolekülen. Bei der Bestimmung der relativen Molekülmasse verwendet man seither eine Sedimentationskonstante (sK Svedberg-Konstante), die sich aus dem Quotienten der Absinkgeschwindigkeit dr und der Zentrifugalbeschleunigung ω2 r ergibt und die die Einheit s dt hat: sK = dr 1 dt ω 2 r Mit der Angabe der Sedimentationskonstanten charakterisiert man Moleküle oder Partikel bereits eindeutig, selbst wenn ihre Diffusionskonstante D und ihre Dichte unbekannt sind. In der Molekularbiologie haben viele der untersuchten Moleküle Sedimentationskonstanten im Bereich von 10-13 s. Man hat daher die Einheit "Svedberg" eingeführt: 1 Svedberg = 1 S = 10-13 s und charakterisiert Moleküle mit ihrem "S-Wert". Beispiele: Die beiden Ribosomenuntereinheiten bei Prokaryonten haben S-Werte von: 30 × 10-13s sK = 30 S 50 × 10-13s sK = 50 S Da die Sedimentationskonstante unter verschiedenen Bedingungen bestimmt werden kann, sind gewisse Vereinheitlichungen notwendig. Meist wird die Sedimentationskonstante auf einen Wert korrigiert, den man erhalten würde, wenn das Medium die Dichte und Viskosität von Wasser bei 20 C hätte. Die Korrektur wird mit folgender Gleichung vorgenommen. 34 PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE s20° ,W = ( η θ , L ρ p − ρ 20° ,W ( η 20° ,W ρ p − ρ θ , L ) ) Sθ,L : unkorrigierte Sedimentationskonstante in einem Medium bei der Temperatur T ηθ,L : Viskosität des Mediums bei der Zeltrifugationstemperatur η20,W : Viskosität des Wassers bei 20 C ρp : Dichte der Teilchen in Lösung ρθ,L : Dichte des Mediums bei Zentrifugationstemperatur ρ20,W : Dichte des Wassers bei 20 C BEISPIELE FÜR BESTIMMUNG ANWENDUNGEN DER RELATIVEN DER SEDIMENTATIONSKONSTANTEN MOLEKÜLMASSE Für die Masse einer Partikel ergibt sich: mp = f = f dr 1 1 ρ dt 1 − L ω 2 r ρp sK ρ 1− L ρp Für kugelförmige Partikel wird der Reibungskoeffizient f = 6 π η r angeben (Stokes, 1856). In der Regel ist die Form eines Moleküls jedoch nicht bekannt. Man drückt daher den Reibungskoeffizienten f durch den experimentell bestimmbaren Diffusionskoeffizienten D aus. f= RT N AD NA = Avogadrokonstante = 6,023 × 1023 mol-1 R = Allgemeine Gaskonstante T = absolute Temperatur (Kelvin) Die relative Molekülmasse Mr berechnet sich zu: Mr = mp N A Eingesetzt und umgeformt ergibt sich die Svedberg-Gleichung: 35 VERSUCH 2: ZENTRIFUGATION Mr = BESTIMMUNG DER RT sK D 1− ρ L ρp KLÄRZEIT Die Klärzeit ist die Zentrifugationszeit, die benötigt wird um ein Teilchen mit einem bestimmten Sedimentationskoeffizienten vollständig zu sedimentieren. Die Integration der umgeformten Gleichung in den Grenzen t1 und t2 ergibt: dr 1 dt ω 2 r dr sKω 2 dt = r t2 r1 1 2 ∫t sKω dt = r∫ r dr 1 0 sK = sK ω 2 ( t2 − t1 ) = ln r2 − ln r1 sK = ln r2 − ln r1 ω 2 ( t2 − t1 ) t2 - t1 ist die Zeitdauer, die die Teilchen benötigen, um von Position r1 bis zu r2 zu gelangen. Daraus lässt sich weiterhin ableiten: ∆ tsK = ln r2 − ln r1 = K ω 2 3600 ∆t : Zentrifugationszeit in Stunden K : Rotorkonstante ZENTRIFUGATIONSTECHNIKEN DIFFERENTIELLE ZENTRIFUGATION Die Trennung von Zellorganellen durch differentielle Zentrifugation ist eine der grundlegendsten und gebräuchlichsten Zentrifugationsverfahren. Dabei wird ein Gemisch von Partikeln (z.B. ein Zellhomogenat) stufenweise höheren Zentrifugalbeschleunigungen bei schrittweise verlängerten Zentrifugationszeiten ausgesetzt. Dabei werden die Komponenten mit großen S-Werten angereichert, während der Überstand langsamer sedimentierende Partikel mit kleineren S-Werten enthält. Die Sedimente (Pellets), die man nach jedem Zentrifugationsschritt erhält, sind jedoch stets mit langsamer sedimentierenden Komponenten verunreinigt, so dass vor einer weiteren Untersuchung das Pellet mit frischem Lösungsmittel resuspendiert und anschließend erneut zentrifugiert werden sollte. 36 PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE (a) (b) (c) Abb. 11: Differentielle Zentrifugation. (a) Vor der Zentrifugation enthält die Lösung Partikel zweier Größenklassen (b) Während der Zentrifugation wandern die größeren Partikel schneller zum Boden des Zentrifugenröhrchens (c) Ausbildung eines Pellets aus großen Partikeln, das mit kleinen Partikeln verunreinigt ist. Der Überstand ist rein und enthält nur kleine Partikel Im Allgemeinen ist bei der differentiellen Zentrifugation die Verwendung eines Festwinkelrotors vorteilhafter als die eines Ausschwingrotors. Drehachse Feststellschraube 30° Rotordeckel Zentrifugenröhrchen mit Deckel Rotor Abb. 12: Aufbau eines Festwinkelrotors In Festwinkelrotoren befinden sich die Zentrifugenröhrchen in einem festen Winkel (zwischen 14°und 40°) zur Rotationsachse. Durch das Zentrifugalfeld bewegen sich die Partikel nur über kurze Distanzen in horizontaler Richtung bis sie an die Wand des Zentrifugenröhrchens stoßen. Unter geeigneten Bedingungen bildet sich an der Außenwand des Zentrifugenröhrchens ein kompaktes Pellet. 37 VERSUCH 2: ZENTRIFUGATION Subzelluläre Fraktionierung Zellhomogenisat in isotoner Saccharoselösung (300 mM) 15 min 1000 g Überstand 20 min 10000 g Überstand 60 min 100000 g Differentielle Zentrifugation nukleäres Pellet 0,8 M mitochondriales Pellet 0,5 M t in d g se ro ch a S Plasma membran 2,0 M Zellkerne 1,7 M mikrosomales Pellet 0,5 M Dichtegradientenzentrifugation Mitochondrien Golgi & Endsomen Lysosomen Plasmamembranvesikel ER-Vesikel 2,0 M Ribosomen Abb. 13: Allgemeines Schema zur subzellulären Fraktionierung eines Säugergewebes, z.B. der Leber. Die Zahlen geben die molare Saccharosekonzentration im oberen bzw. unteren Bereich des Gradienten an. DICHTEGRADIENTEN-ZENTRIFUGATION Bisher wurde vorausgesetzt, dass die Sedimentation in einem homogenen Medium stattfindet. Die gleichmäßige Wanderung der Partikel in einer Ultrazentrifuge wird jedoch durch mechanische Vibrationen, Wärmegradienten und Konvektionen gestört. Diese Störungen können durch Zentrifugation in einem Dichtegradienten verringert werden. Geeignete Substanzen zur Bildung eines Gradienten sind Saccharose, Glyzerin, Cäsiumchlorid, Cäsiumsulfat und weniger gebräuchliche Stoffe wie Ficoll und Metrizamid. Der Gradient kann entweder mit einem Gradienten-Mischer vorgeformt bzw. von Hand aufgetragen werden oder bei der Zentrifugation selbst gebildet werden. Der Gradient ist am Boden des Zentrifugenröhrchens am dichtesten und nimmt mit der Höhe an Dichte ab. Die Wahl der Eigenschaften des Gradienten hängt vom gewünschten Verwendungszweck ab. Man kann die Dichtegradienten-Zentrifugation in die Zonen-Zentrifugation und die isopyknische Zentrifugation einteilen. 38 PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE DICHTEGRADIENTEN-DIFFERENTIAL- ODER ZONENZENTRIFUGATION Das Charakteristische der Dichtegradienten-Differentialzentrifugation (rate zonal method) ist die Wanderung der Partikel durch einen stabilisierenden, sehr flachen Gradienten, dessen maximale Dichte nicht größer sein darf als die des am wenigsten dichten sedimentierenden Materials. Während der Zentrifugation wandern die Partikel mit einer Geschwindigkeit durch den Gradienten, die von Größe und Form der Partikel, Zentripetalbeschleunigung sowie Dichte und Viskosität des Mediums abhängt. Enthält die Probe, die auf den vorgeformten Gradienten aufgeschichtet wird, eine Mischung verschiedener Partikel, so wandert jede Partikelklasse unabhängig von den anderen durch den Gradienten und eine Trennung der Partikel kann selbst dann erzielt werden, wenn die Unterschiede in den S-Werten nur gering sind. Abb. 14: Zonen-Zentrifugation Die Zentrifugation muss also abgebrochen werden, bevor die ersten Partikel den Boden des Zentrifugenröhrchens erreicht haben. Diese Methode eignet sich gut für Substanzen, die sich zwar in der Größe, aber nicht in der Dichte voneinander unterscheiden. Zonen-Zentrifugationen werden bevorzugt in Swing-out-Rotoren durchgeführt. Swing-outRotoren zeichnen sich dadurch aus, dass sich die Zentrifugenröhrchen (bzw. Becher) vor der Zentrifugation in vertikaler Position befinden und während der Zentrifugation um 90° (relativ zur Rotorachse) in die horizontale Lage ausschwenken. Im Gegensatz zu Festwinkelrotoren ist die Konvektion von Flüssigkeiten in Swing-out-Rotoren herabgesetzt (d.h. Verminderung von Wandeffekten). Zudem ist der längere Weg, den die Partikel während der Sedimentation zurücklegen, vorteilhaft für die Auftrennung. Die Isolierung der Chloroplasten im Praktikumsversuch erfolgt ebenfalls nach dieser Methode. Zur Auftrennung des Materials verwendet man in diesem Fall einen diskontinuierlichen Saccharosegradienten (30%, 35%, 50%). I SOPYKNISCHE ZENTRIFUGATION Die Technik der isopyknischen Zentrifugation dient der Trennung von Partikeln unterschiedlicher Dichte. Wie bei der Zonen-Zentrifugation ist ein Dichtegradient nötig, aber im Unterschied dazu übersteigt hier die maximale Dichte des Gradientenmaterials die der Partikel. Zwei Typen von Dichtegradienten sind möglich: vorgeformte und solche, die sich bei der Zentrifugation unter dem Einfluss eines Zentrifugalfeldes ausbilden. In beiden Gradiententypen werden die Partikel solange wandern, bis sie in den Bereich des Gradienten gelangen, an dem die Dichte des Gradientenmaterials der Dichte der Partikel entspricht. Hier sedimentieren die Teilchen nicht weiter, da sie praktisch auf einer Unterlage schwimmen, die eine größere Dichte als sie selbst besitzt. 39 VERSUCH 2: ZENTRIFUGATION Abb. 15: Isopyknische Zentrifugation Die so ermittelte Partikeldichte wird auch Buoyant-Dichte genannt. Buoyant-Dichten variieren entsprechend dem Medium, in dem sie bestimmt werden, da verschiedene Medien die Hydration unterschiedlich beeinflussen. In der Praxis verwendet man als Gradientenmaterial Schwermetallsalzlösungen (z.B. CsCl, Cs2SO4, KBr), die solange zentrifugiert werden, bis sich ein Sedimentations-DiffusionsGleichgewicht eingestellt hat. Gleichzeitig unterliegt auch die Verteilung der zu trennenden Moleküle einem Sedimentations-Diffusions-Gleichgewicht. Damit sich dieses Gleichgewicht einstellt, muss die Zentrifugation lange genug und mit höherer Geschwindigkeit durchgeführt werden. Nach der Auftrennung verschiedener Moleküle oder Organellen in einem Dichtegradienten schließt sich die Gradientenfraktionierung an, entweder durch Austropfen (bottom unloading), durch Auspumpen (top unloading) oder durch Unterschichten mit einer Flüssigkeit hoher Dichte mittels einer Pumpe wobei, das verdrängte Gradientenmaterial ein Spektralphotometer passiert, bevor es in Fraktionen gesammelt wird (upward displacement). a b Abb. 16: Gradientenfraktionierung:(a,b) Auspumpen. 40 c Austropfen (c) PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE ANALYTISCHE ULTRAZENTRIFUGE Seit ihrer Entwicklung in den 30er Jahren spielte die analytische Ultrazentrifuge eine wichtige Rolle bei der Betrachtung theoretischer Aspekte der Sedimentation, der Bestimmung der Sedimentations-Konstanten und der Untersuchung von Makromolekülen. Moderne analytische Ultrazentrifugen, gekoppelt mit Computersystemen, ermöglichen darüber hinaus das Studium der molekularen und hydrodynamischen Eigenschaften von Partikeln. Das zu untersuchende Material befindet sich in Messzellen, welche nur ein geringes Fassungsvermögen von 0,4 bis 1 ml haben. Zudem besitzen sie zwei parallel angeordnete Fenster, die den Durchgang von Licht ermöglichen. Die Zellen, die insgesamt aus sehr vielen Einzelteilen bestehen, werden in den Rotor eingesetzt. Die Richtung der Sedimentation des Materials ist senkrecht zum Lichtstrahl, wobei die Verteilung der Partikel durch die Änderung der optischen Eigenschaften der Lösung festgestellt werden kann. Die für analytische Ultrazentrifugen verwendeten optischen Systeme gliedern sich in drei Typen: 1. Absorption (das zu trennende Material absorbiert Licht einer bestimmten Wellenlänge) 2. Schlierenoptische Systeme messen Änderungen im Brechungsindex des Mediums, wie sie durch Änderung der Konzentration verursacht werden. 3. Interferenz Referenzzelle Beleuchtungsoptik Probenzelle Scanoptik Photomultiplier Abb. 17: Aufbau einer Ultrazentrifuge 41 VERSUCH 2: ZENTRIFUGATION 0,4 0,3 A280 0,2 0,1 0,0 -0,1 0,0 0,2 0,4 0,6 0,8 1,0 r Abb. 18: Wanderung der Partikelfront während eines Sedimentations-Geschwindigkeits-Laufes CHLOROPLASTEN Chloroplasten kommen nur in pflanzlichen Zellen vor. Sie zählen zu den großen Zellorganellen und haben ein Doppelmembransystem. Chloroplasten sind die Orte der Photosynthese. Die Vorgänge laufen mittels der Chlorophylle a und b ab, die in der inneren Membran eingelagert sind. Diese innere Membran stülpt sich zur Oberflächenvergrößerung ein und bildet einzeln liegende Stromathylakoide oder durch deren Übereinanderlagerung Granathylakoide, die in ihrer Gesamtheit als Grana bezeichnet werden. In der Grundsubstanz (Matrix oder Stroma) befinden sich Ribosomen, Lipidtröpfchen, Stärkekörner und eine ringförmige DNA. Chloroplasten bilden sich aus Proplastiden unter dem Einfluss von Licht. Neben den Chlorophyllen, die das langwellige rote Licht absorbieren und dadurch die Blätter grün erscheinen lassen, sind in der inneren Membran noch gelbe und rote Carotinoide eingelagert, die im Herbst die Buntfärbung der Blätter bewirken. EXPERIMENTELLER TEIL Pro Person ca. 20 g Pflanzenmaterial (Blattspinat, Löwenzahn) vor Versuchsbeginn sammeln und mitbringen! VERSUCHSABLAUF 42 • Puffer, Medien und Gradientenlösung herstellen • Probegradient herstellen • Aufarbeitung des Pflanzenmaterials • Gradient herstellen • Zentrifugation und währenddessen Besprechung der theoretischen Grundlagen • Besprechung der vorgefundenen Banden PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE • Mit einer Pasteurpipette aus jeder Bande Material entnehmen und unter dem Auflichtfluoreszenzmikroskop betrachten. Wichtig: alle Geräte und Materialien unbedingt auf Eis stellen und die Aufarbeitung bis zur ersten Zentrifugation schnell und sorgfältig durchführen! DURCHFÜHRUNG Puffer, Medien und Gradientenlösungen: 1. Herstellung der Stammlösung: 144 ml Na2HPO4 (0.1 M) + 56 ml KH2PO4 (0.1 M) ergeben 200 ml Phosphatpuffer, pH 7,4 (MG, relative Molekülmasse: Na2HPO4 × 2 H2O: 178, KH2PO4: 136). 2. Isolationsmedium für Chloroplasten: 195 ml Phosphatpuffer (0,1 M) + 20 g Saccharose ergeben eine 0.3 M Saccharoselösung (MG Saccharose: 342). 3. Herstellung einer 1 mM Pufferlösung: 5 ml Phosphatpuffer 1:100 mit H2O verdünnen. Daraus werden dann die Gradientenlösungen und das Medium zum Resuspendieren der Chloroplasten hergestellt. 4. Resuspendiermedium: 150 ml Phosphatpuffer (1 mM) + 15.4 g Saccharose ergeben eine 0.3 M Saccharoselösung. 5. Herstellung der Gradientenlösungen (Angaben in Gewichtsprozent) 35%ige Saccharoselösung: 70 g Sacch. auf 130 g Phosphatpuffer (1 mM); Dichte 1,1318 g cm-3 40%ige Saccharoselösung: 80 g Sacch. auf 120 g Phosphatpuffer (1 mM); Dichte 1,1513 g cm-3 50%ige Saccharoselösung: 100 g Sacch. auf 100 g Phosphatpuffer (1 mM); Dichte 1,1870 g cm-3 43 VERSUCH 2: ZENTRIFUGATION Tabelle 1: Dichte einiger Zellorganellen AUFARBEITUNG DES Partikel Dichte [g/cm-3] Mikrosomen 1,13 - 1,15 Chloroplasten (Bruchstücke) 1,16 - 1,18 Mitochondrien 1,17 - 1,21 intakte Chloroplasten 1,20 - 1,25 Peroxisomen 1,25 - 1,27 Zellkerne 1,32 PFLANZENMATERIALS Das kühl gestellte Pflanzenmaterial (Löwenzahn, Spinat; ca. 60 g mit Mittelrippen) wird mit dest. Wasser gewaschen und von den Mittelrippen befreit (Mittelrippen sind chloroplastenarm und sklerenchymatisches Gewebe der Mittelrippen wirkt sich störend bei der Homogenisation aus). Bei der Aufarbeitung im Mörser wird das Pflanzenmaterial mit Isolationsmedium und Seesand zerrieben und anschließend schnell!!! über Mull gefiltert. Der "Extrakt" wird auf 2 Zentrifugengläser verteilt (austarieren) und ca. 9 min bei 4.000 Upm abzentrifugiert. Der Überstand wird in einem Zug weggeleert und der Bodensatz mit 4 ml Suspensionsmedium resuspendiert. Die gesammelten Suspensionen werden kühl aufbewahrt, bis je 1 ml davon auf den endgültigen Gradienten aufgetragen werden. 44 PHYSIKALISCH-TECHNISCHE METHODEN IN DER BIOLOGIE a b Abb. 19: Gradientenherstellung unterschichten (b) überschichten. (a) Die Herstellung des Gradienten erfolgt nach Methode (b), wobei 10 ml 50 %ige Saccharoselösung mit jeweils 10 ml 40 - bzw. 35 %iger Saccharoselösung überschichtet wird. Die Zentrifugation der Gradienten erfolgt dann bei 3000 Upm (45 min). Nach der Zentrifugation werden aus den entstandenen Banden vorsichtig mit einer Pasteur-Pipette Probenentnommen und im Auflichtfluoreszenz-Mikroskop untersucht. LITERATUR 1. Cooper, T. G.: Biochemische Arbeitsmethoden, Walter de Gruyter, Berlin, 1981 2. Laskowski, W., Pohlit, W.: Biophysik, Thieme TB Band II, Stuttgart, 1974 3. Lichtenthaler, Pfister: Praktikum der Photosynthese, Quelle und Meyer, Heidelberg, 1978 4. Strasburger, E.: Lehrbuch der Botanik, G. Fischer Verlag, Stuttgart, New York, 1983 45