Stoffwechsel von Proteinen und Aminosäuren
Werbung

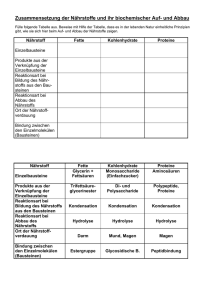
Stoffwechsel von Proteinen und Aminosäuren Löffler/Petrides/Heinrich: Biochemie und Pathobiochemie, 8. Auflage (2007) S. 56-59, 69-79, 314-323, 427-476, 644-646 www.lehrbuch-medizin.de Löffler/Petrides: Biochemie und Pathobiochemie, 7. Auflage (2003) S. 46-100, 294-299, 461-517, 1096-1097 Übersicht 1. Proteine, Aminosäuren (AS) 2. Extrazelluläre Proteinverdauung 3. Proteolyse-Mechanismen 4. Resorption 5. Intrazellulärer Proteinabbau 6. Aminosäureabbau A: Aminostickstoff 6.1 Schlüsselreaktionen 6.2 Pyridoxalphosphat 6.3 Aminosäuretransport 6.4 Harnstoffzyklus 7. Aminosäureabbau B: Kohlenstoffgerüste 7.1 Schlüsselreaktionen 7.2 Coenzyme 7.3 Aminosäuren und C1-Stoffwechsel 8. AS-Stoffwechsel unter besonderen Bedingungen Proteine • hochmolekulare Naturstoffe • Grundelemente: Aminosäuren, kettenartig verknüpft • enthalten z.T. Nicht-EiweißAnteile: Kohlenhydrate, Lipide, Mineralstoffe • in pflanzlichen und tierischen Lebensmitteln • als Energiequelle: untergeordnete Bedeutung Aminosäuren (AS) • aus Kohlenstoff (C), Wasserstoff (H), Sauerstoff (O) und Stickstoff (N) • Grundbausteine der Proteine: 20 (+1) proteinogene L-αAminosäuren bilden die Proteinsequenz (=Primärstruktur) Struktur der Aminosäure-Seitenketten I Aminosäuren mit hydrophober Seitenkette (Ile) Struktur der Aminosäure-Seitenketten II Aminosäuren mit polarer, ungeladener Seitenkette __ NH2 Struktur der Aminosäure-Seitenketten III Aminosäuren mit geladener Seitenkette positiv geladen = basisch negativ geladen = sauer Aminosäuren werden in Gruppen synthetisiert Histidin • Kohlenstoff-Skelett stammt aus Kohlenhydrat-Stoffwechsel • Biosynthesen nichtessentieller AS: höchstens 3 Enzyme Serin-Familie Aromaten(Shikimisäure-) Familie PyruvatFamilie Citratcyclus AspartatFamilie GlutamatFamilie • essentielle(*) AS nur in Pflanzen und Mikroorganismen gebildet • in der tierischen Zelle fehlen 3 Schlüsselenzyme zur Bildung dieser AS (Energieeinsparung) Essentielle und nichtessentielle Aminosäuren Struktur Azidität Essentiell nicht- und bedingt essentiell aliphatisch neutral Valin (Val, V) Leucin (Leu, L) Isoleucin (Ile, I) Threonin (Thr, T) Methionin (Met, M) Glycin (Gly, G) Alanin (Ala, A) Serin (Ser, S) Cystein (Cys, C) Asparagin (Asn, N) Glutamin (Gln, Q) aliphatisch sauer Asparaginsäure (Asp, D) Glutaminsäure (Glu, E) aliphatisch basisch Lysin (Lys, K) Arginin (Arg, R) aromatisch neutral Phenylalanin (Phe, F) Tyrosin (Tyr, Y) heterozyklisch neutral Tryptophan (Trp, W) Prolin (Pro, P) heterozyklisch basisch Histidin (His, H) Essentielle Aminosäuren im Stoffwechsel • 1. Abbauschritt (Entfernung der Aminogruppe) ist oft reversibel = α-Ketosäuren können diese AS ersetzen (Transaminierung) nicht bei Lysin (Lys), Threonin (Thr) • Histidin: kann aus Erythrozyten und Muskulatur mobilisiert werden • Tyrosin (Tyr) und Cystein (Cys): bedingt essentiell = werden aus essentiellen AS synthetisiert • Arginin (Arg) kann essentiell werden (z.B. in Wachstum, Schwangerschaft) Nichtessentielle Aminosäuren • einfach gebaute Seitenkette • Biosynthese und Abbau: gleiche Zwischenprodukte, aber unterschiedliche Enzyme (außer Transaminierung) = individuelle Regulation von Auf- und Abbau • höchste Konzentration im Blut: Blut Glutamin (Gln) und Alanin (Ala) • hohe intrazelluläre Konzentration: Glycin (Gly), Alanin (Ala), Aspartat (Asp), Glutamat (Glu) und Glutamin (Gln) Nicht-kanonische proteinogene AS können – bei entsprechendem Signal - ebenfalls während der Translation eingebaut werden Selenocystein (A), Pyrrolysin (B), N-Formylmethionin (C) z.B. in GlutathionPeroxidase Nicht proteinogene AS und AS-Derivate • α-, ß- oder γ-ständige Aminogruppe(n) • Derivate der (proteinogenen) AS enstehen meist durch Decarboxylierung Æ biogene Amine • Intermediate in Stoffwechselwegen • Bestandteile von Coenzymen • Signalüberträger Ornithin, Ornithin,Citrullin Citrullin ß-Alanin ß-Alanin γ-Aminobuttersäure γ-Aminobuttersäure(GABA) (GABA) Taurin Taurin(Aminoethylsulfonsäure) (Aminoethylsulfonsäure) 4-Hydroxy-Prolin, 4-Hydroxy-Prolin,5-Hydroxy-Lysin 5-Hydroxy-Lysin γ-Carboxy-Glutamat γ-Carboxy-Glutamat Harnstoffzyklus Harnstoffzyklus Coenzym CoenzymA-Vorstufe A-Vorstufe Neurotransmitter Neurotransmitter Gallensäure-Konjugation Gallensäure-Konjugation im imKollagen Kollagen Ca-bindende Ca-bindendeProteine Proteine (Gerinnungsfaktoren) (Gerinnungsfaktoren) Peptidbindung = Säureamid-Bindung Mechanismus: Eigenschaften: Dehydratation energieaufwändig planar starr mesomeriestabilisiert (partielle Doppelbindung) Polypeptide – Proteine I Sekundärstrukturen antiparallel α-Helix parallel ß-Faltblatt = Anordnungen der Polypeptidkette mit der maximalen Zahl an Wasserstoffbrückenbindungen Polypeptide – Proteine II Tertiärstruktur = Quartärstruktur = Sekundärstrukturelemente in räumlicher Anordnung Untereinheiten bilden Funktionseinheit z.B. Ribonuclease A z.B. Hämoglobin Kräfte: Wasserstoffbrücken, Disulfidbrücken (-S-S-), van der Waals-Kräfte (hydrophobe Wechselwirkungen, Aromaten) Proteinumsatz Synthese und Abbau = turnover Deutschland: ~70 kg schwere Person: 100 g Zufuhr 300 - 400 g Umsatz an Körperprotein pro Tag Proteinverdauung Aufschluss der Nahrungseiweiße EXTRAZELLULÄR durch Proteasen (Proteinasen, Peptidasen) des Verdauungstraktes in Magen, Duodenum: im Dünndarm: Proteasen: Proteasen:gehören gehörenzur zurEnzymklasse Enzymklasseder derHydrolasen: Hydrolasen: S-S‘ S-S‘++HH2200Æ ÆS-OH S-OH++H-S‘ H-S‘ ‚Fließband‘ Verdauungstrakt Beleg-/Parietalzellen: pH-Wert ~ 2 Hauptzellen: Pepsinogen Æ Pepsin Azinuszellen: Zymogengranula liefert inaktive Proenzyme der Endound Carboxypeptidasen Bürstensaum enthält membranständige Enteropeptidase und Aminopeptidasen Æ proteolytische Aktivierung der Exo- und Endopeptidasen (pH > 8) Enterozyten: Aufnahme von Aminosäuren (35 %), Di- und Tripeptiden (65 %) Pfortader (Vena portae) Leber: Aminosäurepool Proteolyse im Verdauungstrakt wo? Enzym Vorstufe Aktivierung durch pH Typ Optimum Magen Pepsin ~ogen Pepsin, sr. pH 1.5 - 2.5 Pankreas, Duodenum (Duo) Trypsin ~ogen 7.5 - 8.5 Chymotrypsin ~ogen Enteropeptidase, Trypsin Elastase Pro~ Trypsin Carboxypeptidase A Pro~ Carboxypeptidase B Pro~ Aminopeptidase Pro~ Duo am Aminopeptidase Bürsten Enteropeptidase epithel intestin. Aminopeptidase Mukosa Di-, Tripeptidase Endopeptidase C-terminale Exopeptidase N-terminale Exopeptidase Endopeptidase N-term. Exopep. Pepsine spalten ca. 15 % der Nahrungsproteine • • im Magen: HCl-Konzentration bis 0.1 mol/l Æ pH = 1 HCl-Sekretion stimuliert durch Gastrin (Peptidhormon) • Säuredenaturierung der Nahrungsproteine • Mucine (Glycoproteine): Schleimschicht Æ pH-Gradient; bei Fehlen: Gastritis, Magenund Duodenal-Ulcus Pepsine sind saure Proteasen Pepsin: Pepsin:SÄURE-BASEN-KATALYSE: SÄURE-BASEN-KATALYSE: •• Asp Aspprotoniert protoniertÆ Ænucleophiler nucleophilerAngriff Angriffauf aufCarbonyl-C Carbonyl-Cdes desPeptids Peptids •• 2x 2xProtonentransfer Protonentransfer •• Spaltung Spaltungder derPeptidbindung Peptidbindung Magen ohne Pepsine? Rennin Rennin(Chymosin, (Chymosin,Lab): Lab): im imMagen Magenin inden denersten erstenMonaten Monatennach nach Geburt Geburt(statt (stattPepsin) Pepsin) Autoaktivierung Autoaktivierung(pH (pH3-5) 3-5) löst löstMilchgerinnung Milchgerinnungaus: aus: Schutzkolloid Schutzkolloidder derMilch Milch(kappa-Casein) (kappa-Casein) wird wirdproteolytisch proteolytischgespalten gespalten Pepsin-Wein (z.B. von Schering) bei agastrischem Syndrom (Achylie, psychisch-nervöse Hemmung der Magensaftsekretion) Wie geht es nach dem Magen weiter? Trypsin Chymotrypsin Exopeptidasen Zymogenaktivierung im Duodenum limitierte Proteolyse Trypsin und Chymotrypsin: Serinproteasen katalytische Triade Chymotrypsin: Chymotrypsin:KOVALENTE KOVALENTEKATALYSE KATALYSE++SÄURE-BASEN-KATALYSE SÄURE-BASEN-KATALYSE (a) (a)Wasserstoff Wasserstoffvon vonSer Sernach nachHis His (b) (b)nucleophiler nucleophilerAngriff Angriffauf aufCarbonyl-C Carbonyl-Cdes desPhe Phe + Æ ÆHH+Transfer Transferauf aufAmid-N Amid-N Æ Æ(c) (c)Spaltung Spaltungder derPeptidbindung; Peptidbindung;Wasseranlagerung Wasseranlagerungspaltet spaltetAcylbindung Acylbindung Carboxypeptidase A: Metalloprotease METALL-KATALYSE: METALL-KATALYSE: •• Zn-Ion Zn-Ionist istan an22His His(oder (oder Arg) Arg)und und11Glu Glukomplexiert komplexiert •• Zn Znpolarisiert polarisiertCarbonylCarbonylgruppe gruppe •• nucleophiler nucleophilerAngriff Angriffeines eines Hydroxylions Hydroxylions •• Spaltung Spaltungder derPeptidPeptidbindung bindung Resorption in den Enterozyten Peptidtransporter • Di-, Tri, evtl. Tetrapeptide werden schneller als AS resorbiert • H+-Symport (Protonengradient, Na/K-ATPase-gekoppelt) • Carrierprotein ist stereospezifisch • nimmt auch Antibiotika auf Neugeborene Neugeborenekönnen könnenintakte intakteProteine Proteinedurch durchPinozytose Pinozytoseinindie die Enterozyten Enterozytenaufnehmen, aufnehmen,da da ••nur nurwenig wenigProteasen Proteasenim imVerdauungskanal Verdauungskanal ••Kolostrum Kolostrumenthält enthältProteaseinhibitoren Proteaseinhibitoren ••funktionelle funktionelleIg‘s Ig‘saus ausder derMuttermilch Muttermilchzusätzlich zusätzlichzu zuplacentaren placentaren Aminosäuretransportsysteme • sekundär aktive Aufnahme, gegen Konzentrationsgefälle • mittels Na+-Symport (wie Glucoseaufnahme) • Bürstensaum (Darmepithel und Nierentubulus): L-Aminosäuren-spezifische Carrierproteine für verschiedene Gruppen von AS: neutrale verzweigtkettige + aromatische, basische saure Aminosäuren Defekte der Proteinverdauung und Resorption • exkokrine Pankreasinsuffizienz bei Parenchymverlust oder Sekretfluss-Störungen • Atrophie / Epitheldefekte der Dünndarmzotten: Oligo- und Polypeptide resorbiert Æ Allergien z.B. Sprue: Sprue verminderte Peptidspaltung an/in Mukosazellen Proteine gelangen in tiefere Darmabschnitte Æ bakterieller Abbau Æ (neuro-)toxische Amine, z.B.: Lysin Lysin Tyrosin Tyrosin Histidin Histidin Tryptophan Tryptophan Æ Æ Æ Æ Æ Æ Æ Æ Cadaverin Cadaverin Tyramin Tyramin Histamin Histamin Indol Indol++Scathol Scathol(Methylindol) (Methylindol) Pfortader (Vena portae) Leber: Entgiftung Defekte einzelner Enzyme / Carrierproteine • hereditäre Defekte proteolytischer Enzyme z.B. Trypsinogen, Enteropeptidase Æ Therapie: orale Zufuhr • Gendefekte von Aminosäuretransportern, z.B.: Hartnup-Krankheit: Hartnup-Krankheit: •• Aufnahmestörung Aufnahmestörungneutraler neutralerAS AS (Trp) (Trp)ininDarm Darmund undNiere Niere •• autosomal autosomalrezessiv, rezessiv,~~1:15.000 1:15.000 •• Serotoninmangel, Serotoninmangel,Pellagra Pellagraund und Indolvergiftung Indolvergiftung Cystinose: Cystinose: •• verminderte verminderteAbgabe Abgabevon vonCystin Cystinaus aus Lysosomen Lysosomen •• autosomal autosomalrezessiv, rezessiv,1:50.000 1:50.000 •• Cystingehalt CystingehaltininRetina, Retina,Niere Nierestark stark erhöht erhöht •• Rachitis, Rachitis,Anämie, Anämie,Niereninsuffizienz Niereninsuffizienz •• tubuläres tubuläresFanconi-Syndrom Fanconi-Syndrom Sekundäre Aminosäuretransport-Störungen • angeborene oder erworbene Primärschäden, z.B. im Zuckerstoffwechsel, Anämien, Rachitis, Schwermetallvergiftungen, Vitamin- oder Mineralmangel generalisierte generalisierterenale renaleHyperaminoazidurie Hyperaminoazidurie • Hyperaminoacidurie in Verbindung mit Glykosurie, Phosphaturie und evtl. Hyperurikämie ==tubuläres -SYNDROM: SYNDROM tubuläresFANCONI FANCONI-SYNDROM: verminderte verminderteReabsorption Reabsorptionvon vonGlucose, Glucose,Aminosäuren, Aminosäuren, Phosphat, Phosphat,Harnsäure, Harnsäure,Bicarbonat Bicarbonat Intrazelluläre Proteolyse Wege der intrazellulären Proteolyse Limitierte Proteolyse Æ Signalübertragung: Prohormon-Konvertasen Caspasen Æ Apoptose Protein-Abbau: • vorwiegend in Proteasomen bzw. Lysosomen • Calpaine – cytosolische Serinproteasen: Ca++-abhängig, Umsatz von Muskelprotein • fehlerhafte (entfaltete) ER-Proteine: Retransport ins Cytosol, proteosomaler Abbau (ER-Stress ÅÆ UPR = unfolded protein response) • mTOR = Sensor des intrazelluären AS-Status‘ beschleunigter bei beschleunigterProteinabbau Proteinabbaubei Stress, Stress,Hitze, Hitze,kataboler katabolerStoffwechsellage Stoffwechsellage gefördert gefördert durch durchGlucagon, Glucagon,Adrenalin, Adrenalin,Glucocorticoide Glucocorticoide und und↓↓[Insulin] [Insulin] Die Protein-Müllabfuhr: Das Proteasom • im Cytoplasma, auch im Kern • Multienzymkomplex, Endoprotease • 30.000 / Zelle • ATP-abhängiger Abbau fehlgefalteter ATP und geschädigter Proteine • diese Proteine sind meist durch Ubiquitin markiert Produkte: Produkte:Dekapeptide Dekapeptide Æu.a. Æu.a.zur zurBeladung Beladungvon von Peptid-Rezeptoren Peptid-Rezeptoren(MHC-I) (MHC-I) Æ ÆTransport Transportan andie dieZelloberfläche Zelloberfläche (immunologische (immunologische SELBST-Erkennung) SELBST-Erkennung) • weiterer cytosol. Abbau: Aminopeptidasen Ubiquitinierung Ubiquitin (Ub): (Ub) Protein, 76 AS konserviert E1 = Ubiquitinaktivierendes Enzym Bindung des Ubiquitins: Thioesterbindung E2 = Ubiquitinkonjugierendes Enzym E3 = Ubiquitin-Ligase ubiquitiniert werden: - Proteine mit kurzer Halbwertzeit - Proteine mit spezifischen Erkennungssequenzen - fehlgefaltete Proteine Isopeptidbindungen Proteasomen-assoziierte Krankheiten erhöhte Proteasomenaktivität: • Cystische Fibrose (Mukoviszidose): fehlgefaltetes Chloridkanalprotein Æ erhöhter Abbau Æ Schleimablagerung • Überfunktion der E3-Ligase Siah1 Æ Zellkern-Proteasomen aktiviert Æ Apoptose • bestimmte Anämien • durch virale Proteine: ‚high risk‘ HPV-E6-Protein: ↑ Ubiquitinierung + proteosomaler Abbau des Tumorsuppressors p53 Æ Cervixkarzinom CMV: schwere Ketten des MHC-I-Komplexes aus ER zurück ins Cytosol Æ proteosomaler Abbau Æ Immunabwehr ↓ Proteasomen-assoziierte Krankheiten II sekundäre Unterfunktion des Proteasoms: • Morbus Parkinson: Parkinson mutiertes Parkin (E3-Ligase) Æ Ubiquitinierungsstörung + gestörte Aktivität von Siah1 (s.o.), Pin1 Æ Degeneration Substantia nigra • Morbus Alzheimer: Alzheimer jeder Fünfte über 80 Jahre! Amyloid-beta: Abbau vermindert Æ Demenz • Chorea Huntington (Veitstanz): Überlastung des Proteasoms durch mutiertes Huntingtin Æ Hirndegeneration Æ Hyperkinese, Demenz M. Parkinson ‚Mägen‘ in der Zelle: Lysosomen • im Cytoplasma • Zellorganell • 300 Vesikel / Zelle • pH 4.5 – 5: ca. 50 saure Hydrolasen (aus Golgi-App.) • Proteinabbau durch Kathepsine, Elastase, Kollagenase u.a. Endoproteinasen Lysosomen II Abbau aufgenommener und intrazellulärer Biomoleküle und Partikel (z.B. defekte Organellen) = NICHT NUR PROTEINE • z.B. Uterus nach Geburt: 2 kg Æ 50 g in 9 Tagen • Mikroorganismen: Abbau im Phagolysosom Produkte: Produkte:Oligopeptide Oligopeptide Beladung BeladungAntigenAntigenpräsentierender präsentierender Rezeptoren Rezeptoren(MHCII) (MHCII) Æ Æimmunologische immunologische FREMD-Erkennung FREMD-Erkennung Abbau extrazellulärer Proteine (Plasmaproteine) im Lysosom Glykoproteine: enthalten N-AcetylNeuraminsäure = Sialinsäure (NANA) Blutgefäßwände: Neuraminidase Æ entfernt NANA Æ Gal exponiert Albumin: nicht glykosyliert z.g.T. in den Nieren mit dem Ultrafiltrat ausgeschieden Wiederaufnahme in die Tubulusepithelzellen der Niere z.g.T. Wiederaufnahme ins Blut lysosomaler Abbau Galaktose bewirkt Rezeptorvermittelte Endozytose in Leberzellen Æ lysosomaler Abbau Abbau Abbauvon vonPeptidhormonen Peptidhormonen ähnlich ähnlichAlbumin Albumin Lysosomen-assoziierte Krankheiten • Intralysosomale Speicherkrankheiten = Abbaustörungen Defekte in einzelnen lysosomalen Enzymen, betreffen je eine Stoffklasse: Mucopolysaccharidosen (z.B. Morbus Hunter) Mucolipidose Typ II (I-Zell-Krankheit) Sphingolipidosen (z.B. Morbus Gaucher, Tay-Sachs) Lipidspeicherkrankheiten (z.B. Morbus Niemann-Pick Typ II) Glycogenose: M. Pompe (Glycogenose Typ II) Æneurologische Symptome (Minderentwicklung), Minderwuchs, Hautveränderungen • rheumatoide Arthritis: Arthritis extrazelluläre Freisetzung lysosomaler Enzyme Lysosomen-assoziierte Krankheiten II Kathepsine: Überproduktion/Sezernierung: korreliert mit Invasivität von Tumorzellen; Kathepsin K: Kollagenabbau Æ Osteolyse Mangel: Kathepsin K: Skelettanomalien „Hereditärer Kathepsin K-Mangel führt in Folge einer KollagenKathepsin D: Osteochondrodysplasie und Persistenz zur Pycnodysostosis, die durch Osteosklerose charakterisiert ist. Defekte imMorbus Kathepsin D-Gen (Neuronale Ceroid-Lipofuszinose NCL = Batten) verursachen eine letale Form der neuronalen Ceroid-Lipofuszinose mit Lipopigmentablagerungen; Verlust von zerebro-kortikalen und retinalen connataler progressiver Neurodegeneration.“ Nervenzellen im Kindesalter (Löffler, S. 323) = Blindheit, Abbau Psychomotorik, Epilepsie Lysosomen und Schönheit •• Falten Falten // Runzeln Runzeln durch durch gesteigerte gesteigerte Kollagenase-Aktivität Kollagenase-Aktivität im im Lysosom Lysosom ((UV-induziert!) UV-induziert!) induziert •• Altersflecken Altersflecken durch durch mangelnden mangelnden lysosomalen lysosomalen Abbau Abbau von von endogenen endogenen Pigmenten Pigmenten