Diagnose und Therapie von interstitiellen Lungenerkrankungen
Werbung
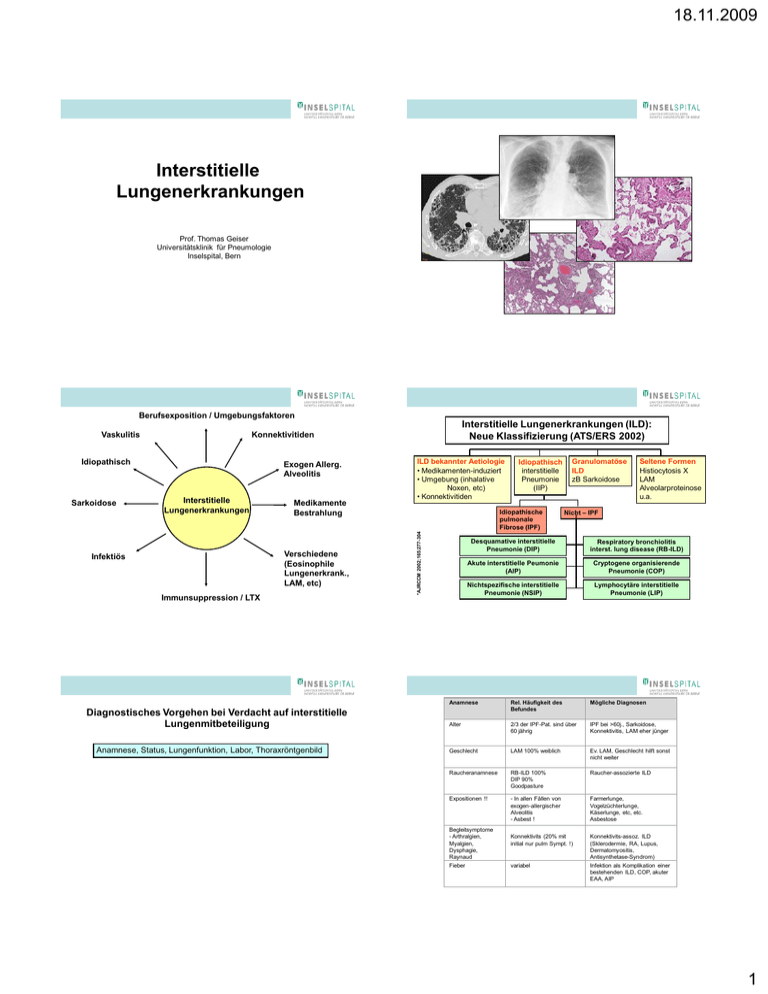
18.11.2009 Interstitielle Lungenerkrankungen Prof. Thomas Geiser Universitätsklinik für Pneumologie Inselspital, Bern Berufsexposition / Umgebungsfaktoren Idiopathisch Sarkoidose Interstitielle Lungenerkrankungen (ILD): Neue Klassifizierung (ATS/ERS 2002) Konnektivitiden Exogen Allerg. Alveolitis Interstitielle Lungenerkrankungen Medikamente Bestrahlung Verschiedene (Eosinophile Lungenerkrank., LAM, etc) Infektiös Immunsuppression / LTX Diagnostisches Vorgehen bei Verdacht auf interstitielle Lungenmitbeteiligung Anamnese, Status, Lungenfunktion, Labor, Thoraxröntgenbild ILD bekannter Aetiologie • Medikamenten-induziert • Umgebung (inhalative Noxen, etc) • Konnektivitiden Idiopathisch interstitielle Pneumonie (IIP) Idiopathische pulmonale Fibrose (IPF) *AJRCCM 2002;165:277-304 Vaskulitis Granulomatöse ILD zB Sarkoidose Seltene Formen Histiocytosis X LAM Alveolarproteinose u.a. Nicht – IPF Desquamative interstitielle Pneumonie (DIP) Respiratory bronchiolitis interst. lung disease (RB-ILD) Akute interstitielle Peumonie (AIP) Cryptogene organisierende Pneumonie (COP) Nichtspezifische interstitielle Pneumonie (NSIP) Lymphocytäre interstitielle Pneumonie (LIP) Anamnese Rel. Häufigkeit des Befundes Mögliche Diagnosen Alter 2/3 der IPF-Pat. sind über 60 jährig IPF bei >60j., Sarkoidose, Konnektivitis, LAM eher jünger Geschlecht LAM 100% weiblich Ev. LAM, Geschlecht hilft sonst nicht weiter Raucheranamnese RB-ILD 100% DIP 90% Goodpasture Raucher-assozierte ILD Expositionen !! - In allen Fällen von exogen-allergischer Alveolitis - Asbest ! Farmerlunge, Vogelzüchterlunge, Käserlunge, etc, etc. Asbestose Konnektivits (20% mit initial nur pulm Sympt. !) Konnektivits-assoz. ILD (Sklerodermie, RA, Lupus, Dermatomyositis, Antisynthetase-Syndrom) Infektion als Komplikation einer bestehenden ILD, COP, akuter EAA, AIP Begleitsymptome - Arthralgien, Myalgien, Dysphagie, Raynaud Fieber variabel 1 18.11.2009 Befunde Rel. Häufigkeit des Befundes Knisterrasseln Trommelschlegelfinger IPF (50%) Erythema nodosum Mögliche Diagnosen Lokalisation der Infiltrate/ Muster Diagnose Häufig bei vielen ILD Mittel- und Oberfeld Häufig in IPF, eher selten in EAA, Sarkoidose, Konnektivitis Sarkoidose, exogen allergische Alveolitis, Silikose, Pneumokoniose, ankylosierende Spondylitis Unterfeld Idiopathische Lungenfibrose (IPF), Konnektivitis-assoziert, Asbestose, chronische EAA. Honigwabenmuster (basal betont) IPF, Asbestose, Sarkoidose IV, chronische EAA Wandernde Infiltrate Organisierende Pneumonie, EAA, allergische bronchopulmonale Aspergillose Mikronoduli Sarkoidose, EAA, Infektion Mit mediastinaler Lymphadenopathie Sarkoidose, Malignität, Silikose, Infekt, IPF. Sarkoidose, Behcet Arthritis variabel Sarkoidose, Konnektivitis Trockene Schleimhäute variabel Sjögren Syndrom Adenopathie, Hepatosplenomegalie variabel Sarkoidose, Amyloidose Neurologie variabel (Neuro)sarkoidose, tuberöse Sklerose DD: Medikamenteninduzierte interstitielle Pneumopathie • Bleomycin • Busulfan • Cyclophosphamid Spirometrie in der Praxis • Amiodarone • Vitalkapazität • Nitrofurantoin • Minocyclin • Sulfasalazin • Methotrexat • Gold • Penicillamin • L-Tryptophan, etc, etc. www.pneumotox.com • Residualvolumen • Totalkapazität 2.6 L (54 % Soll) 1.3 L (56 % Soll) 3.9 L (55 % Soll) • FEV1 vor • FEV1 nach • FEV1/FVC 1.8 L (67 % Soll) 1.8 L (67% Soll) 70% • CO Diffusion 7.7 mL/mmHg/min (25% Soll) • Bestrahlung 6-Minuten Gehtest Datum: 21.11.03 14:20 Barometer (mmHg): 715 ID: 7053789 Alter (J): Geschlecht: 54 Grösse (cm): 180 m Gewicht (kg): 66 BMI (kg/m2): 20.4 Borg-Scale: 3 Borg-Scale: 5-6 Ruhe- Gehstrecke: 485 m Diagnostisches Vorgehen bei Verdacht auf interstitielle Lungenmitbeteiligung Anamnese, Status, Lungenfunktion, Labor, Thoraxröntgenbild O2-Sättigung (transkutan) 100 90 SaO2 % 80 70 60 50 0 1 2 3 Zeit (min) 4 5 4 5 6 Hochauflösendes Computertomogramm HR-CT Puls 140 S/min 120 100 80 60 0 1 2 3 Zeit (min) 6 2 18.11.2009 Histologische Diagnostik Transbronchiale Biopsien via Bronchoskopie RB-ILD COP NSIP Sarkoidose Neue Technologien: Endobronchialer Ultraschall (EBUS) Thorakoskopische Wedge Biopsie Endobronchialer Ultraschall (EBUS) (BF-UC160F-OL8; Olympus Medical Systems, Tokyo, Japan) Das Ansprechen auf Therapie und die Prognose sind abhängig von der Histologie 59-jährige Patientin mit zunehmendem Husten und Auswurf - Kein Ansprechen auf Antibiotika - Verdacht auf interstitielle Pneumopathie im CT - Restriktion, Belastungshypoxämie - Beginn mit Steroiden, gutes Ansprechen - Rezidiv nach Absetzen der Steroide -Erneute Evaluation mit Bronchoskopie, BAL Histologie Bjoraker et al, AJRCCM 1998 3 18.11.2009 Abklärung ILD: Vom Hausarzt in die Spezialklinik Gold –Standard für die Diagnostik von interstitiellen Lungenerkrankungen • Klinik - inkl Lungenfunktionsteste • Radiologie - HR-CT • BAL/ Histologie - Transbronchiale Biopsien - ev thorakoskopische Wedge Biopsien C. B., 1943 Hochauflösendes CT • Anstrengungsdyspnoe, Husten • Basale RG • Restriktion • Diffusionsstörung, Arbeitshypoxämie • retikuläre, basal betonte Transparenzminderung Verdacht auf interstitielle Lungenerkrankung Verdachtsdiagnose ? Usual interstitial pneumonia (UIP) Muster 4 18.11.2009 Idiopathische Pulmonale Fibrose (IPF) Interstitielle Lungenerkrankungen (ILD): Neue Klassifizierung (ATS/ERS 2002) Diagnosekriterien (ohne offene Lungenbiopsie) ILD bekannter Aetiologie • Medikamenten-induziert • Umgebung (inhalative Noxen, etc) • Konnektivitiden Minor Criteria • Alter > 50 Jahre • Langsamer Beginn der Dyspnoe • Krankheitsdauer > 3 Monate • inspiratorische RG basal bds Nicht spezifische interstitielle Pneumopathie NSIP Idiopathische interstitielle Pneumopathie (IIP) Granulomatöse ILD zB Sarkoidose Seltene Formen Histiocytosis X LAM Alveolarproteinose u.a. Nicht – IPF Idiopathische pulmonale Fibrose (IPF) *AJRCCM 2002;165:277-304 Major Criteria • Ausschluss von anderen Ursachen einer interstitiellen Lungenerkrankung (Med.induziert, Konnektivitis, EAA) • Restriktion, Hypoxämie, verminderte CO Diffusion • Retikuläre Transparenzminderungen basal in HR-CT • Bronchoskopie mit TBB/BAL ohne Hinweise auf andere Ursachen Desquamative interstitielle Pneumonie (DIP) Respiratory bronchiolitis interst. lung disease (RB-ILD) Akute interstitielle Peumonie (AIP) Cryptogene organisierende Pneumonie (COP) Nichtspezifische interstitielle Pneumonie (NSIP) Lymphocytäre interstitielle Pneumonie (LIP) IPF/UIP Fibrotische NSIP Zelluläre NSIP Fibrotic NSIP Cellular NSIP Martinez, 2006 Steroid non responsive Cryptogene organisierende Pneumopathie (COP) = idiopathic BOOP Steroid responsive RB-ILD and DIP: Raucherassoziert ? • subacute with fever, cough, malaise, weight loss, mild dyspnea • age 30-50 years old • smoking history almost universal !! • chronic progressive dyspnea, dry cough • PFT: mild to moderate restriction, hypoxemia • PFT: • HR-CT: multiple patchy opacities, from ground glass to consolidation • HR-CT: RB-ILD: scattered bilateral, ground glass, centrilobular nodules, bronchial wall thickening DIP: diffuse bilateral, ground glass opacities, reticular abnormalities • BAL: mixed pattern with lymphocytosis • Histology: intra-alveolar granulation tissue • Prognosis: excellent on steroids (usually 6-12 months) normal to obstructive in RB-ILD, restrictive in DIP • BAL: BAL macrophages (> 90%) • Good prognosis if stop smoking and treatment with steroids ! 5 18.11.2009 Diagnostisches Vorgehen bei Verdacht auf interstitielle Lungenerkrankung Anamnese, Status, Lungenfunktion, Labor, Thoraxröntgenbild HR-Computertomographie Atypische klinische/radiol. Veränderungen Exogen-allergische Alveolitis (HypersensitivitätsPneumonitis) • akut, subakut, chronisch • Vogelzüchter-Lunge • Farmer-Lunge • Käser-Lunge • Luftbefeuchter-Lunge • etc, etc • oft rasche Besserung bei fehlender Exposition Typische Klinik und Radiologie (bspw IPF, EAA,Konnektivitiden, Sarkoidose) Bronchoskopie mit transbronchialer Biopsie, BAL ? Falls nicht diagnostisch Thorakoskopische Biopsie UIP NSIP RB DIP OP LIP DAD Non-IIP *AJRCCM 2002;165:277-304 Antiinflammatorisch • Steroide • Azathioprin • N-Acetylcystein • Cyclophosphamid Neue Therapien in IPF: das BUILD Studienprogramm King et al, Am J Respir Crit Care Med 177;75-81, 2008 Antifibrotisch • Bosentan (ERA)? • Pyrfenidon ? • TGF- Inhibitoren ? BUILD-1 Resultate: 100 90 80 70 Bosentan p=0.009 (biopt. bestätigt) 60 50 Placebo 40 Lungenschädigung 30 Entzündung 20 10 0 0 Mod. ATS Fibrose Indikationen Dauersauerstofftherapie CH (Schweizer Richtlinien 2006) 1) Chronisch arterielle Hypoxämie in klinisch stabilem Zustand mit PaO2 < 55 mm Hg / 7.3 kPa 3 6 9 Behandlung (Monate) 12 Wahl der Sauerstoffquelle O2-Konzentrator Flüssigsauerstoff 2) Oder PaO2 < 60 mm Hg bei sekundärer Polyglobulie und /oder Zeichen des chronischen Cor pulmonale 3) Patienten mit situativ lang dauernden Hypoxämien → belastungsinduzierte Hypoxämie (PaO2 < 55 mmHg) mit dem Nachweis einer verbesserten Leistungstoleranz unter Sauerstoffatmung 6 18.11.2009 Interstitielle Lungenerkrankungen : Multidisziplinäre Diagnostik und Therapie Pathologe Pneumologe Radiologe Hausarzt 7