Biochemie-Seminar 15
Werbung
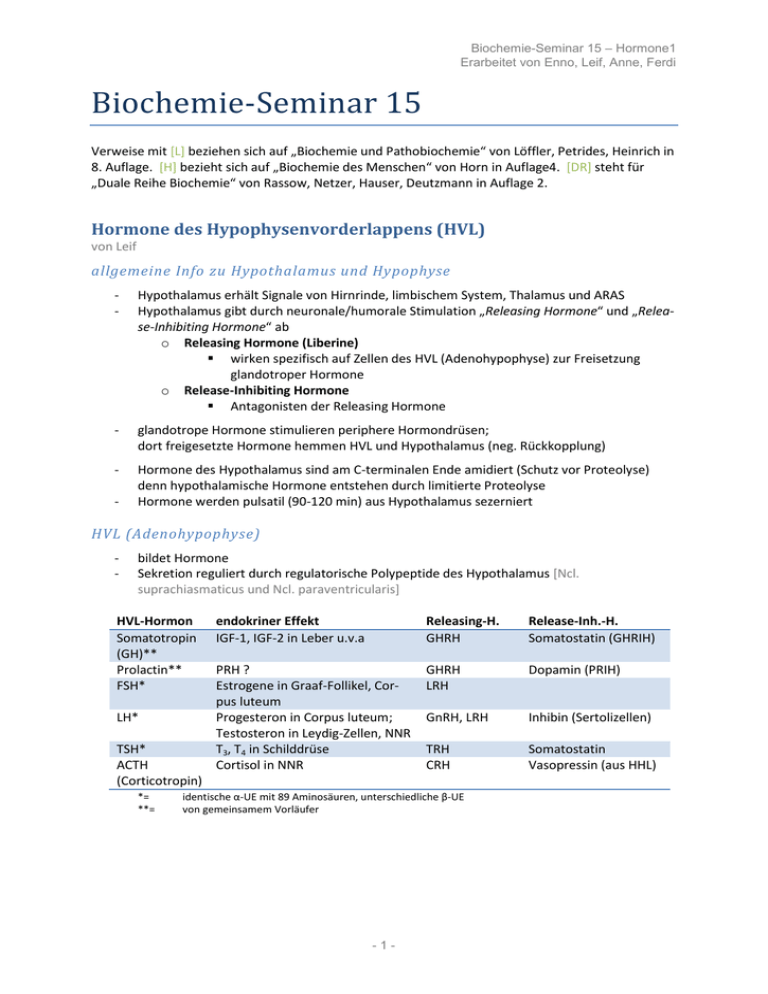
Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Biochemie-Seminar 15 Verweise mit [L] beziehen sich auf „Biochemie und Pathobiochemie“ von Löffler, Petrides, Heinrich in 8. Auflage. [H] bezieht sich auf „Biochemie des Menschen“ von Horn in Auflage4. [DR] steht für „Duale Reihe Biochemie“ von Rassow, Netzer, Hauser, Deutzmann in Auflage 2. Hormone des Hypophysenvorderlappens (HVL) von Leif allgemeine Info zu Hypothalamus und Hypophyse - Hypothalamus erhält Signale von Hirnrinde, limbischem System, Thalamus und ARAS Hypothalamus gibt durch neuronale/humorale Stimulation „Releasing Hormone“ und „Release-Inhibiting Hormone“ ab o Releasing Hormone (Liberine) wirken spezifisch auf Zellen des HVL (Adenohypophyse) zur Freisetzung glandotroper Hormone o Release-Inhibiting Hormone Antagonisten der Releasing Hormone - glandotrope Hormone stimulieren periphere Hormondrüsen; dort freigesetzte Hormone hemmen HVL und Hypothalamus (neg. Rückkopplung) - Hormone des Hypothalamus sind am C-terminalen Ende amidiert (Schutz vor Proteolyse) denn hypothalamische Hormone entstehen durch limitierte Proteolyse Hormone werden pulsatil (90-120 min) aus Hypothalamus sezerniert - HVL (Adenohypophyse) - bildet Hormone Sekretion reguliert durch regulatorische Polypeptide des Hypothalamus [Ncl. suprachiasmaticus und Ncl. paraventricularis] HVL-Hormon Somatotropin (GH)** Prolactin** FSH* LH* TSH* ACTH (Corticotropin) *= **= endokriner Effekt IGF-1, IGF-2 in Leber u.v.a Releasing-H. GHRH Release-Inh.-H. Somatostatin (GHRIH) PRH ? Estrogene in Graaf-Follikel, Corpus luteum Progesteron in Corpus luteum; Testosteron in Leydig-Zellen, NNR T3, T4 in Schilddrüse Cortisol in NNR GHRH LRH Dopamin (PRIH) GnRH, LRH Inhibin (Sertolizellen) TRH CRH Somatostatin Vasopressin (aus HHL) identische α-UE mit 89 Aminosäuren, unterschiedliche β-UE von gemeinsamem Vorläufer -1- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi ACTH (Corticotropin) - adrenocorticotropes Hormon in basophilen Zellen des HVL synthetisiert und in Sekretgranula gespeichert Hypophyse enthält ca. 250 μg ACTH, 10-20% davon werden täglich sezerniert o 7-10 kurze Perioden am Tag, meist am frühen Morgen o Plasma-HWZ 20-25 min - Biosynthese über Pro-Opiomelanocortin (POMC) proteolytische Prozessierung durch Prohormonconvertasen (PC) an Lysin- und Arginin-reichen Regionen [basophile Seitenketten] [POMC kann durch limitierte Proteolyse auch zu Endorphin, β-Lipotropin, MSH, Opiatpeptiden werden] besteht aus 39 Aminosäuren, davon 24 N-terminale für biologische Aktivität verantwortlich - Regulation - Stimulation der Sekretion des ACTH durch CRH, Cholecystokinin, Stress o Nachlieferung des ACTH über CRH-stimulierte Transkription des POMC-Gens - Inhibition der Sekretion des ACTH durch Cortisol Wirkung - stimuliert Synthese und Regulation der Glucocorticoide, Androgene, Estrogene in NNR: o Aktivierung der Cholesterinesterase o Aktivierung des Proteinbiosynthese, Steriodsynthese o Steigerung der Glykogenolyse und des Hexosemonophophatwegs - Folgen: o BZ steigt o nicht-veresterte FS im Blut steigen o N-, Kalium-, Phosphat-Ausscheidung steigt o Retention von Na+, Cl-, Wasser o Abfall der Eosinophilen und Lymphozyten o Anstieg der Leukos o gesteigerte Harnsäureausscheidung (wg. erhöhtem Purinstoffwechsel) GnRH - Gonadotropin-releasing-Hormon steuert hormonelle Regulation der Gonadenfunktion Regulation - GnRH-produzierende Hormone werden von Wachstumsfaktoren aus Gliazellen (z.B. TGFα, TGFβ) und Prostaglandin E2 reguliert - Regulation durch Kisspeptin Wirkung - stimuliert Synthese und Freisetzung von LH (Luteotropin) und FSH (Follitropin) aus HVL - GnRH-Störungen in der Entwicklung führen zu verzögerter Pubertät und Hypogonadismus -2- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi LH, FSH Wirkung LH o o Wirkung FSH o o stimuliert Leydig-Zellen des Hodens zu Testosteronsynthese und –sekretion stimuliert Theca-Zellen zu Androgen-Synthese ; Corpus luteum zu ProgesteronSynthese; Granulosazellen zu Estrogensynthese stimuliert Sertoli-Zellen zur Spermatogenese stimuliert Graaf’schen Follikel zur Follikelreifung und Estrogenproduktion; Erhöhung der LH-Rezeptoren an Granulosazellen Feinregulation o Inhibine aus Sertoli-Zellen des Hodens und Granulosa-Zellen des Ovars freigesetzt hemmen spezifisch FSH o Aktivine aus Sertoli-Zellen, Follikelepithel des Ovars und Zellen des HVL stimulieren FSH-Biosynthese und –Sekretion o Follistatin hemmt Aktivin Somatotropin (STH/ GH „growth hormone“) - aus somatotropen Zellen der Adenohypophyse strukturverwand mit Prolacin; nicht glykosyliert im Blutplasma an Bindeprotein gebunden (lösliche Form des zellulären GH-Rezeptors) Regulation - [L] S. 886 Abb. 27.38 - stimuliert durch GHRH („growth hormone releasing hormone“) aus Ncl. arcuatus und Ncl. ventromedialis gelangt an GHRH-Rezeptoren G-Protein PKA+PLC Synthese und Freisetzung von GH - stimuliert durch Ghrelin aus Magenmukosa (antizipatorisch vor Nahrungsaufnahme sezerniert) an GH-Sekretagogrezeptor (GHSR) PLC GH-Release über [Ca++]IZ - inhibiert durch Somatostatin, gebildet im Hypothalamus aus Präprosomatostatin durch Prohormonkonvertasen G-Protein hemmt Adenylatcyclase - Inhibition durch IGF-1 durch negative Rückkopplung auf hypothalamischer Ebene auf die GHRH-Produktion und auf hypophysärer Ebene auf die GH-Sekretion -3- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Wirkung - Somatotropin (GH) hat direkte insulinantagonistische Wirkungen [z.B. eine Hemmung der Glucoseaufnahme in Muskel- und Fettgewebe, Förderung der Gluconeogenese und Fettmobilisierung durch Lipolyse und Ketogenese] Erhöhung der Glucose und freien Fettsauren im Blut - GH stimuliert in den meisten Geweben Aminosäureaufnahme und Proteinbiosynthese - GH stimuliert im Muskel Fettsäureaufnahme und –verwertung, sowie Proteinbiosynthese „Viele Wirkungen von Somatotropin (GH) werden über lokale Bildung von IGF-I und IGFBindeproteinen vermittelt, welche zusammen Wachstum und Körperzusammensetzung kontrollieren.“ - Wirkung des GH wird über einen GH-Rezeptor (Cytokinrezeptor) vermittelt: GH-Bindung induziert Rezeptordimerisierung nachgeschaltete Aktivierung der JAK/STATSignaltransduktionskaskade Aktivierung GH regulierter Gene(v.a. Insulin like growth factors-1 und -2 (IGF-1 und IGF-2, früher: Somatomedine) [GH-Rezeptoren sind vor allem in der Leber exprimiert, jedoch auch in vielen anderen Körperzellen, z.B. Wachstumszonen auf Chondrozyten im Knochen, Knorpeln und verschiedenen anderen Geweben] - IGF-1 und IGF-2 werden aus Vorstufen durch limitierte Proteolyse gebildet o IGFs zeigen hohe Homologie zu Insulin und binden auch an Insulinrezeptoren o zirkulieren im Blut gebunden an IGF-Bindeproteine (IGF-BP) o IGF-1 bindet auch v.a. an einen spezifischen IGF-1-Rezeptor [Strukturähnlichkeit mit dem Insulinrezeptor; Signalübertragung erfolgt ähnlich wie beim Insulinrezeptor durch Tyrosinkinaseaktivität] o IGF-2-Rezeptor [Mannose-6-Phosphat-Rezeptor] zeigt einen anderen Aufbau als der Insulin- und IGF-I-Rezeptor und keine Tyrosinkinaseaktivität o hohe IGF-1-Spiegel neonatal und während der Pubertät gefunden [Serumkonzentration von IGF-1 wird diagnostisch als integrales Signal der GH-Wirkung verwendet, da die Analytik des GH wegen kurzer HWZ und pulsatilen, vom Lebensalter abhängigen Ausschüttung nur von Speziallabors durchgeführt und interpretiert werden kann} o IGF-1 und IGF-BPs für Knochen- und Knorpelwachstum essentiell In vivo stimuliert IGF-1 am intakten Rippenknorpel den Einbau von Sulfat in Proteoglykane und den von Thymidin in DNA wenn die Zellen konfluent sind und ihr Wachstum einstellen Thymidineinbau , IGF-1 führt zur Synthese extrazellularer Matrix [also Reaktion einer Zielzelle auf IGF-1 durch Proliferationszustand bestimmt] o IGFs stimulieren Wachstums- und Differenzierungsvorgange Differenzierung von Adipozyten aus entsprechenden Vorlauferzellen IGF-2 ist vor allem ein embryonaler und fetaler Wachstumsfaktor, zusammen mit Insulin - wichtige Wirkungen von Somatotropin laut Vorlesung Prozess kurzfristig („insulinähnlich“) Glc-Aufnahme AS-Aufnahme GLC-Verwertung Lipolyse Proteosynthese langfristig („diabetogen“) Glc-Aufnahme Lipolyse Proteosynthese Leber Muskel Fettgewebe (+) + + + - + (-) + -4- + + Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Prolaktin „Das dem GH strukturverwandte Prolactin wirkt über einen Rezeptor der Cytokinfamilie durch JAKSTATPhyosphorylierungskaskaden auf die Brustdrüsenentwicklung und Lactation.“ - während Schwangerschaft erhöht sich Zahl und Größe der lactotrophen Zellen Vergrößerung der Adenohypophyse um bis zu 50% Nebenwirkungen auf die Sehnervenkreuzung [nach Beendigung von Schwangerschaft und Lactation rückläufig] - Prolactin nicht posttranslational modifiziert; strukturell verwandt mit GH o weist drei intramolekulare Disulfidbrücken auf und hat eine Plasmahalbwertszeit von ca. 15 Minuten Wirkung - direkte Wirkungen auf die Entwicklung des Brustdrüsenepithels während Schwangerschaft o Hinweise auf Beteiligung an Tumorentwicklung von Brust- und Prostatakarzinomen - wirkt über einen Klasse 1-Rezeptor der Cytokinrezeptorsuperfamilie [phosphorylierte Tyrosinreste des Prolactinrezeptors sind auch Andockstellen für die Adaptorproteine SHC, GRB 2 und GAB 2] Bindung und Aktivierung von Ras und Raf MAP-Kinasewege - synergistisch mit LH Progesteron-Synthese im Corpus luteum - synergistisch mit STH, Thyroxin, Insulin Induktion der Enzyme für Lactosebildung - Kinasen der Src-Familien können an den Prolactinrezeptor binden und Proteinkinase B sowie PIP-3-Kinasewege aktivieren Hemmung der Apoptose und Stimulation der Proliferation Regulation - im Gegensatz zu den anderen Hypophysenhormonen bisher kein hypothalamisches releasing-Hormon - Inhibition der Sekretion durch hypothalamisches Dopamin über Dopamin D2-Rezeptoren Dopamin wird auch als „prolactin inhibiting factor“ bezeichnet. - volle Wirkung entfaltet sich erst nach Geburt da Estrogene und Gestagene Enzyme der Lactosebildung hemmen Pathobiochemie - Erhöhte, andauernde Prolactinsekretion bei Adenomen der lactotrophen Zellen, sog. Prolactinomen, beobachte Amenorrhoe, Galactorrhoe und Infertilität junger Frauen sowie verringertee Libido und Impotenz bei Männern [sekundär Gonadotropinsekretion supprimiert] - Prolactinome können durch Dopaminagonisten oder transsphenoidale, selektive Entfernung des Prolactinoms behandelt werden -5- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Trijodthyronin T3, Tetrajodthyronin T4 von Anne - THR (=TSH-releasing hormon) ist ein Tripeptid, welches durch posttranslationale Prozessierung eines Prohormons mit 225 AS entsteht - Diese Prozessierung finde u.a. im ER statt, wo aus dem Pro-TRH-Protein durch die Prohormonkonvertasen PC1 undPC2 6 TRH-Vorläuferpeptide der Sequenz „Arg-Gln-His-ProGly-Arg“ entstehen Die Expression dieser Prohormonkonvertasen wird durch Leptin stimuliert und durch Nahrungskarenz gehemmt Diese werden durch verschiedene Peptidasen noch modifiziert (einzelne Schritte hier laut Frau Dr. Siepert nicht so wichtig) TRH hat eine HWZ von 2 Minuten Der Abbau des TRH erfolgt durch die Thyroliberinase (hormonell reguliert, auf den lactotropen Zellen der Adenohypophyse exprimiert) spaltet den Pyroglutamylrest unter Bildung eines Histidinprolinamids ab das Enzym unterliegt dem Rückkopplungsmechanismus: durch T3 wird die Expression stimuliert, durch Estradiol gehemmt - - - - Das schließlich entstehende biologisch aktive TRH-Neuropeptid wird durch die Stimulation der TRH produzierenden neuroendokrinen Zellen des Hypothalamus in Schüben freigesetzt Anschließend erfolgt der Transport über den Portalkreislauf des Hypophysenstiels zu den thyreotropen Zellen der Hypophyse Dort bindet TRH an spezifische Rezeptoren der Plasmamembran der basophilen Hypophysenzellen und stimuliert die TSH (Thyreotropin) Sekretion (die Freisetzung erfolgt innerhalb von Minuten) TSH wird von den thyreotropen Zellen des Hypophysenvorderlappens freigesetzt Es besteht aus einer α-UE mit 92 AS und einer β-UE mit 110 AS; täglich werden ca. 200 µg TSH sezerniert wobei die höchsten TSH-Spiegel am Spätabend und in der ersten Nachthälfte erreicht werden, die HWZ des Hormons beträgt 50 Minuten Schlafentzug, Hunger oder andere pathophysiologische Konstellationen hemmen und unterbrechen die reguläre TSH-Freisetzung Die TSH-Bestimmung im Serum ist der erste wichtige Nachweisparameter des Funktionszustandes der Schilddrüsenhormonachse und erlaubt erste diagnostische Rückschlüsse TSH-Rezeptor - - - Der TSH-Rezeptor gehört zu den G(Sα)-Protein gekoppelten, heptahelicalen Rezeptoren und stimuliert über die Adenylatcyclyse die cAMP –Produktion Zudem wird bei hohen TSH-Konzentrationen in geringen Umfang der PhosphoinositolSignalweg in Thyrozyten aktiviert Der Rezeptor weist eine sehr große extrazelluläre Domäne auf ; diese bildet aus neun leucinreichen repetetiven Sequenzen eine Hufeisen-Struktur und ist für die Bindung des intakten, glykosylierten TSH verantwortlich Der Rezeptor hat bereits ohne Ligandenbindung eine gewisse Grundaktivität, die zu einer niedrigen basalen Aktivierung der Adenylatcyclase und damit der Schilddrüsenhormonproduktion und Freisetzung ohne TSH- Stimulierung führt Der TSH- Rezeptor reguliert faktisch alle wichtigen Schritte der Schilddrüsenhormonproduktion und wird als der zentrale Regulator der Schilddrüsenhormonachse angesehen -6- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Struktur von T3 und T4: - Die beiden Schilddrüsenhormone leiten sich von der Aminosäure Tyrosin ab Die iodfreie Grundsubstanz der Schilddrüsenhormone wird als Thyronin bezeichnet L-Thyroxin (T4) ist das Tetraiodthyronin, die Iodatome sind in 3, 3‘, 5- und 5‘-Stellung angeordnet Triiodthyronin oder Liothyronin (T3) hat die 5‘-Stelle unsubstituiert siehe [L] S. 850 Regulation von T3 und T4 - - Hypothalamus : Integration von humoralen und nervalen Afferenzen →TRH- Freisetzung Adenohypophyse: TRH stimuliert die Biosynthese und Freisetzung von TSH Schilddrüse: TSH bindet an den G-Protein- gekoppelten Rezeptor Stimulation der Hormonbiosynthese (über Steigerung der Genexpression) Förderung des Wachstums von Schilddrüsenepithelzellen Die Schilddrüsenhormone T3 und T4 hemmen dann die Biosynthese von TRH und TSH negativer Feedbackmechanismus Somatostatin hemmt die Synthese und Freisetzung von TSH siehe [L] S.847 Abb. 27.5 Biosynthese der Schilddrüsenhormone - - Das in der Schilddrüse synthetisierte Thyreoglobulin und die aus ihm entstehenden Schilddrüsenhormone Thyroxin und Triiodthyronin sind die wichtigsten iodhaltigen Verbindungen im Organismus Iodid ist ein Spurenelement, daher muss die Schilddrüse ein effektives System zur Aufnahme des Iodod enthalten 1. Iodid wird über den NIS Transporter (Natrium Iodid Symporter) in die Thyreozyten aufgenommen 2. Durch den Ionenkanal Pendrin wird Iodid ins Follikellumen abgegeben du dort mit H²O² in Iodonium-Ionen umgewandelt 3. Diese dienen der Iodierung von Tyrosylresten im Thyreoglobulin 4. Mithilfe der Thyreoperoxidase erfolgt die Kopplung iodierter Tyrosylreste im Proteinverbund des Thyreoglobulins unter Ausbildung einer Etherbindung → T3 und T4 stellen modifizierte Aminosäurereste dieses Proteins dar 5. Nach Übertragung des Iodtyrosylrestes bleibt der Aminosäurerest als Dehydroalanin zurück 6. Thyreoglobulin wird von den Thyrozyten aus dem Follikellumen aufgenommen und intrazellulär lysosomal abgebaut 7. T3 und T4 werden freigesetzt und sezerniert [L] S.851, Abb. 27.10 Transport der Schilddrüsenhormone im Blut - Die SH sind als iodierte Aromaten sehr hydrophob In den Kapillaren der Schilddrüse werden sie an Hormonverteilungs- und Transportproteine gebunden, sie kriegen dann in weniger als 1% in freier Form vor Die Transportproteine sind: o Thyroxin- bindendes Globulin (TBG) o Thyroxin- bindendes Präalbumin (TBPA) o Albumin -7- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Biologische Wirksamkeit von T3 und T4 - Täglich werden beim Erwachsenen auf 70kg Körpergewicht 130 nmol T4 von der Schilddrüse produziert (einzige T4 Produktion im Körper) Die T3 Gesamtproduktion liegt bei 50 nmol, wobei 60-80% des T3 außerhalb der Schilddrüse von Deiodaseenzymen aus T4 gebildet wird T4 wird dabei durch die 5‘-Deiodase (Dio 1/2 ) durch Abspaltung eines Iodatoms am äußeren Ring in T3 umgewandelt (in Schilddrüse, Leber und Niere) Wenn durch die 5-Deiodase (Dio 3) am inneren Ring ein Iodatom abgespalten wird, entsteht biologisch inaktives reverses rT3 Die Deiodasen sind selenhaltig! Schilddrüsenhormone sind als Phenole auch Substrate für Sulfotransferasen und Glucuronidasen nach Sulfatierung und Glucuronidierung werden sie über die Galle ausgeschieden Der molekulare Wirkmechanismus von T 3 - - - siehe [L] S. 856 Abb. 27.15 T3 Rezeptoren sind auch ohne Liganden im Chromatin lokalisiert T3 Rezeptoren binden an Schilddrüsenhormon responsive Elemente der T3 empfindlichen Gene →Repression Ligandenbindung hat 2 Effekte hebt die Repression auf kann zu einer zusätzlichen Transkriptionsstimulation führen Die Schilddrüsenhormone T3und T4werden durch die Transporter MCT 8 bzw. OATP 1C1 in die Zielzellen aufgenommen. T4wird dort durch die 5’-Deiodasen in T3 umgewandelt. Nach Translokation in den Zellkern bindet T3 an den T3-Rezeptor. Dieser wirkt entweder als Homodimer oder häufiger als Heterodimer mit dem Retinoatrezeptor RXR und bindet in dieser Form an entsprechende Enhancerelemente der DNA. veränderte Transkription entsprechender Gene Es liegt ein entwicklungsabhängiges und gewebespezifisches Expressionsmuster der Rezeptorisoformen vor Zelluläre Wirkung der Schilddrüsenhormone - - - Dazu gibt’s im Script eine unglaublich vollgepackte Folie, hier die wichtigsten Punkte: Schilddrüsenhormone…. steigern den Sauerstoffverbrauch vieler Gewebe. Dieser Effekt ist auf einen gesteigerten Substratumsatz sowie eine erhöhte Expression der Na+/K+-ATPase in der Plasmamembran und der Ca2+-ATPase im saroplasmatischen Retikulum zurückzuführen. Mit dem gesteigerten Energieumsatz der Gewebe geht auch eine gesteigerte Thermogenese einher. Aktivieren, Gluconeogenese, Glykogenolyse, Liponeogenese (durch Stimulierung des Malatenzyms, der Glucose-6-phospat-Dehydrogenase und der Fettsäuresynthase) und Proteinbiosynthese (letzteres durch Förderung des Importes von AS in die Zellen) Stimulieren die Cholesterinbiosynthese durch Induktion der HMG-CoA-Reductase fördern das Körperwachstum durch Stimulierung der Biosynthese von STH in der Hypophyse und durch direkte Effekt beim Knochenwachstum besitzen eine Schlüsselfunktion bei Differenzierungsvorgängen, vor allem der Hirnentwicklung bei Neugeborenen durch Förderung der Dendritenbildung und der Myelinisierung -8- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Pathobiochemie - Schilddrüsenerkrankungen sind durch Veränderung der normalen Schilddrüsengröße und/ oder Schilddrüsenfunktion charakterisiert Unzureichende Iodversorgung eines drittels der Menschheit ist eine einfach vermeidbare Ursache von verschiedenen Entwicklungsstörungen bei Kindern und Beeinträchtigung der Stoffwechselfunktion bei Erwachsenen Iodmangelstruma - - Bei inadäquater Iodversorgung kommt es zu einer Beeinträchtigung der Schilddrüsenhormonproduktion und –freisetzung Dadurch werden die hypothalamische TRH- und die hypophysäre TSH-Produktion stiumuliert, die Schilddrüse versucht der unzureichenden Hormonsynthese durch Iodmangel entgegen zu wirken Diese Stimulation stellt einen Proliferationsreiz dar, es kommt zur Bildung von Wachstumsfaktoren (u.a. IGF-1) und zur Thyrozytenproliferation und Neubildung von Follikeln →Struma Diese erhöhte Zellteilung ist die Basis für die Entwicklung autonomer Bereiche, die nicht mehr unter der Feedback-Regulation der hypothalamisch-hypophysären Achse stehen „Heiße Knoten“ Hyperthyreose: Morbus Basedow (Grave’s desease) - - Der TSH- Rezeptor ist Ziel von Schilddrüsenautoantikörpern, wird somit stimuliert Es werden vermehrt Schilddrüsenhormone produziert und sezerniert, die Rückkopplungshemmung fällt jedoch weg Die Folgen sind: 1. Tachykardie (und vergrößerte Blutdruckamplitude, vermehrtes HZV) 2. Nervosität 3. Vermehrte Schwitzneigung 4. Wärmeintoleranz 5. Gewichtsverlust Es kommt zu einer erhöhten adrenergen Aktivität des Myokards bei noralen PlasmaKatecholaminspiegeln durch Änderung der Expression der Gene für den β1- Rezeptor Da der TSH-Rezeptor kontinuierlich stimuliert wird, werden über den Phosphoinositolweg das Wachstum und die Proliferation der Thyrozyten stimuliert Struma Therapieansätze sind - Komplette Entfernung der Schilddrüse Zerstörung der schilddrüse mit radioaktiv markiertem Iod Substanzen, die die TPO-katalysierte Schilddrüsenhormonsynthese blockieren Thyrostatika Hypothyreose: Morbus Hashimoto - Bildung von Blockierenden Antikörpern gegen die TSH-Rezeptoren, d.h. die Hormonproduktion nimmt ab Desweiteren kommt es zur langsamen aber kontinuierlichen zytotoxischen Zerstörung der Thyrozyten mit Fibrosierung des Gewebes Das führt über längere Zeit zum kompletten Verlust funktionsfähiger Thyrozyten und Follikel -9- Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Therapie: - Man muss eine voll ausgeprägte Hypothyreose mit synthetischen Schilddrüsenhormonen behandeln Am häufigsten sind übrigens Frauen im geschlechtsreifen Alter betroffen Angeborene Hypothyreose: - - Die Häufigkeit dieser Krankheit beträgt 1 zu 3500 Die Entwicklung der Schilddrüse erfolgt im ersten Drittel der Schwangerschaft Für die korrekte Entwicklung ist die kombinierte und organisierte Expression von mindestens den folgenden Transkriptionsfaktoren nötig: TTF1, PAX8, NKX2.1, HEX Falls dies nicht der Fall ist, ist die Organentwicklung des Kindes entweder gestört oder fällt ganz aus Man weist diese Krankheit mit einem obligatorischen Neugeborenen- Screening auf erhöhtes TSH im Blut nach Im Mutterleib kann das Kind durch mütterliche Hormone versorgt werden, aber postnatal muss innerhalb der ersten 2 Lebenswochen mit einer T4- Substitutionstherapie begonnen werden, die lebenslang beibehalten werden muss Sonst kommt es zu gestörter körperlicher und geistiger Entwicklung - 10 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Glucocorticoide: Cortisol von Enno - - Definition: o „Glucocorticoide sind Steroidhormone der Nebenniere, deren primäre Stoffwechselfunktion die Glucoseversorgung und Mobilisierung von Energiespeichern ist.“ wichtigster Vertreter: Cortisol Funktion des Cortisols - langfristige Umstellung des Stoffwechsels auf Dauerstress auch in Ruhe für Regulation vieler Körperfunktionen (Bsp: Immunsystem) und Embryonalentwicklung wichtig siehe [Horn] S. 365 Synthese des Cortisols - - - - Cortisol leitet sich vom Cholesterin ab Steroidhormon produzierende Zellen haben hohe Anzahl an Lipidtropfen o darin verestertes Cholesterin gespeichert zur Aufnahme von Cholesterin viele LDL-Rezeptoren auf Zelloberfläche ACTH reagiert mit Rezeptoren auf Zellmembran der Zona fasciculata-Zellen o Aktivierung Adenylatcyclase cAMP Cholesterinesterase phosphoryliert (aktiviert) Cholsterin aus Lipidtröpfchen mobilisiert Synthese findet in Mitochondrien und Cytoplasma statt initialer Schritt: Umwandlung von Cholsterin Pregnenolon o durch Cholesterin-Desmolase in innerer Mitochondrien-Membran lokalisiert Cytochrom P450-abhängig o Pregnenolon entsteht durch Abspaltung der Seitenkette zw. C-Atom 20 und 22 mit Einführung einer Ketogruppe an C20 Pregnenolon verlässt Mitochondrium durch Enzyme des endoplasmatischen Retikulums (3-Hydroxysteroid-DH und 4,5-Ketosteroid-Isomerase) in Progesteron umgewandelt Cytochrom P450-abhängig zu 17-Hydroxyprogesteron hydroxyliert (17-SteroidHydroxylase) Hydroxylierung an C21 (21-Hydroxylase) Zwischenprodukt gelangt wieder ins Mitochondrium erneute Hydroxylierung an C11 (11-Steroid-Hydroxylase) Cortisol aus Pregnenolon entstehen auch weitere Steroidhormone, wie Aldosteron, Testosteron, Östadiol (siehe [DR] Abb. B-20.16 bzw. Vorlesungsfolie „Hormone“ 39) C17 und C21 Hydroxylierung: C11 Hydroxylierung: Umlagerung der Doppelbindung: ER Mitochondrium ER - 11 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Regulation - Biosythese durch Hypothalamus und Hypophyse kontrolliert - bei bestimmten Stimuli (Bsp: Hypoglykämie, emotionale Faktoren) wird Sekretion von Corticotropin-Releasing-Hormon (CRH) im Hypothalamus gesteigert - über G-Protein-gekoppelten Rezeptor in Adenohypophyse Biosynthese und Freisetzung von adrenocorticotropem Hormon (ACTH) stimuliert - durch ACTH in Niere innerhalb weniger Minuten Biosynthese von Cortisol angeregt o stimuliert Expression der erforderlichen Enzyme und Bildung vom benötigten NADH - Cortisolspiegel im Blut steigt - Cortisol hemmt seine eigene Biosynthese durch negative Rückkopplung über Hypothalamus und Hypophyse Aktivatoren der Biosynthese sind u.a. Katecholamine Transport im Blut - - Cortisol nicht zellulär gespeichert, sondern bei Bedarf produziert (wie alle Steroidhormone) schlecht wasserlöslich bindet nach Sekretion aus Zona fasciculata-Zellen im Plasma an Transcortin o Transcortin (ein -Globulin)von Leber sezerniert Progesteron auch hohe Affinität zu Transcortin o es kann Cortisol verdrängen hohe Konzentration an freiem Cortisol im Blut o Cortisol kann bei hohen Konzentrationen auch an Albumin binden normaler Plasma-Cortisolspiegel 5-25 µg/100ml (morgens 8:00 Uhr, nüchtern) o unterliegt circadianen Schwankungen (morgens am höchsten, zum abend abnehmend) Abbau des Cortisols - - - in Hepatozyten inaktiviert durch o a) NADPH/H+-abhängige, enzymatische Hydrierung am Ring o b) NADH/H+ oder NADPH/H+- abhängige Hydrierung der Ketogruppe es entstehen Tetrahydro-Verbindungen o werden in Glucuronid- oder Sulfatester umgewandelt bei 17-Hydroxyverbindungen kann Seitenkette abgespalten werden o entstehen 17-Ketosteroide mit zusätzlicher Keto- bzw. Hydroxygruppe an C11 freie und konjugierte Glucocorticoide über Galle in Darm sezerniert o z.T. über enterohepatischen Kreislauf reabsorbiert o Großteil in überwiegend unkonjugierter Form über Nieren ausgeschieden da Cortisol primär in Leber abgebaut, sind bei oral therapeutischen Anwendungen höhere Dosen nötig, als bei intravenöser Applikation (da nach enteraler Resorption über Pfortader in Leber und dort teilweise schon inaktiviert) Wirkmechanismus - Cortisol diffundiert in Zielzelle bindet an Cortisolrezeptor o Rezeptor liegt in inaktiver Form gebunden an HSP70 und 90 im Cytoplasma vor nach Bindung löst sich Rezeptor von den HSP und wird in den Zellkern transloziert im Zellkern reguliert er nach Dimerisierung die Transkription verschiedener Gene - 12 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi zelluläre Wirkung von Cortisol AUF DEN STOFFWECHSEL - - - - Bewältigung von Belastungssituationen wie z.B. Nahrungskarenz und Stress Mobilisierung von Energiespeichern Induktion der Gluconeogenese o Steigerung der Expression der benötigten Enzyme o auch Induktion der Glykogensynthese damit die gebildete Glucose zwischengespeichert werden kann fördern den Abbau von der Proteinspeicher o Bereitstellung der benötigten Substrate für Gluconeogenese o Aminotransferasen in Leber aktiviert (für AS-Transport) Induktion der Enzyme zum Abbau der Lipidspeicher Hemmung der Prostaglandin-Biosynthese o Induktion des Porteins Lipocortin Hemmung der Phospholipase A2 Hemmung der Freisetzung von Arachidonsäure aus Membranlipiden Glucocorticoide wirken synergistisch mit Katecholaminen (somit als Gegenspieler von Insulin) o Cortisol: steigert Gluconeogenese Lipolyse o Adrenalin: Abbau von Glykogen Lipolyse erhöhter Sympathikotonus steigert Cortisol-Biosynthese indirekt (via CRH) Katecholamine steigern Cortisol-Biosynthese direkt AUF DAS ORGANSYSTEM - - - - - Immunsystem: o bei Immunantwort Interleukine-Expression hochreguliert diese stimulieren durch Wirkung auf Hypothalamus und Hypophyse die Cortisol-Biosynthese o Cortisol hemmt dann die Biosynthese von Interleukinen Immunantwort begrenzt o immunsuppresive Wirkung bei hohen therapeutischen Dosen therapeutisch gg. Organabstoßung nach Transplantation oder bei Autoimmunerkrankungen genutzt ZNS: o Glucocorticoide passieren Blut-Hirn-Schranke (da hydrophob) o Steigerung der Aufmerksamkeit und Lernbereitschaft (Typ I Rezeptoren) o Missstimmung, Depression und Lernschwierigkeiten (Typ II Rezeptoren, bei hohen Dosen) Knochen: o Verzögerung des Längenwachstums Verzögerung der Differenzierung von Knorpelzellen in Epiphyse Hemmung der Osteoblasten-Proliferation o bei hohen Cortisoldosen Osteoporose und Hemmung der Produktion von Bindegewebe (Körpergröße bei langfristig immunsupprimierten Patienten) Entzündung und Schmerz: o Hemmung entzü ndungsfö rdernder Prozesse z.B. Prostaglandinbildung, NO-Synthase und Histaminfreisetzung werden gehemmt) Lunge: o Steigerung der Expression von 2-Rezeptoren o Steigerung der Surfactantproduktion (wichtig bei Frü hgeborenen und Neugeborenen „Unreife der Lunge“) o Steigerung der Expression der Na+/K+-ATPasen in vielen Geweben - 13 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Pathobiochemie - langanhaltend erhöhter Cortisol-Spiegel führt wegen der überwiegend katabolen Reaktionen und negativer Organwirkung zu massiven Schäden (können auch zum Tode führen) gesteigerte Gluconeogenese und Lipolyse können zu Diabetes Typ 2 führen Cushing-Syndrom: o = Stammfettsucht o Ursache = stark erhöhte Cortisol-Spiegel durch Tumor (Hypophyse oder Nebenniere) oder lang anhaltende Therapie Symptome viszerale Fettpolster, Mondgesicht, Büffelnacken Bluthochdruck, Ödeme Hirsutismus, Amenorrhoe, Virilismus transparente Haut, Muskelschwäche Osteoporose Glucosetoleranz , Typ 2 Diabetes mellitus - Ursache verstärkte Lipolyse, Fett-Umverteilung Aldosteron-Effekte Androgen-Effekte Verstärkte Proteolyse Aktivierung des Knochemabbaus Verstärkte Gluconeogenese + verstärkte Lipolyse Morbus Addison: o betrifft meist alle Schichten der Nebennierenrinde o Ursache: Langanhaltende Cortisontherapie Abnahme ACTH-Sekretion Atrophie der Zona fasciculata und reticularis o Symptome sind unspezifisch Müdigkeit, Leistungsabfall, Hypoglykämien, Hyperpigmentierung der Haut (ACTH aktiviert Rezeptoren fü r MSH und somit die Melaninbiosynthese) o unter Stress-Situationen: Blutdruckabfall, Kreislaufschock (Addison-Krise) o Therapie: Substitution mit Cortisonpräparaten - 14 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Mineralcorticoide: Aldosteron von Enno - Steroidhormon in der Zona glomerulosa und Nebennierenrinde gebildet Funktion des Aldosterons - - fördert die Rückresorbtion von Na+ in den Intermediärtubuli und Sammelrohren der Niere wichtiger Bestandteil des Renin-Angiotensin-Aldosteron-Systems einziges Hormon, dass regulierend in den Kaliumhaushalt eingreift o reguliert Kaliumausscheidung indirekt steigert die Na+ Rückresorbtion und erhöht damit die Kaliumausscheidung geschieht durch Aldosteron-abhängige Steigerung der Na+-K+-ATPaseAktivität o erhöhte Kalium-Plasmakonzentrationen stimulieren wiederum die AldosteronSekretion [Horn] S. 386 Synthese des Aldosterons - aus Cholesterin synthetisiert Oxidation am C3 und Verschiebung der Doppelbindung Progesteron (s.o.) Hydroxylierung an Position 21, 18 und 11 18-Hydroxycorticosteron Oxidation der Hydroxylgruppe an C18 Aldosteron in wässriger Lösung liegt Aldosteron als Halbacetal vor Regulation der Biosynthese und Sekretion - Angiotensin II stimuliert über AT1-Rezeptoren die Aldosteron-Biosynthese und Sekretion o ACTH dagegen nur geringe Bedeutung - Anstieg des Natriumbestandes im Körper Hemmung Reninsekretion, Bildung von Angiotensin II und damit auch Hemmung der Aldosteron-Produktion - Anstieg der Plasma-Kaliumkonzentration = starker Reiz für Biosynthese - Anstieg der Natriumretention durch die Nieren bzw. Anstieg der Kaliumausscheidung o Erhöhung des extrazellulären Volumens mit gleichzeitigem Kaliumverlust Sistieren der Aldosteronbildung und Sekretion - 15 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Wirkmechanismus - zellulärer Wirkmechanismus ähnlich dem von anderen Steroidhormonen Hormon in Zelle aufgenommen bindet an cytosolischen Rezeptor Aldosteron-Rezeptor-Komplex gelangt nach Konformationsänderung (= Aktivierung) in den Zellkern beeinflusst die Expression spezifischer Gene o in Na+-resorbierenden Zellen vermehrte Expression von: ENaC (Natriumkanal) in apikaler Zellmembran Na+/K+-ATPase sowie einige Enzyme des Citratcyclus (ATP-Bereitstellung für Transport) Spironolactone - Gruppe von Aldosteron-Analoga wirken als Mineralcorticoid-Antagonisten - Behandlung von primärem Hyperaldosteronismus - verdrängen Aldosteron kompetetiv vom Rezeptor - Rezeptor-Antagonist-Komolex gelangt nicht in Zellkern (keine Konformationsänderung) o keine Änderung der Genexpression - Vorlesungsfolie 17 (Elektrolyte 2010) bzw. [L] Abb. 28.23 - 16 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi Gestagene, Östrogene, Androgene von Ferdi - - - [DR] S.602-608; [L] S. 870-885 Gestagene sind Hormone, die im Corpus luteum und in der Planzenta gebildet werden und für die Vorbereitung und Aufrechterhaltung der Schwangerschaft essentiell sind, z. Bsp.: Progesteron Östrogene sind Hormone, die im Ovar (Granulosazellen), Plazenta, Nebennierenrinde (NNR), Hoden und weniger in Muskel, Fettgewebe, Nerven (mit Aromataseaktivität!) gebildet werden und die bei der Frau die Ausbildung und Entwicklung der Geschlechtsorgane/-merkmale beeinflussen und bei beiden Geschlechtern (zusammen mit Testosteron) das Skelettwachstum stimulieren, z Bsp.: Östradiol. Östratriol, Östron Androgene sind Hormone die in der NNR und in den Gonaden synthetisiert werden und die beim Mann die Ausbildung und Entwicklung der Geschlechtsorgane/-merkmale sowie geschlechtsspezifische Verhalten beeinflussen und bei beiden Geschlechtern (zusammen mit Östrogenen) das Skelettwachstum regulieren, z. Bsp.: Testosteron, Dihydrotestosteron Hypothalamischer GnRH-Pulsgenerator „Die hormonelle Regulation der Gonadenfunktion bei Frau und Mann wird vom neuroendokrin aktiven hypothalamischen Peptid (GnRH) gesteuert, dessen pulsatile Sekretion in Amplitude und Frequenz moduliert wird.“ - - - - GnRH = „gonadotropin-releasing hormone“ Funktion GnRH: o stimuliert Bildung der Sexualhormone über LH (luteinisierendes Hormon) und FSH (Follikel stimulierendes Hormon) (Gonadotropine) Aus mediobasalem Hypothalamus freigesetzt Freisetzende Neurone hier stark verschaltet, daher interne Signale ( z. Bsp.: metabolischer Zustand) als auch externe Einflüsse ( z. Bsp.: Licht, emotionale Komponenten) für Freisetzung entscheidend Freisetzung dazu hauptsächlich über hormonellen und neuronalen Einflüssen reguliert: o Prostaglandin E2 o TGFβ, TGFα einschließlich Inhibine TGFβ – Familie o Aktivin und Follistatin ( im Hypothalamus produziert) o Neu entdeckt: Kisspeptin, aktiv als Kisspeptin-54 (aus 145 AS durch Prohormonkonvertase zu 54 As aktiviert)oder Metastin (hemmt Wachstum von Tumormetastasen) stimuliert die Gonadotropinsekretion bindet an GPR54 Rezeptor an GnRH – Neuronen pubertätsauslösend Name als Tribut an die berühmte Schokoladenmarke aus der Heimatstadt des Entdeckers: Hershey,USA ebenfalls durch Sekretionsprodukte und Funktion der umgebenen Astrozyten und Gliazellen beeinflusst näheres zur Regulation siehe [L], S. 871 GnRH Netzwerk als Pulsgenerator bezeichnet Weist intrinsische synchronisierte Aktivitätsrhythmen auf, das heißt das es zu rhythmischen, pulsatilen GnRH – Freisetzung kommt Regulation ,Synchronisation und Koordination also über weitere benachbarte und verschaltete Neurone reguliert Einzelne Pulse dauern nur wenige Minuten und können im Abstand von ein bis drei Stunden auftreten - 17 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi - GnRH- Pulse führen zu hypohysären LH-Pulsen pulsatile Sekretion kann pathologisch ausbleiben oder es kommt zur Dauerausschüttung Störung Gonadotropinfreisetzung Klinik: o Pulsatile Gabe von GnRH bei ausbleibender Pubertät o kontinuierliche GnRH (bzw. Analoga) -Gabe bei vorzeitiger Pubertät, Gonadotropinabhängigen Erkrankungen (Prostatakarzinom),experimentelle Fetalitätskontrolle [L] , S.871 Biosynthese der Steroidhormone „Alle Steroidhormone sind vom Cholesterin abgeleitet und werden in hohen Konzentrationen in bestimmten Organen auf Bedarf produziert und ohne weitere Speicherung sezerniert.“ - In NNR werden von Embryonalentwicklung bis zum Lebensende Steroidhormone produziert o In Zona reticularis entstehen Dehydroepiandrosteron (DHEA) und Dehydroepiandrosteron-Sulfat (DHEAS) o Daraus können lokal weitere Steroidhormone gebildet werden - Weitere Bildung in Gonaden o Androgene in Leydig-Zwischenzellen des Hodens o Östrogene in Theca-interna und Granulosa-Zellen des Ovars produziert - Plazenta o Östrogene , (siehe oben) - Desweiteren lokale Bildung in spez. Geweben o Z.Bsp. kann Testosteron über Aromatase zu Östradiol oder über 5α-Reduktase zu Dihydrotestosteron umgewandelt werden o Ebenfalls kann so DHEA zu Androstendion werden o Außerdem immer da wo hormonbildende Enzyme vorhanden sind, können auch Steroidhormone unabhängig von NNR, Gonaden, Plazenta aus Cholesterin gebildet werden o Sexualentwicklung, Alter, Tumorigenese etc. sind so von lokaler Aktivierung und Inaktivierung der Steroidhormone abhängig [DR] S. 595 - - - Androgene werden nach Bildung in Leydig-Zellen im Blut im Komplex mit Albumin und dem spezifischen Sexualhormon-bindenden Protein (SHBG) transportiert und dann in Zielzellen umgewandelt Reguliert wird die Androgen Biosynthese wieder über o LH , welches an G-Protein gekoppelten Rezeptor der Leydig-Zellen bindet und hier die Ausschüttung aktiviert ( analog zu ACTH der Cortisolbiosynthese) o FSH , welches an G - Protein gekoppelten Rezeptor der Sertoli-Zellen bindet und dort die Spermatogenese in Anwesenheit von Testosteron unterstützt o Negative Rückkopplung über Testosteron und Dihydrotestosteron (hemmen Synthese und Sekretion von GnRH und LH) o FSH- Sekretion ,wird durch Inhibin gehemmt und durch Aktivin stimuliert welches wiederrum durch Follistatin gehemmt wird o Leptin aus dem Fettgewebe stimuliert die Gonadotropinbildung Östrogene entstehen durch Aromatase Reaktionen aus Androgenen, siehe Abbildung Progesteron wird als Zwischenstufe bei den meisten Steroidhormonen gebildet Der Transport findet im Blut bei Östrogenen über SHBG und Albumin, bei Progesteron über Transcortin statt - 18 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi - Reguliert wird die Östrogen und Progesteron Biosynthese ebenfalls durch GnRH bzw. LH und FSH, jedoch wesentlich komplexer, z. Bsp. durch den GnRH-Pulsgenerator wie auch die fehlende Rückkopplung auf Hypothalamus und Hypophyse in der Menopause starker Anstieg LH und FSH, aber auch über komplexe Schwankungen im geheimnisvollen weiblichen Zyklus [L] S. 872; [DR] S. 608 Zielgewebe der Gonadotropine beim Mann - - - Genaue Testosteron-Synthese siehe [L] S. 875 LH stimuliert die Androgenbiosynthese in den Leydigzellen o Prolactin potenziert die Wirkung von LH und wirkt zusammen mit Testosteron am männlichen Reproduktionstrakt und an androgenempfindlichen Geweben o Prolactinüberproduktion durch Hypophysentumore ( Prolactinom) hemmt die Testosteronsynthese durch down-Regulation Impotenz dann nur heilbar wenn Testosteron zugeführt und Prolactinspiegel gesenkt werden [L],S. 871 FSH wirkt auf FSH Rezeptor, was pleiotrope Effekte auslöst: Stimulierung PKA,MAPKinase,PI3 – Kinase, PLA2 o Signaltransduktionswege führen zu einer Änderung der Genexpression der Sertolizellen die mehr als 300 verschiedene Protein umfasst o Kurzer histologischer Ausflug: Sertoli-Zellen liegen in Tubuli seminiferi und phagozytieren beschädigte Samenzellen, ernähren sich entwickelnde Spermatozoen, produzieren Proteine für weitere Differenzierung (z. Bsp. Das Androgen-bindendeProtein ABP, welches Testosteron bindet und erhält so dessen Konzentration lange aufrecht) und sezernieren für Spermiumbewegung nötige Tubulusflüssigkeit also essentiell für Spermatogenese Testosteron wirkt ebenfalls synergistisch auf Sertolizellen, allerdings im geringeren Maße, indem es z. Bsp. Die Transkription des Pem-Gens reguliert - 19 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi - Molekulare Wirkungen von Androgenen (Testosteron): o Wirken auf transkriptorischer Ebene o Meist aktivierend o Dihydrotestosteron bindet ebenfalls an Testosteron-Rezeptoren , ist aber aufgrund höherer Affinität wesentlich wirksamer - Zelluläre Wirkungen von Androgenen (Testosteron): o Stimulieren Bildung und Reifung der Geschlechtsorgane und akzessorischer Drüsen (Prostata) o Regulieren Spermatogenese, Sexualverhalten und Potenz o Indirekte Wirkung auf Sertoli-Zellen (siehe oben) o Bewirkt Ausbildung sekundärer Geschlechtsmerkmale (Bartwuchs, männliche Körperbehaarung, Vergrößerung Kehlkopf) o Ausbildung des typischen männlichen Knochenbaus und Muskulatur o Hat anabole Wirkung gerne als Doping eingesetzt o Reguliert das Skelettwachstum und den Wachstumssprung vor der Pubertät zusammen mit Östrogen (Östrogen für Schließen der Epiphysenfuge nötig) o Klinik: bei Männern mit Aromatasemangel, also keiner Möglichkeit der Östrogensynthese schleißt sich Epiphysenfuge nicht Abbau der Androgene o Abbau von 5αDHT erfolgt in peripheren Geweben (30–50%) und in der Leber (50– 70%) o Abbau katalysiert durch eine 3α-Hydroxy-Steroiddehydrogenase zu 3αAndrostendiol. o Im weiteren Abbau entstehen 17-Ketosteroide Androsteron und Etiocholanolon die in das Blutplasma übertreten und entweder in freier Form oder als sulfatierte bzw. glucuronidierte Derivate in den Urin ausgeschieden werden - Zielgewebe der Gonadotropine bei der Frau - Verlauf der weiblichen Hormone über die Lebensjahre o [L] S.879 o Vor Einsetzen der Menstruation tritt Reifung der hypothalamische - hypophysären Achse ein , die durch wechselnde Muster der Gonadotropinsekretion gekennzeichnet ist o 2-4 Lebensmonat: FSH (stark) und LH (weniger) steigen im Plasma an Anstieg von Östradiol und 17α – hydroxyprogesteron o 3-4 Lebensjahr: kontinuierlicher Abfall der Gonadotropinspiegel - 20 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi o o o - Bei Einsetzen der Pubertät: pulsatile Gonadotropinsekretion (erst nur während des Schlafes später über den gesamten Tag, LH – Pulse größer als FSH - Pulse) Bei Ende der Reproduktionsphase: Hormonproduktion in Peripherie fällt ab ausbleibende negative Rückkopplung ungehemmte Gonadotropinsekretion in der Hypophyse Östrogene und Progesteron regulieren also die Freisetzung von GnRH und so ist ihre synergistische Wirkung für entscheiden für den LH - und FSH – Anstieg während des Menstruationszyklus Menstruationszyklus o [DR] S. 607 o Gliedert sich in drei Phasen: 1. Follikelphase 2. Ovulation 3. Lutealphase o Follikelphase Beginn 1. Tag der Regelblutung Hier Follikelreifung durch FSH und Östrogene reguliert Hemmwirkung von Östrogen und Progesteron fällt weg und so wird FSH – Spiegel erhöht, welcher die Reifung von Tertiärfollikeln stimuliert FSH induziert indirekt über Aktivin Ausbildung des eigenen FSH – Rezeptors aus Granulosazellen FSH induziert Aromatase Östrogenbildung aus Androgenen Östrogene unterstützen Follikelreifung und Proliferation der Unterusschleimhaut Parallel stimuliert LH an Thekazellen die Androgenbildung als Aussgangsubstrat für Östrogenproduktion Östrogen, LH, FSH – Regulation s. o. Abnahme der FSH – Sekretion führt zum Absterben aller Follikel außer dem dominanten Graaf – Follikel ( Follikelatresie) Vollendung des Reifungsprozesses o Ovulation Etwa in der Zyklusmitte ( 13.14.15. Tag ) Es wird Schwellen-Plasmaöstrogenkonzentration überschritten, oberhalb derer Östrogene die GnRH –Sekretion stimulieren pos. Rückkopplung FSH nimmt zu aber charakteristisch ist der steile LH – Anstieg ( LH – Peak), der die Ovulation induziert Oozyte aus Graaf – Follikel freigesetzt Dann umschlagen von pos. und neg. Rückkopplung durch Östrogen ([DR], S. 606) - 21 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi o - - - Lutealphase ( 14. – 28. Tag) Aus Graaf – Follikel bildet sich Corpus luteum mestruationes ( Gelbkörper ), welches unter LH – Einfluss Östrogene und Progesteron produziert Progesteron bereitet Uterusschleimhaut auf Einnistung durch stärke Durchblutung, Drüsenwachstum und Einlagerung von Glykogen in Stromazellen vor Durch Progesteron nimmt GnRH –Sekretion stark ab LH - und FSH – Spiegel sinken Falls sich die befruchtete Eizelle einnistet (Nidation), stimuliert das von der Blastozyste und später von der Plazenta gebildete hCG ( humanes Choriongonadotropin) die Synthese von Östrogen und Progesteron, Corpus luteum graviditatis produziert ebenfalls weiter Progesteron und Östrogene Falls keine Befruchtung stattfindet degeneriert das Corpus luteum (Corpus albicans) Absinken Östrogen und Progesteron Niedrige Progesteronspiegel führen im Stratum functionale der Unterusschleimhaut zu Durchblutungsstörungen Menstruation Biosynthese siehe oben oder wunderbar bebildert [L] S.881 Molekulare Wirkungen on Östrogen und Progesteron o Wirkung wird über ligandenaktivierte Transkriptionsfaktoren vermittelt o Es existieren 2 verschiedene Östrogenrezeptoren: ERα und ERβ mit unterschiedlicher Gewebeverteilung und Bindungsaffinität für Östrogen o Für Progesteron gibt es anscheinend nur einen Rezeptor Zelluläre Wirkungen von Östrogen o Für Wachstum und Reifung der weiblichen Geschlechtsorgane zuständig o Entwicklung der sekundären weiblichen Geschlechtsorgane o Bis Menopause Proliferation der Uterusschleimhaut und Follikelreifung o Haben anti – Arteriosklerose Wirkung o Wichtig für Knochenwachstum und Schließen der Epiphysenfuge o Frauen werden vor Osteoporose geschützt, indem Biosynthese von Osteoklasten aktivierende Interleukine gehemmt wird ( fällt nach Menopause weg Knochenbruchrisiko) Zelluläre Wirkung von Progesteron o Vorbereitung der Uterusschleimhauf auf Nidation o Aufrechterhaltung der Schwangerschaft o Absinken der Progesteronspiegels Schwangerschaftsabbruch Östrogenwirkungen [DR] S. 605 Progesteronwirkungen [DR] S. 606 - 22 - Biochemie-Seminar 15 – Hormone1 Erarbeitet von Enno, Leif, Anne, Ferdi - Abbau der weiblichen Hormone o Östrogene werden hauptsächlich über Hydroxylierungsreaktionen abgebaut, die zu Katechol – Östrogenen führen o 2- und 4- Hydroxyderivate werden durch Catechol – O – Methyltransferasen methoxyliert o Beim Abbau existieren individuelle Unterschiede 2-Hydroxylierung bei Raucherinnen erhöht und bei Frauen mit Polymorphismus im Cytochrom P1A1 – Gen erniedrigt o Hydroxymetabolite sollen karzinogen sein o Frauen mit niedriger Catechol - O – Methyltransferaseaktivität Höheres Brustkrebsrisiko o Teil der Hydroxymetabolite gelangt über Galle in Darm und wird über enterohepatischen Kreislauf resorbiert o mangelnder Abbau und ungenügender Ausscheidung (z. Bsp. bei Leberzirrhose) Anstieg Plasmaöstradiolspiegel beim Mann Feminisierung ( Gynäkomastie (Brustbildung), Abdominalglatze!!! ( Verlust männlicher Behaarung) o Progesteron bzw. sein Hauptmetabolit ( 17α, 20α – Dihydroxyprogesteron) werden glucorinidiert und sulfatiert und dann zu gleichen Teilen über Galle in den Darm und in den Urin ausgeschieden - 23 -