2.27 Bronchoskopie 2
Werbung
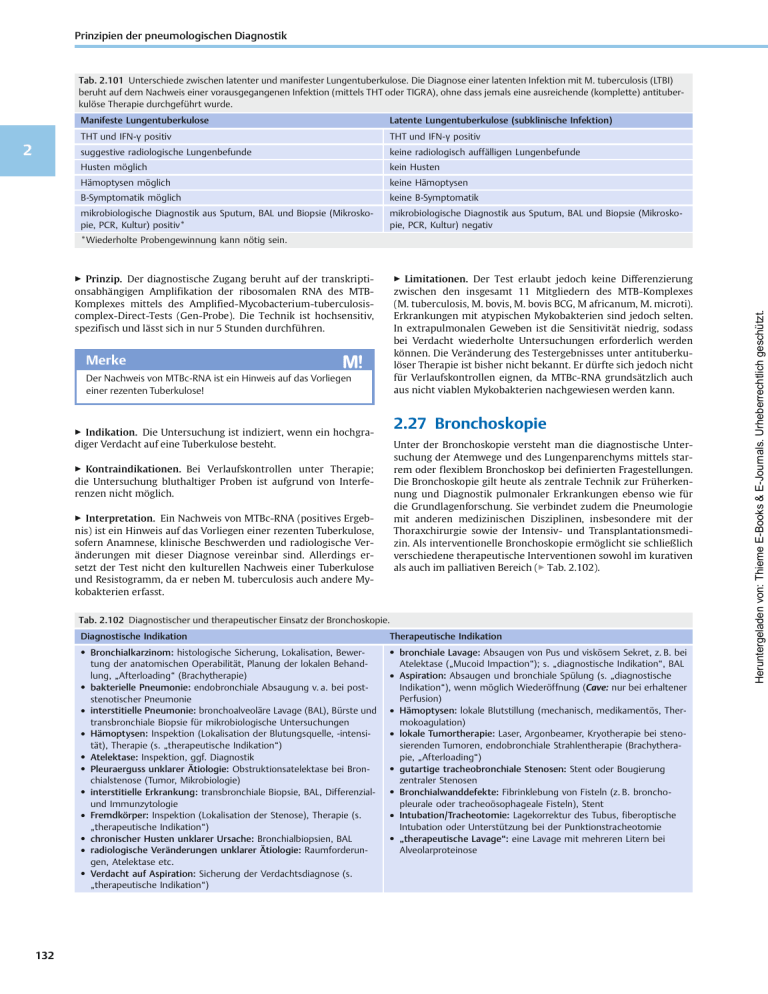
Prinzipien der pneumologischen Diagnostik Tab. 2.101 Unterschiede zwischen latenter und manifester Lungentuberkulose. Die Diagnose einer latenten Infektion mit M. tuberculosis (LTBI) beruht auf dem Nachweis einer vorausgegangenen Infektion (mittels THT oder TIGRA), ohne dass jemals eine ausreichende (komplette) antituberkulöse Therapie durchgeführt wurde. 2 Manifeste Lungentuberkulose Latente Lungentuberkulose (subklinische Infektion) THT und IFN-γ positiv THT und IFN-γ positiv suggestive radiologische Lungenbefunde keine radiologisch auffälligen Lungenbefunde Husten möglich kein Husten Hämoptysen möglich keine Hämoptysen B-Symptomatik möglich keine B-Symptomatik mikrobiologische Diagnostik aus Sputum, BAL und Biopsie (Mikroskopie, PCR, Kultur) positiv* mikrobiologische Diagnostik aus Sputum, BAL und Biopsie (Mikroskopie, PCR, Kultur) negativ ▶ Prinzip. Der diagnostische Zugang beruht auf der transkriptionsabhängigen Amplifikation der ribosomalen RNA des MTBKomplexes mittels des Amplified-Mycobacterium-tuberculosiscomplex-Direct-Tests (Gen-Probe). Die Technik ist hochsensitiv, spezifisch und lässt sich in nur 5 Stunden durchführen. Merke ▶ Limitationen. Der Test erlaubt jedoch keine Differenzierung zwischen den insgesamt 11 Mitgliedern des MTB-Komplexes (M. tuberculosis, M. bovis, M. bovis BCG, M africanum, M. microti). Erkrankungen mit atypischen Mykobakterien sind jedoch selten. In extrapulmonalen Geweben ist die Sensitivität niedrig, sodass bei Verdacht wiederholte Untersuchungen erforderlich werden können. Die Veränderung des Testergebnisses unter antituberkulöser Therapie ist bisher nicht bekannt. Er dürfte sich jedoch nicht für Verlaufskontrollen eignen, da MTBc-RNA grundsätzlich auch aus nicht viablen Mykobakterien nachgewiesen werden kann. H Der Nachweis von MTBc-RNA ist ein Hinweis auf das Vorliegen einer rezenten Tuberkulose! 2.27 Bronchoskopie ▶ Indikation. Die Untersuchung ist indiziert, wenn ein hochgradiger Verdacht auf eine Tuberkulose besteht. Unter der Bronchoskopie versteht man die diagnostische Untersuchung der Atemwege und des Lungenparenchyms mittels starrem oder flexiblem Bronchoskop bei definierten Fragestellungen. Die Bronchoskopie gilt heute als zentrale Technik zur Früherkennung und Diagnostik pulmonaler Erkrankungen ebenso wie für die Grundlagenforschung. Sie verbindet zudem die Pneumologie mit anderen medizinischen Disziplinen, insbesondere mit der Thoraxchirurgie sowie der Intensiv- und Transplantationsmedizin. Als interventionelle Bronchoskopie ermöglicht sie schließlich verschiedene therapeutische Interventionen sowohl im kurativen als auch im palliativen Bereich (▶ Tab. 2.102). ▶ Kontraindikationen. Bei Verlaufskontrollen unter Therapie; die Untersuchung bluthaltiger Proben ist aufgrund von Interferenzen nicht möglich. ▶ Interpretation. Ein Nachweis von MTBc-RNA (positives Ergebnis) ist ein Hinweis auf das Vorliegen einer rezenten Tuberkulose, sofern Anamnese, klinische Beschwerden und radiologische Veränderungen mit dieser Diagnose vereinbar sind. Allerdings ersetzt der Test nicht den kulturellen Nachweis einer Tuberkulose und Resistogramm, da er neben M. tuberculosis auch andere Mykobakterien erfasst. Tab. 2.102 Diagnostischer und therapeutischer Einsatz der Bronchoskopie. Diagnostische Indikation ● ● ● ● ● ● ● ● ● ● ● 132 Bronchialkarzinom: histologische Sicherung, Lokalisation, Bewertung der anatomischen Operabilität, Planung der lokalen Behandlung, „Afterloading“ (Brachytherapie) bakterielle Pneumonie: endobronchiale Absaugung v. a. bei poststenotischer Pneumonie interstitielle Pneumonie: bronchoalveoläre Lavage (BAL), Bürste und transbronchiale Biopsie für mikrobiologische Untersuchungen Hämoptysen: Inspektion (Lokalisation der Blutungsquelle, ‑intensität), Therapie (s. „therapeutische Indikation“) Atelektase: Inspektion, ggf. Diagnostik Pleuraerguss unklarer Ätiologie: Obstruktionsatelektase bei Bronchialstenose (Tumor, Mikrobiologie) interstitielle Erkrankung: transbronchiale Biopsie, BAL, Differenzialund Immunzytologie Fremdkörper: Inspektion (Lokalisation der Stenose), Therapie (s. „therapeutische Indikation“) chronischer Husten unklarer Ursache: Bronchialbiopsien, BAL radiologische Veränderungen unklarer Ätiologie: Raumforderungen, Atelektase etc. Verdacht auf Aspiration: Sicherung der Verdachtsdiagnose (s. „therapeutische Indikation“) Therapeutische Indikation ● ● ● ● ● ● ● ● bronchiale Lavage: Absaugen von Pus und viskösem Sekret, z. B. bei Atelektase („Mucoid Impaction“); s. „diagnostische Indikation“, BAL Aspiration: Absaugen und bronchiale Spülung (s. „diagnostische Indikation“), wenn möglich Wiederöffnung (Cave: nur bei erhaltener Perfusion) Hämoptysen: lokale Blutstillung (mechanisch, medikamentös, Thermokoagulation) lokale Tumortherapie: Laser, Argonbeamer, Kryotherapie bei stenosierenden Tumoren, endobronchiale Strahlentherapie (Brachytherapie, „Afterloading“) gutartige tracheobronchiale Stenosen: Stent oder Bougierung zentraler Stenosen Bronchialwanddefekte: Fibrinklebung von Fisteln (z. B. bronchopleurale oder tracheoösophageale Fisteln), Stent Intubation/Tracheotomie: Lagekorrektur des Tubus, fiberoptische Intubation oder Unterstützung bei der Punktionstracheotomie „therapeutische Lavage“: eine Lavage mit mehreren Litern bei Alveolarproteinose Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. *Wiederholte Probengewinnung kann nötig sein. 2.27 Bronchoskopie Hintergrundwissen Ursprung der Bronchoskopie V Die Entwicklung und Etablierung der direkten Bronchoskopie geht auf den deutschen Mediziner Gustav Killian (1860 – 1921) zurück. Angeregt zu dieser Technik wurde er durch die Beobachtungen von Adolf Kußmaul (1822 – 1902), dem es gelang, den Ösophagus eines vom Jahrmarkt aufgegriffenen Schwertschluckers mit einer gerade verlaufenden Röhre zu intubieren. Die erste Bronchoskopie eines Menschen führte Killian 1897 mittels eines Ösophaguskops durch und entfernte ein Knochenstück aus dem rechten Hauptbronchus. Im Folgejahr präsentierte er die Methode auf einer laryngologischen Tagung. Der Japaner Shigeto Ikeda stellte 1966 das erste flexible Bronchoskop vor. choskopie heute speziellen Fragestellungen bzw. Interventionen vorbehalten. Hierzu zählen Situationen, bei denen größerlumige Geräte bzw. Sonden benutzt werden und eine bessere Übersicht erforderlich ist. Zu den speziellen Indikationen (▶ Tab. 2.104) für die Durchführung einer starren Bronchoskopie gehören ○ eine anhaltende pulmonale Hämorrhagie: bessere Übersicht zur Identifizierung der Blutungsquelle; bessere Absaugmöglichkeit über einen größeren Schlauch, ○ Fremdkörperaspiration: größeres Instrumentarium, ○ Interventionen mittels Laser und Argon-Beamer: größere Übersicht, ○ Stent-Implantation: leichtere Korrektur oder Entfernung des Stents bei nicht optimaler Lage. 2 2.27.2 Indikationen Je nach Typ des Bronchoskops lassen sich 2 Formen der Bronchoskopie unterscheiden. ● flexible Bronchoskopie: In der täglichen Routine hat die flexible Bronchoskopie heute die starre Bronchoskopie weitgehend verdrängt. Die flexible Bronchoskopie in Lokalanästhesie ermöglicht eine makroskopische Beurteilung der Bronchien, zumindest bis auf Subsegmentebene. Sie kann beim intubierten Patienten durch den Tubus erfolgen (Mindestgröße des Tubus: 8,5). Abgesehen von einigen speziellen Anwendungen lassen sich bronchoskopische Interventionen mit den flexiblen Instrumenten schneller, bequemer und unter Umgehung einer Vollnarkose für den Patienten schonender durchführen (▶ Tab. 2.103). ● starre Bronchoskopie: Außer bei Intubationsschwierigkeiten (z. B. bei Deformierung oder Instabilität der Halswirbelsäule oder nach ausgedehnten operativen Eingriffen im Halsbereich) ist die starre Bronchoskopie stets das sicherste Verfahren. Allerdings bedarf sie einer Vollnarkose mit „Jet“-Beatmung über das starre Instrument. Zudem ist die Verletzungsgefahr (Verletzungen der Zähne oder der Atemwege) höher als bei flexibler Bronchoskopie. Daher bleibt die Indikation zur starren Bron- Die Bronchoskopie wird sowohl bei therapeutischen als auch bei diagnostischen bzw. interventionellen Fragestellungen durchgeführt (▶ Tab. 2.104). Elektive Bronchoskopien sollten durch ein CT-Thorax, Lungenfunktion und Gerinnungsstatus vorbereitet werden, um Kontraindikationen auszuschließen, die endoskopische Diagnostik zu planen und das Risiko der Untersuchung zu minimieren (s. u.). Von diesen elektiven diagnostischen Indikationen sind folgende absolute Indikationen abzugrenzen, bei denen die Bronchoskopie so schnell als möglich anzustreben ist („Notfallbronchoskopie“): ● aktuelle Hämoptysen bzw. Hämoptoe: unmittelbare Untersuchung erforderlich! ○ Lokalisation? Sog. „Blutstraßen“ zur Identifizierung der Blutungslokalisation (Seite, Lappen, Segment)? Und/oder fortbestehende Blutung? ○ Ziel: Maßnahmen zur Blutstillung (▶ Tab. 2.105) und als Grundlage der Seitenlagerung bzw. einseitigen Intubation bei anhaltender Blutung ● Verdacht auf Fremdkörperaspiration: Identifizierung eines Fremdkörpers! ○ Ziel: wenn möglich, unmittelbare Entfernung des Fremdkörpers Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 2.27.1 Formen der Bronchoskopie Tab. 2.103 Vor- und Nachteile der flexiblen bzw. starren Bronchoskopie. Kriterien Flexible Bronchoskopie Nachteile ● ● ● ● kleine Bioptate eingeschränkte Übersicht eingeschränkter Handlungsspielraum bei Entfernung von Fremdkörpern oder bei Komplikationen Beatmung nicht intubierter Patienten während der Untersuchung nicht möglich Starre Bronchoskopie ● ● ● ● ● ● ● Vorteile ● ● ● ● ● ● ● ● keine Vollnarkose (Lokalanästhesie, Sedierung) geringerer technischer und personeller Aufwand leicht erlernbar bequemere Position für Untersucher optimale Kooperation bei Monitorsicht (gemeinsame Interpretation bzw. Besprechung von Befunden mit Anwesenden, Training) direkte Darstellung distaler Abschnitte bis in Höhe der Subsegmentbronchien geringere Verletzungsgefahr für Patienten auch beim intubierten Patienten durch den Tubus möglich (Mindestgröße des Tubus: 8,5) ● ● ● ● ● schwierigere Technik Vollnarkose notwendig (Organisation, Anästhesie, größerer technischer und personeller Aufwand) Ventilation erforderlich („Jet“-Beatmung) unbequemere Position für Untersucher begrenzter Blick in Peripherie bei intubierten Patienten oder Erkrankungen der HWS nicht möglich Verletzungsgefahr (Stimmbänder, Trachealperforation, Verletzungen der Zähne) optimale Übersicht v. a. der zentralen Abschnitte Beatmung möglich größere Bioptate bessere Absaugmöglichkeit größerer Handlungsspielraum bei Entfernung von Fremdkörpern oder bei Komplikationen 133 Prinzipien der pneumologischen Diagnostik Tab. 2.104 Differenzielle Indikation für die flexible oder starre Bronchoskopie. Differenzielle Indikation Starr Flexibel massive Blutung +++ + Kinderbronchoskopie +++ + Fremdkörperentfernung ++ ++ ++ Bevorzugt starres Instrument 2 ▶ Absolute Kontraindikationen. Hierzu zählen ● nicht behandelbare, lebensbedrohlich Arrhythmie, ● nicht korrigierbare Koagulopathie, ● submaximale Oxygenierung des Patienten vor der Prozedur, ● akute pulmonale Globalinsuffizienz (Ausnahme: Patient ist bereits intubiert und beatmet). H Merke Flexibles oder starres Instrument Lasertherapie ++ Stent-Implantation ++ ++ zentraler Tumor ++ ++ + +++ Das Risiko einer bronchoskopischen Intervention sollte individuell zwischen dem medizinischen Nutzen (therapeutische Konsequenz) und den potenziellen Komplikationen abgewogen werden. Abklärung bronchopulmonaler Symptome peripherer Tumor + +++ Lagekontrolle Tubus/Intensivmedizin – +++ postoperative Kontrolle – +++ funktionelle Beurteilung – +++ + + + : Methode der Wahl; + + : gleichwertige Methode; + : Alternativmethode; –: keine Indikation ● ● Sekretverlegung der Atemwege: Identifizierung eines Sekretverhalts! ○ Ziel: unmittelbare Beseitigung des Sekrets Aspiration: Absaugen des Aspirats und ausgiebige Spülung! ○ Ziel: Entfernung und Neutralisation des sauren pH des Magensaftes ▶ Relative Kontraindikationen. Im Gegensatz zu den o. g. absoluten Kontraindikationen lassen sich relative vor Durchführung der Bronchoskopie oft beseitigen (▶ Tab. 2.105): ● FEV1 ≤ 1 l: Entwicklung einer therapierefraktären Hypoxämie → maximale antiobstruktive Therapie: 3 – 5 Tage 40 mg Methyprednisolon, SABA + SAMA über Feuchtvernebler, Theophyllin ● Gerinnungsstörung: Quick, PTT, Thrombozytenzahl, Blutungszeit → Substitution (Vitamin K, Thrombozyten) ● aktuelle antikoagulatorische Therapie (gilt v. a. bei geplanten transbronchialen Biopsien, nicht für Inspektion, Spülung oder BAL) ○ Heparin: am Tag der Untersuchung pausieren ○ Azetylsalizylsäure oder andere thrombozytenwirksame Medikamente (Clopidogrel, GP-IIb/IIIa-Inhibitoren, Dipyridamol): Absetzen der Therapie ≥ 5 Tage vor Untersuchung Bei der Therapie mit thrombozytenwirksamen Medikamenten muss auch nach einer Latenz mit einer erhöhten Blutungsneigung gerechnet werden. 2.27.3 Kontraindikationen Die vor Brochoskopie zu erwägenden Kontraindikationen sind abhängig von den erforderlichen bronchoskopischen Untersuchungstechniken (transbronchiale Biopsie, BAL etc.). Sie lassen sich zudem nach der Dringlichkeit bzw. der zugrunde liegenden Erkrankung in relative und absolute Kontraindikationen unterteilen. H Merke ● ● pulmonale Hypertonie: deutliche Blutungsneigung bei Bürste oder Biopsie bronchiale Hyperreagibilität: Gefahr einer schweren Bronchokonstriktion → Prämedikation mit β2-Mimetikum und ggf. 1 – 2 Amp. Adrenalin 1:10 000 intraluminal, 250 mg Methylprednisolon i. v. vor der Untersuchung Tab. 2.105 Mögliche Komplikationen bronchoskopischer Techniken in Verbindung mit Begleiterkrankungen und die erforderlichen Maßnahmen. Vorerkrankungen ● ● Koagulopathie hämorrhagische Diathese Mögliche Komplikationen Maßnahmen Blutung ● ● schwere pulmonale Globalinsuffizienz Hypoxämie ● ● bronchiale Hyperreagibilität ● ● akuter Myokardinfarkt ● ● dekompensierte Herzinsuffizienz ● ● maximale antiobstruktive Therapie maximale O2-Gabe während der Untersuchung in Intubationsbereitschaft inhalatives β2-Mimetikum vor Intervention 1–2 Amp. Adrenalin intrabronchial Obstruktion Mukosaödem ● Reinfarkt Arrhythmien Verschiebung der Intervention Hypoxämie Herz-Kreislauf-Versagen Rekompensation vor Intervention ● Thrombopenie (< 30 000 Gpt/l) Blutung Thrombozytensubstitution (auf > 30 000 Gpt/l) hochgradige Trachealobstruktion Unterbrechung der Ventilation ● ● 134 Konakion (1 Amp. i. v. oder 20 Tropfen oral über ≥ 4 Tage vor Intervention) Faktorsubstitution bei flexibler Bronchoskopie kurzzeitige wiederholte Intubationen („fraktionierte Bronchoskopie“) starre Bronchoskopie Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Bevorzugt flexibles Instrument 2.27 Bronchoskopie ● Die Bronchoskopie verursacht ein geringes Larynxödem mit Heiserkeit, eine Hypoxämie bei Patienten mit Gasaustauschstörung, Arrhythmien (v. a. vorzeitige Vorhof- oder Ventrikelkontraktionen und Bradykardie) sowie selten eine Infektion (Verschleppung aus oberen Atemwegen). Die transbronchiale Biopsie geht in 2 – 5 % mit einem Pneumothorax und in 1 – 1,5 % mit einer relevanten Blutung einher (▶ Tab. 2.106). Die Mortalität beträgt 1 – 4/10 000 Patienten, wobei vor allem Ältere und komorbide Patienten (schwere COPD, koronare Herzkrankheit, Pneumonie mit Hypoxämie, fortgeschrittene Tumorerkrankung, zentralnervöse Störungen) gefährdet sind. Eine transbronchiale Biopsie verdreifacht die Mortalität auf 12/10 000 Patienten. Folgende Komplikationen können im Rahmen einer Bronchoskopie auftreten: ● Blutung: Kleinere, selbstlimitierende Blutungen nach Biopsie von nicht maligne veränderter Mukosa treten regelmäßig auf. Mit einem erhöhten Risiko einer anhaltenden bzw. stärkeren Hämorrhagie ist jedoch stets bei bronchialer oder transbronchialer Tumorbiopsie zu rechnen. Auch Patienten mit Urämie, terminaler Niereninsuffizienz, oberer Einflussstauung sowie unter Antikoagulation haben Blutungen. Mittelgradige Blutungen, die eine Segmentblockade erfordern (Wedge-Position), treten in 10 – 15 % auf. ● ● ● G Cave Bei zentraler oder peripherer Tumorbiopsie besteht stets die Gefahr einer schweren, arteriellen Blutung! ● ● ● ● ● Verletzungen der Stimmbänder: mechanische Alteration (Ödem, Einblutung): Heiserkeit (über 34 – 48 Stunden) Laryngospasmus: durch Lokalanästhesie oder direkten Kontakt Bronchospasmus: vor allem bei BHR (z. B. bei Asthma oder postinfektiös) oder durch lokale Anästhesie Pneumothorax: bei transbronchialer Biopsie, selten auch bei transbronchialer Bürste und Nadelbiopsie (▶ Tab. 2.106) Hypoxämie: rezidivierende oder anhaltende Entsättigungen, z. B. durch Übersedierung (im Zweifel Antidot verabreichen; bei Midazolam: Anexate) und/oder einem größeren Volumen von Spülflüssigkeit (> 1 l) Fieber: etwa 6 – 8 Stunden nach BAL kommt es oft zu einer einmaligen Erhöhung der Körpertemperatur (bis 40 °C), abhängig vom instillierten BAL-Volumen. Die Ursache ist nach wie vor unklar (vermutlich durch die Bronchoskopie eingeschleppte Infektionen?). „pseudo-pneumonisches“ Infiltrat: radiologisch nachweisbar bis etwa 48 Stunden nach BAL Aspiration von galligem Magensekret: kann während der Bronchoskopie trotz Nahrungskarenz auftreten. Klinisch erkennt man diese an einem Schwall gelblich-oranger Flüssigkeit, die sich unvermittelt von tracheal in den Atemwegen nach distal ausbreitet. Besonders gefährdet sind ältere und immobile Patienten mit zentralnervöser Neuropathie oder Cardiainsuffizienz. Die Maßnahmen umfassen das vollständige Absaugen des Aspirats mit anschließender ausgiebiger Spülung (ca. 100 ml NaCl-Lsg.). selten: epileptische Anfälle, Methämoglobinämie mit refraktärer Zyanose (z. B. bei Laserung oder Thermokoagulation) oder kardiale Arrhythmien bis hin zum Herzstillstand Cave 2 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 2.27.4 Komplikationen G Grundsätzlich muss bei terminaler Niereninsuffizienz, Urämie, oberer Einflussstauung (Vena-cava-superior-Obstruktion) oder pulmonaler Hypertonie mit einer verstärkten, z. T. auch lebensbedrohlichen Blutung gerechnet werden! Merke Indikationen zum Abbruch der Bronchoskopie H Während der Untersuchung kann es zu Situationen kommen, die einen Abbruch der Bronchoskopie erfordern. Für die Entscheidung zum Abbruch können folgende Kriterien herangezogen werden: ● Auftreten von persistierenden Arrhythmien (jeglicher Form) ● progressiver oder persistierender O2-Sättigungsabfall < 80 % über ≥ 30 Sekunden ● unzureichende Oxygenierung des Patienten (Hb sat < 90 %) während der Intervention unter maximaler O2-Gabe (ca. 10 l/ min) ● Hypoxämie unklarer Ursache bereits vor oder unmittelbar nach Einleitung der Untersuchung Tab. 2.106 Mögliche Komplikationen und Maßnahmen nach bronchoskopischen Techniken. Untersuchungstechnik Mögliche Komplikationen Maßnahmen Inspektion keine keine erforderlich bronchiale Biopsie Blutung ● transbronchiale Zangenbiopsie ● ● ● Blutung Pneumothorax ● ● ● transbronchiale Nadelbiopsie ● ● bronchoalveoläre Lavage Blutung Mediastinitis (nach Latenz: ca. 2 Wochen) ● ● Wedge-Position des Bronchoskops im betroffenen Segment bzw. Subsegment (bis zu 15 min) Adrenalin (1 Amp., 1 mg Epinephrin) Wedge-Position des Bronchoskops im betreffenden Segment bzw. Subsegment (bis zu 15 min) Adrenalin lokal (1 Amp., 1 mg Epinephrin) Thorax in Exspiration (3 h nach Intervention) Wedge-Position des Bronchoskops im betroffenen Segment bzw. Subsegment (bis zu 15 min) Adrenalin (1 Amp., 1 mg Epinephrin) meist singulärer Fieberschub (bis 40 °C) 6–8 h nach der Intervention 1000 mg Paracetamol (auch als Prophylaxe 3 h nach BAL) Bürstenbiopsie meist leichte Blutung ● Katheterbiopsie ● ● meist nur leichte Blutung Pneumothorax (selten) ● Wedge-Position des Bronchoskops im betroffenen Segment bzw. Subsegment (bis zu 15 min) Adrenalin (1 Amp., 1 mg Epinephrin) 135 Prinzipien der pneumologischen Diagnostik G Cave Ein deutlich erhöhtes Risiko besteht bei einem oder mehreren der folgenden Befunde: ● PaO2 < 60 mmHg ● PaCO2 > 44 mmHg ● FEV1 < 60 % (bzw. < 1 l) ● Quick < 30 % ● Thrombozytenzahl < 20/nl ● bronchiale Hyperreagibilität ● schweres Lungenemphysem ● pulmonale Hypertonie ● KHK ● tachykarde Herzrhythmusstörung 2 2.27.5 Durchführung der flexiblen Bronchoskopie Voraussetzungen Zur Bronchoskopie sollten folgende Befunde vorliegen: ● Lungenfunktion: Ganzkörperplethysmografie bzw. Spirometrie (FEV1 > 1,6 bei geplanter TBB), Blutgase (respiratorische Globalinsuffizienz?) ● Echo/Rh-Katheter: nur in besonderen Fällen! ● Gerinnung: Quick, PTT, Thrombozyten; besonders nützlich: Blutungszeit als globaler Gerinnungsparameter ● Bildgebung: Röntgen-Thorax und vor allem CT-Thorax (zur Orientierung und Lokalisation von möglichen Befunden) und zur Festlegung des zu untersuchenden Segmentes/Subsegmentes ● Nahrungskarenz: Der Patient muss nüchtern sein (letzte Mahlzeit > 5 h; letzte Flüssigkeitsaufnahme > 2 h; Cave: Aspirationsgefahr!) Es gibt prinzipiell 2 ernste Notfälle während einer Bronchoskopie: ● Blutung: Eine ernstere Blutung erkennt an der Geschwindigkeit des aus einem zuvor bioptierten Segment hervorquellenden Blutes (▶ Tab. 2.107). Zudem geht innerhalb von einer Sekunde die Sicht verloren, Absaugen bleibt ohne Erfolg und der Patient beginnt unmittelbar Blut zu expektorieren. ● Herz-Kreislauf-Stillstand: Herz-Kreislauf-Monitoring zeigt eine zunehmende Bradykardie. Zunächst Anschlüsse prüfen. Pulsfrequenz manuell prüfen, RR-Messung. Wenn Bestätigung, sofortige Extubation. Am günstigsten klassische Intubation. Einfacher ist es den Tubus über das Bronchoskop zu ziehen und die Intubation unter Sicht vorzunehmen. Dann Beatmungsbeutel und Sauerstoff anschließen und manuell beatmen. Verlegung auf Intensivstation. Prämedikation Die Prämedikation wird zur Hemmung der bronchialen Sekretproduktion und Minderung des Vagustonus eingesetzt. Die Notwendigkeit einer Routine-Prämedikation ist allerdings umstritten und daher nicht regelmäßig erforderlich. H Merke Sinnvoll ist eine Prämedikation jedoch bei Patienten mit primär vorhandenem Husten, bronchialer Hyperreagibilität und bekannter vasovagalen Instabilität. Die Prämedikation wird jeweils eine Stunde vor Bronchoskopie entweder mit einem ● Vagolytikum (Atropin 0,01 mg/kgKG i. m., s. Anhang) oder ● Antitussivum (Dicodid, z. B. Hydrocodon 1 Amp. (= 15 mg Hydrocodonhydrochlorid) s. c.; Maximaldosis: 0,6 mg/kgKG) vorgenommen. Tab. 2.107 Schweregrade pulmonaler Blutungen im Rahmen bronchoskopischer Maßnahmen. Blutungsintensität Geschwindigkeit des austretenden Blutes Bronchoskopische Sicht Effekt des Absaugens Blutexpektoration Maßnahmen sehr stark lebensbedrohlich sehr schnell (< 1 s) geht unmittelbar verloren ohne Effekt sofort, meist mit Latenz von ca. 5 s ● ● ● ● ● 136 Wedge-Position des Bronchoskops im betroffenen Segment bzw. Subsegment ggf. Adrenalin (1 Amp., 1 mg Epinephrin) Beendigung der Bronchoskopie Lagerung des Patienten auf die betroffene Seite einseitige Intubation der nicht betroffenen Seite stark schnell (< 5 s) geht rasch wieder verloren (< 5 s) nur passagerer Effekt, wiederholt erforderlich verzögert, mit Latenz von > 20 s ● moderat nach Latenz, langsam hervortretend kann beeinträchtigt sein problemlos möglich ggf. nach längerer Latenz je nach Bedarf ggf. absaugen schwach verzögert und langsam, selbstlimitierend nicht beeinträchtigt nicht erforderlich keine keine ● Wedge-Position des Bronchoskops im betroffenen Segment bzw. Subsegment Adrenalin (1 Amp., 1 mg Epinephrin) Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Notfälle während der Bronchoskopie 2.27 Bronchoskopie Checkliste Hintergrundwissen Unmittelbar vor Durchführung der Bronchoskopie zu prüfende Aspekte Stimmbandanästhesie – ja oder nein? ● ● ● ● ● ● ● ● keine antikoagulatorische Therapie (Heparin) am Tag der Untersuchung? Wurden Azetylsalizylsäure oder andere thrombozytenwirksame Medikamente (Clopidogrel, GP-IIb/IIIa-Inhibitoren, Dipyridamol) ≥ 5 Tage vor Untersuchung abgesetzt (v. a. bei geplanter transbronchialer Biopsie sowie Tumorbiopsie)? Besteht eine bronchiale Hyperreagibilität (z. B. Asthma)? Cave: Mit Bronchokonstriktion rechnen (Prämedikation mit β2-Mimetikum, ggf. Adrenalin intraluminal) Besteht eine Koagulopathie (Gerinnungsparameter)? Cave: Quick < 30 %; PTT > 60 Besteht eine Thrombopenie? Cave: Thrombozytenzahl < 30 000 Gtp/l Ist der Patient nüchtern? (Nahrungskarenz > 5 h seit letzter Mahlzeit bzw. > 2 h seit letzter Flüssigkeitsaufnahme) Erlauben Lungenfunktion und Blutgase eine Bronchoskopie? (keine Globalinsuffizienz, FEV1 > 1,6 l bei geplanter transbronchiale Zangenbiopsie) Cave: Pneumothorax! Verbietet eine pulmonale Hypertonie eine (transbronchiale) Zangenbiopsie? (schwere Hämorrhagie) Liegen Hb bzw. Erythrozytenzahl im Normbereich? Zur gezielten Lokalanästhesie der Stimmbänder gibt es kontroverse Meinungen (0. Applikation, s. o.). Nachteile sind der durch die Xylocain-Lösung verursachte reflektorische Stimmband- und Larynxschluss. In diesem Fall wird man gezwungen sich erneut zu orientieren, was die Intubation verzögert. Zügiger und für den Patienten weniger störend ist eine direkte Intubation unter Umgehung der Stimmbandanästhesie. Zudem sorgt das in den tiefen Atemwegen applizierte Xylocain durch den initial noch vorhandenen natürlichen Hustenreflex von retrograd für eine Lokalänästhesie der Stimmbänder und Larynx. 2 Überwachung Die Überwachung erfolgt bei jedem Patienten in Form ● einer kontinuierlichen Pulsoxymetrie (Entsättigungen?), ● eines EKG-Monitors (Rhythmusstörungen? Asystolie? Hypotonie?), ● einer intermittierenden RR-Messung (Hypo- oder Hypertonie?). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ● V Im Zweifelsfall sollte man sich stets an der Ansprechbarkeit des Patienten orientieren. Lokalanästhesie Hintergrundwissen Die Lokalanästhesie beim nicht intubierten Patienten erfolgt in 2 Phasen: ● präinterventionell: Pharynx und Stimmbänder werden entweder mit nebulisiertem oder mit aerosoliertem (1 – 2 %) Xylocain lokal (z. B. als Spray oder als Inhalation, Maximaldosis: 250 – 300 mg für einen 70-kg-Patienten) anästhesiert. Die Inhalation erfolgt unmittelbar vor der Untersuchung mit 5 ml einer 2 % igen Xylocainlösung über ca. 20 Minuten mittels Düsenvernebler. Nicht selten empfindet der Patient die Lokalanästhesie als unangenehm („Das ist das Schlimmste bei der Bronchoskopie“). ● intrainterventionell: Während der Untersuchung werden die Atemwege über das Bronchoskop anästhesiert, jeweils mit 1 – 2 ml-Fraktionen nach folgendem Schema: ○ 0. Applikation: Applikation von unmittelbar oberhalb der Stimmbänder (→ Stimmbänder, Larynx; optional) ○ 1. Applikation: unmittelbar nach Passage der Stimmbänder (→ Trachea, Hauptcarina, distale Hauptbronchien) ○ 2. Applikation: rechte Lunge, in Höhe Hauptcarina (→ Hauptcarina, Hauptbronchus rechts) ○ 3. Applikation: linke Lunge in Höhe Hauptcarina (→ Hauptcarina, Hauptbronchus links) ○ 4. Applikation: linker, nach lateral rechtwinklig abgehender Oberlappen (→ Oberlappensegment, Lingula und Oberlappensegmentgruppe) ○ 5. Applikation: gezielte lokale Applikation vor „tiefer“ Untersuchung bzw. Wedge-Position im zu untersuchenden Segment/Subsegment (z. B. vor BAL) Xylocain – antimikrobielle Eigenschaften V Den Lokalanästhetika werden seit Langem antibakterielle Eigenschaften zugeschrieben. Das gilt u. a. auch für Xylocain, was zur Lokalanästhesie im Rahmen der Bronchoskopie eingesetzt wird. Tatsächlich zeigen verschiedene In-Vitro-Studien, dass Xylocain das Wachstum von Bakterien hemmt. Diese In-vitro-Daten reflektieren allerdings nur bedingt die In-vivo-Situation. In der Zwischenzeit zeigen verschiedene Studien, dass die Konzentration von Xylocain in vivo während einer Bronchoskopie keine bakterizide Wirkung auf das Ergebnis der Bakterienkultur hat. Im Zweifelsfall empfiehlt es sich, Bronchialsekret vor der lokalen Anästhesie der unteren Atemwege zu aspirieren. Falls das nicht möglich ist, sollte die Probe nach Instillation von 20 ml NaCl erfolgen (Verdünnungseffekt). Merke H Bei Aspiration von Sekret aus einem definierten Bereich der Atemwege/Lunge sollte berücksichtigt werden, dass sich das zuletzt aspirierte Material noch im Arbeitskanal befindet (ca. 0,5 ml) und möglicherweise aus einem davor inspizierten, anderen Bereich stammt. Sedierung Bei vorsichtiger (fraktionierter) individueller Dosierung ist eine Sedierung des Patienten (z. B. mit Midazolam) während der Bronchoskopie in aller Regel problemlos möglich (▶ Tab. 2.110). Bei geplanten schmerzhaften Interventionen (z. B. Dilatation einer Atemwegsstenose) sollte eine Analgosedierung durch die Kombination eines Sedativums mit einem Analgetikum erfolgen (▶ Tab. 2.110). 137 Prinzipien der pneumologischen Diagnostik Tab. 2.108 Sedierung mittels Midazolam: Schema. 2 Zeitpunkt Einzeldosis (mg) Kumulativdosis (mg) nach Aufklärung (Beruhigung) 1 1 nach 3–5 min bzw. vor Beginn der Untersuchung 2–3 3–4 wenn Patient weiter ansprechbar, kurz der Untersuchung 1–2 4–6 wenn Patient weiter ansprechbar, kurz vor oder während der Untersuchung 1–2 5–8 bei längerer Untersuchung nach ca. 15–30 min 1–2 6–10 Tab. 2.109 Sedierung mittels Midazolam in Kombination mit Propofol: Schema. Midazolam (mg) nach Aufklärung (Beruhigung) 1 Propofol (mg) nach 3–5 min bzw. vor Beginn der Untersuchung 2–3 20–40 wenn Patient wieder ansprechbar, während der Untersuchung 1–2 oder 20 bei längerer Untersuchung nach ca. 15–30 min 1–2 oder 20 Tab. 2.110 Gebräuchliche Sedierungsschemata bei bronchoskopischen Untersuchungen. 138 Kriterium Sedativa Medikament Midazolam (Dormicum, Midazolam-ratiopharm) Propofol (Disoprivan, Recofol) Fentanyl (Fentanyl-Janssen) Analgetika Pethidin (Dolantin) Alfentanil (Rapifen) Eigenschaften Sedativum mit amnestischen, aber ohne analgetische Eigenschaften. Sehr kurze Halbwertszeit (t1/2 = 30 min) kurz wirksames Anästhetikum (t1/ 2 = 2–4 min) ohne analgetische Eigenschaften stark wirksames Analgetikum und kein Sedativum (→ Kombination mit Midazolam) kurz wirksames Analgetikum bei akuten Schmerzen opioides Analgetikum vergleichbar dem Fentanyl, jedoch mit schnellerem Wirkungseintritt und kürzerer Wirkdauer Wirkung sedierend, amnestisch sedierend, narkotisch (keine Analgesie), antiemetisch, reduziert Laryngospasmen analgetisch, Langzeitsedierung Analgetikum mit 0,1–0,2-facher Morphinpotenz; max. Wirkung bei i. v. Gabe nach 3–10 min, bei i. m. Gabe nach 20–40 min; Wirkdauer: 2–4 h Analgetikum mit 30– 40-facher Morphinpotenz; Wirkungseintritt nach ca. 1 min; Wirkungsdauer: 30–60 min Dosis 2–5(–10) mg i. v. Bolusdosis von 1– 2 mg/kgKG i. v., dann Dauerinfusion von 6–12 mg/ kgKG/h 0,05–1 mg i. v. i. m./s. c. 25–150 mg (½–3 Amp.); i. v. 50 mg (1 Amp.) alle 3–6 h, Tageshöchstdosis 500 mg (10 Amp.) 15–30 μg/kgKG i. v. Erholungszeit (bis Ansprechbarkeit) <1 h 10–20 min ca. 1 h 2–6 h 20–40 min Nebenwirkungen/Komplikationen Urtikara, Pruritus (Nase), Amnesie, Agitiertheit, Muskelkrämpfe und ‑tremor, Aggressivität, Singultus, kardiovaskuläre Depression, Hypo-/Apnoe, Hypotonie dosisabhängige kardiovaskuläre Depression, Atemdepression, zentralnervöse Erregung (Bewegungen, Muskelkrämpfe), Histaminfreisetzung keine kardiovaskulären oder respiratorischen Komplikationen (wie z. B. Hypoxämie) häufiger als bei anderen Opioiden Hypotonie (negativ inotrop) und Rhythmusstörungen, Atemdepression Hypotonie (negativ inotrop) und Rhythmusstörungen, Atemdepression Kombination für eine zusätzliche Analgesie: + 25 μg Fentanyl (0,5 ml) bei zu erwartenden Schmerzen, z. B. Dilatation); Nachdosieren von Fentanyl oder Midazolam ≥ 5 min für eine zusätzliche Analgesie: Propofol zusammen mit kurz wirksamem Analgetikum (z. B. Remifentanil, Ultiva) analgetische Ergänzung zu Propofol; bei Zeichen von Angst: 1– 2 mg Midazolam für eine zusätzliche Analgesie in Kombination mit Midazolam Antidot Flumazenil (Anexate) 0,2–0,5 mg als Bolus, weiter nach Bedarf kein Antidot Narcanti (NARCANTI) 0,4 mg (2 ml) Naloxon i. v. als Bolus, weiter nach Bedarf Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Zeitpunkt 2.27 Bronchoskopie Häufigste Sedierungsschemata H Das am häufigsten verwendete Sedierungsschema beruht auf der Gabe von Midazolam. ● Midazolam (Dormicum): z. B. 3 mg (ältere Patienten) bis 10 mg (jüngere Patienten) i. v. ● Fentanyl (Fentanyl-Janssen): z. B. 0,05 – 0,1 mg i. v. in Abhängigkeit von Alter, Leberfunktion und Oxygenierung ● Propofol (Disoprivan): 20 – 50 mg als Bolus i. v., weiter nach sedierender Wirkung ▶ Midazolam-Sedierung. Die Sedierung mittels Midazolam kann sich an folgendem Schema orientieren (▶ Tab. 2.108): Auch wenn die individuelle Wirkung von Midazolam nicht vorherzusagen ist, benötigen jüngere Patienten (< 30 Jahre) meist eine höhere Dosis als ältere (> 60 Jahre). Die Injektion erfolgt mittels einer 5-ml-Spritze (Midazolam-Konzentration: 1 mg/ 1 ml) in Form von 1 – 3-mg-Fraktionen. Grundsätzlich ist eine langsame Injektion angezeigt. Sofern gleichzeitig eine Infusionslösung infundiert wird, lässt sich die Applikationsgeschwindigkeit mittels der Tropffrequenz regulieren. In der Regel ist eine Sedierung mit Midazolam mit 5(–10) mg ausreichend (s. o.). Die Kombination mit einem Analgetikum sollte speziellen Fragestellungen vorbehalten bleiben. ▶ Midazolam/Propofol-Sedierung. Die Sedierung mittels Midazolam in Kombination mit Propofol kann sich an folgendem Schema orientieren (▶ Tab. 2.109): Intubation ▶ Zugang. Der Zugang kann entweder über eine nasale oder orale Intubation (beißfestes Mundstück) erfolgen (▶ Tab. 2.111). Grundsätzlich wird die Entscheidung über den zu wählenden Intubationsweg auf dem Boden der individuellen Situation bzw. Indikation flexibel erfolgen. ▶ Komplikationen. Im Rahmen der Intubation können folgende Komplikationen auftreten: ● Laryngospasmus: Bei empfindlichen Patienten oder unzureichender lokaler Rachenanästhesie kommt es zur reflexartigen ● Larynxkontraktion. Die Spitze des Bronchoskops wird von der Epiglottis nach seitlich verdrängt. Auch die gezielte Gabe von Xylocain auf die Stimmbänder verursacht einen Larynxschlussreflex. Fehlintubation: Man erkennt die Fehlintubation des Ösophagus daran, dass kein Lumen erkennbar wird, die Schleimhaut längsgefaltet ist und/oder die Sicht trotz Saugen nicht frei wird. Zudem ist ein Absaugen von Sekret vergeblich. 2 Position zum Patienten Die Bronchoskopie kann relativ zum Patienten von allen Seiten durchgeführt werden. ● Orthogradposition („Kopf-Position“): Es handelt sich um die häufigste Position beim Bronchoskopieren. Der Untersucher steht am Kopfende der Liege hinter dem Patienten. Diese Position erleichtert die Orientierung im Bronchialsystem, denn die Seitenzuteilung verhält sich parallel zur eigenen Seitenperspektive. Zudem ist der Patient neben den Armaturen von Oxymetrie, EKG- sowie Video-Monitor im unmittelbaren Blickfeld. ● Lateralposition: Hierbei steht der Untersucher seitlich links oder rechts in Höhe des Kopfes des Patienten. Diese Position kann notwendig werden, wenn Apparaturen aus Platzgründen (z. B. auf der Intensivstation) die Orthogradposition nicht erlauben. Nachteile sind die erschwerte seitenanatomische Zuordnung. ● Opposition: Hier sitzen Patient und Untersucher einander gegenüber und ihre Gesichter sind auf gleicher Höhe. Diese Position ist immer dann indiziert, wenn der Patient nicht flach liegen kann (z. B. bei Erkrankungen der Wirbelsäule). Nachteilig ist, dass eine Sedierung des Patienten nicht möglich ist bzw. dieser bei vasovagalen Reaktionen vom Stuhl gleiten kann. Praxistipp Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Merke Z Es kommt gelegentlich vor, dass man während der Untersuchung durch Husten oder ein kurzzeitiges Abwenden vom Monitor (Bewertung der Proben, Fragen) ungewollt auf die kontralaterale Lungenseite gelangt. Aus diesem Grunde sollte man sich während der Untersuchung z. B. durch das Aufsuchen der Hauptcarina neu orientieren. Tab. 2.111 Entscheidungskriterien bzw. Vor- und Nachteile der nasalen bzw. oralen Intubation. Eigenschaft/Kriterium Nasale Intubation Entscheidungskriterien ● ● keine vorausgegangenen Verletzungen oder Operationen der Nase Nasengang erscheint normal groß (kann jedoch täuschen) Orale Intubation ● ● ● ● ● ● Kontraindikationen ● ● Vorteile ● ● Nebenwirkungen ● ● mögliche Nachteile (Probleme) vorausgegangene Operationen der Nase vorausgegangenes Trauma mit Verletzung der Nase/ Nasenfraktur offensichtlich kleiner Nasengang Intubation nicht ohne Verletzung möglich nasaler Intubationsversuch schmerzhaft („niemals erzwingen“) im Zweifelsfall: orale Intubation vorausgegangene Verletzungen oder Operationen der Nase Intubation nicht ohne Verletzung der Nase möglich keine kein Schutz erforderlich leichtes Auffinden der Epiglottis ● nasale Verletzung und Blutung unbedachtes Ziehen des Bronchoskops während der Untersuchung führt zu Schmerzen und Verletzungen der Nase ● Verletzungen und nasale Blutung möglich ● ● Mundstück (beißfest) bei oraler Intubation Verletzungen unwahrscheinlich Würgereflex Beschädigung des Bronchoskops bei Verrutschen des Mundrings Auffinden des Epiglottis schwieriger als bei nasaler Intubation 139 Prinzipien der pneumologischen Diagnostik Abb. 2.56 Endobronchiale Anatomie und endobronchialer Aspekt. Orientierung im Bronchialsystem Hintergrundwissen Eine Herausforderung für jeden Anfänger oder bei einer Untersuchung in Lateralposition stellt die seitenanatomische Orientierung in den Atemwegen dar (▶ Abb. 2.56). Zur Orientierung dienen vor allem folgende 2 anatomischen „Wegweiser“ im Bronchialsystem: ● „rechter Oberlappen“: das etwa 2 cm nach der Hauptcarina nach lateral abgehende rechte Oberlappensegment mit den 3 in Form der Ecken eines Dreiecks angeordneten Oberlappensegmentostien 1, 2 und 3. Dagegen geht links das Oberlappensegment nach 4 – 5 cm nach lateral in einem nahezu rechten Winkel ab. Hier findet man zunächst nach kaudal das Lingulasegment und im weiteren Verlauf die Oberlappensegmentgruppe. Im Gegensatz zum rechten Oberlappen gehen links das 1erund 2er-Segment oft gemeinsam ab bzw. bilden ein gemeinsames Ostium. ● „Drei-Ostien-Ebene“: die „Drei-Ostien-Ebene“ rechts, ca. 2 cm unterhalb des Oberlappenostiums, bei der von medial nach lateral in einer Linie Mittellappen-, Unterlappen- und 6er-Segmentostium zu erkennen sind. Mit Hilfe dieser beiden Anhaltspunkte oder „Wegweiser“ lässt sich das rechte Bronchialsystem zur Seitenorientierung identifizieren. Merke H Aufgrund der Vergrößerung der modernen Video-Optik erscheint der endobronchiale Aspekt ungleich größer als in Wirklichkeit (z. B. Orientierung an der Zangengröße!). 140 Thorax in Exspiration V Bei Verdacht auf Entwicklung eines Pneumothorax (z. B. postinterventionell) ist eine Thoraxaufnahme in Exspiration indiziert. Die Gründe für diese Aufnahmetechnik sind Folgende: ● kleineres intrathorakales Volumen: deutlichere Ablösung der Lunge von der Thoraxwand, ● dichteres Lungenparenchym: bessere Abgrenzung von Lungenparenchym und freier intrapleuraler Luft Beide Aspekte spielen bei deutlich fortgeschrittenem Pneumothorax (> 1000 ml pleurale Luft) keine Rolle. Sie können jedoch bei einem beginnenden oder kleinen Pneumothorax (< 500 ml) die Sensitivität der Technik verbessern. Nachbeobachtung Die Nachbeobachtung (▶ Tab. 2.112) der Patienten umfasst folgende Aspekte: ● Herz-Kreislauf-Überwachung: 2 – 4 Stunden ● Sauerstoffgabe: 2 – 4 Stunden (1 – 3 l/min, je nach Bedarf) ● Kriterien der Erholung: ○ Ansprechbarkeit bzw. Erweckbarkeit des Patienten ○ Wiederauftreten des Würgreflexes ○ Aufrechterhaltung einer normalen O2-Sattigung ohne zusätzliche O2-Gabe ● Ausschluss eines Pneumothorax: Röntgen-Thorax in Exspiration ≥ 3 Stunden nach der Bronchoskopie; Indikation: transbronchiale Zangen-, Bürsten- und Nadelbiopsie Ablauf der Bronchoskopie 2.27.6 Bronchoskopische Techniken Unabhängig vom diagnostischen oder therapeutischen Ansatz umfasst eine Bronchoskopie 8 Phasen (▶ Tab. 2.112), die nacheinander durchlaufen werden. In ▶ Tab. 2.113 sind typische endobronchiale Befunde und deren diagnostische Bedeutung bzw. Ursache dargestellt. Mittels Bronchoskopie lassen sich Atemwegsgewebe (Bronchialbiopsien) und ‑zellen (Bürste), Lungengewebe (transbronchiale Biopsie) sowie bronchoalveolären Zellen (bronchoalveoläre Lavage) gewinnen (▶ Tab. 2.114) (▶ Abb. 2.57). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 2 2.27 Bronchoskopie Tab. 2.112 Ablauf einer Bronchoskopie. 1. Voraussetzung (ca. 15 min) Zu bearbeitende Aspekte Zu prüfende Befunde/Vorgehen Einblick in alle relevanten Vorbefunde ● ● ● ● 2. 3. Fragestellung (ca. 5 min) Einblick in die spezielle Anforderung im individuellen Fall ● Festlegung des Vorgehens (ca.5 min) Einblick in alle relevanten Vorbefunde ● ● ● ● 4. Inspektion (ca. 5 min) Beurteilung der Mukosa, der Segmentanatomie sowie aller einsehbaren Bereiche vom Pharynx bis zur Subsegmentebene nach makroskopischen Kriterien ● ● ● ● ● ● ● ● ● ● 5. Maßnahmen (10– 60 min) (▶ Abb. 2.57) ● ● ● ● abhängig vom Inspektionsbefund leichtes Auffinden der Epiglottis Tumor Segmentstenosen ● ● ● ● ● 6. 7. 8. Ausschluss und Beseitigung von Komplikationen (1–10 min) ● Wurden alle erforderlichen Untersuchungen durchgeführt? Ist mit Komplikationen zu rechnen? (Blutung? Pneumothorax bei TBB?) ● Dokumentation und Befund-Anforderungen (ca. 15 min) Verfassen des Befundberichtes sowie der Anforderungen für die gewonnenen Proben ● Überwachung des Patienten (ca. 2–4 h) ausreichende Respiration und Herz-KreislaufFunktion? ● ● ● ● ● ● ● schriftliche Einwilligung des Patienten Vorerkrankungen (Komorbidität) Blutgase Lungenfunktion (v. a. FEV1), Gerinnung, Thrombozytenzahl etc. 2 vom veranlassenden Arzt formulierte Fragestellung bei Unklarheiten telef. Rücksprache mit verantwortlichem Arzt Beurteilung des Röntgen-Thorax und v. a. des CT (erlaubt die Lokalisation des anzusteuernden Prozesses dabei sich bewusst werden, welches Segment aufzufinden und genauer zu untersuchen ist Entscheidung über die sinnvollste diagnostische Technik (TBB? BAL?) und Bewertung der Erfolgsaussichten Inspektion erfolgt entlang des Rachens Identifizierung der Epiglottis Stimmbänder (Lage, Funktion, Beweglichkeit, vollständiger Stimmbandschluss) Beschaffenheit der Mukosa (ödematös, atrophisch, Gefäßinjektionen, Schienenstrangphänomen, Vulnerabilität) Trachea und Hauptcarina Inspektion beider Hauptbronchien und Identifizierung und Beurteilung aller Segmentostien und Segmente/Subsegemente atypische Segmentabgänge Identifizierung aller Ostien ggf. Korrektur der Tubuslage Fremdkörper, Tumor, Eiter? Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Phasen bronchiale Tumorbiopsie mikrobiologische Spülung Bürstenbiopsie (Zytologie oder Mikrobiologie) BAL (Differenzial- und Immunzytologie) Nadelbiopsie (Zytologie) erkennbarer Prozesse oder in den infrage kommenden Segmenten/Subsegmenten/Carinen erkennbare fortbestehende Blutung? bei Bedarf Maßnahmen zur Blutstillung ggf. Ausfüllung der Röntgenanforderung für ≥ 3 h nach Intervention (Thorax in Exspiration), die dem Befund beigelegt wird Befund zur Bronchoskopie (inkl. detaillierte Listung der durchgeführten Techniken) Ausfüllen der Anforderungsscheine für Histologie, Zytologie, Mikrobiologie und ggf. BAL-Immunzytologie O2 (1–3 l/min) Herz-Kreislauf-Überwachung (Monitor) bis zum vollständigen Erwachen Durchführung eines Thorax in Exspiration ≥ 3 h nach Bronchoskopie 141 Prinzipien der pneumologischen Diagnostik Tab. 2.113 Typische endobronchiale Befunde und deren diagnostische Bedeutung bzw. Ursache. Anatomische Struktur Normalbefund Pathologischer Befund Rachen/Zunge Zunge und Zungengrund mit Papillen (Papillae linguales) ● ● ● normal konfigurierte Zungenwurzel aufgerichtete, leicht gebogene Epiglottis ● ● ● ● ● ● ● Larynx/Epiglottis ● ● Stimmbänder ● ● ● ● Trachea ● ● eindeutig zu identifizierende Epiglottis normaler Form Mukosa ohne Tumor oder Membranen und ohne Auflagerungen ● paarige bzw. symmetrisch angeordnete Stimmlippen mit Rima glottidis beide Stellknorpel (Cartilagines arytaenoideae) erkennbar beim Atmen Stimmlippen weit geöffnet, wodurch die Stimmritze eine charakteristische dreieckige Form annimmt Mobilität vorhanden (vollständiger Verschlussreflex spontan oder bei „Hi“ sagen) ● gestrecktes röhrenförmiges Gebilde mit Pars membranacea (dorsal) und Ringknorpel zu erkennen intakte Mukosa ● ● ● ● ● ● ● ● ● Hauptcarina scharf hervorstehend und nach beiden Seiten symmetrisch in die Hauptbronchien führend ● ● ● Hauptbronchien freies, im Durchmesser ca. 8–12 mm großes Lumen bis in Höhe des Abgangs des Oberlappens nach lateral ● ● ● ● Segmentbronchien (1.–3. Ordnung) freies, im Durchmesser ca. 2–4 mm großes Lumen, rechts 10 Segmente, links 9 (Segment 7 fehlt) ● ● ● ● Subsegmentbronchien ● ● 2–4 Subsegmente pro Segment erkennbar freies, im Durchmesser ca. 1–2 mm großes Lumen ● ● ● Candidiasis der Zunge und/oder des Rachens Papillenhypertrophie Pharyngitis, Phlegmone Pseudomembranen (Rachendiphtherie) Tumoren (Nasopharynx- oder Pharynxkarzinom) Schlucklähmung (Paralyse des N. glossopharyngeus) Pharyngismus („Schlundkrampf“) Vocal-Cord-Dysfunction Erbrochenes Formanomalien des Kehlkopfs Laryngitis Diphtherie („Krupp“) Pseudokrupp (Laryngitis subglottica) Lähmung der Stimmritze mit Intermediärstellung eines oder beider Stimmbänder infolge einer Schädigung des N. laryngeus inferior (N. laryngeus recurrens) und des N. laryngeus superior („Kadaverstellung“) Mobilität vorhanden (vollständiger Verschlussreflex spontan oder bei „Hi“-Laut des Patienten) Verlagerung (mediastinaler Prozess) Säbelscheidendeformation (Kompression von außen?) Fistel (Tumor? Ösophagusprozess? postoperativ?) Tumor Candidiasis verbreitert (subcarinale Lymphome) Tumorinfiltration Candidiasis Tumorinfiltration der Mukosa exophytisch wachsender zentraler Tumor Fremdkörper Kompression von außen Tumor mit oder ohne Stenose bzw. Verschluss des Segmentes Kompression von außen Verziehung (Traktion) Mukosaödem (Carinen verbreitert) Tumor mit oder ohne Stenose oder Verschluss des Subsegmentes Verziehung Mukosaödem Tab. 2.114 Indikation, Durchführung und Komplikationen von bronchoskopischen Techniken. Technik Anwendung Durchführung Nebenwirkungen bronchiale Zangenbiopsie bei endobronchialem Tumorwachstum Biopsie eines im einsehbaren Bronchialbereich lokalisierten Prozesses lokale Blutung transbronchiale Zangenbiopsie ● ● periphere Befunde (Tumor, interstitielle infektiöse Veränderungen) ggf. unter Durchleuchtung ● ● nach Lokalisierung ggf. unter Durchleuchtung Vorschieben der Zange oder Bürste ⅔-Querfinger-Regel ● ● Fremdkörperfasszange endobronchialer Fremdkörper Entfernung eines tracheobronchialen Fremdkörpers lokale Blutung Nadelbiopsie peribronchiale Tumoren oder Lymphknoten unter sonografischer Überwachung oder nach Lokalisation (CT-Befund) Nadel durch die Bronchuswand in das peribronchiale Gewebe vorschieben lokale Blutung Katheterbiopsie ● wie bei Zangenbiopsie Vorschieben von Zange oder Bürste lokale Blutung ● 142 erhöhtes Blutungsrisiko (v. a. bei chronischer Nieren- und Leberinsuffizienz sowie Therapie mit Thrombozytenaggregationshemmern) Pneumothorax bei endo- oder transbronchialem Tumorwachstum Gewinnung von Pathogenen Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Pharnyx 2 ● 2.27 Bronchoskopie Tab. 2.114 Fortsetzung Anwendung ● ● ● Bürstenbiopsie (Zytologie, Mikrobiologie) ● ● ● mikrobiologische endoskopische Spülung („PseudoBAL“) ● ● Sekretgewinnung Durchführung Nebenwirkungen interstitielle Lungenerkrankungen eosinophilenassoziierte Erkrankungen Sarkoidose Instillation von 100–300 ml vorgewärmter 0,9 %iger NaCl-Lsg. in 20 ml-Fraktionen und unmittelbarer Aspiration ● bei endobronchialem Tumorwachstum mit oder ohne Durchleuchtung in der Tiefe eines Segmentes bei Verdacht auf Tumormanifestation Gewinnung von Pathogenen (Mikrobiologie) gedeckte Mikrobürste (geringe Kontamination des Untersuchungsmaterials durch Mund-Rachen-Flora) gezieltes Spülen eines Segmentes mit 20–40 ml 0,9 % iger NaCl-Lsg. in Wedge-Position anschließend Absaugen in „Falle“ (Bakteriologie, Virologie, Tbc) ● Sekretgewinnung ohne Spülung mittels Aspiration ● ● Spitze des Bronchoskops in WedgePosition eines Segmentes 20–40 ml 0,9 %iger NaCl-Lsg. Instillieren anschließend Absaugen in „Falle“ (Bakteriologie, Virologie, Tbc) vorhandenes Sekret direkt absaugen ● meist einmaliges und wenige Stunden anhaltendes Fieber 6–8 h nach BAL ein über 2–3 Tage nachweisbares peripheres Infiltrat lokale Blutung durch Gewebeläsion ● ● Flüssigkeitsbelastung (vermehrter Hustenreiz) submuköse Einblutungen durch Saugung submuköse Einblutungen durch Saugung Merke Zange (Histopathologie) Bronchialbürste (Zytologie) Bronchialspülung (Mikrobiologie) bronchoalveoläre Lavage (Differenzial- und Immunzytologie) Abb. 2.57 Methoden der flexiblen Bronchoskopie. ▶ Mikrobiologische Diagnostik. Die Indikation zur Diagnostik pathogener Mikrorganismen mittels Zangen- oder (geschützter) Bürstenbiopsie aus dem Herdgebiet besteht bei interstitieller, nosokomialer oder therapierefraktärer Pneumonie, abszedierenden Pneumonien, opportunistischen Infektionen, Infektionen mit fakultativ oder obligat anaerobe Keimen sowie Aktinomykosis bzw. Nokardiosis. Zur mikrobiologischen Diagnostik des gewonnenen Atemwegsmaterials gehören Grampräparat, aerobe und anaerobe Kultur und Diagnostik auf Mykobakterien. H Die Zangen- und (geschützte) Bürstenbiopsie aus dem Herdgebiet ist diagnostisches Mittel der Wahl bei opportunistischen Infektionen, interstitieller Pneumonitis, nosokomialen, therapierefraktären und abszedierenden Pneumonien, Aktinomykosen oder Nokardiosen sowie anaeroben Pathogenen. Die therapeutischen Techniken der Bronchoskopie beziehen sich in erster Linie auf die Beseitigung von Pus und Mukus bei Retention. Im Rahmen einer Alveolarproteinose ist eine seitengetrennte Lavage von mehreren Litern durch starre Bronchoskopie und unter Vollnarkose angezeigt. Merke ⅔-Querfinger-Regel ▶ Diagnostische Techniken. Hierzu gehören ● Absaugen von Sekret und Durchführung einer Spülung zur mikrobiologischen Diagnostik direkt oder mittels Katheter, ● BAL zur Differenzial- und Immunzytologie der bronchoalveolären Zellen (v. a. bei interstitiellen Erkrankungen), ● Bürstenbiopsien aus dem parenchymalen Herdgebiet zur histologischen und/oder mikrobiologischen Diagnostik, ● Zangenbiopsien von Bronchialgewebe und/oder parenchymalem Herdgebiet zur histologischen und/oder mikrobiologischen Diagnostik, ● Nadelbiopsien parenchymaler und/oder mediastinaler Strukturen (Tumor, Lymphknoten). 2 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Technik bronchoalveoläre Lavage (BAL) H Die ⅔-Querfinger-Regel oder ‑Technik erlaubt die Durchführung der transbronchialen Biopsie ohne Röntgenkontrolle. Dabei wird die geschlossenen Zange bis an die Pleura vorgeschoben (= nicht passierbarer Widerstand), was der Patient durch einen Schmerz bemerkt (Druck auf Pleura parietalis). Der Untersucher fasst die Zange unmittelbar am Arbeitskanal des Bronchoskops und führt sie 3 Querfinger zurück. Anschließend wird die Zange geöffnet, wieder 2 Querfinger vorgeschoben und geschlossen. Auf diese Weise bleibt ein Abstand zur Pleura von einem Querfinger (ca. 6 – 10 mm) erhalten, sodass das Risiko einer Pleuraverletzung mit konsekutivem Pneumothorax gering ist. Praxistipp Bewertungskriterien bei Zangenbiopsie Z Bei tiefer transbronchialer Biopsie ist der zu bioptierende Prozess nicht zu erkennen. Hier kann jedoch Farbe, Konsistenz, Größe und Gewicht der Biopsie Informationen liefern (▶ Tab. 2.115). 143 Prinzipien der pneumologischen Diagnostik 2 Kriterien Eher normales Gewebe Eher verändertes Gewebe Größe kleine, zarte Biopsien große Biopsien Gewicht Gewebeprobe schwimmt (Lungenparenchym, luftgefüllt) Gewebeprobe sinkt zum Boden des Gefäßes (solides Gewebe) Widerstand stärkerer Widerstand und ruckartiges Lösen beim Zurückziehen der geschlossenen Zange kaum (manchmal kein) spürbarer Widerstand beim Zurückziehen der geschlossenen Zange Konsistenz feste bis derbe Probe weiche, z. T. zerfallende Probe Farbe rosafarben u. a. mit weißlichen (Nekrosen) oder schwärzlichen Anteilen (altes Blut, Gewebeblutungen, Anthrakose) 2.27.7 Sonderformen der Bronchoskopie Bronchoskopie auf der Intensivstation ▶ Indikationen. Die Bronchoskopie im Rahmen der intensivmedizinischen Behandlung erstreckt sich auf folgende Indikationen: ● Atelektase: therapeutische Sekretabsaugung bei „Mucoid Impaction“ ● Keimgewinnung: mikrobiologische Diagnostik, indiziert immer vor Beginn einer antibiotischen Therapie, ggf. antibiotikafreies Intervall von 12 – 24 h vor Untersuchung. Beurteilung im Direktpräparat (Gram-Färbung obligat) und Kultur. Bewertung: Mikrobiologie: Keimzahl × 104 cfu/ml bzw. bei Bürstenabstrichen × 103 cfu/ml spricht für Infektion. ● Verdacht auf Aspiration: therapeutisches Absaugen, Fremdkörperentfernung ● Verbrennung: Nachweis eines Inhalationstraumas. Makroskopisch: akute Rötung, evtl. Ruß (hohe Mortalität unabhängig vom Ausmaß der Verbrennung) ● Verschlechterung der Beatmungsparameter unklarer Ursache: Tubuslage, Aspiration, Infektion ● Kontrolle der Tubuslage: der Hauptcarina aufsitzend, einseitige Intubation eines Hauptbronchus Bei intubierten Patienten ist es sinnvoll, den Tubus durch die Hilfe eines Dritten manuell zu fixieren, um das Bronchoskop frei bewegen zu können und den Tubus nicht zu dislozieren. ▶ Sekretgewinnung bei Tracheostoma und Trachealtubus. Man geht folgendermaßen vor: ● bei Tubus- bzw. Kanülenwechsel sterilen Absaugkatheter einführen ● aspiriertes Sekret in einem sterilen Röhrchen auffangen ● alternativ Katheterspitze mit steriler Schere abschneiden und in Röhrchen mit Transportmedium (z. B. NaCl oder spezielles Kulturmedium) einsenden ● bei Ergebnisinterpretation berücksichtigen, dass nach intratrachealer Intubation bzw. Anlegen eines Tracheostomas innerhalb von Stunden eine Besiedlung der tiefen Atemwege („Kolonisation“) mit Oropharyngealflora erfolgt ▶ Komplikationen. Folgende Komplikationen sind möglich: häufiger: ○ vorübergehender Abfall der Sauerstoffsättigung ≤ 15 % des Ausgangswertes ○ Abhusten von Blutkoageln bis 2 Tage nach endoskopischer Biopsie ○ Husten am Untersuchungstag ○ bei BAL: Temperaturanstieg 6 – 8 h nach der Untersuchung ○ bei transbronchialer Biopsie: pulmonale Hämorrhagie, Pneumothorax ○ Blutung ● 144 ● selten: ○ Trachea-Bronchusläsion/‑perforation ○ Pneumothorax ○ Bronchospasmus ○ Broncholaryngospasmus ○ Larynxödem ○ Larynxverletzung 2.27.8 Bronchoalveoläre Lavage (BAL) Hinsichtlich des Begriffs „BAL“ herrscht eine gewisse Verwirrung, da mehrere Formen der bronchoalveolären Spülung/Lavage möglich sind (▶ Tab. 2.116). Im klassischen Sinne handelt es sich bei der BAL um eine fraktionierte Lavage mit mindestens 100 ml 0,9 %iger NaCl-Lösung, durch die bronchoalveoläre Zellen zur Differenzial- und Immunzytologie zurückgewonnen werden. Die Indikation bezieht sich vorwiegend auf interstitielle Lungenerkrankungen (▶ Tab. 2.117). Bei der Spülung handelt es sich dagegen um eine Lavage eines Segmentes bei Verdacht auf eine pulmonale Infektion zum Nachweis von Pathogenen. Hierzu werden 20 – 40 ml direkt durch den Arbeitskanal in ein Segment oder Subsegment instilliert und nach 20 Sekunden wieder aspiriert. Deshalb sollte man zur besseren begrifflichen Abgrenzung hier von einer mikrobiologischen Lavage sprechen. ▶ Indikation. Die Untersuchung der BAL erfolgt sowohl zur mikrobiologischen Diagnostik als auch in der Differenzial- und Immunzytologie (▶ Tab. 2.118) – zur mikrobiologischen Untersuchung etwa bei immunsupprimierten Patienten mit Pneumonie (Sensitivität ca. 70 %, Spezifität 80 – 95 %) oder bei verschiedenen Lungen- und Bronchialerkrankungen in der Zytologie, ggf. mit Lymphozytendifferenzierung. Differenzial- und Immunzytologie ▶ Indikation. Die Differenzial- und Immunzytologie ist bei folgenden Lungenerkrankungen indiziert: ● Verdacht auf Sarkoidose ● interstitielle Erkrankungen unklarer Ursache (v. a. IPF, Ausschluss Sarkoidose, eosinophilenassoziierte Erkrankungen) (▶ Tab. 2.119) (▶ Abb. 2.58, ▶ Abb. 2.59) ▶ Durchführung. Folgende Schritte sind zur Durchführung einer BAL erforderlich: ● Auswahl des Segmentes: Hierzu wird ein repräsentatives oder ein betroffenes Segment gewählt. Als Segmente der 1. Wahl gelten S 4 und S 5 bds. (Mittellappen, Lingula). Lokalisation und Größe dieser Segmente erlauben im Allgemeinen eine gute Recovery. Bei den übrigen Segmenten (v. a. im Oberlappen und S 9) ist die Zurückgewinnung der Lavageflüssigkeit aufgrund der Lage oder der Größe eingeschränkt. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Tab. 2.115 Differenzierung mittels Zangenbiopsie zwischen „verdächtigen“ transbronchial gewonnen Proben und normalem gesundem Gewebe. 2.27 Bronchoskopie Tab. 2.116 Formen der bronchoalveolären Spülung bzw. Lavage. Bezeichnung Durchführung therapeutische Lavage bei Alveolarproteinose ● Indikation/Befund Spülung nach Aspiration je 40–80 ml in den betroffenen Segmenten Entfernung des Aspirats und Neutralisation des sauren Magensaftes mikrobiologische Spülung 20–40 ml im betroffenen Segment Identifizierung und Charakterisierung eines Pathogens bronchoalveoläre Lavage (BAL) 100–300 ml meist im 4., 5. oder 8. Segment bds. Differenzial- und Immunzytologie bronchoalveolärer Zellen bei interstitiellen Lungenerkrankungen (Alveolitis, Bronchiolitis) unilaterale Lunge mit 20–40 L kontralaterale Lunge in separater Intervention ● Entfernung des proteinreichen Materials 2 Tab. 2.117 Bronchoskopische Untersuchungen bei unterschiedlichen Lungenerkrankungen. Inspektion Pathologie Mikrobiologie Immunzytologie Bürsten-Zytologie bronchiale Biopsie transbronchiale Zangen- oder Nadelbiopsie Spülung Bürste Biopsie BAL Malignom/Metastasen + (bronchialer Tumor) + + + – – – + bakterielle Pneumonie + (Pus) + – + + ± ± – atypische Pneumonie – – – + + + + – opportunistische Infektion – + – + + + + – Lungenparenchymerkrankungen – – + + – – – + Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Verdachtsdiagnose RB-ILD: respiratorische Bronchiolitis mit interstitieller Lungenerkrankung; ±:möglich; + : indiziert; –: nicht sinnvoll Tab. 2.118 Gegenüberstellung von BAL und mikrobiologischer Lungenspülung. Kriterium Klassische BAL Mikrobiologische Spülung Spülmenge 100–300 ml 20–40 ml bevorzugte Segmente 4er- oder 5er-Segmente bds. (apikales) OL-Segment alternative Segmente 5er-Segmente bds. betroffenes Segment Befund Differenzial-, Immunzytologie Erregernachweis (qualitativ) Indikation bei Verdacht auf diffuse Lungenerkrankung, Sarkoidose infektiöse Lungenerkrankung Abb. 2.58 Diagnostische Aussagen auf dem Boden der Differenzialzytologie der BAL-Zellen. V. a. interstitielle Lungenerkrankung interstitielle Erkrankung unwahrscheinlich unauffällige Zellverteilung Differenzialzytologie auffällige Zellverteilung Eosinophilie Neutrophilie Lymphozytose > 20 % aller Zellen > 50 % aller Zellen > 20 % aller Zellen – eosinophile Pneumonie – Churg-Strauss-Syndrom – medikam.-assoz. Reaktion – Parasitose – hypereosinophiles Syndrom – bakterielle Pneumonie – exogen-allergische Alveolitis – Sarkoidose (aktiv) – anderer immunologischer aktiver Prozess 145 Prinzipien der pneumologischen Diagnostik Tab. 2.119 Abfolge der zu beurteilenden Parameter bei der Interpretation der BAL-Differenzial- und Immunzytologie. 2 Sollwert Diagnostische Rückschlüsse bei Abweichung vom Sollwert 1. Recovery > 30 % des instillierten Volumens anatomische Besonderheit, COPD/Emphysem 2. Zellzahl 3–10 × 106 Zellen/ml ● ● 3. Differenzialzytologie ● ● ● 4. CD4/CD8-Quotient Eosinophile ≤ 1 % Neutrophile ≤ 3 % Lymphozytose ≤ 18 % ● ● ● 1–3,5 ● ● 5. Lymphozyten Lymphozytose (< 20 %) ● ● ● 6. Lymphozyten-Subpopulationen CD103+CD4+T-Zellen (< 40 %) ● CD25+CD4+T-Zellen (< 10 %) ● ● ● > 10 × 106 Zellen/ml: EAA, Pneumonie < 3 × 106 Zellen/ml: ungenügende Recovery, Immunsuppression? eosinophilenassoziierte Erkrankung bakterielle Pneumonie Sarkoidose, EAA > 3,5: Sarkoidose < 1: IPF/UIP, BOOP, EAA EAA Sarkoidose akute/chronische LTx-Abstoßung Emphysem Fibrose (IPF/UIP) BOOP lymphozytäre Aktivierung 7. Rauchermakrophagen <3% RB-ILD/DIP 8. Siderophagen (Fe-positiv) keine alveoläre Hämorrhagie (Malignom, Stauung/Herzinsuffizienz, Vaskulitis) V. a. interstitielle Lungenerkrankung interstitielle Erkrankung unwahrscheinlich unauffällige Zellverteilung Immunzytologie auffällige Zellverteilung CD4/CD8Quotient CD103+CD4+T-Zellen CD25+CD4+T-Zellen CD1a+-Zellen NKT-Zellen > 3,5 % <1% > 40 % aller Zellen > 10 % aller Zellen >3% aller Zellen > 15 % aller Zellen Sarkoidose Fibrose (UIP) BOOP Kollagenose Emphysem (COPD) EAA Fibrose (UIP) aktive lymphozytäre Entzündung RB-ILD LangerhansHistiozytose RB-ILD Sarkoidose (> Stadium II) Abb. 2.59 Diagnostische Aussagen auf dem Boden der Immunzytologie der BAL-T-Lymphozyten. ● ● 146 Lavage: Alle Spülungen erfolgen mit körperwarmer, 0,9 %iger NaCl-Lösung in Fraktionen zu 20 ml und einem Gesamtvolumen von 100 – 300 ml. Dabei kommt es nicht selten vor, dass der Katheter zu weit in die Peripherie geschoben wird, was zu Blutungen oder zum Kollaps der Subsegmente während der Aspiration führen kann. Daher sollte das distale Ende des Spülkatheters immer sichtbar bleiben. Auf diese Weise lässt sich eine Blutung oder das Anliegen des Katheters an der Bronchialwand erkennen und ggf. korrigieren (vorsichtiges Drehen des Bronchoskops oder Spüldrainage sehr langsam zurückziehen). Einfluss der Erkrankung: Die Recovey ist bei obstruktiven Erkrankungen und hier vor allem bei manifestem Emphysem eingeschränkt. ● Qualitätskriterien: Zu den Qualitätskriterien der BAL zählen ○ eine Mindestmenge von 100 ml vorgewärmter 0,9 %iger NaCl-Lösung, ○ eine Lavage-Recovery > 30 % des instillierten Volumens, ○ keine Blutbeimengungen (Verfälschung des Befundes durch Blutzellenbeimischung). Merke H Die bronchoalveoläre Lavage wird immer vor einer endo- oder transbronchialen Biopsie durchgeführt (Blutung!). Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Parameter 2.27 Bronchoskopie H Merke Für eine reproduzierbare diagnostische Aussage (Differenzialund Immunzytologie) muss mindestens ein Drittel der instillierten Lavageflüssigkeit zurückgewonnen werden. Mikrobiologische Diagnostik ▶ Indikation. Eine mikrobiologische Diagnostik wird bei folgenden klinischen Situationen durchgeführt: ● immunsupprimierte Patienten (Z. n. Organ- bzw. Knochenmarktransplantation) ● HIV-positive Patienten (AIDS) ▶ Durchführung. Die Spitze des Bronchoskops wird in Verschlussposition platziert. Anschließend werden 20 – 40 ml einer 0,9 %igen NaCl-Lösung in 20 ml-Aliquots instilliert, nach einer Latenz von 10 – 20 Sekunden aspiriert und in einer „Falle“ aufgefangen. Die Latenz erlaubt die Konvektion von peripheren Partikeln bzw. Erregern in zentralere Bereiche. Das Aspirat wird dann zur mikrobiologischen Diagnostik eingesandt. Komplikationen der BAL ● ● ● ▶ Interpretation. Die Interpretation der BAL richtet sich nach 8 Kriterien (▶ Tab. 2.119). Eine differenzierte Bewertung der typischen BAL-Parameter ist in ▶ Tab. 2.120 dargestellt. Bei zu geringer BAL-Recovery dominieren die bronchialen Zellen (v. a. Neutrophile, Makrophagen). Erst bei über einem Drittel werden auch genügend alveoläre Zellen erfasst. Mit zunehmendem BAL-Volumen erhöht sich die Zahl der zurückgewonnenen Zellen. 2 ● ● vorübergehender Abfall der Sauerstoffsättigung < 15 % Bronchospasmus (selten) Husten nach der BAL (verbliebene Flüssigkeit!) bzw. am Untersuchungstag einmaliger Temperaturanstieg 6 – 10 Stunden nach der Untersuchung radiologisch erkennbares „pseudo-pneumonisches“ Infiltrat innerhalb von 48 Stunden nach der Lavage Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ▶ Nebenwirkungen. Mit zunehmendem BAL-Volumen erhöht sich die Zahl der zurückgewonnenen Zellen. In der Regel reichen 100 ml für eine diagnostische Aussage aus während gleichzeitig die Nebenwirkungen (Flüssigkeitsbelastung der Lunge: Husten und postinterventionelles Fieber) in einem günstigen Verhältnis zueinander stehen. Für eine repräsentative Aussage zum bronchoalveolären Zellmuster sollte über ein Drittel der instillierten Volumens zurückgewonnen werden (> 30 ml bei einem Instillationsvolumen von 100 ml). Wird das nicht erreicht, sollte entweder das instillierte Volumen so lange erhöht werden, bis das Kriterium erfüllt ist oder die Lavage in einem anderen Segment/Subsegment wiederholt werden. Tab. 2.120 Diagnoseweisende Befunde der Differenzial- und Immunzytologie bronchoalveolärer Zellen. Parameter/Veränderung Diagnose möglich/diagnostischer Hinweis Diagnostische Wahrscheinlichkeit Eher unwahrscheinliche Erkrankungen Differenzialzytologie Lymphozytose (> 40 %) ● ● ● Eosinophilie (> 20 %) exogen allergische Alveolitis aktive Sarkoidose Virus-Pneumonitis eosinophilenassoziierte Erkrankung ● ● > 70 % Spezifität hoch < 40 % Spezifität niedrig hoch bakterielle Pneumonie ● ● Neutrophilie (> 40 %) bakterielle Pneumonie je höher der Anteil, desto wahrscheinlicher die Diagnose bakterielle Pneumonie Sarkoidose alle anderen Erkrankungen Immunzytologie Vermehrung der CD4+-T-Lymphozyten s. CD4/CD8-Quotient Verminderung der CD8+ TLymphozyten s. CD4/CD8-Quotient CD4/CD8-Quotient > 3 Sarkoidose ● ● CD4/CD8-Quotient < 3 ● ● ● Vermehrung der NKT-Zellen (> 15 %) ● ● ● ● ● CD1+ Zellen > 3 % bei Quotient > 10: diagnostische Wahrscheinlichkeit > 99 % < 10: geringere diagnostische Sicherheit ● ● ● ● IPF/UIP bakterielle Pneumonie BOOP EAA BOOP EAA interstitielle Fibrose niedrig bis mäßig Sarkoidose RB-ILD/DIP (15–30 %) Sarkoidose (10–20 %, v. a. in Stadium II und III) Malignom? Sepsis? Bronchiolitis obliterans (LTx) keine Daten ● Langerhans-Zell-Histiozytose (> 60 %) ● ● ● je höher der Anteil, desto wahrscheinlicher die Diagnose IPF/UIP bakterielle Pneumonie BOOP EAA alle übrigen Erkrankungen 147 Prinzipien der pneumologischen Diagnostik Navigationsverfahren Eine magnetfeldbasierte Navigation kann die bronchoskopische Lokalisation in periphere Lungenregionen erleichtern. 2 ▶ Ziel. Verbesserung der Zielgenauigkeit bei bronchoskopischen Biopsien bei Raumforderungen. ▶ Technik. Das System besteht aus einem niederfrequenten elektromagnetischen Feld, das durch ein Bord in der Untersuchungsliege erzeugt wird, einem Arbeitskatheter, in den eine Sensorspitze geführt wird, und einem Rechnersystem, mit dessen Hilfe die Lageinformation der Sensorspitze innerhalb des Magnetfeldes mit einer zuvor angefertigten dreidimensionalen Computertomografie hergestellt wird. Damit kann der Katheter entlang eines in der virtuellen Bronchoskopie (s. u.) geplanten und kontrollierten Weges bis zum Ziel geführt werden. ▶ Bewertung. Die Technik ist derzeit noch nicht vollständig entwickelt. Es bleibt abzuwarten, ob sich die technisch und finanziell aufwendige Untersuchung in der Routinediagnostik etabliert. Virtuelle Bronchoskopie (VB) Die VB basiert auf einer Rekonstruktion der Lunge und Atemwege mittels Bildgebung. ▶ Terminologie. Die Bezeichnung „virtuelle Bronchoskopie“ ist irreführend, da sie fälschlicherweise ein der Bronchoskopie gleichwertiges Verfahren suggeriert. ▶ Indikation. Eine Indikation besteht dann, wenn ein klinischer Nutzen abzusehen ist (nicht einsehbare Stenosen, komplizierte anatomische Verhältnisse, extrabronchiale Veränderungen). ▶ Ziel. Die virtuelle Inspektion des Bronchialsystems vor der eigentlichen Bronchoskopie dient der Einschätzung der erforderlichen diagnostischen Maßnahmen. ▶ Technik. Die VB basiert auf einer dreidimensionalen Rekonstruktion von computertomografisch gewonnenen Daten. Dabei wird die Grenzfläche Luft/Gewebe digital markiert. Eine rechnergestützte Rekonstruktion bietet ein anatomisches Abbild endound peribronchialer Strukturen. ▶ Durchführung. Im ersten Schritt wird eine CT mit 3D-Rekonstruktion durchgeführt, um die erforderlichen Maßnahmen bzw. Techniken festzulegen. Im zweiten Schritt erfolgt die Bronchoskopie mit Umsetzung der erforderlichen Maßnahmen. ▶ Bewertung. Die VB ist ein komplementäres Verfahren, das die konventionelle Bronchoskopie nicht ersetzt. Sie ermöglicht vielmehr eine integrierte Bewertung der anatomischen Verhältnisse (endo-, peribronchial) und bessere Vorbereitung auf die tatsächliche Bronchoskopie. Autofluoreszenzbronchoskopie (AFB) Die Fluoreszenzbronchoskopie macht sich zunutze, dass maligne transformierte Schleimhautbezirke eine alterierte Autofluoreszenz aufweisen, wenn sie Licht einer definierten Wellenlänge ausgesetzt werden. 148 ▶ Prinzip. Die Fluoreszenzbronchoskopie erlaubt die Identifizierung von Präkanzerosen und Frühstadien von Karzinomen. Dysplasien und Carcinomata in situ (CIS) gehen mit einer Verdickung oberflächlicher Mukosaschichten sowie morphologischer und metabolischer Veränderungen einher, durch die das Fluoreszenzlicht abgeschwächt wird. Die betroffene Mukosa erscheint verglichen mit dem umliegenden Gewebe dunkler, z. T. bläulich bis bräunlich. ▶ Indikation. Die Indikation besteht bei allen Patienten mit Verdacht auf Bronchialkarzinom zur Identifizierung von Präkanzerosen und Frühstadien von Karzinomen. ▶ Ziel. Die AFB zielt auf die Identifizierung malignen Gewebes auf dem Boden dessen subepithelialer Fluoreszenzeigenschaften. Damit lässt sich der Nachweis von malignen (Cis) und prämalignen (Dysplasie Grad II und III) Veränderungen verdoppeln. ▶ Technik. Die verfügbaren Systeme arbeiteten entweder mit Laser- oder Xenon-Licht als Anregungsenergie. Die modernste Technik stellt die Video-Autofluoreszenztechnik dar, die in Form und Handhabung einer normalen Videobronchoskopie vergleichbar ist. Das bronchoskopische Bild wird von einer mit CCD (Charge-coupled Device)-Sensor-Kamera am distalen Ende aufgenommen. Hiermit sind die Bildqualität im Weißlicht- und Autofluoreszenzmodus mit dem Videobronchoskopie-Standard vergleichbar. Weißlicht- und Video-Autofluoreszenzbild lassen sich simultan auf dem Bildschirm beurteilen und dokumentieren (sog. „Twin-Mode“). ▶ Durchführung. Die Durchführung der AFB ist der einer herkömmlichen Bronchoskopie vergleichbar. Sie ist durch die vergleichende Bewertung von Weißbild und Autofloureszenzbild allerdings zeitaufwendiger. ▶ Bewertung. Grundsätzlich lässt sich mit dieser Technik die Diagnostik von Tumoren im Frühstadium verbessern. Für einen breiten Einsatz im Sinne eines Screenings ist die Methode jedoch nicht genügend validiert. 2.27.10 Interventionelle Bronchoskopie Die interventionelle Bronchoskopie zur Behandlung umfasst bronchoskopische Techniken, mit denen sich bestimmte Situationen innerhalb der erreichbaren Atemwege behandeln lassen. Zum Spektrum der interventionellen Techniken gehören Stents, Nd-YAG-Laser, Hochfrequenzdiathermie und Brachytherapie bei der Behandlung maligner Erkrankungen ebenso wie Dilatation bei Post-LTx-Komplikationen und die Implantation von Ventilen bei Lungenemphysem. ▶ Indikation. Das Spektrum der heute verfügbaren endoskopischen Behandlungsmethoden umfasst mechanische, thermische, radiologische und fotochemische Verfahren, die sich hinsichtlich ihrer kurz- und langfristigen Wirkungen unterscheiden und z. T. ergänzen. Die Wahl des Verfahrens hängt von der Dringlichkeit der Situation ab und von Ziel der Behandlung (palliativ oder kurativ). Zudem wird die Indikation zur Rekanalisation heute zurückhaltender gestellt, und dabei mögliche Komplikationen und die Einschätzung der Maßnahmen im Hinblick auf den zu erwartenden symptomatischen Effekt, die Perfusion des betroffenen Lungenabschnitts nach Wiedereröffnung sowie die Gesamtprognose des Patienten zu berücksichtigen (▶ Tab. 2.121). Bei Patienten mit einer Überlebensprognose von weniger als 3 Monaten sollte von interventionellen Verfahren eher abgesehen werden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 2.27.9 Ergänzende Techniken 2.27 Bronchoskopie Tab. 2.121 Kriterien als Entscheidungshilfe für die Durchführung interventioneller Maßnahmen zur Rekanalisation bei Atemwegsstenose bzw. ‑verschluss. Parameter Maßnahmen sinnvoll erwartete Überlebenszeit > 3 Monate < 3 Monate Perfusion distal des stenosierten/verschlossenen Lungenbereichs Vorhanden nicht vorhanden Kontinuität des Lumens Erkennbar nicht identifizierbar Tumormanifestation endobronchial, exophytisch-stenosierend peribronchial, von außen stenosierend Je kürzer die Symptome bestehen, umso eher erscheint eine Rekanalisation erfolgversprechend. ▶ Zentrale Stenosen. Grundlage der interventionellen Maßnahmen ist die Verwendung einer starren Bronchoskopie, die insbesondere bei drohendem Verschluss der Trachea oder eines singulären Hauptbronchus als Methode der Wahl gilt. Hierbei wird das Bronchoskoprohr durch die Stenose gebohrt, wobei sich Gewebe bereits mit der Spitze des starren Bronchoskops abtragen lässt und die Stenose aufdehnt. Gleichzeitig ist hierdurch die Beatmung unmittelbar gesichert. Blutungen werden durch die Kompression mit dem Bronchoskop verhindert. Abgetragene Gewebestücke können mit Fremdkörperzangen, poststenotisches Sekret mit großlumigen Saugern entfernt werden. In einem zweiten Schritt lässt sich nach Rückzug der Optik das stenosierende Gewebe mechanisch oder mittels thermischer Verfahren weiter abtragen. Stents ▶ Definition. Unter einem Stent versteht man eine „Prothese“ aus unterschiedlichsten Materialien, die zur Sicherstellung des endobronchialen Lumens bei stenosierenden Prozessen (endoluminaler Tumor, Tumorkompression von außen) oder zur Stabilisierung der Atemwege (z. B. Bronchomalazie) implantiert wird. ▶ Ziel. Ziel des Verfahrens ist die Rekanalisation und Gewährleistung eines ausreichenden Atemwegslumens. ▶ Prinzip und Technik. Unter den Rekanalisationsverfahren hat sich vor allem die Prothetik in den letzten Jahren verbessert. Jedoch gibt es weiterhin keine universelle Prothese. Prothesen sind in unterschiedlicher Form als Silikonröhren und selbstexpandierende Maschendrahtprothesen mit und ohne Beschichtung ver- 2 fügbar. Sie werden mit dem starren Bronchoskop oder mit speziellen Implantationsgeräten eingesetzt. Gerade Stents (Dumon) werden durch Noppen auf der äußeren Oberfläche an der Bronchialwand fixiert. Y-förmige Stents zur Schienung der Bifurkation (Dynamic Stent) werden durch die beiden distalen Arme in den Hauptbronchien gehalten (▶ Tab. 2.122). Es stehen Silikon-Stents nach Dumon, Hybrid-Stents nach Freitag (Bifurkationsstent), Metall-Stents sowie Nitinol-Stents zur Verfügung. Während Metall-Stents in flexibler Technik implantiert werden können, erfordern Silikonprothesen eine starre Technik. Nitinol-Stents kombinieren die Vorteile des Silikon- mit denen des Metall-Stents. Die Polyurethan-Ummantelung verhindert das Einwachsen von Granulations- oder Tumorgewebe. Sie sind damit hinsichtlich temporärer Strategien mit Silikonprothesen vergleichbar. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. H Merke Maßnahmen weniger sinnvoll ▶ Durchführung. Metall-Stents können auch flexibel in Lokalanästhesie implantiert werden. Hierzu wird der Stent über Führungsdraht in die Stenose eingebracht und dann durch Abziehen eines Haltefadens (Ultraflex-Stent) oder durch Zurückziehen einer Hülle freigesetzt (z. B. Leufen-Stent). Dabei sollte die Implantation unter endoskopischer Sicht erfolgen und mittels Durchleuchtung überprüft werden. Flexible Metall-Stents eignen sich zur Schienung komplexer Stenosen in gebogenen oder konischen Atemwegen und Überbrückung von Fisteln zu den Nachbarorganen. ▶ Komplikationen. Zu den Komplikationen gehören vor allem die Stent-Dislokation, Sekretretention (Silikon-Stents), Granulationsgewebe und Stent-Defekte (Metall-Stents). Bronchoplastie (Ballondilatation) ▶ Definition. Bei der Ballondilatation wird ein Ballon in den stenosierten Bereich geführt und dort mittels NaCl-Lösung entfaltet. Sie hat das Bougieren stenosierender Atemwege ersetzt. Tab. 2.122 Gegenüberstellung der wichtigsten Eigenschaften der gebräuchlichsten Atemwegsstents. Schwierigkeiten der Implantation und Entfernung des Stents sind vor allem von den Erfahrungen des Untersuchers abhängig. Silikon-Stents Metall-Stents Hybrid-Stents Bronchoskopietechnik starr flexibel oder starr flexibel oder starr Implantation einfach Schwieriger schwieriger Entfernung einfach Schwieriger schwieriger Einwachsen von Gewebe kommt nicht vor oder minimal Häufig meist nur gering ausgeprägt Kosten gering Moderat hoch anatomischer Innendurchmesser reduziert bleibt erhalten bleibt erhalten Stent-Expansion kontrolliert Die Expansion kann zur Verletzung der Atemwege führen. unterschiedlich stark Dislokation oft Selten variabel 149 Prinzipien der pneumologischen Diagnostik Wand abfließt und dort Schäden verursacht. Für die Abtragung großvolumiger Tumoren (z. B. subtotaler Verschluss des rechten Hauptbronchus) ist die oberflächlich wirkende APC weniger geeignet. ▶ Prinzip und Vorgehen. Ein Dilatationsballon (Fa. Boston Scientific) wird über den Arbeitskanal des flexiblen Bronchoskops in die Stenose eingebracht und für 60 – 90 Sekunden mit steriler NaCl-Lösung in aufeinanderfolgenden Schritten bis zu maximal 11 atm gedehnt. Insgesamt werden auf diese Weise 1 – 3 Dilatationen durchgeführt. Der Effekt der Dilatation ist individuell unterschiedlich. Er kann durchaus bei dynamischen Stenosen wenig makroskopisch eindrucksvoll sein, obwohl der Patient funktionell eine Besserung bemerkt. Die lokalen Verhältnisse während der Dilatation lassen sich beobachten, indem man die Spitze des flexiblen Bronchoskops mit dem Ballon in Kontakt bringt. Um die Ballonplatzierung und Expansion zu kontrollieren kann in Einzelfällen der Ballon zusätzlich mit etwas Kontrastmittel gefüllt und die Dehnung unter Durchleuchtung beobachtet werden. Kryotherapie ▶ Nebenwirkungen. Die Dilatation kann selbst beim sedierten Patienten als Schmerz wahrgenommen werden. Hier sollte zusätzlich ein Analgesierung (½ Amp. Dolantin) verabreicht werden (Analgosedierung, s. o.). Bei zentralen Stenosen kann der Patient während der Dilatation über einen Lungenflügel beatmet werden oder nach ausreichender Präoxygenierung eine kurze Phase der Apnoe tolerieren; dann können Tumorstenosen weniger traumatisch über Führungsdraht mit Dilatationsballons aufgedehnt werden. Rupturen des stenosierenden Rings sind häufig. Sie gehen zudem mit Blutungen einher. Bei zu tief bzw. peripher platziertem Ballon kann es zur Ruptur von Segmentcarinen kommen. Oberflächliche Mukosaverletzungen sind jedoch meist nicht relevant. Merke H Die mechanische Eröffnung mittels starrem Bronchoskop oder Dilatationsballon ist das schnellste und sicherste Verfahren zur Beseitigung einer lebensbedrohlichen Stenose zentraler Atemwege. ▶ Definition. Bei der Kryotherapie handelt es sich um eine Methode, durch die das betroffene endobronchiale Gewebe mittels Tiefkühlung zerstört wird. ▶ Indikation. Eine Indikation besteht bei allen stenosierenden Tumoren, sofern nicht ein Totalverschluss unmittelbar droht. Da der Effekt verzögert eintritt, ist die Methode zur notfallmäßigen Behandlung hochgradiger Atemwegsverschlüsse nur bedingt geeignet. ▶ Prinzip und Technik. Hierzu wird eine Hohlsonde mit flüssigem Stickstoff durchströmt, die das Gewebe nach Kontakt bei Temperaturen von –70 °C in weniger als einer Minute gefrieren lässt und damit zerstört. An der Sonde anhaftende gefrorene Tumorpartikel lassen sich unmittelbar entfernen. Durch die Kälte werden Tumorgefäße verschlossen, sodass Blutungen kaum auftreten. Verbliebene Tumorreste zerfallen nekrotisch und lassen sich nach 1 – 2 Tagen endoskopisch abtragen. ▶ Nebenwirkungen. Bei hochgradigen Stenosen kann die Sonde zu Ventilationsproblemen führen, da eine vollständige Besiegung des Tumors nicht erfolgt. Blutungen sind selten. Endobronchiale Lasertherapie ▶ Definition. Bei der endobronchialen Lasertherapie handelt es sich um eine fotothermische Methode, mit der sich Fremdgewebe aus den Atemwegen entfernen lässt. ▶ Indikation. Die Indikation besteht bei allen subtotalen Tumorstenosen, sofern die Kontinuität der Atemwege erkennbar ist (▶ Tab. 2.123). Merke Elektrokauterisation Zu den thermischen Verfahren gehören elektrische Sonden, Schlingen und Messer. Aufgrund mehrerer Nachteile (eingeschränkte Sicht beim Überwerfen der Schlinge, Blutungen mit Sichtbeeinträchtigung und Behinderung der Beatmung) hat die Elektrokauterisation keine weite Verbreitung gefunden. Erst durch die Einführung der Koagulation mit Argon-Plasma hat sich die Elektrodiathermie auch in der Bronchologie etabliert. ▶ Prinzip und Technik. Die Technik beruht auf der Umwandlung von energiereichem Licht in Wärme/Hitze. Hierzu wird NeodymYttrium-Aluminium-Granat (ND-YAG) als laseraktives Medium verwendet, was Infrarotlicht der Wellenlänge 1064 nm erzeugt. Die Eindringtiefe beträgt 5 – 10 mm. Der nicht sichtbare infrarote aktive Laserstrahl wird über den Pilotstrahl eines Helium-Lasers gelenkt, mit dem das zu behandelnde Gewebeareal anvisiert werden kann. ▶ Prinzip und Technik. Bei der APC wird der Strom nicht durch direkten Kontakt, sondern durch ionisiertes Argon-Gas berührungsfrei großflächig an das Gewebe appliziert (30 – 60 W). An schwer einsehbaren Stellen kann das Gas auch in nicht erreichbaren Arealen oder Blutungen in der Tiefe wirksam werden. Allerdings ist die Eindringtiefe auf wenige Millimeter begrenzt. Größere Tumormassen lassen sich damit nicht abtragen. ▶ Vorgehen. Die Lasersonde wird über den Arbeitskanal des Bronchoskops in die Atemwege vorgeschoben. Das zu destruierende Gewebe wird über einen koaxial geführten Pilotlaser im sichtbaren (roten) Wellenbereich (Helium-Laser) anvisiert, ohne direkten Kontakt mit dem Gewebe. Zunächst wird mit niedriger Energie das Gewebe koaguliert und dann mit Energien bis zu 40 W vaporisiert. Argon-Plasma-Koagulation (APC) ▶ Nebenwirkungen. Bei hochgradigen Stenosen besteht das Risiko, dass der Strom unkontrolliert über die nicht betroffene 150 H Die berührungsfreie thermische Rekanalisation mit APC und Laser ist für die engen Verhältnisse in den Atemwegen besonders geeignet. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 2 ▶ Indikation. Die Bronchoplastie wird zur Dehnung bei stenosierenden Erkrankungen von außen eingesetzt. Insbesondere wird die Dilatation von postoperativen Stenosen im Anastomosenbereich nach LTx eingesetzt. 2.27 Bronchoskopie Tab. 2.123 Indikationen und Kontraindikationen zur endobronchialen Laser- oder Argon-Beamer-Therapie. Indikation Kontraindikation guter Allgemeinzustand ohne fortgeschrittene Organerkrankungen (Herz, Leber) ● ● ● morbider/komorbider Patient ventilierter Patient bei FiO2 von > 0,5 vorausgegangene mehrwöchige Beatmung noch perfundierte Lungenareale im zu eröffnenden Bereich nicht mehr perfundierte Lungenareale im zu eröffnenden Bereich (Erhöhung des Totraums) Atemwegsstenose durch endobronchial wachsenden Tumor Atemwegsstenose durch Kompression von außen mit intakter Mukosa übersichtliche Anatomie mit eindeutiger Darstellung der Atemwegskontinuität unübersichtliche Anatomie (keine Orientierung, keine Segmentzuordnung etc.) normale Koagulationsparameter schwere hämorrhagische Diathese Cave G Sowohl beim Laser als auch bei der Behandlung mit APC besteht Brand-/Explosionsgefahr bei zu großer Hitze in sauerstoffreicher Umgebung. Deswegen muss die O2-Beimischung der Atemluft auf 40 % begrenzt werden. Selbst bei großer Erfahrung besteht die Gefahr dieser Komplikationen. Ein Mitarbeiter sollte daher ausschließlich für die Sauerstoffgabe verantwortlich sein! Brachytherapie ▶ Definition. Unter Brachytherapie („Afterloading“) wird eine Bestrahlung malignen Gewebes aus unmittelbarer Umgebung (endobronchial) verstanden. ▶ Indikation. Die Indikation besteht, wenn ein Tumor endooder peribronchial vorliegt bzw. auf diesen Bereich beschränkt ist. Dabei kann die Behandlung auch mit einer potenziell kurativen Dosis durchgeführt werden. Patienten mit kompletter Remission nach Brachytherapie haben eine vergleichsweise gute Chance für ein Langzeitüberleben. ▶ Prinzip und Technik. Die Brachytherapie wird durch das endoskopische Einlegen der Strahlenquelle (192Ir) vorbereitet. Hierzu wird ein Katheter endobronchial platziert, in den die Strahlenquelle computergesteuert nachgeladen wird („Afterloading“). Die Intensität an der Oberfläche ist sehr hoch (Hochdosis-Radiotherapie/HDR oder auch Kleinraumbestrahlung/Brachytherapie), fällt jedoch zur Umgebung steil ab, sodass umgebendes Gewebe geschont wird. ▶ Nebenwirkungen. Es kann zu lokalen Entzündungsreaktionen und Blutungen kommen. Zu beachten ist die Dislokation der Sonde. ▶ Bewertung. Wenn der Tumor auf die Bronchialwand und auf die nähere Umgebung beschränkt ist, besteht die Möglichkeit durch endoskopisches Einbringen einer Strahlenquelle (192Ir) mit einer potenziell kurativen Dosis zu behandeln. Fotodynamische Therapie (PDT) ▶ Definition. Bei der PDT handelt es sich um eine Methode, bei der das Gewebe nach Sensibilisierung gegenüber Licht mittels endobronchialer Laserbehandlung zerstört wird. Die Wirkung kann über Monate anhalten und verbessert die Langzeitremission nach der Brachytherapie. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ▶ Nebenwirkungen. Eine kurze Impulsdauer und kontinuierliche Rauchgasabsaugung vermindern die Brandgefahr. Todesfälle durch Asphyxie oder Blutungen kommen vor. 2 ▶ Indikation. Die Indikation zur PDT besteht zur palliativen Behandlung fortgeschrittener Tumoren oder zur Kuration kleinerer Tumoren. ▶ Prinzip und Technik. Zur PDT werden lichtsensibilisierende Substanzen systemisch oder lokal appliziert, die speziell die Tumorzellen lichtempfindlich machen (z. B. Hämatoporphyrin-Derivate, HPD). Lichteinwirkung lässt die Substanzen zerfallen, wobei Sauerstoffradikale entstehen, die die malignen Zellen innerhalb weniger Tage zerstören. ▶ Vorgehen. Nach Sensibilisierung des Tumors durch intravenöse Gabe von HPD wird nach 2 Tagen unter Lichtabschirmung des Patienten (Augenschutz des Personals) ein Strahlenapplikator in den Tumor eingeführt und mit einer Dosis von 200 W/cm2, bei einer Leistung von 200 J/cm2 über 500 s bestrahlt. Das nekrotische Material muss endoskopisch abgetragen werden. ▶ Nebenwirkungen. Die Nebenwirkungen sind mit anderen bronchoskopischen Verfahren vergleichbar. Zusätzlich muss allerdings das nekrotische Material mittels wiederholter Interventionen endoskopisch abgetragen werden. Zudem bleibt der Patient für mehrere Wochen lichtempfindlich, und insbesondere die Augen müssen vor Lichtexposition geschützt werden. Bronchoskopische Lungenvolumenreduktion (BLVR) Eine Untergruppe der mit chirurgischer Lungenvolumenreduktion behandelten Emphysem-Patienten profitiert möglicherweise von der Implantation endobronchialer Ventile (EBV). Diese werden bronchoskopisch in Lappen- oder Segmentostien implantiert und evakuieren den behandelten Lungenbereich. ▶ Ziel. Ziel des Verfahrens ist der Ausschluss des Lungenbereichs von der Ventilation mit möglichst vollständiger Atelektase des entsprechenden Lungenlappens. Damit lässt sich ein der Lobektomie vergleichbarer Effekt ohne operationsbedingte Risiken erzielen. ▶ Technik. EBV sind auf Trägerkatheter montiert, die sich bronchoskopisch in Lappen- oder Segmentostien implantieren lassen, vergleichbar der Implantation eines Stents. Aufgrund der lobären 151 Prinzipien der pneumologischen Diagnostik ▶ Komplikationen. Mögliche Komplikationen umfassen die Entwicklung eines Pneumothorax durch die Verschiebung der Lungenflügel infolge der Atelektase und Sekretretention distal des implantierten Ventils ebenso wie die nicht optimale Platzierung bzw. Dislokation der EBV. Fehlerhaft implantierte oder dislozierte EBV können mit der Zange entfernt werden. 2 ▶ Bewertung. Bei fortgeschrittener COPD mit bullösem Lungenemphysem bietet die Implantation der EBV eine Option. Allerdings liegen noch nicht genügend Erfahrungen mit dieser Technik vor. Strategische Planung Vor der Durchführung bronchologischer Interventionen sollten verschiedene Aspekte individuell geprüft werden (▶ Tab. 2.124). 2.28 Transthorakale Punktionsmethoden ▶ Definition. Zur Gewinnung von Pleuraflüssigkeit, Pleuragewebe bzw. Thoraxwand oder Lungenparenchym zur morphologischen und mikrobiologischen Diagnostik sind verschiedene transthorakale Interventionen möglich. Hierzu gehören die transthorakale Punktion oder Thorakozentese und die transthorakale Biopsie. Eine Thorakozentese und Pleurabiopsie sind immer dann indiziert, wenn die Ätiologie eines pleuralen Prozesses oder Ergusses nicht geklärt und mit einer gewissen Wahrscheinlichkeit nicht einer anderen Erkrankung (Herzinsuffizienz, Reno- oder Hepatopathie, Lungenembolie etc.) zuzuordnen ist. Während die Thorakozentese als Punktion der Brusthöhle mittels einer kleinen Nadel oder eines Katheters neben der Diagnostik aufgrund der Ergussentlastung therapeutische Aspekte trägt, dient die Pleurabiopsie in erster Linie der Diagnostik. ▶ Indikationen. Die Thorakozentese kann sowohl als diagnostische als auch als therapeutische Technik Verwendung finden. Sie ist am häufigsten bei Pleuraergüssen unklarer Ursache indiziert. Darüber hinaus kann mittels des Befundes einer Thorakozentese entschieden werden, ob eine größerlumige Drainage, z. B. eines infektiös oder parapneumonisch bedingten Pleuraergusses (Pleuraempyem) erforderlich ist. Ferner bietet die Thorakozentese Hinweise für die Bewertung der Ausdehnung eines zugrunde liegenden Bronchialkarzinoms (Staging). Neben der diagnostischen Bedeutung bietet sie die Möglichkeit, Patienten mit ausgedehnten Pleuraergüssen im Sinne einer symptomatischen Maßnahme von der in der Regel auftretenden Dyspnoe zu befreien. ▶ Kontraindikationen. Als wichtigste Kontraindikationen für die transthorakale Punktion gelten: ● mangelnde Kooperation des Patienten ● schwere Gerinnungsstörungen ● eine fortgeschrittene Lungenerkrankung mit einem FEV1 < 1,5 l Tab. 2.124 Grundlegende, vor der Durchführung von interventionellen Maßnahmen zu berücksichtigende Aspekte. Ausgangsbefund/Fragestellung Maßnahmen Besteht ein endobronchiales Tumorwachstum? ● ● Besteht eine Kompression von außen? wenn ja, Implantation eines Stents erwägen Sind Behandlungen vorausgegangen? Welche Therapieoptionen sind noch möglich? Welche Wirkung hatte eine Vorbehandlung? Besteht das Risiko einer Fistelbildung zu Nachbarorganen oder ist diese bereits vorhanden? wenn ja, Stent implantieren Wie dringend ist der Eingriff? Handelt es sich um einen Notfall? ● Droht ein Verschluss zentraler Atemwege? ● ● ● ● Wie ist die voraussichtliche Prognose und Lebensqualität? ● ● ● Sofern ein Verschluss zentraler Atemwege droht, ist unmittelbar eine starre Bronchoskopie mit mechanischer und thermischer Abtragung des Tumors erforderlich. Bei Kompression von außen erfolgt eine Stent-Implantation. Besteht kein Notfall, sollten zunächst weitere Untersuchungen (lokales und systemisches Staging) erfolgen. Bei deutlich eingeschränkter Prognose mit einer Lebenserwartung von wenigen Tagen bei morbidem Patienten sollten palliative Maßnahmen ergriffen werden. Die Prognose ist allerdings selten voraussehbar. Im Zweifelsfall sollte eine Intervention durchgeführt werden, um dem Patienten ein relativ beschwerdefreies Leben zu ermöglichen. Bestehen andere therapeutische Optionen? Die Entscheidung für einen Eingriff sollte im interdisziplinären Kolloquium innerhalb des Gesamttherapiekonzepts diskutiert werden, um eine andere Option nicht zu übersehen. Welches ist das geeignete bronchoskopische Verfahren? Die zur Verfügung stehenden Techniken sind hinsichtlich Akut- und Langzeiteffekt komplementär und sollten in optimaler Weise kombiniert werden. Welches ist das risikoärmste endoskopische Verfahren? Man sollte zunächst immer mit dem am wenigsten invasiven Verfahren (mechanische und thermische Rekanalisation) beginnen, um den Atemweg zu sichern. Bei anderen Verfahren besteht immer ein Risiko möglicher Komplikationen (Explosion, Brand, Asphyxie, Blutung oder Perforation). Daher ist es sinnvoll, im Voraus diesbezüglich die Durchführung der Maßnahmen zu überdenken. Welche Kosten entstehen durch die Therapie? ● ● ● 152 Abtragen des Tumors (mechanisch, thermisch) ggf. Stent (drohende Perforation) Stents kosten 300–1200 Euro. Ein einziges Ventil zur Emphysemtherapie kostet 1000 Euro; nicht selten werden bis zu 7 Ventile in einem Patienten eingesetzt. Ein Argon-Plasma-Koagulator ist wesentlich günstiger als ein Neodym-YAG-Laser. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Kollateralventilation sollten dabei alle Segmente eines Lappens verschlossen werden.