191 bis 200
Werbung

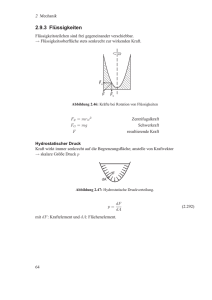
_________________________ Azeotrope __________________________________ Viele binäre flüssige Mischungen zeigen das vorhin diskutierte Siedediagramm, doch zahlreiche wichtige Systeme weichen davon ab. Ein solches Verhalten kann auftreten, wenn die Wechselwirkungen zwischen den beiden Komponenten A und B die Flüssigkeit stabilisieren mit der Folge, dass bei einer bestimmten Zusammensetzung der Siedepunkt höher liegt als die Siedepunkte der Einzelkomponenten (z.B. Chloroform und Aceton)(siehe Abbildung). Ebenso kommen Siedekurven mit einem Minimum vor (z.B. Ethanol und Wasser). B A Kommt es zu einem Extremwert wie in der nebenstehenden Abbildung, so hat das wichtige Konsequenzen für die Destillation. Bei fortschreitender Verdampfung (von a1 kommend) verschiebt sich die Zusammensetzung der verbleibenden Flüssigkeit (wenn der Dampf abgezogen wird) hin zu B, während A entfernt wird. Der Siedepunkt der Flüssigkeit steigt, und der Dampf reichert sich mit der Komponente B an. Ist genug A verdampft, so dass die Flüssigkeit die Zusammensetzung a4 aufweist, dann hat deren Dampf dieselbe Zusammensetzung. Die Verdampfung erfolgt nun ohne eine Änderung der Zusammensetzung ⇒ die Mischung bildet ein Azeotrop (“Sieden ohne Änderung“). Nach Erreichen der azeotropen Zusammensetzung ist eine Trennung der beiden Flüssigkeiten durch Destillation nicht mehr mö191 glich. _________________________ Flüssig/Fest-Phasendiagramme __________________________________ Feste und flüssige Phasen können in einem System bei Temperaturen unterhalb des Siedepunktes nebeneinander vorliegen (z.B. bei zwei Metallen wie Antimon (Sb) und Wismut (Bi), die bis hinauf zu ihrem Schmelzpunkten praktisch nicht miteinander mischbar sind). Ein solches Phasendiagramm zeigt die Abbildung. Bei a1 liegt 2-Komponentenflüssigkeit vor. Bei Abkühlung auf a2 erreicht sie das mit “Flüssigkeit + A“ bezeichnete Zweiphasengebiet (fast reiner Festkörper A scheidet sich aus der Flüssigkeit ab). Beim weiteren Abkühlen auf a3 bildet sich noch mehr Festkörper und die relativen Mengen folgen dem Hebelgesetz. Bei a4 ist weniger Flüssigkeit vorhanden als bei a3 und die Zusammensetzung der Flüssigkeit ist durch e gegeben. Diese Flüssigkeit erstarrt nun zu einem 2-Phasen-System von fast reinem A und B ⇒ bei a5 sind die Zusammensetzungen der beiden festen Phasen a5´ und a5´´ . Festkörper P=1 P=1 P=2 Die vertikale Linie durch e gibt die eutektische Zusammensetzung an (“gut schmelzen“). Eine Flüssigkeit mit der eutektischen Zusammensetzung erstarrt bei einer einzigen Temperatur, ohne zuvor festes A oder B aus der Lösung abzuscheiden. Lösungen mit Zusammensetzungen rechts von e scheiden beim Abkühlen A ab; aus Lösungen mit Zusammensetzungen links von e wird B abgeschieden. Ein technisch wichtiges Eutektikum ist Lötzinn (67% (w/w) Zinn und 33% (w/w) Blei) mit einem Schmelzpunkt von 183°C. Auch NaCl/H2O im Verhältnis 23/77 ist Eutektikum mit Schmelzpunkt bei -21.1°C. D.h. wenn vereiste Strasse mit Salz gestreut wird, dann schmilzt die Mischung, wenn die 192 Temperatur über -21.1°C liegt. _________________________ Ultrareinheit und kontrollierte Verunreinigungen __________________________________ Einige technische Entwicklungen (z.B. Halbleiterbauelemente aus Si oder Ge) erfordern Materialien mit extremer Reinheit. Betrachten wir eine binäre Flüssigkeit ( ) der Zusammensetzung a (siehe Abbildung), dann liegt im Wesentlichen die Komponente B mit einer geringen Beimengung von A vor. Beim Abkühlen auf a1 entsteht ein Festkörper mit der Zusammensetzung b1 (er enthält weniger A, ist also etwas reiner als die Flüssigkeit, liegt aber nur in geringer Menge vor). Er kann als Ausgangsmaterial für die nächste Stufe einer fraktionierten Kristallisation verwendet werden und führt dann zu reinem B. Die Abb. gilt nur, wenn das Erstarren so langsam abläuft, dass die Zusammensetzung des Festkörpers einheitlich ist und den Gleichgewichtswert annimmt. Beim Zonenschmelzen nutzt man die Tatsache, dass das System nicht im Gleichgewicht ist. Entscheidend ist, dass die Verunreinigung in der geschmolzenen Substanz besser löslich ist als im festen Material. Die geschmolzene Zone wird durch die Flüssigkeit bei der Vertikalen durch a repräsentiert und die Verunreinigung sei die Komponente A. Lässt man die Probe auf a2 abkühlen, dann scheidet sich ein Festkörper der Zusammensetzung b2 ab und die verbleibende Flüssigkeit (die beheizte Zone) liegt bei a2´ (ist also mit der Verunreinigung A angereichert). Dieser Prozess wird dann weiter fortgesetzt, bis die flüssige Phase fast reines A enthält. In der Praxis wird die Verunreinigung an einem Ende gesammelt, indem eine schmale, geschmolzene Zone mehrfach von einem Ende der Probe zum anderen Ende gef193 ührt wird. _________________________ Zonenschmelzen __________________________________ Beim Zonenschmelzen hat die Probe die Form eines dünnen Zylinders. Das Material wird in einer schmalen, scheibenförmigen Zone aufgeschmolzen, die vom einen Ende des Zylinders zum anderen geführt wird. Die flüssige Zone sammelt während ihrer Wanderung die Verunreinigung(en). In der Praxis wird die heiße Zone wiederholt zu einem Ende des Materials geführt. Dieses Ende ist die “Deponie“ für die Verunreinigung(en). Nach Abkühlung entsteht hier ein stärker verunreinigter Feststoff, der verworfen werden kann. 194 _________________________ Fl ü ssigkristalle – Liquid Crystals __________________________________ __________________________________ Bei einigen Verbindungen gibt es zwischen dem kristallinen Feststoff und der isotropen Flüssigkeit sogenannte flüssigkristalline Zwischenzustände (Mesophasen). Beim Schmelzen einer flüssigkristallinen Substanz bleibt ein Teil der Fernordnung erhalten. Dieses Phänomen tritt bevorzugt bei anisotroper Molekülgeometrie auf. Flüssigkristalle (liquid crystals) gehören heute mit zu den wichtigsten Materialien. Tm crystalline (position long-range order) TSmN smectic nematic (orientation long-range order) Tc isotropic (short-range order) Temperature 195 _________________________ Nachtrag: eine wichtige Methode zur Strukturanalyse von Festkörpern ist die Röntgenstreuung __________________________________ 196 _________________________ Die Anisotropie von Flüssigkristallen __________________________________ X Y flexible aliphatische Kette starres Mesogen 197 _________________________ Flüssigkristalle sind aus unserem täglichen Leben nicht mehr wegzudenken __________________________________ Flüssigkristallanzeige Liquid Crystal Displays (LCDs) 198 _________________________ Wie funktioniert eine LCD ? __________________________________ Die Effekte, die wir in einer Flüssigkristallanzeige beobachten, beruhen auf der Reorientierung der Flüssigkristalle unter dem Einfluß eines elektrischen Feldes zwischen zwei Elektroden. Die Zeitauflösung dieser Vorgänge liegt dabei im Bereich von ≈ 10-6 s. 199 _________________________ Schematische Darstellung der Reorientierung nematischer Flüssigkristalle unter dem Einfluss eines elektrischen Feldes __________________________________ elektrisches Feld: aus elektrisches Feld: ein Flüssigkristalle Orientierungsschicht (PI) Elektroden 200