Integration und Organ Spezialisierung 1. Organspezialisierung
Werbung
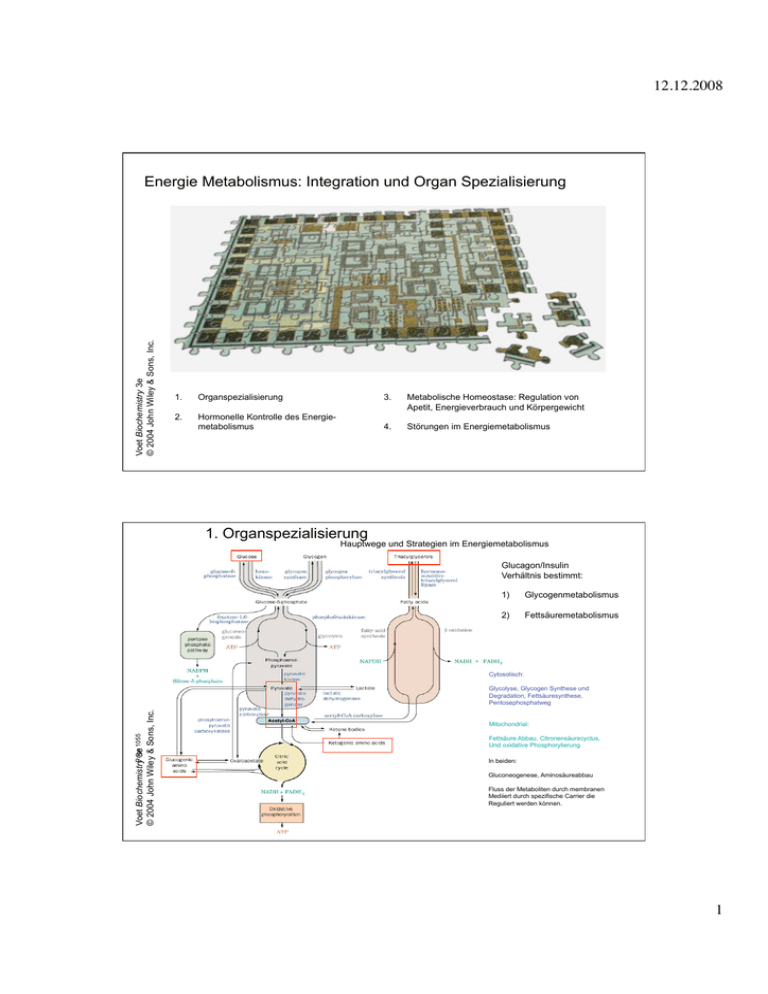
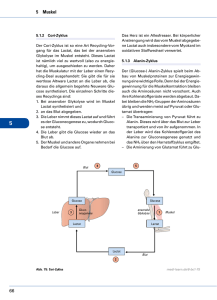
12.12.2008 Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Energie Metabolismus: Integration und Organ Spezialisierung 1. Organspezialisierung 3. Metabolische Homeostase: Regulation von Apetit, Energieverbrauch und Körpergewicht 2. Hormonelle Kontrolle des Energiemetabolismus 4. Störungen im Energiemetabolismus 1. Organspezialisierung Hauptwege und Strategien im Energiemetabolismus Glucagon/Insulin Verhältnis bestimmt: 1) Glycogenmetabolismus 2) Fettsäuremetabolismus Cytosolisch: Voet BiochemistryPage 3e 1055 © 2004 John Wiley & Sons, Inc. Glycolyse, Glycogen Synthese und Degradation, Fettsäuresynthese, Pentosephosphatweg Mitochondrial: Fettsäure Abbau, Citronensäurecyclus, Und oxidative Phosphorylierung In beiden: Gluconeogenese, Aminosäureabbau Fluss der Metaboliten durch membranen Mediiert durch spezifische Carrier die Reguliert werden können. 1 12.12.2008 Figure 22-1 Figure 22-2 Rote Pfeile= guter Ernährungszustand 2 12.12.2008 A. Das Gehirn braucht kontinuierliche Glucosezufuhr Hohe Respirationsrate -> 20% des O2 Verbrauchs im ruhenden Körper -> dagegen nur 2% der Körpermasse. Unabhängig vom Zustand geistiger Aktivität (Schlaf und Wachzustand gleich). Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Energie im Hirn um Plasmamembran Na+ - K+ - ATPase zu versorgen. -> Erhaltung des Membranpotentials Hirn braucht Glukose in ausnahmefällen (Hungern) Ketonkörper. -> kein Speicher -> ständige Versorgung über Blutstrom. -> bei weniger als der Hälfte des Normalwertes -> Hirnstörungen d.h. bei Insulinüberdosierung -> Koma und Tod. -> Leber muss Glukosespiegel im Blut konstant halten. B. Muskel 1) Glucose gespeichert in form von Glykogen. 2) Glucose kann aber nicht exportiert werden da keine Glucose-6-phosphatase -> Muskel Kohlenstoff Metabolismus dient nur dem Muskel Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. 3) Muskel kann dennoch als Energiespeicher funktionieren über den Abbau von Protein. Aminosäuren zu Pyruvat -> Alanin -> Blutstrom -> Leber (=Glucose-Alanin cycle) 4) Muskel nimmt nicht direkt Teil an Gluconeogenese -> keine Glucagon Rezeptoren 5) Muskel Rezeptoren für Adrenalin -> reguliert Glykogen Abbau -> Flucht (Glukagon unabhängig) 6) Herz und Skelettmuskel verschiedene Isozyme der PFK2, Herz PFK2 gegensätzlich zu Leber PFK2 reguliert die des Skeletmuskels gar nicht reguliert durch Phosophorylierung. 3 12.12.2008 Quelle von ATP während körperlicher Betätigung im Mensch Figure 22-3 Muskelkontraktion kann anaerob sein unter starker Belastung 1) Muskelkontraktion ist ATP getrieben d.h. ist abhängig von Atmung. 2) In Ruhezustand brauchen Muskeln etwa 30% des konsumierten O2. 3) Bei hoher Belastung -> Phosphocreatinin + ADP -> Creatin + ATP. Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. 4) Bei Sprint nicht genug -> ATP Produktion durch Glykolyse von G6P und Lactat Produktion -> O2- Verbrauch wird verzögert und in die Leber verlegt -> Sauerstoffschuld. 4 12.12.2008 Muskelermüdung hat eine Schutzfunktion Ermüdung ist nicht begründet im Aufbrauchen von Glykogen Grund: Protonen Produktion in der Glycolyse senkt den intramuskulären pH von 7 bis auf 6.4 Nicht wie irrtümlicherweise angenommen wegen lactat, denn bei pH7 und hohem lactat funktioniert der Muskel noch perfekt. Wie die Ansäuerung des Muskels Müdigkeit bewirkt ist nicht klar. Erklärungsversuche: 1) Pi durch den Verbrauch von ATP steigt und präzipitiert bei tiefem pH mit Ca2+ -> Muskelkraft herabgesetzt. 2) K+ das von kontraktierendem Muskel ausgeschüttet wird kann zur Depolarizstion des Muskels führen Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Muskelermüdung = adaptation zur Verhinderung der Selbstzerstörung des Muskels bei erschöpfter ATP Versorgung. Das Herz ist ein aerobes Organ Herzmuskel kontinuierlich, nicht intermittierend wie Skelettmuskel -> aerober Metabolismus -> sehr viele Mitochondrien pro Zelle (bis zu 40% des Cytoplasmatischen Volumens) dagegen Gewisse Skelettmuskelzellen fast keine Mitochondrien. Brennstoffe: FS, Ketonkörper, Glucose, Pyruvat, Lactat In Ruhezustand: FS bevorzugte Energiequelle des Herzens. C. Fettgewebe speichert und setzt Fettsäuren und Hormone frei Adipocyten Wo: unter Haut, in der Abdominalhöhle, im Skelettmuskel, um Blutgefässe, um Brustdrüse. Menge: 70kg Mann -> 15 kg Fett. -> sichert Ueberleben für 3 Monate. Aufgabe: Speicher, metabolische Homeostase Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Glycerophosphate shuttle Meiste FS aus der Leber -> esterifiziert mit glycerol-3-phosphat -> Triacylglyceride gespeichert Glycerol-3-phosphat aus DHAP welches aus Glycolyse oder Gluconeogenese stammt. => Glyceroneogenese. Hydrolisieren der Triacylglyceride hormonsensitiv (Glucagon, Insulin, Adrenalin). Aber auch glycerol-3-phosphate sensitiv: cytosolic NADH => Wenig glycerol-3-phosphate -> FS werden freigesetzt Glucose Aufnahme beeinflusst FS Mobilisierung 5 12.12.2008 Fettleibigkeit ist das Resultat abnormaler metabolischer Kontrolle Fettleibigkeit = 20% über dem Normalgewicht Normalerweise Gewichtshomeostase und NahrungsaufNahme über einen Set-point geregelt. Bei Fettleibigen dieser Set-point abnormal hoch. Bei Abnehmen zu normalgewicht zeigen diese Individuen Metabolische Symptome des Hungerns: Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. -) Kälteempfindlich -) 25% reduzierter Kalorienbedarf als normal -) tiefe Herzrate -) Verrückt nach Essen Fettzellen von Fettleibigen: gleich gross wie normale mehr in der Anzahl proliferieren viel mehr in Zellkultur als normale -> Einmal differenzierte Adipocyten gehen nicht mehr verloren -> möglicherweise versuchen Adipocyten eine gewisse Grösse beizubehalten -> Beeinflussung des Metabolismus und somit des Apetits. D. Leber Die Leber ist das metabolische Verteilzentrum des Körpers Nährstoffe werden im Blut im Gleichgewicht gehalten für den Verbrauch im Hirn, Muskel und anderen Organen. Nährstoffe die absorbiert werden im Darm in die Portal Vene ausgeschüttet, welche Direkt in die Leber führt (Ausnahme Fettsäuren). Die Leber ist ein Blutglukose Puffer Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Aufnahme und Abgabe von Glukose in Antwort zu Glukagon, Insulin, Adrenalin und Glukose. Nach Carbohydratreicher Malzeit -> Blutglukose etwa 6mM (kurzfristig bis 11 mM). -> Leber konvertiert Glukose zu G6P (durch Glukokinase, nicht Hexokinase Glukokinase geringer Affinität zu Glukose, d.h. Konversion wird nur gemacht wenn Glukose levels relativ hoch sind). Leberzellen können Glukose direkt aufnehmen ! (im Gegensatz zu Muskel und Fettzellen) d.h. Insulin hat keinen direkten Einfluss auf Glukoseaufnahme in Leberzellen. Fructose -> siehe nächstes slide, Galactose und Mannose in Leber auch zu G6P bzw. F6P umgewandelt. Ueber Nacht fasten -> Glukose etwa 4mM -> Glukose wird ins Blut abgegeben. Lactat und Alanin aus Muskel werden in der Leber in Enerigemetabolismus eingespeist. 6 12.12.2008 hungern genährt Versorgung von anderen Organen Versorgung von Leber und anderen Organen Figure 22-4 Metabolische Wege von G6P in der Leber G6P ist im Zentrum des Carbohydrat Stoffwechsels Figure 22-5 7 12.12.2008 Der Weg von G6P variiert abhängig von den metabolischen Bedürfnissen G6P an Scheideweg des Karbohydrat Metabolismus: 1) 2) 3) 4) Zu Glukose Zu Glykogen Zu Acetyl-CoA -> FS -> Phospholipide, Cholesterol, Gallensäuren Pentose Phosphat Weg -> NADPH -> FS Biosynthese, Nukleotid Biosynthese Die Leber synthetisiert oder degradiert Triglyceride Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. FS : Energiebedarf -> degradation -> AcetylCoA und Ketonekörper -> Blut Eergiebedarf tief -> synthese von triglyceriden -> VLDL in Blut -> Adipocyten In Leber FS Synthese und Abbau abhängig von FS Konzentration -> Teufelskreis Da Synthese und Abbau somit im Gleichgewicht -> verhindert durch KompartmentIerung. -> FS oxidation in Mitochondrien, Syntese in Cytosol. -> geregelt durch Carnitin palmitoyl transferase I (inhib. Durch MalonylCoA für FS Synth) -> wenn Energiebedarf tief -> FS können nicht in Mitochondrien. -> Energiebedarf der Leber selber -> Abbau von Glukose Leber -> keine Kettonkörper brauchbar da keine 3-ketoacyl-CoA Transferase -> unter Hohem Energiebedarf FS Hauptbrennstoff nicht Glukose oder Ketonkörper. Aminosäuren sind wichtige metabolische Brennstoffe Der Glykogenspeicher der Leber reicht um die Glukose levels für etwa 6 Stunden aufrecht zu Erhalten. Danach Glukoneogenese aus Proteinen von Muskel (alanin) oder aus Harnstoffzyklus Aus Glutamin. Fett kann nicht zu Glukose umgewandelt werden in Tieren, da kein energetisch positiver Weg von AcetylCoA zu oxalacetat existiert. Die Leber ist die metabolische Hauptverarbeitungseinheit des Körpers Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Zusätzliche Funktionen: Synthese von Blutplasmaproteinen degradation von Porphyrinen und Nukleinsäurebasen Speicher von Eisen Detoxifizierung von Drogen und Giften (oxidation Cytochrome) 8 12.12.2008 E. Nieren Filtern Harnstoff aus Blut behält wichtige Metaboliten zurück Hält pH Gleichgewicht aufrecht Erreicht durch: Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Glutamin -> α-ketoglutarat + 2 NH4+ Glutamin zu NH4+ zur Exkretion von H+ Resultierendes α-ketoglutarat wird zu CO2 um HCO3- Pufferkapazität des Blutes aufrechtzuerhalten. Niere ist neben der Leber das einzige Organ das Gluconeogenese machen kann. Während hungern generiert die Niere bis zu 50% des Glucosebedarfs im Körper. F. Blut transportiert Metaboliten für Interorganmetabolismus Glucose und Lactat werden im Cori Zyklus transportiert starke Muskelalrbeit -> anaerobe Bedingungen Figure 22-6 9 12.12.2008 Der Glucose-Alanin Zyklus transportiert Alanin zur Leber Stickstoff wird vom Muskel zur Leber transportiert (Abfallentsorgung) Figure 22-7 2. Hormonelle Kontrolle des Energiemetabolismus Pancreas and adrenal gland secrete hormones in response to metabolic fuels to maintain the bodies homeostasis. Insulin release is triggered by glucose in pancreas Glucose enters pancreatic beta cells. Glucokinase = beta cells glucose sensor G6P is entirely degraded to pyruvate in beta cells. -> respiratory activity then regulates via unknown pathways insulin production. Insulin verursacht Energiespeicherung im Muskel und Fettzellen Insulin fördert Glucose Aufnahme in Muskel und Fettzellen über einen insulin sensitiven Glucosetransporter GLUT4. Das Hirn exprimiert konstitutiv einen Insulin insensitiven Glucose transporter -> dauernde Glucoseversorgung. Die Leber exprimiert GLUT4 nicht und antwortet auch nicht auf Insulinerhöhung mit Glucoseaufnahme. Aber Insulin blockiert Gluconeogenese und Glycogenolyse. Glucagon und Catecholamine sind Gegenspieler von Insulin Figure 22-8 10 12.12.2008 Table 22-1 Guter Ernährungszustand Figure 22-9a 11 12.12.2008 Fasten/Stress Figure 22-9b Figure 22-9 12 12.12.2008 Table 22-2 Mehrere Rezeptortypen und Signaltransduktionswege regulieren den Metabolismus Insulin Epinephrin Glucagon β adrenergic receptor α adrenergic receptor Zellen können auf spezifische Signale oder Kombination von Signalen reagieren mit einer Variation in der Stärke und Dauer der zellulären Antwort. Figure 22-10 13 12.12.2008 3. Metabolische Homeostase: Regulation von Apetit, Energieverbrauch und Körpergewicht Metabolische Homeostase: Balance zwischen Energieaufnahme und Energieverbrauch A. AMP-abhängige Protein Kinase (AMPK) misst den Energiezustand der Zelle Alle metabolischen Wege durch ATP und AMP beeinflusst (AMP/ATP Verhältniss in Zelle Aufschluss über zustand der Zelle) Viele Enzyme werden durch AMP allosterisch aktiviert oder inhibiert. Andere werden durch AMPK phosphoryliert. AMPK aktiviert metabolische Abbauwege die ATP produzieren um ATP für lebenswichtige Prozesse zu sparen. AMPK selber ist ein heterotrimer das für seine effiziente Aktivität von der LKB1 kinase phospohryliert und aktiviert wird. AMPK aktiviert Glykolyse im ischemischen Herzmuskel Herzisoform von PFK, PFK2 wird phospohryliert -> PFK2 aktiviert -> F2,6P wird erhöht -> PFK1 und Glykolyse werden akttiviert. In unterversorgtem Herzmuskel (wenig Blut) -> wenig Sauerstoff -> wenig oxidative phosphorylierung -> AMP Anhäufing-> -> AMPK aktiviert -> switch zu anaerober Glykolyse um ATP zu produzieren. AMPK inhibiert Lipogenese und Gluconeogenese in der Leber AMPK -> ihibiert acetyl-CoA carboxylase (committed step in FS synthese) HMG-CoA reduktase (geschw. best. Schritt in Cholesterin Biosynthese) Glycogen Synthase -> wenig ATP-> diese Stoffwechselwege werden abgeschaltet. AMPK fördert FS Oxidation und Glukose Aufnahme im Skelettmuskel Da AMPK acetyl-CoA carboxylase inhibiert -> weniger Malonyl-CoA (Startmaterial für FS Synthese) -> Dies hat zur Folge, dass Carnitin Palmitoyl transferase I aktiver wird (Malonyl-CoA ist deren inhibitor). -> mehr palmitoyl-CoA kann von Cytoplasma in die Mitochondrien transportiert werden -> mehr FS oxidation. AMPK erhöht die Expression von GLUT1 und GLUT4 -> Insulinabängiger Eintritt von Glucose in Zellen erhöht. AMPK inhibiert Lipolyse in Fettzellen AMPK inhibiert die Hormon-sensitive triacylglycerol Lipase -> das Enzym geht nicht in das Lipiddroplet in den Fettzellen -> kein Spalten von Triglyceriden -> weniger FS in Blutstrom. 14 12.12.2008 Haupteffekte von AMPK auf Glukose und Lipidmetabolsimus Figure 22-11 Kollagen ähnlich globulärer C-Term B. Adiponectin reguliert AMPK Aktivität Adiponectin ist ein 247 AS langes Peptidhormon, das exklusiv von Fettzellen ausgeschieden wird. Im Blut 3 Formen Bindet an Adiponectin Rezeptoren auf Leber und Muskelzellen -> Erhöht die Phosphorylierung und Aktivität von AMPK-> Regulation von Metabolismus Erhöhung der Insulinsensitivität, da Adiponectin und Insulin ähnliche Antworten in Zellen von Leber und Muskel hervorrufen. Erniederigtes Adiponectin is assoziiert mit Insulinresistenz Paradox: Je mehr Fetzellen, desto weniger Adiponectin im Blut. Fettzellen -> erhöht TNFalpha -> reduziert Adiponectin. Figure 22-12 15 12.12.2008 C. Leptin ist ein Sättigungshormon ‘Lipostat’ im Hypothalamus Mutante Mäuse -> defekte Gene die Fettleibigkeit verursachen können obese (ob) diabetes (db) Verbinden der Blutzirkulation zwischen Normalen und obese (ob/ob) Mäusen führt zur Normalisierung im mutanten Tier = Parabiose Voet BiochemistryPage 3e 1061 © 2004 John Wiley & Sons, Inc. ⇒ Zirkulierender Faktor verantwortlich Gleiches Experiment in db/db Mäusen ⇒ Erfolglos OB Gen kodiert für Leptin (leptos=dünn) Nur in Adipocyten exprimiert -> informant Für Hirn wenn genug Fett da ist.-> Leptin injektion in (ob/ob) Mäuse -> essen Weniger -> nehmen ab. Normal (OB/OB, left) and obese (ob/ob, right) mice. Leptin Behandlung von db/db Mäusen keine Wirkung -> DB= hypothet. Leptin Rezeptor? Expression cloning DB Gen codiert für leptin Rezeptor (OB-R). OB-R Gewebespezifische Splicevarianten Wenn Mutation -> leptinbindung und Signaltransduktion nicht möglich. -> Obese -> Leptinlevels im Serum hoch. -> Voet BiochemistryPage 3e 1062 © 2004 John Wiley & Sons, Inc. DB -> ‘Leptin’ Resistenz. X-Ray structure of human leptin-E100. Struktur ähnlich zu Cytokinen und Wachstumsfaktoren (4-Helix Bündel) Im Menschen Obesity nicht durch Leptinstörung, da mehr Adipocyten auch mehr Leptin produzieren. Wahrscheinlich ist viel mer eine Leptinresistenz, verursacht entweder durch geringere Rezeptor Mengen oder den Rezeptor der Leptin durch die Blut-Hirn Schranke transportiert. Erniedrigte Antwort auf Leptin führt zu hohen Konzentrationen von Neuropetid Y 16 12.12.2008 Von Hypothalamus sezerniert -> stimuliert Appetit -> Fettakkumulation. Leptin und Insulin inhibieren NPY Ausschüttung wenn sie an ihre Rezeptoren gebunden sind. Page 807 D. Ghrelin und PYY3-36 sind regulieren kurzzeitig Appetit Gastric peptide das Appetit stimuliert Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Bei fasten Ghrelin stimuliert und in Blut -> Nahrungsaufnahme. 17 12.12.2008 PYY3-36 Gastrointestinal Trakt Produziert PYY proportinal Zur Kalorienaufnahme. Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Infusion von PYY reduziert Kalorienaufnahme. Regulatoren: Insulin Leptin NPY Gastrointestinal Hormone: PYY Ghrelin Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Nahrungsabhängige Signlae: lange FS-CoA -> Nahrungsübersch. AMP-activated kinase AMPK -> Mangel AMPK inhibiert durch Insulin und Leptin, stimuliert durch ghrelin. AMPK aktiv FS-CoA werden oxidiert mTOR wird inaktiviert, welches leptin reguliert. 18 12.12.2008 Verarbeitung der Signale für Fettregulation und Sättigung im Hirn = Nucleus tractus solitarius Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. = Cholecytokinin (Morton et al., Nature, 2006) Hypothalamic integration of hormonal signals Neurons in the Arcuate Nucleus region of the hypothalamus integrate and transmit hunger signals Arcuate Nucleus: 2 Neuonal types that secrete different Peptides Neuropeptide Y (NPY) and Agouti related peptide (AgRP) -> stimulator of food intake. Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Pro-opiomelanocortin (POMC) -> induces release of α-melanocyte stimulating hormone (α-MSH) Cocaine and amphetamine-regulated transcript (CART) -> inhibitors of food intake and stimulators of energy expenditure Das Gelichgewicht der 2 Zelltypen ist kontrolliert durch: Leptin, insulin, ghrelin und PYY3-36 19 12.12.2008 Voet BiochemistryPage 3e 1064 © 2004 John Wiley & Sons, Inc. Hormone die den Appetit kontrollieren Leptinreceptors act through JAK/STAT pathway Hypothalamische neuronale circuits Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Gleichgewicht (Morton et al., Nature, 2006) 20 12.12.2008 E. Kontrolle des Energieverbrauchs durch adaptive Thermogenese Energie wird gebraucht um Arbeit zu verrichten und um Wärme zu produzieren. Ueberschüssige Energie als Glykogen oder Fett gespeichert. Mechanismus nötig um Fettleibigkeit zu verhindern. 2 Möglichkeiten: Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. 1) 2) Appetitkontrolle (hormonell) Nahrungsinduzierte Thermogenese = form von adaptiver Thermogenese Kälteinduzierte Thermogenese: -> abkoppeln der ATP Synthese von Protonengradient in oxidativer phosphorylierung durch uncoupling protein 1 (UCP1). UCP1 ist stimuliert durch freie Fettsäuren, welche vermehrt durch Noradrenalin induzierte Triacylglycerol lipase gebildet werden. Auch leptin induziert UCP1 das vor allem in braunem Fettgewebe vorkommt. . UCP2 (weisses Fettgewebe) und UCP3 (Muskel und braunes Fettgewebe) sind homologe mit ähnlicher Funktion wie UCP1 aber ob sie involviert sind in thermogenese ist unklar. 4. Störungen im Energiemetabolismus Nahrungsaufnahme nicht kontinuierlich -> Anpassung des Metabolismus an Fastenperioden Falschregulation von metabolischen Prozessen -> Diabetes und Obesity A. Fasten führt zu metabolischer Anpassung Absorbierte Brennstoffe werden sofort zugeteilt Proteine -> AS -> Proteinsysnthese -> bei viel AS -> Energieproduktion oder Glycogensynthese es gibt keine Speicherdepots für AS. Carbohydrate -> Glucose -> Energie oder Speichern in Form von Glycogen oder Fette FS -> triacylglyceridspeicher oder Energiegewinnung. Blutglucose bleibt fast konstant Die gegensätzliche Wirkung von Insulin und Glucagon stellen sicher, dass Glucose im Blut relativ konstant bleibt (kleine Tageszeitabhängige Schwankungen bleiben). 21 12.12.2008 Gluconeogenese stellt Glucoseversorgung während des Fastens sicher Langes Fasten -> Leberglycogenspeicher wird gelehrt. -> Gluconeogenese wird erhöht auch in Nieren Glucose kann nicht aus FS gemacht werden (Pyruvat und oxalacetat can not be made from acetyl-CoA) -> während Fasten -> Glucose aus glycerol (von fetten) aber noch wichtiger aus Proteinen -> Abbau von Muskel -> nicht ewiger Muskelabbau möglich -> alternativen Ketonkörper Figure 22-15 Ketonkörper werden die Hauptenergiequelle während längerem Fasten FS-> Acety-CoA -> Ketonkörper Das Hirn kann sich langsam an der Verbrauch von Ketonkörpern gewöhnen (muss neu Enzyme anschalten um Ketonkörper zu metabolisieren). -> Muskelabbau wird verringert nach Initiation von Ketonkörperproduktion -> Muskelabbau geht auf 25% zurück. -> Die Ueberlebenszeit eines Individuums hängt viel mehr von den Fettreserven ab als von der Muskelmasse. z.B. können schwer Uebergewichtige über ein Jahr ohne Nahrung auskommen. Restriktion in der Kalorienaufnahme verlängert möglicherweise das Leben Restriktion der Kalorienaufnahme um 30-40% führt in Nagern dazu, dass die Tiere eine bis zu 50% längere Lebenserwartung haben. -> Gebiet intensiver Forschung (hängt mit Insulin signaling zusammen, siehe Spezialvorlesung). 22 12.12.2008 B. Diabetes Mellitus is durch hohe Blutglukose levels charakterisiert Insulin nicht genug sekretiert oder Zielzellen werden durch Insulin nicht stimuliert. Konsequenz: Glukose in Blutstrom bleibt hoch und kann in Urin gelangen wo sie einfach nachgewiesen werden kann. Wenn Zielzellen nicht reagieren -> obwohl Insulin hoch -> Glukose hoch -> kann aber nicht in Zellen rein -> Zellen im Hungerzustand -> -> FS oxidation, Glukoneogenses -> Ketonkörperbildung -> abnormal hohe Ketonkörperkonzentration -> sind Säuren -> Pufferkapazität des Blutes runtergesetzt -> hohe H+, Ammonium, Na+, K+ und Phosphat excretion -> braucht viel Wasser -> Blutvolumen wird kleiner -> Durst. Insulin abhängiger Diabetes wird durch Verlust von pankreatischen beta-Zellen verursacht Dieser Typ I Diabetes durch autoimmunantwort Verursacht welche spezifisch beta Zellen im Pankreas tötet. -> tägliche Insulinspritzen nötig -> weniger präzise metabolische Kontrolle -> Lebenserwartung um etwa 1/3 herabgesetzt. -> hyperglycämie -> Glycosylierung von Linsenproteinen -> Katarakte. Andere Lösung als Insulinspritzen: transplantation von beta Zellen (macht aber immunsupressiva notwendig). Figure 22-16 23 12.12.2008 Insulin unabhängiger Diabetes kann durch Mangel an Insulinrezeptoren oder defekter Insulinsignaltransduktionskaskade verursacht werden Dieser Typ II Diabetes stellt 90% der Fälle dar. In Uebergewichtigen Individuen mit genetischer Prädisposition. Produzieren zwar Insulin aber Zellen antworten nicht darauf = Insulin Resistenz. Voet Biochemistry 3e © 2004 John Wiley & Sons, Inc. Hyperglycemia induziert Insulinproduktion -> hohe basallevels von Insulin erschweren Antwort von beta Zellen auf noch höhere levels von Glucose. Intrazelluläre Signaltransduktionskaskade von Insulin Ueberessen -> erhöht Insulinproduktion -> reduziert mit der Zeit die Produktion von Insulinrezeptoren -> schlechter Glukose Aufnahme. Lösung: Reduktion in der Aufnahme von Nahrung. Obesity führt zu mehr FS im Blut -> reduziert Insulin Signaling. Insulinreceptor Substrate werden nicht aktiviert -> Insulin Signaltransduktion reduziert. Figure 22-17 24 12.12.2008 Supprimiert Glucose Auschüttung der Leber AMPK phospohrylierung wird erhöht -> reduziert Gluconeogenese im Muskel und erhöht Glucose verbrauch in Muskel Fördert Insulin-Stimulierte Glukose im Muskel TDZ bindet an PPAR-gamma ein Transkriptionsfaktor der Adiponectinsynthese erhöht. -> erhöhung von AMPK Aktivität. -> weniger lipolyse, weniger FS export -> weniger FS in Blut -> weniger Insulinresistenz. Page 813 25





![Figure 14-1 Plot of ln[A] versus time for a first](http://s1.studylibde.com/store/data/011570233_1-88128775b0e44d7bbbef6452196ac987-300x300.png)




