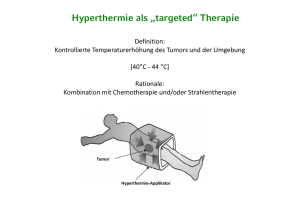
Lokoregionale Hyperthermie in Kombination mit Strahlentherapie
Werbung

AusderMedizinischenKlinikundPoliklinikIII derLudwig-Maximilian-UniversitätMünchen Direktor:Prof.Dr.W.Hiddemann LokoregionaleHyperthermieinKombinationmitStrahlentherapieoderChemotherapiebei MammakarzinomenundBrustwandrezidiven Dissertation zumErlangendesDoktorgradesderMedizin andermedizinischenFakultätder Ludwig-Maximilian-UniversitätzuMünchen vorgelegtvon NinaPernthaler ausBozen 2016 MitGenehmigungdermedizinischenFakultät derUniversitätMünchen Berichterstatter:Prof.Dr.RolfIssels Mitberichterstatter:Prof.Dr.ReinholdTiling Dekan:Prof.Dr.med.dent.ReinhardHickel TagdermündlichenPrüfung:14.6.2016 1 Inhaltsverzeichnis Seite 1EinführungundHintergrund 7 1.1DasMammakarzinomderFrau 7 1.1.1Epidemiologie 1.1.2Risikofaktoren 1.1.3Diagnostik 8 1.1.4Klinik 9 1.1.4.1Symptome 1.1.4.2Lokalisation 1.1.5Histopathologie 9 1.1.5.1HistologischeKlassifikation 1.1.5.2Hormonrezeptoren 10 1.1.5.3HER2/neu 1.1.5.4Grading 1.1.5.5Tumorstadien 1.1.5.6Resektionsränder 12 1.1.5.7Metastasierungswege 13 1.1.6Prognosefaktoren(aktuell2014) 13 14 14 15 16 1.1.6.1AllgemeinePrognosefaktoren 1.1.6.2GenetikundBRCA1/BRCA2 1.1.7Therapie 1.1.7.1PrimäreTherapie: 1.1.7.1.1ChirurgischeTherapie 1.1.7.1.2Strahlentherapie 1.1.7.1.3Chemotherapie 1.1.7.1.4EndokrineTherapie 2 1.1.7.1.5Antikörpertherapie 1.1.7.2PalliativeTherapie 16 1.2DieHyperthermie 17 1.2.1Einleitung 1.2.2Geschichte 1.2.3LokoregionaleHyperthermiebeiBrustwandrezidiven 18 desMammakarzinoms–bisherigeErgebnisse 1.2.4LokoregionaleHyperthermieimBrustwandbereich 19 1.2.4.1Hyperthermieplanung 1.2.4.2Behandlung 1.2.5Wirkmechanismus 20 21 1.2.5.1Radiosensitivierung 1.2.5.2Chemosensitivierung 1.2.5.3DirekteZytotoxizität 1.2.6Nebenwirkungen 22 1.2.7Kontraindikationen 22 23 3PatientenundMethoden 24 3.1Patientenkollektiv 3.2Auswertung 25 2FragestellungenundZiele 3.3Behandlungsübersicht 3 3.5Hyperthermie-Ablauf 26 3.6Hyperthermie-VerfahrenundverwendeteGeräte 3.7Routineuntersuchungen 27 3.8DefinitionderToxizität 3.9KarnofskyIndex 28 3.10Dosisreduktion 29 3.11DatenerfassungundAuswertung 3.12DokumentationundverwendeteSoftware 30 4Ergebnisse 31 4.1Patientencharakteristika 31 4.2Behandlung 31 4.2.1ÜberlebensparameterfürPatientinnenmitRadiotherapie 4.2.1.1Insgesamt 4.2.1.2InAbhängigkeitvonVortherapien 4.2.1.3InAbhängigkeitvonHormonrezeptor-Status 31 33 34 4.2.1.4InAbhängigkeitvonHer2neuÜberexpression 35 4.2.1.5InAbhängigkeitvonadj.vs.neoadj.Therapie 36 4.2.1.6InAbhängigkeitvonMetastasierung 38 4.2.2ÜberlebensparameterfürPatientinnenmitChemotherapie 4.3ToxizitätderTherapie 40 42 42 4.3.1HämatologischeToxizität 4.3.1.1Anämie 4.3.1.2Thrombozytopenie 4.3.1.3Leukopenie 4.3.1.4Nephrotoxizität 4 4.3.2Nicht-hämatologischeToxizität 4.3.2.1Verbrennungen 4.3.2.2FieberundInfektionen 4.3.2.3ÜbelkeitundErbrechen 43 43 4.3.2.4Alopezie 4.3.3Hyperthermie-assoziierteToxizität 4.3.3.1Hyperthermie-bedingteSchmerzen 4.3.3.2LagerungsbedingteSchmerzen 4.4DurchführbarkeitderTherapie 43 4.4.2GründefüreinenTherapieabbruch 45 46 5.3DiskussionderErgebnissedervorliegendenretrospektivenAnalyse 47 4.4.1Dosisreduktion 5Diskussion 5.1Einleitung 5.2Hyperthermie 5.3.1ErgebnisseüberdieWirksamkeitderHyperthermie beiStrahlentherapie-PatientenundChemotherapie-Patienten 5.3.1.1EinflussfaktorenaufdieErgebnisse 5.3.1.1.1Grading 48 5.3.1.1.2Linie 5.3.1.1.3Her2neu-Status 5.3.1.1.4Tumorstadium 5.3.1.1.5Metastasen 5.3.1.1.6NeoadjuvanteTherapievs.AduvanteTherapie 49 5.3.1.1.7Hormonrezeptor-Status 50 5 5.3.1.2RadiatiomitHyperthermievs. ChemotherapiemitHyperthermie 50 5.3.1.3FazitüberdieWirksamkeitderHyperthermie 51 5.3.2VerträglichkeitundDurchführbarkeit 5.3.2.1Toxizität 51 52 5.3.2.1.1HämatologischeToxizität 5.3.2.1.2Nicht-hämatologischeToxizität 5.3.2.1.3Hyperthermie-assoziierteToxizität 53 5.3.2.3FazitVerträglichkeitundDurchführbarkeit 53 5.3.2.2Durchführbarkeit 5.4Ausblick 54 6Zusammenfassung 55 7Anhang 57 8Literaturverzeichnis 61 9Danksagung 66 6 1EinführungundHintergrund 1.1DasMammakarzinomderFrau 1.1.1Epidemiologie DasMammakarzinomist-imGegensatzzumsehrseltenauftretendenMammakarzinomdesMannes -dashäufigsteMalignomderFrauundstelltmiteinerInzidenzvonetwa610/100.000Einwohner proJahrinDeutschlandeinernstzunehmendesGesundheitsproblemdar.DieInzidenziststeigend, dieMortalitätnimmtjedochinderEuropäischenUnionunddenUSAaufgrundeinerfrüheren DiagnosestellungundderVerbesserungdermedikamentösenTherapieab(Bauerfeind,2009;Sauer, 2010). 1.1.2Risikofaktoren “BeiallgemeinhohemErkrankungsrisikoinderweiblichenBevölkerungvon7–12%sindGruppen vonFrauenmiterhöhtemMammakarzinom-Risikodefiniert: - FrauenmitfamiliärerBelastung(RisikoeinschätzunginAbhängigkeitvonUmfangundGrad derVerwandtschaft) FrauenmitbereitsaufgetretenenBrusterkrankungenundPräkanzerosen FrauenimhöherenLebensalteraufgrundderAltersverteilungdesMammakarzinoms (Erkrankungsgipfel>60.Lebensjahr)beisteigendhoherLebenserwartung.“(Bauerfeind 2009) WeiteregesicherteRisikofaktorensindkonstitutionelleFaktorenwiederbody-mass-Indexund körperlicheAktivität,derMenopausenstatusundReproduktivitätscharakteristikawiedieAnzahlder GeburtenunddasAlterbeiderersterGeburt.(Kaaksetal.,2005;Phippsetal2010). EinepositiveFamilienanamneseerhöhtdasErkrankungsrisikofüreinMammakarzinomumetwadas Zweifache,beierstgradigenVerwandtenistdiesesRisikohöheralsbeizweit-odermehrgradigen Verwandten.EinewesentlicheRollefürdasgenetischeRisikospieltdieMutationderBrustkrebsSuszeptibilitätsgenebreastcancer1(BRCA1)undbreastcancer2(BRCA2).Sieregulierenals TumorsuppressorgenedasWachstumunddieDifferenzierungimBrustepithel(Mavaddatetal., 2010).BeieinerBRCA1/2MutationliegtdieErkrankungswahrscheinlichkeitfürBrustkrebsbiszum 80.Lebensjahrbei30-80%. DieSubstitutionvonHormoneninderPostmenopauseistindenletztenJahrendurchentsprechende StudiendatenzurErhöhungdesMammakarzinom-RisikosindenFokusderKritikgeraten.Ineinigen StudienwurdedieHormonersatztherapiealseinerderentscheidendenRisikofaktorenbeider EntstehungdesMammakarzinomsuntersucht.(Cancer,1997;CollaborativeGrouponHormonal FactorsinBreast,2001;Collins,Blake,&Crosignani,2005).EineStudievonEisenetal(2008)zeigte hingegeneinenprotektivenEffektderHormonersatztherapiebeipostmenopausalemBRCA1- positivenMutationsträgerinnen. 7 RisikotabellefürdieEntwicklungeinesMammakarzinoms Risikofaktor RelativesRisiko 1Fall(Verwandte1.Grades) 2,6-2,8 2Fälle(Verwandte1.Grades 4,2-6,8 AlterbeiMenopause <45Jahre 1,0 >55Jahre 2,0 Alterbei1.Geburt <20Jahre 1,0 >30Jahre 1,9 Nullipara 1,5 Kombinationen RR<50Jahre RR>50Jahre EineBiopsiewegeneinesverdächtigenMammabefundes 1,7 1,3 1Verwandte+1eigeneBiopsie 4,4 3,3 1Verwandte+1eigeneBiopsien+1.Geburt>30+Menarche<12 5,8 4,2 Familienanamnese Tabelleaus„DieOnkologie“(Hiddemann,Bertram,2.Auflage,S.954) 1.1.3Diagnostik DieDiagnostikbeinhaltetdieAnamnese,diekörperlicheUntersuchung,dieLaborchemieunddie apparativeDiagnostik. BeiderAnamnesewirdaufdiefamiliäreVorbelastungundaufeineeventuellbestehendeB– Symptomatik(Fieber,Nachtschweiß,Gewichtsverlust)geachtet.BeiderkörperlichenUntersuchung istdiePalpationderBrustundderAxillabeidseitsStandard.DabeiwirdnebenpalpablenKnotenauf weiteremalignitätsverdächtigeVeränderungenderBrustgeachtet,zudeneneineeingezogeneoder sekretierendeMamilleoderexzematöseHautveränderungenzählen. 8 DieapparativeDiagnostikbestehtprimärinderSonografiederBrustundderMammografie.Als schnelleundkostengünstigeMethode,dieohneionisierendeStrahlungarbeitet,istdieSonografie MittelersterWahlbeiderDiagnostikeinespalpablenKnotensderMamma.Siedientder DifferenzierungzwischenbindegewebigenVerdichtungenoderZysten,wiesieinsbesonderebei jungenPatientinnenhäufigvorkommen,undeinersolidenRaumforderung. DieMammografieistdieUntersuchungmitderhöchstenSensitivitätunterdenbildgebenden Verfahren.SieermöglichtalseinzigeBildgebungdieDiagnoseeinesMammakarzinomsim FrühstadiumundwirdbeiBestehenvonRisikofaktorenundabeinemAltervon50Jahrenals „Screening“angewandt.DieStrahlenbelastungliegtbei2-5mSvproMammografie(Bauerfeind,2009; Shrimpton,Hillier,Lewis,&Dunn,2005).MammagrafischeAnhaltspunktefüreinMalignomderBrust sindvorallemderNachweiseinerGewebsvermehrungunddasVorhandenseinvongruppierten Mikrokalzifikationen.VerdächtigsindaucheineVeränderungenderDrüsenarchitektur,die VergrößerungeinesGangesundasymmetrischeMammae. DabeiguterSensitivitätdieSpezifitätderMRTlediglichbeietwa70%liegt,wirddiesesVerfahren nurinAusnahmefällen,wiez.B.demVorliegeneinesBrustimplantats,gewählt.DieSkelettSzintigrafiedientderDetektionvonKnochenmetastasen(Dempke,2006). BeiMalignitätsverdachtwirdeineBiopsiedernachgewiesenenStrukturveränderungangestrebt. StandardsinddieStanzbiopsieunddieVakuumbiopsie. 1.1.4Klinik 1.1.4.1Symptome KlinischpräsentierensichdiePatientenjenachZeitrahmendervorbestehendenErkrankungmit einempalpablenBefundderMammaodermitSymptomenderMetastasierung.Häufigsinddie PatientenjedochklinischunauffälligundwerdeninVorsorgeuntersuchungenerfasst. 1.1.4.2Lokalisation DerüberwiegendeAnteilderMammakarzinomebefindetsichimoberenäußerenQuadranten(49%), gefolgtvonderMamilla(17%)unddemobereninnerenQuadranten(16%).MiteinemAnteilvon6 %sindMammakarzinomeimunterenäußerenQuadrantendagegenselten.Entsprechendder LokalisationdesMammakarzinomsunterscheidetsichderlymphatischeMetastasierungsweg. 1.1.5Histopathologie 1.1.5.1HistologischeKlassifikation Histopathologischlassensichdasinvasive(85-95%)unddasnicht-invasiveMammakarzinom(5-15%, Carcinomainsitu)unterscheiden.DasducaleCarcinomainsitu(DCIS)wirdalsunmittelbarer VorläuferdesinvasivenKarzinomsbeschrieben.DurchseinehäufigeAssoziationzumammografisch detektierbarenMikrokalzifikationenistderAnteilandenDCISzudenneudiagnostizierten Mammakarzinomenstetiggestiegen(Petru,Jonat,Fink,&Köchli,2005).Dasinvasiv-ductale 9 MammakarzinomistmiteinemAnteilvon65-80%derhäufigsteTyp;außerdemgibtesinvasive Subtypen(lobulärestubuläres,medulläres,papilläresundmuzinösesKarzinom),diesichinihrem klinischenVerlaufundihrerTherapieempfindlichkeitunterscheiden.(Guarneri&Conte,2004;Sauer, 2010). DasinflammatorischeMammakarzinomlässtsichklinischoftschwervoneinerMastitis unterscheidenundtrittseltenauf.EsistdurcheinenaggressivVerlaufmitfrüherAusbreitungder malignenZellenentlangderLymphspaltenderHaut(lymphangiosiscarcinomatosa)charakterisiert. 1.1.5.2Hormonrezeptoren “BeialleninvasivenMammakarzinomenundi.d.R.auchbeieinemDCISistimRahmender PrimärdiagnostikdieBestimmungdesÖstrogenrezeptorsundProgesteronrezeptorsobligat durchzuführen“(Bauerfeind,2009).DerHormonrezeptor-StatusistprädiktivfürdasAnsprechenauf eineadjuvanteendokrineTherapieundhatsomiteineentscheidendeAuswirkungaufdiePrognose desTumors.DabeiwirdalsGrenzwertderhormonsensitivenTumoreeineimmunhistochemische Anfärbungvon>10%derZellkernefestgelegt. 1.1.5.3HER2/neu HER2/neu(Humanepidermalgrowthreceptor2)gehörtzurGruppederWachstumsfaktorRezeptoren.20-30%dermetastatischenBrusttumorezeigeneineHER2/neuÜberexpression.In zahlreichenStudienwirddieserÜberexpressionunteranderemZellzyklus-regulierende SignalwegstörungenundeineHemmungderApoptosezugeschrieben.ZudemsindmitHER2/neu einigenegativePrognosefaktorenassoziiert,zudeneneinschnellesTumorwachstum,einTrendzu RezidivenundeinschlechtesAnsprechenaufdieStandard–Chemotherapiemitkonsekutiv verringerterÜberlebenszeitgehören(Gorietal.,2004;Untch,2010;Wangetal.,2000).EinTumor hatabeinemimmunhistochemischenScorevon2+,derdurchdieFloureszenz-in-situ-Hybridisierung (FISH)oderdurchdieChromogen-in-situ-Hybridisierung(CISH)bewertetwird,eineschwache HER2/neuÜberexpression,abeinemScorevon3+giltdieÜberexpressionvonHER2/neualsstark (Hiddemann&Bartram,2010). Patientinnen,diewederpositivfürHormonrezeptorensind,nocheineÜberexpressionvonHER2/neu aufweisen,werdeninderLiteraturals„triplenegativebreastcancer“beschrieben.Siehabeneine schlechtePrognose,sindschwierigzubehandelnundhabeneinhohesRezidivrisiko(Carey,2010). 1.1.5.4Grading BeiderEinteilungeinesTumorsnachdemGradseinerDifferenzierung(Grading)wirdaufdie AusprägungderEntwicklungvontubulärerStrukturen,aufdasAuftretenvonKernpolymorphienund aufdieMitoserategeachtet.DementsprechendgibtesgutdifferenzierteTumoremitdemGrading1 (G1),mäßigdifferenzierteG2-Tumoreundschlechtdifferenzierte,hochmaligneG3-Tumore 1.1.5.5Tumorstadien DasTNM-StadiumgibtAuskunftüberdieklinische(c)unddiepathologische(p)GrößedesTumors (T),denLymphknotenbefall(N)undeineFernmetastasierung(M).BeieinemMammakarzinommit multiplenMalignomknotenwirddemTumorstadiumdasSuffix„m“hinzugefügt,beieinervaskulären InfiltrationdasSuffix„v“.AuchderLymphknotenbefallNkannweiterdifferenziertwerden:N1 10 beschreibteineMetastasierunginipsilateraleaxilläreLymphknoten,N2beschreibtipsilaterale axilläreLymphknoten,dieanStrukturenfixiertsindoderLymphknoten,dieentlangderA.mammaria verlaufen.IpsilateraleinfraklaviculäeLymphknotenoderdasgleichzeitigeAuftretenvonaxillärenund A.mammaria–LymphknotenwerdenalsN3charakterisiert.DerBegriff„nodalnegativ“beschreibt einentumorfreienLymphknotenstatus,N0. TNMStadiendesMammakarzinoms T-Primärtumor Tx Primärtumornichtbeurteilbar T0 KeinAnhaltfürPrimärtumor Tis Carcinomainsitu T1 Tumor2cmoderwenigeringrößterAusdehnung T1mic Microinvasionvon0,1cmoderwenigeringrößter Ausdehnung T1a >0,1cmabernicht>0,5cmingrößterAusdehnung T1b >0,5cmabernicht>1cmingrößterAusdehnung T1c >1cmabernicht>2cmingrößterAusdehnung T2 >2cmabernicht>als5cm T3 Tumor>5cmingrößterAusdehnung T4 TumorjeglicherGrößemitdirekterAusdehnungauf BrustwandoderHaut T4a MitAusdehnungaufdieBrustwand T4b MitÖdem,UlzerationderBrusthautoder SatellitenmetastasenderHautderselbenBrust T4c T4aundT4bgemeinsam T4d InflammatorischesMammakarzinom N–regionäreLymphknoten Nx Lymphknotennichtbeurteilbar N0 KeinAnhaltfürLymphknotenmetastasen N1mic Micrometastase:<0,2mmabernicht>2mmingrößter Ausdehnung N1 Metastase(n)in1–3ipsilateralenaxillären Lymphknotenund/oderipsilateraleLymphknoten entlangderA.mammariainternamit mikroskopischer(en)Metastase(n),diebeider 11 Sentinel- Lymphknoten-Dissektionentdecktwurden,abernicht klinischerkennbarbwaren N2 Metastase(n)in4–9ipsilateralenaxillären Lymphknotenoderinklinischerkennbarenc ipsilateralen LymphknotenentlangderA.mammariainternaohne axilläreLymphknotenmetastasen N3 Metastaseninmindestens10ipsilateralenaxillären Lymphknoten;oderinipsilateraleninfraklavikulären Lymphknoten;oderinklinischerkennbaren LymphknotenentlangderA. mammariainternamitmindestenseineraxillären Lymphknotenmetastase;odermehrals3 axilläreLymphknotenmetastasenmitklinischnicht erkennbarer(en),mikroskopisch nachweisbarer(en)Metastase(n)inLymphknoten entlangderA.mammariainterna;oder Metastase(n)inipsilateralensupraklavikulären Lymphknoten M–Fernmetastasen Mx Vorliegenvonfernmetastasenkannnichtbeurteilt werden M0 KeinAnhaltfürFernmetastasen M1 Fernmetastasen 1.1.5.6Resektionsränder NachExzisioneinesTumorsmussinderHistopathologiefestgestelltwerden,obderTumor vollständigentferntwurde.ZudiesemZweckwirddasPräparathistologischaufseineTumorfreiheit andenExzisionsrändernuntersucht.EinResektionsstatusR0bedeutet,dassderTumorimGesunden reseziertwurde,R1beschreibteinTumorpräparat,aufdessenRändernmikroskopischTumorzellen nachgewiesenwerdenkönnenundR2isteinExzisionspräparat,beidembereitsmakroskopisch erkennbarist,dassderTumornichtvollständigentferntwurde. 12 1.1.5.7Metastasierungswege AbhängigvonderhistomorphologischenundbiologischenCharakteristikkanneineMetastasierung bereitsfrüherfolgen.AmHäufigstenmetastasiertdasMammakarzinomlymphogenindieAxillaund hämatogeninLeberundLunge(zusammen50-75%).DesWeiteren,miteinemAnteilam Metastasierungsverhaltenvon25-49%,sinddiePleura,dasSkelett,dieHautunddieNebenniere betroffen.InandereOrganemetastasiertdasMammakarzinomin5-20%,dazugehörtbeispielsweise daszentraleNervensystem(Hiddemann&Bartram,2009). 1.1.6Prognosefaktoren 1.1.6.1AllgemeinePrognosefaktoren SeitderKonsensuskonferenzvonSt.Gallen2009wirdeineEinteilungdesMammakarzinomsindrei Risikogruppenempfohlen.AlsFaktorenfürdieEinschätzungdesVerlaufeseinesMammakarzinoms werdendieTumorgröße,derNodalstatus,derHormonrezeptor-undHER2/neu-Status,das AuftretenvonGefäßinvasion,dasGradingunddasAltergenannt. Risikogruppen(Konsensuskonferenz,St.Gallen2009) Risiko Charakteristik Lowrisk nodalnegativ;dieTumorgrößeliegtunter1cm,die Hormonrezeptorensindpositiv,HER2/neuist negativ.DerTumormussimGradingeinemG1 Tumorentsprechen,diePatientinmussüber35 JahrealtseinundesdarfkeineAnzeichenfüreine Gefäßinvasiongeben. Indermediaterisk Nodalnegativ,wobeidieanderenobengenannten Kriteriennichterfülltseinmüssen.AuchTumoremit 1-3befallenenLymphknoten,abereinemnegativen HER2/neu-StatusgehörenindieseGruppe. Highrisk Alleanderen EinweitererPrognosefaktorkanndurchdieSubtypisierungdesÖstrogen-RezeptorsinLuminal-Aund Luminal-Bgewonnenwerden.TumoremitÖstrogen-Rezeptor-SubtypLuminal-Bhabeneinehöhere ProliferationsrateundeineschlechterePrognose(Cheangetal.,2009).DieDifferenzierungvon Luminal-A-undLuminal-B-TumorenberuhtlautdenderzeitgültigenEmpfehlungenaufeinem 14%igenCut-off-WertdesProliferationsmarkersKi67.(KonsensuskonferenzSt.Gallen2013) 1.1.6.2GenetikundBRCA1/BRCA2 DieFernmetastasierungvonMammakarzinomenistdieHauptursachefürdiehoheMortalitätsrate dieserTumore.InderaktuellenForschungwerdendeshalbGenprofileuntersucht,diebereitszum 13 ZeitpunktderDiagnoseeineAussagebezüglichdesVerlaufsundderPrognoseeines Mammakarzinomserlauben,mitdemZiel,dieanschließendeBehandlungsstrategieindividuell anzupassen.Dabeisindinsbesonderedie70-Gen-Signatur(Mammaprint)undder21-GenRezidivscore(Onkotype)zunennen.DieseTestsuntersuchenGene,diebeimZellzyklus,der Ausbreitung,derMetastasierungundderAngiogenesedesTumorseineRollespielen.(Hartmann, Gerber,Elling,Heintze,&Reimer,2012;Manjili,Najarian,&Wang,2012).InderNSABPB14Studie hattenPatientenmiteinemniedrigen21-Gen-Rezidivscore(Oncotype)einRisikovon6,8%für Fernmetastasen,beiPatientenmiteinemhohenRezidivscorelagdiesesRisikobei30,5%(Paiketal., 2004). 1.1.7Therapie: DiezeitlicheAbfolgederKomponenteneinerMammakarzinom-Therapieistindividuell unterschiedlichundallenvoranabhängigvondenRisikofaktoren.Grundsätzlichstehendie chirurgischeResektiondesTumors,dieneoadjuvanteoderadjuvanteChemo-,Hormon-und StrahlentherapiesowiediepalliativeTherapiezurAuswahl. 1.1.7.1PrimäreTherapie 1.1.7.1.1ChirurgischeTherapie DiechirurgischeTherapiebestehtinderbrusterhaltendenTherapieunddermodifiziertenradikalen Mastektomie. BrusterhaltendeTherapie(BET): TrotzgroßerErfolgeinderChemo-,Hormon-undRadiotherapiebleibtdieChirurgiederwichtigste TeilderkurativenTherapie(Verkooijenetal.,2005).Esgilt,dassnichtdieRadikalitäteiner operativenExzisiondesMammakarzinomsdasÜberlebenderPatientenverlängert,sondernallen voran,obderTumorzumDiagnosezeitpunktmetastasierthat.DaherhatsichdieSentinelLymphknoten-BiopsiemitbrusterhaltenderTherapie(BET)inKombinationmiteinerpostoperativen RadiatioalsStandardverfahrendurchgesetzt.UnterderVoraussetzung,dassderTumorwederHaut oderMuskulaturinfiltriert,nocheineretromammilläreoderzentraleLokalisationdesTumors vorliegt,wirdeinelokaleTumorentfernungunterErhaltderBrustvorgenommen.„EineSentinelLymphknoten-BiopsiewirdalsStandarderachtetbeiklinischnegativerAxilla.EineAxilladissektion solltebeiallenPatientinnenmitnegativemSentinel-LymphknotenundausgewähltenPatientinnen mitlediglichmikroskopischemoderEinzelzell-Befallvermiedenwerden.“(KonsensuskonferenzSt. Gallen,2009) DurchdieSentinel-Techniksollgeklärtwerden,obdasMammakarzinombereitslymphogen metastasierthat.DazuwirdeinFarbstoffoderradioaktiv-markiertesTechnetiumvorderOperation peritumoralsubdermalinjiziert.DersomarkierteLymphknotenkannentwederdurchseineFarbe oderdurchseineRadioaktivitätmiteinerGamma-Hand-Sondedetektiertwerden.Anschließendwird dieserersteLymphknotendesAbflussgebietes(Sentinel-Lymphknoten)entferntundhistologisch 14 begutachtet.BeiTumorfreiheitdesLymphknotenskannaufeineAxilla-Dissektionverzichtetwerden (Petruetal.,2005). ModifizierteradikaleMastekomie(MRM): WenndieVoraussetzungenfüreineBETnichtgegebensind,beispielsweisebeieinerungünstigen RelationzwischenTumorgrößeundBrustvolumen,wirdeinemodifizierteradikaleMastektomie (MRM)vorgenommen.DurchdiesesVerfahrensollenFolgeschäden,wiesiebeiderradikalen klassischenMastektomieentstehen,minimiertwerden.EswerdendergesamteBrustdrüsenkörper, dieMamilleunddiePectoralisfasziereseziert,sowiedieaxillärenLymphknotendesLevelsI (subscapulär,interpectoral,pectoral)unddesLevelsII(apikal,zentral).DieMRMisttrotzder erheblichenpsychologischenBelastungderPatientininetwa20-30%derFälledieMethodeder Wahl. 1.1.7.1.2Strahlentherapie EineadjuvanteRadiatioistnachbrusterhaltenderTherapieobligat.DieDosissollca.50Gybei konventionellerFraktionierungbetragen(5×1,8-2,0Gy/Woche).BeiausgedehnterLymphknotenMetastasierungoderR2ResektionwirdzudemdieAxillabestrahlt.(Abu-HamarAeletal.,2010; Williamsetal.,2011).EinelokaleDosisaufsättigung(Boost-Bestrahlung)desTumorbettessenktdie lokaleRezidivrateinderBrust,bewirktjedochkeinenÜberlebensvorteil.DieempfohleneBoost-Dosis beträgt(10-)16GyinkonventionellerFraktionierung(5x1,8-2,0Gy/Woche).(AGO-S3Leitlinie2012) LediglichbeipräinvasivenTumoren(DCIS)kannbeieinerGröße<2cm,einemNon-high-grade KarzinomundeinemResektionsrand>1cmaufeineadjuvanteStrahlentherapieverzichtetwerden (Petruetal.,2005). 1.1.7.1.3Chemotherapie IsteineChemotherapieindiziert,kanndiesevorderOperation(neoadjuvant)oderdanach(adjuvant) durchgeführtwerden.BeideVerfahrensindhinsichtlichdesGesamtüberlebensgleichwertig.Die neoadjuvanteTherapiekannzueinerhöherenRateanbrusterhaltendenTherapienführen.Zuden erfolreicheingesetztenZytostatikabeimMammakarzinomzählendieGruppederAnthrazykline (Doxorubicin,Epirubicin),derTaxane(Paclitaxel,Docetaxel),FluorouracilundCyclophosphamid.Das bevorzugteChemotherapie-SchemaistFEC/DOCmitdenKomponentenFluorouracil,Epirubcinund Cyclophosphamid,dasmitDocetaxelkombiniertwird. NeuadjuvanteChemotherapie:GemässdenAGO-Leitlinienvon2013wirddieneoadjuvante(primäre, präoperative)systemischeTherapiealsdieStandardbehandlungbeiPatientinnenmitlokal fortgeschrittenen,primärinoperablenoderinflammatorischenMammakarzinomenimRahmeneines multimodalenTherapiekonzeptesangesehen.Als„lokalfortgeschritten“geltenTumoremiteinem Durchmesservonmehrals5cm,Haut–oderThoraxwandmetastasenundeinemultiple Lymphknoten-Metastasierung.(Shenkieretal.,2004).WennneoadjuvanteineChemotherapieKombinationzumEinsatzkommt,solltedieseeinAnthrazyklinundeinTaxan(beiHER2-Positivität 15 Trastuzumab)enthalten.DieDauerderpräoperativenTherapiesollte6-8Zyklen(entspr.18-24 Wochen)betragen. AdjuvanteChemotherapie:EineIndikationfüreineadjuvanteChemotherapiebestehtbeiHER2positivenTumoren,beiendokrinnichtsensitivenTumoren(ERundPRnegativ),beinodal-positiven Tumorenodernodal-negativenTumorenmithohemRezidivrisiko,beiG3Tumorenundbeijungem Erkrankungsalter(<35Jahre).DieadjuvanteChemotherapiesollteeinTaxanenthalten.Eine anthrazyklin-undtaxanhaltigeadjuvanteStandard-Chemotherapiedauert18-24Wochen. 1.1.7.1.4EndokrineTherapie DerselektiveÖstrogenrezeptormodulator(SERM)TamoxifenistderammeistenbenutzteWirkstoff inderHormontherapie.TamoxifenwirktantagonistischimBrustgewebe,agonistischjedochim KnochenundhatsomiteinenpositivenEffektaufdieKnochendichte.BeiPatientinnenmitöstrogen- und/oderprogesteronrezeptor-positivenTumorenisteineendokrineBehandlungklarindiziert.Bei prämenopausalenPatientinnenistTamoxifendieendokrineTherapiederWahl.Dieantiöstrogene TherapiemitTamoxifen20mgproTagsollübereineZeitdauervon5Jahrenbzw.biszumRezidiv erfolgen.BeipostmenopausalenFrauensindAromatasehemmerder3.Generation(z.B.Anastrozol) demTamoxifenhinsichtlichdeskrankheitsfreienÜberlebensüberlegen.Eskönnendabei verschiedeneendokrineTherapieschematazumEinsatzkommen,z.B.2–3JahreTamoxifen,gefolgt vonAromatasehemmernbiszueinerGesamttherapiedauervon5Jahren;oder5Jahre Tamoxifentherapiegefolgtvon5JahrenAromatasehemmern. 1.1.7.1.5Antikörpertherapie DermonoklonaleAntikörperTrastuzumabrichtetsichgegendenHER2/neu-Rezeptorundhemmt dadurchdasdurchHER2/neugetriggerteWachstumdesTumors.Erhatzudemeinezytotoxische AktivitätgegenüberZellen,dieHer2neuüberexprimieren(Komarovaetal.,2011).Patientinnenmit HER2-überexprimierendenTumorenmiteinemDurchmesser≥1cmsolleneine(neo-)adjuvante BehandlungmitTrastuzumabüber1Jahrerhalten.DieadjuvanteBehandlungmitTrastuzumabsollte vorzugsweisegleichzeitigmitderTaxan-PhasederadjuvantenChemotherapiebegonnenwerden. 1.1.7.2PalliativeTherapie ZurpalliativenTherapiegehörenMaßnahmen,diezurVerbesserungderLebensqualität,zur SchmerzreduktionundzurSymptomkontrollebeitragen.Dazugehörenpatientenadaptierte Therapien,mitdeneneineBeschwerdelinderungbeimöglichstgeringerToxizitäterreichtwerden will.ImGegensatzzurneoadjuvantenoderajuvantenTherapiegilthierkeinkurativerAnsatz. 16 1.2Hyperthermie 1.2.1Einleitung UnterregionalerHyperthermieverstehtmandieErwärmungeinesTumorgebietesdurchäußere ApplikatorenaufTemperaturenvon40-44°C.Bereitsabca.42,5°CwirktWärmezytotoxisch,siehat ineinemBereichvon40–43°CaberaucheinenadditivenEffektaufChemo–undRadiotherapie (Hiddemannetal.,2009;Ott,Issels&Wessalovski,2010). GrundsätzlichbestehtdieMöglichkeitderlokoregionalenHyperthermie,derregionalen TiefenhyperthermieundderGanzkörperhyperthermie.DaindervorliegendenArbeitDatenzur lokoregionalenHyperthermieverwendetwerden,wirdaufdieBeschreibungderanderen Hyperthermie-Verfahrenverzichtet. 1.2.2VorgeschichteundStandderklinischenStudien Endedes19.JahrhundertentdecktederChirurgWilliamColey,dassPatienten,dienachihrer operativenTumorentfernungeinepostoperativeInfektionentwickelten,einebessere Überlebensratezeigten,dadurchdieInfektioneineImmunantworthervorgerufenwurde.Es entstandderGrundsteinderÜberlegungenzurbesserenTumorkontrolledurchdieAktivierungdes Immunsystems.AmAnfangdes20.JahrhundertserforschteneinigeWissenschaftler(Doyen,E., 1910,Müller,C.1913),dassgewissemenschlicheTumorendurchErhitzungmitTemperaturenunter 55°Cselektivzerstörtwerdenkönnen.1963wiesCrilediebiologischenEffektedererhöhten TemperaturenimTumorgebietkonkretnach.Inden70gerJahrenbemerkteman,dasseinestrikte KorrelationzwischenTemperaturundWachstumsgeschwindigkeitinTumorzellenbesteht,undzwar beigutverträglichenTemperaturenzwischen40°Cund43°C.AußerdemwurdedieHyperthermieals potenterSensitiviererfürStrahlen-undChemotherapieentdecktundsokonntemaneinen zusätzlichenNutzeninderTumortherapienachweisen(LindneretIssels,2011). 2010konnteindererstenrandomisiertenPhase-III-Studiegezeigtwerden,dassdieregionale HyperthermiedenNutzenderChemotherapiebeimWeichteilsarkomverbessert.Dieregionale HyperthermiewurdedaraufhinindenESMO-Guidelines(2012)aufgenommenundzähltheutezuden leitliniengerechtenTherapieverfahrenbeiWeichteilsarkomen.(Isselsetal.,2010) 1996wurdendieErgebnissevonfünfrandomisiertenStudienüberdieWirksamkeiteiner StrahlentherapieinKombinationmitHyperthermiebeiBrustkarzinomenveröffentlicht.Die untersuchtenPatientenhattenentwederfortgeschrittenenPrimärtumorenoderRezidiveander Brustwand.Diecompleteresponserate(CR)war41%fürdiealleinigeRadiatioimUnterschiedzu59 %fürRadiatiomitHyperthermie(OR2,3).DerEffektwarabhängigvonderGrößedesTumors: Tumore<16cm²hattenCRvon70%,Tumore>16cm²hingegen45%.AußerdemwardieWirkung abhängigvonderTiefederTumorlokalisationunddemVorliegenvonFernmetastasen.Patientenmit FernmetastasenhatteneinehöhereTodesrate,sodassdieAutorenannahmen,dasssieanden Fernmetastasenverstarben,ohnedassdienötigeZeitbestand,dieWirkungderTherapieim Tumorgebietzuerkennen.DengrößtenEffektzeigtedieHyperthermiebeiPatienten,diebereits vorbestrahltwaren:BeinichtvorbestrahltenPatientenwarendieErgebnissevergleichbar, 17 unabhängigdavon,obdieRadiatioalleineoderinKombinationmitHyperthermieverabreichtwurde. BeivorbestrahltenPatientenhattedieGruppemitalleinigerRadiatioeineCRvon31%,danur palliativeStrahlendosengegebenwerdenkonnten,dieKombinationsgruppedagegenhatteeineCR von57%(p<0,01).DiePatientenmitalleinigerRadiatiohattenin31%derFälleeinelokale Progression,diePatientenmitHyperthermiein17%derFälle.ImDPFSundOSzeigteninsgesamt74 %derPatientennachHyperthermiebehandlungeineProgressionaußerhalbdesTherapiegebietes währenddesfollow-up;esistdabeizubedenken,dassetwa50%derPatientenbereitszum TherapiestartFernmetastasenhatten.EsresultiertdahereinschlechtesÜberleben,obwohldie DatenfürdielokaleKontrollevielversprechendwaren.Das2-Jahres-Überlebenbetrugetwa40%. DasGesamtüberlebenwarfürbeideGruppenvergleichbar(Vernon,CC,Hand,JW,Field,SB1996). SeitdemwurdeneinigeStudienzurHyperthermiebeiBrustwandtumorenpubliziert. 1.2.3LokoregionaleHyperthermiebeiBrustwandrezidivendesMammakarzinoms–bisherige Ergebnisse 2005veröffentlichteJonesetal.eineStudiezurHyperthermiebeioberflächlichliegendenTumoren undlegteeinenSchwerpunktderUntersuchungenaufdiethermaleDosis,diefürdielokaleKontrolle einesTumorsnotwendigist.DieStudiengruppesaheinenZusammenhangzwischendemlimitierten EinsatzvonHyperthermieunddenfehlenden,präzisenDatenzurnotwenigenthermalenDosis währendderHyperthermie-Behandlung.„DerGrundfürdenBedarfanthermalerDosimetrieist,dass erstsoeineprüffähigeVerschreibungderHyperthermiemöglichgemachtwird.WieinjederForm derTherapiebrauchteseinestabilewissenschaftlicheBasis,indiesemFalldieDosimetrie,umzu widerspruchsfreienBehandlungskonzepten,DatenreportsundzuQualitätssicherheitzuführen“,so dieStudieJonesetal.2005.Darinkonntegezeigtwerden,dasseineTemperaturvon>10CEM43°C T90(=einethermaleDosis>43°C,dievon90%desZielvolumenserreichtwird)fürdielokale KontrolleeinesTumorsvonVorteilist.AußerdemergabdieStudieeinensignifikantenVorteilfür Patienten,derenoberflächlicherTumormitHyperthermieundRadiatiobehandeltwurden,im UnterschiedzuPatientenmitalleinigerRadiatio.DieCRlaginderHyperthermiegruppebei66%,in derRadiatiogruppebei42%(OR2,7;95%CI1,2bis5,8).AuchhierzeigtesicheindeutlicherVorteil beiPatienten,diebereitsvorbestrahltwarenundlediglicheinegeringeStrahlendosiserhalten konnten.InKombinationmitHyperthermiereichtedieseDosisfüreineCRvon68%,während PatientenmitalleinigerRadiatioeineCRvon24%hatten.InderGruppedernicht-vorbestrahlten PatientenwarderUnterschieddeutlichwenigerausgeprägt(CT65%inderHyperthermiegruppe versus51%inderRadiatiogrupppe). Eineebenfalls2005veröffentlichteStudiekonntedieWirksamkeitderpostoperativen ThermoradiotherapiebeifortgeschrittenenundrezidivierendenMammakarzinomenzeigen.Das3- Jahres-Gesamtüberlebenlagbei89%,miteinemkrankheitsfreienÜberlebenvon68%undeiner lokalenKontrollratevon80%.DieuntersuchtenPatientenhattenHochrisiko-Tumoremitmarginalen Resektionsgrenzen(Welz,2005). EinederwenigenrandomisiertenPhase-III-StudienwurdevonseitendesMedicalResearchCouncils durchgeführt.DieuntersuchtenPatientenwurdeninzweiGruppenunterteilt:Patientenmiteinem BrustwandrezidiveinesMammakarzinomsundPatientenmiteinemlokalfortgeschrittenen MammkarzinombeiintakterBrust.DiesezweiGruppenwurdennochmalsaufgeteilt:EineGruppe 18 erhielteineThermoradiotherapie,dieandereGruppeerhielteinealleinigeStrahlentherapie.Vonden Patienten,diedieThermoradiotherapieerhielten,hattenfast50%zumZeitpunktderTherapie Fernmetastasen.DiePatientenmitThermoradiotherapiehatteneinecCRvon59%,beiPatientenmit alleinigerStrahlentherapiebetrugdiecCRRate67%(Zagar2010). EbenfallsimJahr2010zeigteeinerandomisiertePhase-I/II-StudiedieguteEffektivitätvon HyperthermieinKombinationmitneoadjuvantemliposomalenDoxorubicinundPaclitaxel.Die4Jahres-ÜberlebensratebetrugfürdaskrankheitsfreieÜberleben63%undfürdasGesamtüberleben 75%(Vujaskovic,2010). DieWirksamkeitvonliposomalemDoxorubicininKombinationmitHyperthermiewurde2014in einerPatientengruppebestätigt,diebereitsmehrfacherfolglosvortherapiertwurde.Eskonnten vielversprechendeobjektiveAntwortratenfestgestelltwerden,diejedochbeidieserpalliativen PatientengruppekeinewesentlicheLebenszeitverlängerungerbrachte.(Zagaretal,2014) 2013wurdeeineStudiemitknapp200Patientinnenpubliziert,diebereitseinRezidivihres MammakarzinomserlittenhattenundsomiteineRisikogruppedarstellten.Eswurdenichtnurdie EffizienzderadjuvantenBehandlungmitRadiotherapieundHyperthermiegeprüft,sondernauchein SchwerpunktaufdieVerträglichkeitdieserTherapieoptiongelegt.DasErgebniszeigteeinehohe lokaleKontrollrate(5-Jahres-LPFS78%)beiakzeptablerToxizität,wobeidieToxizitätnachden „CommonTerminologyCriteriaforAdverseEvents“gemessenwurde.(Linthorstetal.2013). Lindhorstetalpublizierteauch2015eineStudiezuHoch-Risikopatienten,diebereitsvorbestrahlt wurdenundnichtchirurgischreseziertwerdenkonnten.AuchhierkonntebeigeringerToxizitäteine zufriedenstellende5-Jahres-LPFS(39%)undoverallsurvival(18%)festgestelltwerden.(Linthorstet al2015) 1.2.4LokoregionaleHyperthermieimBrustwandbereich DieHyperthermieisteinVerfahrenzurErwärmungeinesTumorsauftherapeutischeTemperaturen von40-45°CmiteinerbegrenztenEindringtiefe.Charakteristischfürloko-regionale HyperthermiegeräteimOberflächenbereichistdieGenerationeineselektrischenFeldes,dasaufdas zubehandelndeGebietangeordnetist.DievomGeräterzeugtenMikro-undRadiowellenerhöhen durchihreInterferenzdieEnergieundkonzentrierensieaufdasZentrumdesTumorgebietes (Lagendijketal.,1998).DieelektromagnetischeKoppelungzwischendemApplikatorunddem KörpergewebeerfolgtdurcheinenWasserbolus.DieEindringtiefederMikro-undRadiowellen beträgtetwa3cm,sienimmtjedochbeiTumorregionenwiederAxillaab,dahierdieKontaktfläche zwischenHautundApplikatorinhomogenist.StandardinderOberflächenhyperthermiesind ApplikatorenvomSpiral-undSingle-Horn-Typ(Ottetal.,2010). 1.2.4.1Hyperthermieplanung Nurdiesorgfältige,multidisziplinärePlanungderHyperthermiedurchÄrzte,Physikerund ElektrotechnikergemäßderQualitätsrichtlinienderESHO(EuropeanSocietyofHyperthermic Oncology)ermöglichtdiefachgemäßeBehandlungeinesPatientenmitHyperthermie. 19 ImerstenSchritterfolgtdieLokalisationdesTumorsmittelsCT/MRT.Anhanddersogewonnenen KenntnisüberdiegenaueLagebeziehungdesTumorszuumliegendenanatomischenStrukturenkann entschiedenwerden,obeineHyperthermiemitdernötigenTemperatursonden-Einlagemöglichist. DernächsteSchrittbeinhaltetdieAnfertigungvondreidimensionalenBilderndeszubehandelnden Gebietes,wasdieBerechnungdesfürdieTherapiebenötigtenelektrischenFeldesermöglicht. AufgrundderVielzahlanweiterenKomponenten,diefürdieErstellungeinesHyperthermieBehandlungsplansnötigsind,wurdedasPlanungsprogramm„Hyperplan“erarbeitet,daszuzüglichzu technischenBerechnungenOptionenfürPatienten-spezifischeVariablenenthältunddie BenutzerfreundlichkeitdesHyperthermiegerätesverbessert.AufdemPlanungssystemkönnenso dreidimensionaleDatensätzevisualisiertundz.B.UntersuchungsbefundewieCT-Sequenzen integriertwerden(Gellermannetal.,2000;Wustetal.,2002). AußerdemmusseinBehandlungsplanerstelltwerden,deru.a.dieZieltemperaturimTumor,die EnergieamBeginnderHyperthermie,deninitialenTemperaturanstiegunddieHöchsttemperatur beinhaltet,aberauchdieDefinitionvonStartundEndederTherapie,dieTherapiedauer,dieAnzahl derBehandlungenunddiemaximalesystemischeTemperaturfestlegt.(Bruggmoseretal.,2011; Lagendijketal.,1998). 1.2.4.2Behandlung DerPatientmusssogelagertwerden,dassdasHyperthermiegerätmiteinerGenauigkeitvoneinem ZentimeteraufdasTumorgebieteingestelltwerdenkann.WährendderBehandlungmussdie systemischeTemperatur,sowieBlutdruckundHerzfrequenzalle15Minutenkontrolliertwerden.Da dasAuftretenvonSchmerzenalsParameterfürdieSchädigungdesgesundenGewebesgewertet werdenkann,solltenAnalgetikanurbeivorbestehendenSchmerzenzurAnwendungkommen. EineadäquateThermometriespielteinegroßeRolleinderHyperthermie,daeinUnter–oder ÜberschreitendertherapeutischenTemperaturenrechtzeitigerkanntwerdenmuss.Beider OberflächenhyperthermiekanndiesdurchdieApplikationvonSondenaufdieepitumoraleHaut erfolgen.DieverwendetenTemperatursondendürfennichtmitdemelektrischenEnergiefeld interferierenundmüssengemäßinternationalemStandardkalibriertwerden.JenachLokalisation desTumorsgibtesdieMöglichkeitderinvasivenThermometrie,beiderTemperatursondendurch einenoperativenEingriffinnerhalbdesTumorsangebrachtwerden.DieTemperaturimZielvolumen kanndurchsogenanntesMappingkontrolliertwerden.HierbeiwirdeineTemperatursondedurch einenKatheterimbehandeltenGebietallefünfbiszehnMinutenbewegt,umdieHomogenitätder zugeführtenTemperaturzuüberprüfen(Lagendijketal.,1998;Ottetal.,2010). DiedurchgeführteBehandlungmussanschließenddokumentiertwerden.DieseDokumentation beinhaltetu.a.diePositiondesPatienten,dieAnzahlderTemperatursondenunddasverwendete Hyperthermie-SystemmitAngabederAmplitude,derFrequenzundderEnergiedeselektrischen Feldes.AußerdemmussdasAuftretenvonSchmerzinseinerDauerundCharakteristikfestgehalten werden. 20 1.2.5Wirkmechanismus DieHauptwirkungderHyperthermieaufdenTumorberuhtgrundsätzlichaufdreiPrinzipien: -Radiosensitivierung -Chemotherapie-Sensitivierung -direkteZytotoxizität 1.2.5.1Radiosensitivierung: Bereits1987zeigteeineStudievonOvergaarddenpositivenEffektderKombinationvon RadiotherapiemitHyperthermieaufeinenTumor,indiesemFalldemmalignenMelanom.Durchdie HyperthermiekonntedieStrahlendosissignifikantverringertwerden,unddamitnahmenauchdie strahlenabhängigenNebenwirkungenab.In18MonatenBeobachtungszeitwarennurnoch56%der alleinmitRadiatiobehandeltenTumorenunterlokalerKontrolle,beiderHyperthermiewarenes86 %(Overgaard&Overgaard,1987). InnerhalbeinesTumorssindeinGroßteilderZellenaufgrundeinerungeordnetenVaskularisation hypoxischunddadurchnichtsensitivfürionisierendeStrahlung(Dietzel,1983).Temperaturen zwischen40-43°CverbessertdieReoxygenierung,indemsiedurcheinevermehrtePerfusiondie Sauerstoffkapazitätsteigert.AußerdeminhibiertdieHyperthermieMechanismenderintratumoralen DNA-ReparaturenvonSchäden,diedurchdieStrahlentherapieverursachtwerden.Dadurchbleiben DNA-Doppelstrangbrüchebestehen(Ottetal.,2010). 1.2.5.2Chemotherapie-Sensitivierung DurchdielokalamTumorapplizierteWärme(40°-43°C)kommteszurvermehrtenPerfusiondes Tumorgebietes,wodurchZytostatikagezielteranihrenWirkungsortgelangen.Außerdembestehtein SynergismuszwischenChemotherapieundHyperthermie.DasAusmaßderthermalen ChemosensitivierungkannsowohlinvitroalsauchinvivodurchdenQuotientendes TumorzellwachstumswährendalleinigerChemotherapieundChemotherapieinKombinationmit Hyperthermiequantifiziertwerden(Issels,2008). 1.2.5.3DirekteZytotoxizität EswirdeinZusammenhangzwischenTemperaturundZeitfürdenklonogenenZelltodvon exponentiellwachsendenZellenbeobachtet.AbeinerdefiniertenTemperatur(z.B.42,0°C) denaturierenProteineundführensozurApoptosederZelle.MechanismenzurZelleliminierungsind dieHemmungderZellproliferation,dieDepolarisationdermitochondrialenMembranundder AnstoßvonApoptose-Signalwegen(Ottetal.,2010). 21 1.2.6Nebenwirkungen HauptnebenwirkungistdieDysästhesie,diedurchhitzebedingteReizungenamperipheren Nervensystementstehenkann.AußerdemwerdenseltenVerbrennungenoderinEinzelfällen subkutaneFettnekrosenbeobachtet(Bornsteinetal.,1993;Haveman,VanDerZee,Wondergem, Hoogeveen,&Hulshof,2004). 1.2.7Kontraindikationen: GrundsätzlichbewirktdieOberflächenhyperthermiekeineVerschlechterungdesAllgemeinbefindens, weshalbdieHyperthermieauchbeimultimorbidenPatienteneingesetztwerdenkann. KontraindikationensinddasBesteheneinesHerzschrittmachersundMetallimplantateim Therapiefeld. 22 2FragestellungundZiele AufdenvorliegendenErgebnissenaufbauendsollenfolgendeFragenaneinemretrospektiverfassten Patientenkollektivbearbeitetwerden: - LokaleKontrollrateundÜberlebensparameterbeivorbestrahltenPatientinnendiemit RadiatioundlokoregionalerHyperthermiebehandeltwurden LokaleKontrollrateundÜberlebensparameterbeiPatientinnenmitlokalfortgeschrittener- Erkrankung,diemitChemotherapieundlokoregionalerHyperthermiebehandeltwurden Risikofaktoren ToxizitätderKombinationsbehandlung 23 3PatientenundMethoden 3.1Patientenkollektiv DieregionaleTiefenhyperthermievonExtremitäten-oderAbdomen/Becken-Sarkomenbildetden SchwerpunktanderHyperthermie-EinheitimKlinikumGrosshadern.DaheristdieAnzahlder PatientenmitoberflächlichenMalignomenwiedemMammakarzinomvergleichsweisegering. AusgewertetwurdenPatientenmiteinemfortgeschrittenenMammakarzinomodereinem Brustwandrezidiv,diebis2010imKlinikumGroßhadernundPartnerklinikenmitlokoregionaler Oberflächenhyperthermiebehandeltwurden. 32PatientenkonntennachdiesenKriterienindieAnalysemiteinbezogenwerden. 24 3.2Auswertung DiezuuntersuchendeZielgrößebestandimTumoransprechensowiederÜberlebenszeitder Patienten.EswurdedieZeitbiszumAuftreteneinesTumorprogress(progressionfreesurvival,PFS) unddasGesamtüberleben(overallsurvival,OS)untersucht.DieseParameterwurdensowohlfürdie gesamtePatientengruppeberechnet,alsauchfürdiezweiUntergruppen„Radiatiomit Hyperthermie“und„ChemotherapiemitHyperthermie“. EswurdenFaktorenanalysiert,dieeinenEinflussaufdieBehandlungsergebnissebewirkenkönnen. DieuntersuchtenFaktorenwaren: - Vorbehandlung - Grading(G1-G3) - Hormonrezeptor-Status/HER2/neu–Status - AdjuvanteTherapievs.neoadjuvanteTherapie - Metastasierung EinweitererSchwerpunktdieserretrospektivenAnalyselaginderVerträglichkeitTherapie.Eswurde hierfürdieToxizitätunddieDurchführbarkeituntersucht. Toxizität: -hämatologischeToxizität -nicht-hämatologischeToxizität(z.B.gastrointestinaleVerträglichkeit) -Hyperthermie-assoziierteToxizität Durchführbarkeit: -Dosisreduktion -GründefüreinenTherapieabbruch 3.3Behandlungsübersicht DerBehandlungsplanderStrahlentherapie-KombinationistinderfolgendenTabelle1dargestellt. EineausführlicheTabellezurStrahlendosisjedesPatientenfindetsichimAnhang.Der BehandlungsplanderChemotherapie-Kombinationwurdeindividuellabgestimmt.AlsBeispielistdie KombinationmitGemcitabin/CisplatinistinTabelle2dargestellt. 25 Tabelle1 Tag1 Tag2 Tag3 Tag4 RTX RTX RTX RTX 1,8/2,0GyED 1,8/2,0GyED 1,8/2,0GyED 1,8/2,0GyED Hyperthermie Hyperthermie Tabelle2 Tag1 Tag2 Tag3 Tag4 Gemcitabin Cisplatin Cisplatin 1000mg/m² 25mg/m² 25mg/m² Hyperthermie Hyperthermie 3.5Hyperthermie-Ablauf VorBeginnderHyperthermie-SitzungwurdenTemperatursondenanderHaut,Blase,Rektumund Vaginaeingeführt.DieTherapiedauerteinsgesamt90Minuten,davonbetrugdieAufwärmphase30 MinutenunddietherapeutischePhase60Minuten.DieLeistungschrittweisebiszueinem Temperaturbereich,derzwischen40-43°Cbetragensollte,erhöht. 3.6Hyperthermie-VerfahrenundverwendeteGeräte EswurdennurPatientenausgewertet,diemiteinerlokoregionalenHyperthermiebehandeltwurden; dieverwendeteApplikatorartwarderSpiral-oderSingle-Horn-Typ,derfürdie Oberflächenhyperthermieamgeeignetstenist.BehandlungenfürausgedehntereTumorenim TiefenbereichmitdemSigma-Eye-Applikatorwurdenausgenommen. 26 3.7Routineuntersuchungen VorStartderTherapiewurdenzumStagingfolgendeUntersuchungendurchgeführt: - körperlicheUntersuchungmitErfassungdesKarnofsky-Index - BlutbildundlaborchemischeUntersuchungenfürdieOrganfunktion(Niere,Leber) - CToderMRTzurBeurteilungdesTumorssowieAusschlussvonMetastasen DieLaboruntersuchungenwurdenproZykluswiederholt.WährendderTherapieerfolgteein ZwischenstagingsowienachAbschlusseinNachstaging;beiVerdachtaufProgresswurdeeine weiterführendeBildgebungveranlasst. InZusammenarbeitmitderRadiologiedesKlinikumGroßhadernwurdedieStaging-Bildgebungnach RECIST-Kriterien(„responseevaluationcriteriaforsolidtumors“,Therasseetal.,2000)bezüglichdes AnsprechensaufdieverabreichteTherapieausgewertet. Tumoransprechen: RECIST-Kriterien KompletteRemission(CR) VerschwindenallerLäsionen PartielleRemission(PR) ≥30%ReduktiondeslängstenDurchmessersder Läsion StabileErkrankung(SD) PatienterfülltwederdieKriterienderPRnochder Progression ProgressiveErkrankung(PD) ≥20%ZunahmederTumorgrößeinderSummeder längstenDiameterverglichenmitdembesten Ansprechen,oderAuftreteneinerneuenLäsion 3.8DefinitionderToxizität ImKapitelToxizitätwurdediehämatologische,dienicht-hämatologischeunddie hyperthermieassoziierteToxizitätderTherapieuntersucht.DiehämatologischeToxizitätwurde anhandderCTCAEKriterien(Version4.0,2010)charakterisiertundumfasstindieserArbeitdie KriterienAnämie,Thrombozytopenie,LeukozytopenieunddieBeeinträchtigungderNierenfunktion anhanddesKreatinin-Wertes. 27 Einteilungderhämatologischen ToxizitätgemäßdenKriterien derCTCAE(2010) Grad1 Grad2 Grad3 Grad4 Grad5 Anämie Hämoglobin HB<10– (Hb)< 8g/dL Referenzbereich (RB)–10g/dL Hb<8g/dL Lebensbedrohliche Tod Konsequenzen, dringende Intervention indiziert Leukozyten <RB– 3000/mm³ <3000– 2000/mm³ <2000- 1000/mm³ <1000/mm³ Thrombozyten <RB– 75000/mm³ 75000– 50000– <25000/mm³ 50000/mm³ 25000/mm³ Tod Kreatinin >1–1,5xRB >1,5–3xR Tod >3xRB >6xRB Tod DienichthämatologischeToxizitätumfassttherapieassoziierteSymptomederPatienten:Fieberund Infektionen,ÜbelkeitundErbrechenundAlopezie. DieHyperthermie-assoziierteToxizitätbeinhaltetdiedurchdieLagerungunddie TemperaturerhöhungentstandenSchmerzenderPatientenundggf.auftretendeVerbrennungen.Die VerbrennungenwerdeninGradeaufgeteilt: GradderVerbrennung Grad1 Rötung,Epidermisbetroffen Grad2 Blase,bisindieunterenDermisreichend Grad3 VerbrennungbisinssubkutaneFettgewebe Grad4 Verkohlung 3.9KarnofskyIndex(KI) DerKarnofskyIndexbeschreibtdengesundheitlichenZustanddesPatientenvorBeginnderTherapie. DurchdiesenPerformance-Statussollfestgehaltenwerden,obbeieinemPatientzumZeitpunktdes TherapiestartseinegesundheitlicheEinschränkungbestand.DerIndexbeinhaltetfolgendeKriterien: 28 KPI ECOG Symptome 100% 0 KeineBeschwerden,keineZeichenderKrankheit 90% 0 FähigzunormalerAktivität,kaumodergeringeSymptome 80% 1 NormaleAktivitätmitAnstrengungmöglich.DeutlicheSymptome 70% 1 Selbstversorgung.NormaleAktivitätoderArbeitnichtmöglich 60% 2 EinigeHilfestellungnötig,selbständigindenmeistenBereichen 50% 2 HilfeundmedizinischeVersorgungwirdoftinAnspruchgenommen 40% 3 Behindert.QualifizierteHilfebenötigt 30% 3 Schwerbehindert.Hospitalisationerforderlich 20% 4 Schwerkrank.IntensivemedizinischeMaßnahmenerforderlich 10% 4 Moribund.UnaufhaltsamerkörperlicherVerfall 0% 5 Tod 3.10Dosisreduktion BeiAuftreteneinerausgeprägtenhämatologischenToxizitätisteineDosisreduktionindiziert. Leukozytenanzahl Thrombozytenanzahl %derGesamtdosis 2,5und>75 100 2,0-2,5oder50-75 50 <2,0oder<50 Abbruch 3.11DatenerfassungundAuswertung DieseArbeitisteineretrospektive,nicht-interventionelleErfassungvonBehandlungsergebnissen,bei denenwiefolgtunterschiedenwird: ProgressionfreesurvivalPFS EswurdedieZeitvonTherapiestartbiszumAuftreteneinesRezidivs-imSinneeinesProgressdes TumorsselbstsowielokaleroderfernerMetastasen-gemessen.BeiPatientenohneausreichende 29 BildgebungwurdenklinischeParameterfürdieAussageeinereindeutigenTumorprogression herangezogen. OverallsurvivalOS DasGesamtüberlebenwurdehierdefiniertalsdasÜberlebenvomZeitpunktderErstdiagnosebis zumTod. 3.12DokumentationundverwendeteSoftware DieDatenderPatientenwurdenineinerMicrosoftExcel2003Tabellefestgehalten.AlsStatistik– ProgrammfürdieAuswertungvonLPFS,DPFSundOASwurdeSPSSVersion10(IBM)verwendet;das ÜberlebenwurdenachKaplan-MeierundCox-Regressionberechnet. 30 4Ergebnisse 4.1Patientencharakteristika Ausgewertetwurden32PatientinnenmiteinemMammakarzinom.AllePatientinnenerhieltennach VorstellungimTumorboardimZeitraumvon1995bis2010eineChemo–oderRadiotherapiein KombinationmitOberflächenhyperthermieamKlinikumGroßhadernoderaneinerPartnerklinik.Die PatientencharakteristikasindinderfolgendenTabelledargestellt. Patientencharakteristika(n=32) Alter KarnofskyIndex Primärtumor Rezidiv Metastasen Median Median Ja Nein 61(42–87) 80(50–100) 2 30 26 -Fernmetastasenn=18 -LokoregionaleMetastasen n=8 6 4.2Behandlung Von32Brustkarzinom-Patientenerhielten24PatienteneineStrahlentherapieundachtPatienten eineChemotherapie. 4.2.1 ÜberlebensparameterfürPatientinnenmitStrahlentherapie 4.2.1.1Insgesamt Patienten,diemitStrahlentherapiebehandeltwurden,zeigteneinprogressionsfreiesÜberlebenvon 6,5MonatenundeinGesamtüberlebenvonknapp3Jahren(35Monaten).Von24Patientenstarben 67%. Progression-freesurvival Medianduration(months) Numberofdeaths MedianDuration(months) Radiatio+HT 6,5(0-17) 16(67%) 35(7-63) 31 Jahre 012345678 Numberatrisk:24 107533320 Jahre 012345678 Numberatrisk:24 1510844420 32 4.2.1.2ÜberlebensparameterinAbhängigkeitvonVortherapien DieausgewertetenPatientinnenhattenmehrheitlichvieleVortherapien.75%derPatientinnen hattenmehrals2Vortherapien;nureinePatientinerhieltdieRadiatio-Hyperthermie-Kombination alsErsttherapieundwurdenichtindieuntenstehendeBerechnungintegriert. n=23 Progression-free survival Medianduration (months) Numberofdeaths MedianDuration (months) 1bis2 Vortherapien (n=5) >2 Vortherapien (n=18) p-Wert Hazardratio 5,5(0-13) 6,5(2,5–10,5) 0,9 0,9(0,3–3) 3(60%) 19(1-36) 13(73%) 35(0-71) 0,9 0,9(0,3–3,5) HR=0.9(95%CI0.3–3)p=0.9 Jahre 01234567 Numberatrisk: 1bis2Vortherapien531 1110 >2Vortherapien1812973 3 3 2 33 4.2.1.3ÜberlebensparameterinAbhängigkeitvomHormonrezeptorstatus PatientinnenmitpositivemHormonrezeptorstatuszeigteneinsignifikantlängeresGesamtüberleben alsPatientinnenmitnegativemHormonrezeptorstatus.VondenPatientinnenmitnegativem Hormonrezeptor-Statusstarben90%. n=24 Progression-free survival Medianduration (months) Overallsurvival Numberofdeaths MedianDuration (months) Hormonrezeptor Hormonrezeptor negativ(n10) positiv(n14) p-Wert Hazardratio 2(1-3) 26(0–57,5) 0,1 0,5(0,2–1) 9(90%) 8(0–16) 7(50%) 48(12–83) 0,02 0,3(0,1–0,8) HR=0.5(95%CI0.2–1)p=0.1 Jahre 01234567 Numberatrisk: Rezeptornegativ102211111 Rezeptorpositiv1485422 2 1 34 HR=0.3(95%CI0.1–0.8)p=0.02 Jahre 01234567 Numberatrisk: Rezeptornegativ103321111 Rezeptorpositiv1412763331 4.2.1.4ÜberlebensparameterinAbhängigkeitvomHer2/NEU-Status BeidemhierbeschriebenenPatientenkollektivergabsichkeinsignifikanterUnterschiedim ÜberlebendurcheineÜberexpressionvonHER2/neu.BeielfPatientenlageineHer2neuÜberexpressionvor. n=24 Progression-free survival Medianduration (months) Numberofdeaths MedianDuration (months) Her2/NEU negativ(n13) Her2/NEUpositiv p-Wert (n11) Hazardratio 14(0–35) 6,5(1–11,5) 0,9 1(0,4–3) 8(62%) 43(32–55) 8(73%) 13(6-20) 0,1 2(0,8–6) 35 HR=2(95%CI0.8–6)p=0.1 Jahre 01234567 Numberatrisk: Her2/Neunegativ1310763321 Her2/Neupositiv115321111 4.2.1.5ÜberlebensparameterinAbhängigkeitvonadjuvanterTherapieversusneoadjuvanter Therapie Patientinnen,dieeineadjuvanteTherapieerhielten,zeigteneinsignifikantbesseres progressionsfreiesÜberlebenundGesamtüberlebenalsPatientinnen,dieeineneoadjuvante Therapieerhielten.AdjuvantbehandeltePatientinnenhattendieMöglichkeit,vorTherapieoperiert werden,wohingegenneoadjuvantbehandeltePatientinneneineninoperablenTumorhatten. n=24 adjuvant(n11) Progression-free survival Medianduration (months) Numberofdeaths MedianDuration (months) Neoadjuvant (n13) p-Wert Hazardratio 38,5(14–63) 2(0,4–4) 0,02 3(1–8,4) 5(46%) 48(10–85) 11(85%) 11(3,5–18) 0,02 3,5(1–10) 36 HR=3(95%CI1–8.4)p=0.02 Jahre 01234567 Numberatrisk: Adjuvant117542211 neoadjuvant133211111 HR=3.5(95%CI1–10)p=0.02 Jahre 01234567 Numberatrisk: Adjuvant119663321 neoadjuvant136421111 37 4.2.1.6ÜberlebensparameterinAbhängigkeitvonderMetastasierung 26PatientenhattenzumZeitpunktderTherapiebereitsMetastasen,davonhattenelfPatienten lokaleMetastasenund15PatientenFernmetastasen.DieVormetastasierungbeiTherapiestartwirkte sichsignifikantaufdasprogressionsfreie-undGesamtüberlebenaus. n=24 Progression-free survival Medianduration (months) Numberofdeaths MedianDuration (months) Metastasen Keine vorhanden(n18) Metastasen(n6) p-Wert Hazardratio 2(0–8) 74(17-132) 0,01 0,1(0,0–0,6) 15(83%) 13(1-25) 1(17%) Notreached 0,04 0,1(0,0–0,8) Metastasierung ja Nein Metastasen 26(81%) 6(19%) Lokalisation lokal 7 Haut 12 Lunge 7 Knochen 7 Leber 2 Pleura 2 Tod 22(85%) 1(16,6%) 38 HR=0.1(95%CI0–0.6)p=0.01 Jahre 01234567 Numberatrisk: Metastasen185311111 KeineMetastasen65442221 HR=0.1(95%CI0–0.8)p=0.04 Jahre 01234567 Numberatrisk: Metastasen1810642221 KeineMetastasen65442221 39 4.2.1ÜberlebensparameterfürPatientenmitChemotherapie DieTumorenderPatientinnen,dieeineChemotherapieinKombinationmitHyperthermieerhielten, warenlokalfortgeschrittenundmehrfachvortherapiert.DieEinflussfaktoren,diebeiPatientinnen mitRadiotherapieuntersuchtwurden,konntenbeidieserPatientengruppenichtvalidestatistisch berechnetwerden,daessichumeinesehrhomogeneGruppehandelte:DiePatientinnenhattenalle mehralszweiVortherapien;siebenderachtPatientinnenhatteneinennegativenHer2-NeuRezeptorstatus,fünfPatientinnenhatteneinenrisikoreichen„triple-negativen“Tumor.Außerbei einerPatientinwarenalleTumoreinoperabel,dieTherapiewurdedaherneoadjuvantdurchgeführt. DieVormetastasierungunddasTemperaturmaximumbeiHyperthermiezeigteinderstatistischen AuswertungkeineSignifikanzimLPFS,DPFSundOS. Progression-freesurvival Medianduration(months) Overallsurvival Numberofdeaths MedianDuration(months) Jahre Chemotherapie+HT(n=8) 2(0–4,5) 6(75%) 13(0,5-26) 0123456 Numberatrisk:8 211111 40 Jahre 01234567 Numberatrisk:8 533333 0 41 4.3ToxizitätderTherapie 4.3.1HämatologischeToxizität 4.3.1.1Anämie DerHämoglobin-WertwurdeabdemerstenTagderTherapieinwöchentlichenAbständen gemessen. DasAusmaßderTherapie–assoziiertenAnämiebetrugimMedianGrad1(0-2);beidreiPatienten warenkeineLaborergebnisseindenAktenzufinden. Anämie Keine Anämie Grad 1 Grad 2 n.e. Anzahl RTX+RHT 13 5 3 3 24 Gemcitabin/Cisplatin+RHT 1 3 1 5 Taxan+RHT 0 2 1 3 Anzahl 14 11 5 2 32 4.3.1.2Thrombozytopenie Esstelltesichheraus,dassdieThrombozytopenieeineseltenauftretendehämatologischeToxizitätin deruntersuchtenGruppeist.ZweiPatientenhatteneineThrombozytopenievonGrad1,zwei PatientenGrad2.25PatientenhattenwährendderTherapiekeineThrombozytopenie.Beidrei PatientenwarenkeineLaborergebnisseindenAktenvermerkt. 4.3.1.3Leukozytopenie BeikeinemPatientenwurdeeineLeukozytopeniebeobachtet. 4.3.1.4Nephrotoxizität BeizweiPatientenwurdeeinAnstiegdesKreatinin-Spiegelsbeobachtet,dereinererstgradigen Toxizitätentsprach.SiewurdenbeidemitderKombinationRadiatioplusHyperthermiebehandelt. 42 4.3.2Nicht-hämatologischeToxizität 4.3.2.1Verbrennungen KeinerderPatientenerlittVerbrennungen,beisiebenPatientenkonntenachderBehandlungeine RötungdesTumorarealsnachgewiesenwerden,dienichtdenKriterieneinerVerbrennungentsprach. 4.4.2.2FieberundInfektionen ZweiPatientenhattenwährendderBehandlungFieber.BeidiesemFieberhandelteessichnichtum neutropenesFieber.AußereinemHarnwegsinfekt,einerWundinfektionmitStaphylokokkusaureus undeinemInfektunklarerGenesegabeskeineInfektioneninderPatientengruppe. 4.3.2.3ÜbelkeitundErbrechen BeivierPatienten,dieeineChemotherapieerhielten,wurdedasAuftretenvonÜbelkeitbemerkt. KeinPatientderStrahlentherapie-GruppegabÜbelkeitoderErbrechenan. 4.3.2.4Alopezie BeikeinemPatientenwurdevonHaarausfallberichtet. 4.3.3HyperthermieassoziierteToxizität 4.3.3.1HyperthermiebedingteSchmerzen WährendderHyperthermiegaben24PatientenSchmerzeninFormvon„brennen“an.Beikeinem PatientführtendieSchmerzenzumAbbruchderTherapie. 4.3.3.2LagerungsbedingteSchmerzen FünfPatientenhattenSchmerzendurcheineunangenehmeLagerungwährendderTherapie. 4.4DurchführbarkeitderTherapie Von252geplantenHyperthermiesitzungeninKombinationmitRadiatiowurden238Sitzungen(94%) durchgeführt.Vondengeplanten57Chemotherapiezyklenmit85Hyperthermiesitzungenwurden53 Zyklen(93%)mit70Hyperthermiesitzungen(82%)durchgeführt.ZweiChemotherapiepatientenund zweiStrahlentherapiepatientinnenhabendieBehandlungabgebrochen.EinPatientistwährenddes 43 BehandlungszeitraumesaneinemMagenkarzinomverstorben.EineausführlicheTabellezuden durchgeführtenTherapienfindetsichimAnhang(Tabelle4:Durchführbarkeit) Durchführbarkeit AnzahlderPatienten Prozent Behandlung vollständig durchgeführt 27/32 84% AbbruchderTherapie 5/32 16% 4.4.1Dosisreduktion BeikeinemPatientenwurdeeineDosisreduktiondurchgeführt. 4.4.2GründefüreinenTherapieabbruch InderGruppederMammakarzinomegabesinsechsFälleneinenTherapieabbruch.Beidenanderen PatientenkonntediegeplanteTherapievollständigdurchgeführtwerden. Gründe für einen Therapieabbruch 6 desease related: Anzahl der Patienten 5 • 3x lokaler Progress des Tumors • 1x neu aufgetretene Hautmetastase 4 3 Non desease related: 2 •1x Tod an Magenkarzinom •1x pectanginöse Beschwerden während HT 1 0 desease related non desease related 44 5.Diskussion 5.1 Einleitung DasMammakarzinomistmiteinerNeuerkrankungsrateinDeutschlandvon60.000/Jahrdas häufigsteKarzinomderFrauundstelltmiteinerMortalitätvon18.000proJahrdiehäufigste tumorassoziierteTodesursachedar. DieStandardtherapiedesMammakarzinomsistdieBETmitadjuvanterStrahlentherapie.Falls bestimmteRisikofaktorenvorliegen,wirddieadjuvanteStrahlentherapiemiteinerAnthrazyklin-und evtl.auchTaxan-haltigenChemotherapiekombiniert,diebeiMöglichkeitzusätzlichmiteiner endokrinenTherapieergänztwird.DieseStandardswurdeninzahlreichenStudienbestätigtund findenweitverbreitetenEinsatz. BeimlokalfortgeschrittenenMammakarzinom,demtriple-negativemMammakarzinomunddem BrustwandrezidiveinesMammakarzinomshatsichjedochbisheutekeineStandardtherapie etabliert.EsgibtverschiedeneAnsätzemitChemotherapien,dieev.mitStrahlentherapiekombiniert werden.VieleStudienbefassensichmitdenVorteileneinerneoadjuvantenChemotherapie,dieoft erstdieResezierbarkeitdesTumorsermöglichtunddanneventuelldurcheinepostoperative Chemotherapieund/oderRadiatioergänztwird.EineStudievonWolmarketal.(2001)analysierte dasoverallsurvival,dasdeseasefreesurvival(DFS)unddieRateanipsilateralenTumorrezidivebeim Patienten,dievierZyklenDoxorubicin/Cyclophosphamidneoadjuvanterhielten,imVergleichzu einerPatientengruppe,diemitderselbenChemotherapieadjuvantbehandeltwurde.Inallendrei untersuchtenZielgrößenkonntekeinUnterschiedzwischendenGruppenfestgestelltwerden(OS, DFS,ipsilat.TumorrezidivbeiadjuvanterGruppe70Prozent9-Jahre-Überleben,53%deseasefree5Jahres-Überlebenund7,6%5-Jahres-ÜberlebenohnelokaleRezidive,versus69%,55%und10%in derneoadjuvantenGruppe).ZudiesemThemawurdenzahlreicheweitereStudiendurchgeführt,die allezudemselbenErgebniskamen. IneinerdervielenPublikationenzurRadiochemotherapiebeifortgeschrittenenMammakarzinomen fassteKaoetal.2005dieErgebnissevonzweirandomisiertenPhase-I/II-Studienzusammen,indenen dieWirksamkeitvonPaclitaxelundRadiatiobeiderTherapiedesprimärnichtresektablen Mammakarzinomsbelegtwerdenkonnte.EinenSchrittweitergingdieStudievonAlvarado-Miranda etal.(2009),beideraufeineneoadjuvanteChemotherapienachderResektiondesTumorseine Chemoradiotherapiefolgte.DieResponder-Ratelagbeidiesenfortgeschrittenen Mammakarzinomen,diesichzu78%imStadiumIIIbefanden,bei29,5%;das5-JahrekrankheitsfreieÜberlebenbetrug76,9%,die5-Jahres-Gesamtüberlebensrate84,2%.AuchRastoqi etal(2008)bestätigtediepositiveWirkungderChemoradiotherapieindieserPatientengruppe.Das 5-Jahres-ÜberlebenvonPatientenmiteinemBrustkarzinomimStadiumIIIalagbei80%,inStadium IIIb45%. DieTherapiedestriple-negativenMammakarzinomsstelltaktuelldiegrößteHerausforderungdar. VielversprechendstelltsichinStudieneineTherapiedieserPatientengruppemiteinerplatinhaltigen Chemotherapie,daunterdieserTherapiegeradediejenigenTumoreansprechen,dieeineMutation imBRCA1/2Genaufweisen.(Telli,2015). 45 DieWirksamkeitderbestehendenBehandlungsmöglichkeitenbezüglichihrerAnsprechratewurde demnachhäufigbestätigt.Beieinerdurchschnittlichen5-Jahres-Überebensratealler Mammakarzinom-Patientinnenvon55%istjedochbeiWeitemkeinzufriedenstellendesErgebnis dieserTherapieoptionenerreicht.HierbestehtBedarfnachweiterführendenStudien(Cracinescu 2010,Vujascovic,2010). 5.2Hyperthermie SeitBeginnderErforschungderHyperthermiealsTumortherapiewurdedieNutzbarkeitdieses VerfahrensfüroberflächlichliegendeTumorenwiedasMammakarzinomundseine Brustwandrezidiveerkannt. WiebereitsimKapitel1.2.3„LokoregionaleHyperthermiebeiBrustwandrezidivendes Mammakarzinoms–bisherigeErgebnisse“abgehandelt,zeigtdieHyperthermiealsTherapieoption desfortgeschrittenenMammakarzinomsvielversprechendeErgebnisseinzahlreichenStudien.Esgibt nurwenigeStudienzurHyperthermiebeiprimärenMammkarzinomenmitniedrigemRisikoprofil,da indieserPatientengruppemitderpostoperativenStrahlentherapiebereitseinoptimalerErfolg verzeichnetwerdenkonnte. IndenunterKapitel1.2.3genanntenStudienwirdvorallemaufdiegeringeToxizitätund NebenwirkungsratederHyperthermiehingewiesen.BezüglichderVerbrennungenhatten beispielweiseinderStudievonEllenJones(2005)von56Patienten14eineVerbrennungersten Grades,neunPatienteneinezweitenGradesunddreiPatienteneinedrittenGrades.DieGrad-3VerbrennungenheiltenmitkonservativenMaßnahmen.KeinPatienterlitt4-gradigeVerbrennungen. DiesegeringeAusprägunganNebenwirkungenwurdeunteranderembeiWelz2005,Vujaskovic2010 undVarma2012bestätigt.AuchdieSchmerzenwarenfürdiePatiententolerierbar;eskamzu keinemAbbruchderTherapieaufgrundvonSchmerzen. AlsRichtliniefürdieQualitätderHyperthermiegiltseit1998dievonLagendijketal.definierteESHOqualityassuranceguideline.DurchdieseArbeitkonntenebenderQualitätaucheineVergleichbarkeit undNachweisbarkeitderinderHyperthermieangewandtenMethodensichergestelltwerden.Da wissenschaftlicheStudienzurWirksamkeitinderTumortherapienurdurchgeführtwerdenkonnten, sobaldeseinheitlicheRichtliniendafürgab,mitwelchentechnischenVerfahreneinerisikoarme ErwärmungdesTherapiearealsmöglichist,beschäftigtensichweitereArbeitsgruppenmitder Qualitätssicherung.BeachtetwerdenmüssenunteranderemdieRichtlinienderDEGRO(deutsche GesellschaftfürRadioonkologie)derWMA(WorldMedicalAssociation)undderWHO(WorldHealth Organization).2011wurdeeineRichtliniezurQualitätssicherungderlokalenTiefenhyperthermiein klinischenStudienerstellt(Bruggmoseretal,2011).DerEinsatzvonHyperthermieerfordertneben qualifiziertenÄrztenauchPhysikerundIngenieure,diefürdietechnischenAspektebezüglichder QualitätssicherungundHyperthermie-Planungverantwortlichsind.DieHyperthermiebleibt dementsprechendspezialisiertenZentrenvorbehalten. 46 5.3DiskussionderErgebnissedervorliegendenretrospektivenAnalyse 5.3.1ErgebnisseüberdieWirksamkeitderHyperthermieinderGruppederStrahlentherapiePatientenundderChemotherapie-Patienten Miteiner1-Jahres-GesamtüberlebensratederRadiatio-Gruppevon66%(5-Jahres-OS26,5%)und einem1-Jahres-PFSvon46%(5-Jahres-PFS22%)sowieeiner1-Jahres-Gesamtüberlebensrateder Chemotherapie-Gruppevon62,5%(5-JahresOS37,5%)undeiner1-JahresPFSvon25%(5-Jahres PFSnichterreicht)liefertdievorliegenderetrospektiveAuswertungErgebnisse,diedeutlichunter denzuvorbeschriebenenStudienliegen. EinemöglicheUrsachefürdieInkongruenzzuanderenStudienistsicherlichdiekleinePatientenzahl von24Radiatio-Patientinnenund8Chemotherapie-Patientinnen.FüreineaussagekräftigeStudie müsstediePatientenzahlgrössersein,hilfreichwäreaucheineKontrollgruppe. EineandereMöglichkeitkönnteimPatientengutselbstbzw.indeneinzelnenRisikofaktorenliegen. Z.B.könntendievorliegendenPatientinnenbesondersspätbehandeltwordensein,nachmehr TherapieversuchenalsbeianderenStudiengruppen.DiehieruntersuchtenPatientinnenhattenim Median4Therapien,bevorsiemitHyperthermiebehandeltwurden(Range1-8).Wieviele VortherapieneinPatientbeiDurchführungderHyperthermie-Kombinationhatte,wirdinkaumeiner Studiegenannt.Trotzdemmussmandementgegenhalten,dassdieHyperthermieimmerbeilokal fortgeschrittenenMammakarzinomenbzw.Brustwandrezidivendurchgeführtwurden;Patientinnen mitdieserTumorentitäthabendefinitionsgemäßinvielerleiHinsichterhöhteRisikofaktoren bezüglichdesTherapieansprechens(undsomitauchderAnzahlderVortherapien)undder Überlebensdaten. DasHyperthermie-VerfahreninGroßhadernoderPartnerklinikenwirdstandartgemäßundinnerhalb derQualitätsrichtliniendurchgeführt.DenGrundfürdieschlechtereÜberlebensratebeidenhier untersuchtenPatientinnendarinzusehen,dassdieTherapienichtadäquatdurchgeführtwurde, kanndaherweitestgehendausgeschlossenwerden. AufdenerstenBlicküberraschendist,dassdieTherapiegruppeninsgesamtinderÜberlebensrate vergleichbareErgebnisseerbringen,obwohlmanaufgrundderRisikoverteilungbeiderGruppen(z.B. Anzahltriple-negativerPatientinnen)beidenRadiatio-PatientinneneinebessereÜberlebensrateals beiChemotherapie-Patientinnenerwartenkönnte.WennmanjedochdiemedianeÜberlebenszeit beachtet,siehtmaneindeutlichlängeresÜberlebeninMonatenfürdieRadiotherapie-Patientinnen. DerMittelwert,dereinähnlichlangesÜberlebenbeidenGruppenfeststellt,istnichtaussagekräftig, daerwenigerrobustgegenüberAusreißernistalsdermedianeWert. 47 5.3.1.1EinflussfaktorenaufdieErgebnisse EswurdeneinigeVariablen,nämlichCharakteristikaundRisikofaktorenderPatientengruppe, statistischberechnet,vondenenmanvermutenkann,dasssieeinenEinflussaufdaskrankheitsfreie undgesamteÜberlebenhaben.Essollteuntersuchtwerden,obdieErgebnissetatsächlichvom TherapieverfahrenodervondenVariablenbeeinflusstwurden. 5.3.1.1.1Grading DasGradingeinesTumorsistinderRisikozuordnungdurchdieKonsensuskonferenzSt.Galleneiner derbestimmendenFaktorenfürdasGesamtüberleben.DabeiwurdejedochvorallemdasRisiko einesG1-TumorsimUnterschiedzuG2-oderG3-Tumorenaufgezeigt.Dasichinderuntersuchten PatientengruppejedochnureineinzigerG1-Tumorbefand,kannhierkeineAussagegetroffen werden,obdasGradingeinesTumorsdasOutcomeverändert.VielmehrzeigtdieRateanhohem Grading,dassdasuntersuchtePatientenkollektivbereitszumStartderTherapierisikobelastetwar. 5.3.1.1.2Vortherapien WievieleVortherapienvorderuntersuchtenKombinationstheoriedurchgeführtwurden,spielte statistischkeineRolle.AuchhieristdieAntwortinderPatientengruppezufinden:NurzweiPatienten erhieltendieHyperthermie-KombinationalsErstlinientherapie.WeiterezweiPatientenerhieltendie untersuchteTherapiealsZweitlinie.63%derPatientenhattenzumTherapiestartbereitsmehrals vierVortherapien.StatistischaussagekräftigeErgebnissewarendahernichtzuerwarten. 5.3.1.1.3HER2/neu-Status BezüglichdesHER2/neu-StatusgabeskeinestatistischsignifikantenUnterschiedezwischender negativenundderpositivenPatientengruppe,auchwennPatientenohneHER2/neu-Überexpression einlängeresGesamtüberlebenalsPatientenmitHER2/neu-Überexpressionzeigten. GrundsätzlichhabenPatientenmitpositivemHER2/neu-StatuseineschlechterePrognose,daein schnelleresWachstumundschlechteresAnsprechenaufStandardtherapienbeidiesenTumoren beobachtetwird.AndererseitshatderEinsatzvonTrastuzumabbeiHER2/neu-positivenTumorendas Outcomedeutlichverbessert. 5.3.1.1.4Tumorstadium DasTumorstadiumderPatientenkonntefüreinestatistischeBerechnungnichtsinnvolleingesetzt werden,denndieAngabendazufehltenbeiinsgesamt15Patienten,obwohldieRechercheauchdas TumorregisterMünchenmiteinschloss.BeivielenPatientenwarnurdasTumorstadiumdes Ersttumorszuermitteln,beimerneutenodervielfachenRezidiv(in94%derFälle)wurdehingegen aufeineErmittlungdesTumorstadiumsverzichtet. 5.3.1.1.5Metastasen DieGruppederStrahlentherapie-Patienten,diezumZeitpunktdesTherapiestartskeineMetastasen aufwiesen,hatteneinstatistischsignifikantlängeresGesamtüberlebenalsPatientenmitMetastasen (p-Wert0,001;HR0,0295%CI0–1).DieGruppedervormetastasiertenPatientenzeigtedabeieine 5-Jahres-Überlebensratevon72%,beiMetastasen-freienPatientenbetrugdie5-JahresÜberlebensrate100%. 48 InderChemotherapie-GruppeergabsichimGesamtüberlebenkeinsignifikanterUnterschied zwischenvormetastasiertenundMetastasen-freienPatienten. Auffallendwar,dassdienichtmetastasiertenPatientenimfortgeschrittenenTumorstadiumunter HyperthermieeinhervorragendesGesamtüberlebenzeigten,ähnlichdemvonPatientenmiteinem niedrigenTumorstadium,dieaufgrundihresniedrigenRisikoprofilseineStandardtherapieerhielten. Esmussjedochdaraufhingewiesenwerden,dassaufgrundderstatistischnichtrelevantenGröße dernichtmetastasiertenPatientengruppe(6Patienten,19%)einevertiefendeStudienotwendig wäre,umdieseErgebnissezubestätigen. 5.3.1.1.6NeoadjuvanteTherapievs.adjuvanteTherapie Esstelltesichheraus,dassadjuvantbehandeltePatienteneinstatistischsignifikantbesseres GesamtüberlebenzeigtenalsPatientenderneoadjuvantenGruppe(p-Wert0,002;HR695%CI 2–21).WiebereitsinderEinleitungerwähnt,gibtesvieleStudien,diebeiderChemotherapievon fortgeschrittenenMammakarzinomenkeinenUnterschiedzwischenderneoadjuvantenundder adjuvantenBehandlungsoptionergaben.Eswurdedeshalbuntersucht,obdiepositiveAuswirkung aufdieadjuvantePatientengruppeaufdieHyperthermiezurückgeführtwerdenkann,oderobder GrundderErgebnisseineineruneinheitlichenRisikostrukturderGruppenliegt. SowohlimGrading,alsauchinderLinie,derVormetastasierungunddemKarnofsky-Indexwarendie PatienteninnerhalbderGruppen–adjuvantundneoadjuvant–vergleichbar.EinUnterschied bestandjedochdarin,dassetwa70%deradjuvantbehandeltenPatienteneinenpositiven Hormonrezeptor-StatusbeinegativemHer2neu-Statusaufwiesen,unddieMehrheitder risikoreichenHer2neu-positivenPatienteneineneoadjuvanteTherapieerhielten.Besondersder Hormonrezeptor-StatusbringtlautLiteratureineVerbesserungderPrognose;dasbessereOutcome fürHormonrezeptor-positivePatientenwurdeauchindervorliegendenUntersuchungbestätigt (sieheunten). Außerdemistfestzustellen,dasseineneoadjuvanteTherapieindieserPatientengruppebevorzugtals OptionbeinichtoperablenTumoreneingesetztwurde,umeineOperabilitätzuerreichen.Adjuvant behandeltePatientenwurdennachmeisterfolgreicherResektiontherapiertundhattendeshalbvon vornhereineinebesserePrognose. Eswäredemnachsinnvoll,einerandomisierteStudiezuerstellen,inderPatientenmitdemselben RisikoprofileineHyperthermie-Kombinationstherapieentwederneoadjuvantoderadjuvanterhalten. SokönntedieMöglichkeiteinervorteilhaftenBeeinflussungderHyperthermieaufdasOutcomevon adjuvantbehandeltenPatientengeprüftwerden. 49 AbhängigkeitderBehandlungvomHormonrezeptor-undHer2Neu-Status 5.3.1.1.7Hormonrezeptor-Status Insgesamt14PatientenhatteneinenHormonrezeptor-positivenTumor.Siezeigteneinlängeres LPFS,DPFSundOSalsHormonrezeptor-negativeTumore,wenngleichderUnterschiednurim Gesamtüberlebenstatistischsignifikantwar(p-Wert0,01;HR0,295%CI0,1–1).DieDatendieser AuswertungstimmensomitmitanderenStudienüberein.DerHormonrezeptor-Statusistein aussagekräftigerPrognosefaktorunderlaubteineAussageüberdasRisikoprofileines Mammakarzinom-Patienten. 5.3.1.2RadiatiomitHyperthermievs.ChemotherapiemitHyperthermie DiePatientinnen,dieeineChemotherapieerhielten,zeigteneinekürzereLPFS,DPFSundOS.Dies liegtamunterschiedlichenRisikoprofil.VonachtChemotherapie-PatientenwiesenfünfPatienten (63%)einentriple-negativenTumorauf–davonzweimiteineminflammatorischen Mammakarzinom.DieweiterendreiPatientenhatteneinennegativenHormonrezeptor-Statusbei ÜberexpressionvonHer2neu.InderRadiatio-GruppehattenlediglichvierPatienteneinentriplenegativenTumor(17%).EinschlechteresOutcomefürPatientenmittriple-negativemBrustkarzinom wurdeinvielenStudienbelegt.2012wurdeeineStudieveröffentlich,inder14.204Patientinnendes NationalComprehensiveCancerNetworkNCCNevaluiertwurden.Patientenmitpositivem HormonrezeptorundnegativemHer2neu-Statuswurdenmittriple-negativenPatientenverglichen. SowohlfürdasAuftretenvonlokalenundfernenMetastasenalsauchfürdasGesamtüberleben 50 zeigtesicheinsignifikanterVorteilderHormonpositiven/Her2neu-negativenPatientengegenüber dentriple-negativenPatienten.(Li,NU2012). WeitereFaktoren,dieeinenEinflussaufdasschlechteOutcomederChemotherapie-Gruppehaben könnten,warendieLiniederTherapie,dasGradingunddieMetastasierungzuTherapiebeginn.Alle achtPatientenderChemotherapie-GruppehattenG3-TumoreundMetastasen,davonvierPatienten mitlokalerMetastasierungundvierPatientenmitFernmetastasen.LediglichdieLiniederTherapie unterschiedsichnichtindenzweiGruppen(medianeLinie:4). 5.3.1.3FazitüberdieWirksamkeitderHyperthermie InBezugaufdas5-Jahres-Überlebensowieaufdas10-Jahres-ÜberlebenkonnteindieserAuswertung einzufriedenstellendesErgebnisbezüglichderWirksamkeitdervorgeschlagenenTherapieoption gezeigtwerden.WährenddieseErgebnissezwardurchauseinepositiveAussageüberdieEffektivität derTherapieindieserspeziellenPatientengruppeerlauben,kannjedochkeinstandhafter, wissenschaftlichakzeptablerVergleichzudenanerkannten,publiziertenStudiengemachtwerden. HiersindweiterführendeAnalysenmitausreichenddokumentiertenStaginguntersuchungenund follow-up-Bildgebungnotwendig.DieuntersuchtePatientenguppeistmit32Individuenkleinund kannsomitkaumstatistischsignifikante,reproduzierbareErgebnisseerbringen.Auchinanderen StudienzurHyperthermiebeimMammakarzinomkonntendurchschlechteRekrutierungnurkleine Patientengruppenevaluiertwerden. EinzusätzlicherSchwachpunktdieserUntersuchungbestehtdarin,dasskeineMöglichkeitbestand, dieobjektiveAnsprechratederTumorenaufdieTherapienachdenRECIST-Kriterienauszuwerten.In ZusammenarbeitmitderRadiologiedesKlinikumGroßhadernswurdezwarmitderRECISTorientiertenAuswertungbegonnen;eskonntenjedochkeinerelevantenErgebnisseermittelt werden,dabeivielenPatientenkeineausreichendeBildgebungvorhandenwar.Bei14von32 PatientenkonntenCT-AufnahmenimodernahedesTherapiezeitraumesermitteltwerden.Fünf davonhattennichtgenügendvieleCT-Aufnahmen,umnachRECIST-Kriterienausgewertetzu werden.AchtPatienten(57%)hatteneineprogressivedesease(PD).EinPatienthatteeinestable desease.BeidieserkleinenAnzahlanausgewertetenPatientenkonntekeineaussagekräftige statistischeBerechnungdurchgeführtwerden. 5.3.2VerträglichkeitundDurchführbarkeitderHyperthermie IndieserretrospektivenAuswertungwurdeeinSchwerpunktderUntersuchungenaufdie VerträglichkeitunddieDurchführbarkeitderHyperthermie-Kombinationstherapiegesetzt.Neben derEffektivitätderHyperthermieinderTumorbekämpfungistdieserPunktbesonderswichtig,um dieHyperthermiealsBehandlungsformweiterzuetablieren.BeifortgeschrittenenMammakarzinomPatienten,dieineinerVielzahlderFällemultimodalvortherapiertundgesundheitlichbeeinträchtigt sind,könnennurnebenwirkungsarmeTherapiezusätzevertretenwerden. 51 DieDatenzuToxizitätundDurchführbarkeitderhieruntersuchtenTherapieunterstützendie vorherrschendeLehrmeinung,dassdieHyperthermieeinVerfahrenmitguterVerträglichkeit darstellt. 5.3.2.1Toxizität ZudenamausführlichstendokumentiertenDatenderuntersuchtenPatientengruppegehörendie AngabenübereventuelleNebenwirkungenderTherapiemitHyperthermie.JederPatienterhieltnach jederHyperthermiesitzungeinenEvaluationsbogen,deru.a.AngabenzuSchmerzen, Allgemeinbefinden,Infektionen,Fieber,ÜbelkeitundErbrechenenthielt.Verbrennungenwurden getrenntvermerkt.AußerdemwurdendieLaborergebnissedokumentiert,dieeineAussageüberdie hämatologischeToxizitätwährenddesTherapiezeitraumssowieeinigeWochendanach ermöglichten. AnalogzudeninderEinleitungerwähntenStudienwardieHyperthermieauchinderuntersuchten Patientengruppegutverträglich. 5.3.2.1.1HämatologischeToxizität BezüglichderhämatologischenToxizitätwarenausschließlichAnämienerstenundzweitenGradeszu vermerken,14PatientenhattenkeineAnämie(44%).DieThrombozytopeniewareineäußerst selteneNebenwirkung,siekambeivierPatientenvor(2PatientenGrad1,zweiPatientenGrad2). BeikeinemPatientenkonnteeineLeukozytopeniebeobachtetwerdenundbeizweiPatientenkames zueinemgeringenAnstiegdesSerum-Kreatinins,entsprechendeinererstgradigenToxizität.Bei insgesamtdreiPatientenwurdenkeineLaborergebnisseinderAktevermerkt.DieToxizitätkam häufigerinderChemotherapie-Gruppevor;hierwurdeimBeispielderAnämienurbeieinem PatientenkeineToxizitätbeobachtet. 5.3.2.1.2Nicht-hämatologischeToxizität Auchdienicht-hämatologischeToxizitätstelltekeineEinschränkungfürdieTherapiedar.KeinPatient erlittVerbrennungen,lediglichachtPatientenwiesennachderHyperthermiesitzungeineRötungdes therapiertenArealsauf. VerbrennungenwarenseitdenAnfängenderForschungüberdieHyperthermieeinlimitierender Faktor.IndervorliegendenAnalysekonnteanalogzuvielenweiterenUntersuchungengezeigt werden,dassdieseNebenwirkungkeinewesentlicheRollemehrinderHyperthermiespielt,dadurch wissenschaftlicheStudienundtechnischenFortschrittdieserRisikofaktorerfolgreichminimiert wurde. Fieber,Infektionen,ÜbelkeitundAlopeziewurdeninderuntersuchtenPatientengruppeselten beobachtet:ZweiPatientenhattenzueinemZeitpunktinnerhalbderTherapieperiodeFieber aufgrundeinesInfektes.Zubetonengilt,dassessichdabeinichtumneutropenesFieberhandelte. BeivierPatienten,dieeineChemotherapieerhielten,wurdeÜbelkeitnotiert.InderRadiatio-Gruppe gabeskeineFällevonÜbelkeit.KeinPatientlittantherapieassoziiertemHaarausfall. 5.3.2.1.3Hyperthermie-assoziierteToxizität BeidenhyperthermiebedingtenNebenwirkungenwarenSchmerzenwährendderHyperthermiedas vorherrschendeProblem.24Patienten(75%)gabenSchmerzenan,diemitdemGefühlvon 52 „Brennen“beschriebenwurden;vierPatientenbeschriebendieses„Brennen“alslediglichleicht ausgeprägt.VierPatientenberichtetenzusätzlichvoneinemunangenehmenDruckgefühldurchden Applikator.ZweiPatientenverwendetenfürdieUmschreibungderSchmerzqualitätdenBegriff „stechend“.BeikeinemPatientenführtendieSchmerzenzueinemAbbruchderTherapie. 5.3.2.2Durchführbarkeit DieHyperthermiestelltesichindieserAnalysealsgutdurchführbaresTherapieverfahrendar.Beiden Radiotherapie-Patientenwurden94%dergeplantenHyperthermiesitzungendurchgeführt;beiden Chemotherapiepatientenwurden93%derChemotherapiezyklenund82%der Hyperthermiesitzungenausgeführt.InderChemotherapie-GruppewurdedieBehandlungmit25% häufigerabgebrochenalsinderRadiatio-Gruppe(8%).DerGrundfürdenAbbruchderTherapie bestandimWesentlicheninderProgressiondesTumors.Grundsätzlichzeigtsichjedochinbeiden GruppeneinezufriedenstellendeRateanvollständigdurchgeführtenTherapien. 5.3.2.3FazitVerträglichkeitundDurchführbarkeit GemeinsammitdenErgebnissenfürdieToxizitätdesuntersuchtenTherapieverfahrenkann festgehaltenwerden,dassdieHyperthermieindieservielfachvortherapiertenPatientengruppeeine Therapieoptionist,diekeineVerschlechterungdesGesundheitszustandesbewirktundeine verträglicheZusatztherapieist.BesondersdieEvaluationsbögen,diederPatientselbstnachjeder Therapiesitzungausfüllt,stelleneineoptimaleDokumentationsmöglichkeitdarunderlaubengültige undreproduzierbareAussagenüberdieHyperthermieverträglichkeit.Nebendenwissenschaftlichen ErkenntnissenzurEffektivitätderHyperthermiesolltedieseVerträglichkeiteinstabilerGrundpfeiler inderArgumentationfüreineTherapiekombinationmitHyperthermiesein. 53 5.4Ausblick AufgrunddergutenWirksamkeitundVerträglichkeitderHyperthermieinKombinationmitChemo- oderRadiotherapiebeimfortgeschrittenenMammakarzinomsolltenweiterführendeStudien durchgeführtwerden.DaindervorliegendenAnalysedieAussagekraftderErgebnisseinmehreren FällendurchdenEinflussvonRisikofaktoreneingeschränktwar,solltenPatientenkollektivemit einheitlichemRisikoprofilgewähltwerden.Beispielsweisekönnteeinausschließlichadjuvant behandeltesundHormonrezeptor-positivesPatientenkollektivuntersuchtwerdenundmiteiner ähnlichenPatientengruppeverglichenwerden,dienichtmitHyperthermiebehandeltwurde. AußerdemsollteeinegeeignethohePatientenzahluntersuchtwerden. DurchdenVergleicheinerReihehomogenerPatientengruppenkönntemöglicherweisedie WirksamkeitderHyperthermienochspezifischeralsbishernachgewiesenwerden.Sohätteman einensolideBasisfüreinegrößerangelegteStudie,dieletztendlichdieausschlaggebende BestätigungfürdieWirksamkeitderHyperthermieliefernkönnte.DieErgebnisseeinergroßenStudie würdendieAkzeptanzdesHyperthermietherapiekonzepteswesentlichverbessern. EinweitererzubeachtenderPunktistdievielfachbestätigteErkenntnis,dassdieHyperthermieeine ReduktionderStrahlendosiszulässt.BisherwurdedieseStrahlenreduktionbeiPatientenangewandt, diedurcheineVorbestrahlungkeineweitereRadiatiointherapeutischerDosiserhaltenkonnten.Hier wurdegezeigt,dassdurchdieHyperthermiedieseniedrigeStrahlendosisdenselbentherapeutischen EffekthattewiediealleinigeStrahlentherapieinhoherDosierung.IndiesemSinnekönnteeine Studiedurchgeführtwerden,inderauchlokalbegrenzteMammakarzinomemitniedriger StrahlendosisinKombinationmitHyperthermiebehandeltwerden–mitdemVorteil,dassdie StrahlenschädenreduziertwerdenunddemPatientendieMöglichkeiterhaltenbleibt,beieinem Rezidivweiterhinbestrahltwerdenzukönnen. 54 6Zusammenfassung InDeutschlandsterbenjedesJahr18.000FrauenaneinemMammakarzinom.Während MammakarzinomemitniedrigemRisikoprofildurcheineüberJahreoptimierteTherapieeine5Jahres-Überlebensratevonüber90%haben,liegtdieseRatebeiPatientenmitfortgeschrittenem oderrezidivierendemMammakarzinombeietwa55%.Durchneoadjuvanteundadjuvante RadiochemotherapiekonnteeinbesseresAnsprechenundeinehöhereRemissionsratedieser Tumoreerreichtwerden–dasGesamtüberlebenistjedochbeiWeitemnichtzufriedenstellend. DieHyperthermieisteinVerfahren,mitdemTumorekontrolliertaufeineTemperaturvon41-43°C erhitztwerden.DiesesVerfahrenhatsichalswirksamesAdditivinderTumortherapieetabliertund wirderfolgreichmitderChemo-undStrahlentherapiekombiniert.Beobachtetwirdsowohleine direktezytotoxischeWirkungdurchdieErhitzungdesTumorgebietes,alsaucheineChemo-und Radiosensitivierung,dieunteranderemaufeinerVerbesserungderPerfusionundaufder ReoxigenierungdesTumorsberuht.InderTherapiederWeichteilsarkomewurdedieHyperthermie 2010indieNationalComprehensiveCancerNetworkGuidelinesaufgenommenundzähltseitdemals anerkannteTherapieoptionfürdieseTumore. ÜberdieEffektivitätderHyperthermieinderTherapievonfortgeschrittenenMammakarzinomen gibteszahlreicheStudien.DieWirksamkeitwurdefürdieKombinationvonHyperthermiemit StrahlentherapieundmitChemotherapiebelegt.InderThermoradiotherapiekonntedergrößte EffektbeivorbestrahltenPatientengezeigtwerden,dadiesePatientennurmiteinergeringen, palliativenStrahlendosisbehandeltwerdenkönnen.DurchdieKombinationmitHyperthermie reichtendieseDosenaus,umeinvergleichbaresErgebniszuerhaltenwiebeiPatientenmit vollständigerStrahlendosis. DieErgebnissedieserStudienfandenvorallemaufgrunddergeringenPatientenzahlnochkeine AufnahmeininternationaleTherapierichtlinien. IndervorliegendenretrospektivenAnalysewurden32Patientenmitfortgeschrittenem MammakarzinomodereinemBrustwandrezidivausgewertet,dievon1995bis2011imKlinikum GroßhadernodereinerPartnerklinikmitHyperthermie–inKombinationmitStrahlen-oder Chemotherapie–behandeltwurden.ZweckdieserAuswertungwarzumeinendiestatistische BerechnungderprogressionsfreienZeitunddesGesamtüberlebensdieserPatientengruppe.Zum anderenwurdedieVerträglichkeitundDurchführbarkeitderTherapieuntersucht. DieErgebnissederAuswertungzeigeneine5-Jahres-Gesamtüberlebensratevon26,5%für Patienten,dieeineThermoradiotherapieerhieltenund37%fürPatientenderChemotherapieGruppe.DasResultatistimVergleichzuanderenHyperthermie-Studien(z.B.5-JahresÜberlebensratevon75%beiVujascovic,2010)deutlichungünstiger,wasvorallemdurchdiekleine PatientengruppesowiedurchuneinheitlicheRisikoprofilebedingtseinkönnte. DielückenhafteDurchführungderStaginguntersuchungenbeeinträchtigtedieMöglichkeiteiner AuswertungdesTumoransprechensaufdieTherapienachRECIST-Kriterienstark.Diesemangelnde VollständigkeitderDokumentationistalsweitererGrundfürdiegeringeValiditätderErgebnissezu nennen. 55 DurchdievorliegendeDissertationkonntebestätigtwerden,dassdieHyperthermieeinverträgliches, nebenwirkungsarmesTherapieadditivmitguterDurchführbarkeitdarstellt.DasvieldiskutierteRisiko vonVerbrennungendurchdieHyperthermieapplikationhatsichindieserPatientengruppenicht bestätigt. FürdieZukunftwäreeswichtig,StudienmitausführlicherBildgebung,homogenemRisikoprofilund statistischrelevantenPatientenzahlendurchzuführen. 56 7Anhang Tabelle1:ChemotherapiedesfortgeschrittenenMammakarzinoms(deVita,Lawrence,&Rosenberg, 2011) Trial No.OfPatients Design HazardRatio– HazardRatioOS DFS Paclitaxel M.D.Anderson 524 0,7 NR CALGB9344 3,121 0,83 0,82 ECTO 1.355 0,65 0,71 GEICAM9906 1248 0,63 0,74 HeCOG 595 0,86 0,41 NSABPB-28 3059 0,83 0,93 FACx8vs. Px4àFACx8 ACx4vs. ACx4àPx4 AàCMFvs. APàCMF FECx6vs. FECx4àPx8 Ex4àCMFvs. Ex3àPx3àCMFx3 ACx4vs. ACx4àPx4 Docetaxel BCIRG001 1491 0,72 0,70 ECOG2197 2885 0,92 0,92 BIG2-98 2887 0,86 0,92 NSABPB-27 2411 0,90 1.07 PACS01 1.999 0,83 0,73 TAXIT206 972 0,79 0,72 U.S.Oncology 1016 FACx6vs. DACx6 ACx4vs. ADx4 A+/-Cx4àCMFx3vs. Ax3àDx3àCMFx3vs. ADx4àCMFx3 ACx4vs. ACx4àDx4 FECx6vs. FECx3àDx3 EàCMFvs. EàDàCMF ACx4vs. DCx4 0,67 0,76 Trials:CALGBCancerandLeucemiaGroupB;ECTO,EuropeanCooperativeTrialinOperablebreast Cancer;GEICAM,GrupoEspanoldeInvestigaciónenCáncerdeMama;HeCOGHellenicCooperative OncologyGroup;NSABP,NationalSurgicalAdjuvantBreastandBowelProject;BCIRG,BreastCancer InternationalResearchGroup;ECOG,EasternCooperativeOncologyGroup;BIG,BreastInternational Group;PACS.Drugsindesigncolumn:F,5-fluorouracil;A,doxorubicin;C,cyclophosphamide;P, paclitaxel;M,Methotrexate;D,docetaxel;E,epirubicin; 57 Tabelle2:Strahlendosis PatientenNr. Gesamtdosis(Gy) Einzeldosis(Gy) Vorbestrahlung 1 40,0 2,0 ja 2 40,0 2,0 Ja 3 50,0 2,0 Ja 4 50,4 1,8 Nein 5 46,0 2,0 ja 6 46,0 2,0 Ja 7 50,4 1,8 nein 8 39,6 1,8 Ja 9 50,4 1,8 Ja 10 50,4 1,8 Ja 11 40,0 2,0 Ja 12 50,0 2,0 Ja 13 50,4 1,8 Ja 14 50,0 2,0 Ja 15 54,0 1,8 Ja 16 40,0 2,0 Ja 17 40,0 2,0 Ja 18 40,0 2,0 Ja 19 40,0 2,0 ja 20 50,0 2,0 Ja 21 50,4 1,8 Ja 22 64,8 1,8 nein 23 50,0 2,0 Ja 24 40,0 2,0 ja 58 Tabelle4:DurchführbarkeitderTherapie PatientenNr. AnzahlderCTXZyklen Radiatio AnzahlderHTBehandlungen Abbruch 1 6/8(75%) Nein 11/16(69%) Ja,wechselauf andereCTXwg. Hautmetastasen 2 5/5(100%) - 10/10(100%) - 3 6/8(75%) - 6/16(37,5%) Ja,Progress 4 9/9(100%) - 9/9(100%) - 5 4/4(100%) - 5/5(100%) - 6 11/11(100%) - 6/6(100%) - 7 9/9(100%) - 17/17(100%) - 8 3/3(100%) - 6/6(100%) - 9 - Ja 6/10(60%) Ja,Progress 10 - Ja 14/14(100%) - 11 - Ja 11/11(100%) - 12 - Ja 7/10(70%) Ja,Todan MagenCA 13 - Ja 8/10(80%) Ja,progress 14 - Ja 10/10(100%) - 15 - Ja 15/15(100%) - 16 - Ja 11/11(100%) - 17 - Ja 10/10(100%) - 18 - Ja 9/9(100%) - 19 - Ja 5/5(100%) - 20 - Ja 9/9(100%) - 21 - Ja 9/10(90%) Ja, pectanginöse Beschwerden 22 - Ja 9/9(100%) - 23 - ja 10/10(100%) - 24 - Ja 9/9(100%) - 59 25 - Ja 4/4(100%) - 26 - Ja 8/8(100%) - 27 - Ja 10/10(100%) - 28 - Ja 12/12(100%) - 29 - Ja 8/8(100%) - 30 - Ja 12/12(100%) - 31 - Ja 12/12(100%) - 32 - Ja 15/15(100%) - 60 8Literaturverzeichnis Abu-HamarAel,H.,Barakat,A.F.,Elgantiry,M.,&Nasef,H.H.(2010).Sequenceofradiationtherapy andchemotherapyasadjuvanttreatmentinbreastcancer.JEgyptNatlCancInst,22(1),95104. Aft,R.(2011).Bisphosphonatesinbreastcancer:clinicalactivityandimplicationsofpreclinicaldata. ClinAdvHematolOncol,9(3),194-205. Ao,A.,Morrison,B.J.,Wang,H.,Lopez,J.A.,Reynolds,B.A.,&Lu,J.(2011).Responseofestrogen receptor-positivebreastcancertumorspherestoantiestrogentreatments.PLoSOne,6(4), e18810.doi:10.1371/journal.pone.0018810 Bauerfeind,I.(2009).Mammakarzinome(I.BauerfeindEd.12thed.Vol.1).München:Zuckschwerdt Verlag. Bornstein,B.A.,Zouranjian,P.S.,Hansen,J.L.,Fraser,S.M.,Gelwan,L.A.,Teicher,B.A.,&Svensson, G.K.(1993).Localhyperthermia,radiationtherapy,andchemotherapyinpatientswithlocalregionalrecurrenceofbreastcarcinoma.IntJRadiatOncolBiolPhys,25(1),79-85. Bruggmoser,G.,Bauchowitz,S.,Canters,R.,Crezee,H.,Ehmann,M.,Gellermann,J.,...Society,E.T. C.i.t.I.W.G.H.i.t.G.C.(2011).Qualityassuranceforclinicalstudiesinregionaldeep hyperthermia.StrahlentherOnkol,187(10),605-610.doi:10.1007/s00066-011-1145-x Buzdar,A.U.,Jonat,W.,Howell,A.,Jones,S.E.,Blomqvist,C.P.,Vogel,C.L.,...Lee,D.(1998). Anastrozoleversusmegestrolacetateinthetreatmentofpostmenopausalwomenwith advancedbreastcarcinoma:resultsofasurvivalupdatebasedonacombinedanalysisof datafromtwomaturephaseIIItrials.ArimidexStudyGroup.Cancer,83(6),1142-1152. Cancer,C.G.o.H.F.i.B.(1997).Breastcancerandhormonereplacementtherapy:collaborative reanalysisofdatafrom51epidemiologicalstudiesof52,705womenwithbreastcancerand 108,411womenwithoutbreastcancer.CollaborativeGrouponHormonalFactorsinBreast Cancer.Lancet,350(9084),1047-1059. Carey,L.A.(2010).Directedtherapyofsubtypesoftriple-negativebreastcancer.Oncologist,15 Suppl5,49-56.doi:10.1634/theoncologist.2010-S5-49 Carlini,P.,Bria,E.,Giannarelli,D.,Ferretti,G.,Felici,A.,Papaldo,P.,...Cognetti,F.(2005).New aromataseinhibitorsassecond-lineendocrinetherapyinpostmenopausalpatientswith metastaticbreastcarcinoma:apooledanalysisoftherandomizedtrials.Cancer,104(7), 1335-1342.doi:10.1002/cncr.21339 CheangMCetal(2009).Ki67Index,HER2Status,andPrognosisofPatientsWithLuminalBBreast Cancer.JNatlCancerInst2009;101(10):736-50 CollaborativeGrouponHormonalFactorsinBreast,C.(2001).Familialbreastcancer:collaborative reanalysisofindividualdatafrom52epidemiologicalstudiesincluding58,209womenwith breastcancerand101,986womenwithoutthedisease.Lancet,358(9291),1389-1399.doi: 10.1016/S0140-6736(01)06524-2 Collins,J.A.,Blake,J.M.,&Crosignani,P.G.(2005).Breastcancerriskwithpostmenopausal hormonaltreatment.HumReprodUpdate,11(6),545-560.doi:10.1093/humupd/dmi028 Cosar,R.,Uzal,C.,Tokatli,F.,Denizli,B.,Saynak,M.,Turan,N.,...Kocak,Z.(2011).Postmastectomy irradiationinbreastinbreastcancerpatientswithT1-2and1-3positiveaxillarylymphnodes: istherearoleforradiationtherapy?RadiatOncol,6,28.doi:10.1186/1748-717X-6-28 Criscitiello,C.,Fumagalli,D.,Saini,K.S.,&Loi,S.(2011).Tamoxifeninearly-stageestrogenreceptorpositivebreastcancer:overviewofclinicaluseandmolecularbiomarkersforpatient selection.OncoTargetsTher,4,1-11.doi:10.2147/OTT.S10155 Darby,DarbyS,McGaleP,CorreaC,TaylorC,ArriagadaR,ClarkeM,CutterD,DaviesC,EwertzM, GodwinJ,GrayR,PierceL,WhelanT,WangY,PetoR.(2011).Effectofradiotherapyafter breast-conservingsurgeryon10-yearrecurrenceand15-yearbreastcancerdeath:metaanalysisofindividualpatientdatafor10,801womenin17randomisedtrials.Lancet.2011 Nov12;378(9804):1707-16.doi:10.1016/S0140-6736(11)61629-2.Epub2011Oct19 Dempke,W.(2006).LehrbuchHämato-Onkologie(1sted.Vol.1):HansHuberVerlag. 61 deVita,V.T.,Lawrence,T.S.,&Rosenberg,S.A.(2011).Cancer-Principles&PracticeofOncology (9thed.Vol.1).Philadelphia:Lippincott,Williams&Wilkins. Dietzel,F.(1983).Basicprinciplesinhyperthermictumortherapy.RecentResultsCancerRes,86,177190. EisenA,(2008)HormonetherapyandtheriskofbreastcancerinBRCA1mutationcarriers.NarodSA etalfortheHereditaryBreastCancerClinicalStudyGroupJNatlCancerInst100:1361–1367 Gellermann,J.,Wust,P.,Stalling,D.,Seebass,M.,Nadobny,J.,Beck,R.,...Felix,R.(2000).Clinical evaluationandverificationofthehyperthermiatreatmentplanningsystemhyperplan.IntJ RadiatOncolBiolPhys,47(4),1145-1156. Gonzalez-Angulo,A.M.,Morales-Vasquez,F.,&Hortobagyi,G.N.(2007).Overviewofresistanceto systemictherapyinpatientswithbreastcancer.AdvExpMedBiol,608,1-22. Gori,S.,Colozza,M.,Mosconi,A.M.,Franceschi,E.,Basurto,C.,Cherubini,R.,...Tonato,M.(2004). PhaseIIstudyofweeklypaclitaxelandtrastuzumabinanthracycline-andtaxane-pretreated patientswithHER2-overexpressingmetastaticbreastcancer.BrJCancer,90(1),36-40.doi: 10.1038/sj.bjc.6601485 Goss,P.E.,Winer,E.P.,Tannock,I.F.,&Schwartz,L.H.(1999).RandomizedphaseIIItrialcomparing thenewpotentandselectivethird-generationaromataseinhibitorvorozolewithmegestrol acetateinpostmenopausaladvancedbreastcancerpatients.NorthAmericanVorozoleStudy Group.JClinOncol,17(1),52-63. Gotzinger,P.,Gebhard,B.,Gnant,M.,Rudas,M.,Reiner,A.,&Jakesz,R.(1998).[Valueofpunch biopsyindiagnosisofpalpablebreasttumors.Aprospectiveanalysisof150patients]. Chirurg,69(10),1068-1071. Guarneri,V.,&Conte,P.F.(2004).Thecurabilityofbreastcancerandthetreatmentofadvanced desease.EurJNuclMedMolImaging,31,149-161. Hartmann,S.,Gerber,B.,Elling,D.,Heintze,K.,&Reimer,T.(2012).The70-GeneSignatureas PrognosticFactorforElderlyWomenwithHormoneReceptor-Positive,HER2-NegativeBreast Cancer.BreastCare(Basel),7(1),19-24.doi:10.1159/000336552 Haveman,J.,VanDerZee,J.,Wondergem,J.,Hoogeveen,J.F.,&Hulshof,M.C.(2004).Effectsof hyperthermiaontheperipheralnervoussystem:areview.IntJHyperthermia,20(4),371391.doi:10.1080/02656730310001637631 Hiddemann,W.,&Bartram,C.R.(2009).DieOnkologie(Vol.2).Berlin:Springer. Hiddemann,W.,&Bartram,C.R.(2010).DieOnkologie(W.Hiddemann&C.R.BartramEds.2nded. Vol.2).Berlin:Springer. Hirano,A.,Shimizu,T.,Kamimura,M.,Ogura,K.,Kim,N.,Setoguchi,Y.,...Fujibayashi,M.(2011). [Responsestoprimarysystemictherapyforbreastcancerasassessedbyhormonereceptor andHER2status].GanToKagakuRyoho,38(5),771-776. Hulka,B.S.(1996).Epidemiologyofsusceptibilitytobreastcancer.ProgClinBiolRes,395,159-174. Issels,R.D.,Lindner,L.H.,Verweij,J.,Wust,P.,Reichardt,P.,Schem,B.C.,...EuropeanSocietyfor Hyperthermic,O.(2010).Neo-adjuvantchemotherapyaloneorwithregionalhyperthermia forlocalisedhigh-risksoft-tissuesarcoma:arandomisedphase3multicentrestudy.Lancet Oncol,11(6),561-570.doi:10.1016/S1470-2045(10)70071-1 Issels,R.D.(2008).Hyperthermiaaddstochemotherapy.Europ.J.Cancer. doi:10.1016/j.ejca.2008.07.038 Jones,E.L.,Oleson,J.R.,Prosnitz,L.R.,Samulski,T.V.,Vujaskovic,Z.,Yu,D.,...Dewhirst,M.W. (2005).Randomizedtrialofhyperthermiaandradiationforsuperficialtumors.JClinOncol, 23(13),3079-3085.doi:10.1200/JCO.2005.05.520 Jones,E.L.,Prosnitz,L.R.,Dewhirst,M.W.,Marcom,P.K.,Hardenbergh,P.H.,Marks,L.B.,... Vujaskovic,Z.(2004).Thermochemoradiotherapyimprovesoxygenationinlocallyadvanced breastcancer.ClinCancerRes,10(13),4287-4293.doi:10.1158/1078-0432.CCR-04-0133 Kaaks,R.,Rinaldi,S.,Key,T.J.,Berrino,F.,Peeters,P.H.,Biessy,C.,...Riboli,E.(2005). Postmenopausalserumandrogens,oestrogensandbreastcancerrisk:theEuropean prospectiveinvestigationintocancerandnutrition.EndocrRelatCancer,12(4),1071-1082. doi:10.1677/erc.1.01038 62 Klijn,J.G.,Blamey,R.W.,Boccardo,F.,Tominaga,T.,Duchateau,L.,Sylvester,R.,...Treatmentof,C. (2001).Combinedtamoxifenandluteinizinghormone-releasinghormone(LHRH)agonist versusLHRHagonistaloneinpremenopausaladvancedbreastcancer:ameta-analysisoffour randomizedtrials.JClinOncol,19(2),343-353. Komarova,T.V.,Kosorukov,V.S.,Frolova,O.Y.,Petrunia,I.V.,Skrypnik,K.A.,Gleba,Y.Y.,& Dorokhov,Y.L.(2011).Plant-madetrastuzumab(herceptin)inhibitsHER2/Neu+cell proliferationandretardstumorgrowth.PLoSOne,6(3),e17541.doi: 10.1371/journal.pone.0017541 Lagendijk,J.J.,VanRhoon,G.C.,Hornsleth,S.N.,Wust,P.,DeLeeuw,A.C.,Schneider,C.J.,... Gromoll,C.(1998).ESHOqualityassuranceguidelinesforregionalhyperthermia.IntJ Hyperthermia,14(2),125-133. LinderetIssels(2011).Hyperthermiainsofttissuesarcoma.CurrentTreatmentOptionsinOncology (2011)12:12-20 LinthorstM,vanGeelAN,BaaijensM,AmezianeA,GhideyW,vanRhoonGC,vanderZeeJ.(2013): Re-irradiationandhyperthermiaaftersurgeryforrecurrentbreastcancer.RadiotherOncol. 2013Nov;109(2):188-93.doi:10.1016/j.radonc.2013.05.010.Epub2013Jun3. LinthorstM,BaaijensM,Wiggenraad3,CreutzbergC,GhideyW,vanRhoonGC,vanderZeeJ. (2015):Localcontrolrateafterthecombinationofre-irradiationandhyperthermiafor irresectablerecurrentbreastcancer:Resultsin248patients.RadiotherOncol.2015May19. pii:S0167-8140(15)00215-7.doi:10.1016/j.radonc.2015.04.019. Manjili,M.H.,Najarian,K.,&Wang,X.Y.(2012).Signaturesoftumor-immuneinteractionsas biomarkersforbreastcancerprognosis.FutureOncol,8(6),703-711.doi:10.2217/fon.12.57 Martin,M.,Villar,A.,Sole-Calvo,A.,Gonzalez,R.,Massuti,B.,Lizon,J.,...GeicamGroup,S.(2003). Doxorubicinincombinationwithfluorouracilandcyclophosphamide(i.v.FACregimen,day1, 21)versusmethotrexateincombinationwithfluorouracilandcyclophosphamide(i.v.CMF regimen,day1,21)asadjuvantchemotherapyforoperablebreastcancer:astudybythe GEICAMgroup.AnnOncol,14(6),833-842. Mavaddat,N.,Pharoah,P.D.,Blows,F.,Driver,K.E.,Provenzano,E.,Thompson,D.,...Antoniou,A. C.(2010).Familialrelativerisksforbreastcancerbypathologicalsubtype:apopulationbasedcohortstudy.BreastCancerRes,12(1),R10.doi:10.1186/bcr2476 Milani,V.,Pazos,M.,Issels,R.D.,Buecklein,V.,Rahman,S.,Tschoep,K.,...Schaffer,M.(2008). Radiochemotherapyincombinationwithregionalhyperthermiainpreirradiatedpatients withrecurrentrectalcancer.StrahlentherOnkol,184(3),163-168.doi:10.1007/s00066-0081731-8 Ott,O.J.,Issels,R.D.,&Wessalowsky,R.(2010).HyperthermiainOncology:Principlesand TherapeuticOutlook(1sted.Vol.1):UNI-MEDVerlag. Overgaard,J.,&Overgaard,M.(1987).Hyperthermiaasanadjuvanttoradiotherapyinthetreatment ofmalignantmelanoma.IntJHyperthermia,3(6),483-501. Paik,S.,Shak,S.,Tang,G.,Kim,C.,Baker,J.,Cronin,M.,...Wolmark,N.(2004).Amultigeneassayto predictrecurrenceoftamoxifen-treated,node-negativebreastcancer.NEnglJMed,351(27), 2817-2826.doi:10.1056/NEJMoa041588 Petru,E.,Jonat,W.,Fink,D.,&Köchli,O.(2005).PraxisbuchGynäkologischeOnkologie(O.KöchliEd. Vol.1).Heidelberg:Springer. Phipps,A.I.,Li,C.I.,Kerlikowske,K.,Barlow,W.E.,&Buist,D.S.(2010).Riskfactorsforductal, lobular,andmixedductal-lobularbreastcancerinascreeningpopulation.CancerEpidemiol BiomarkersPrev,19(6),1643-1654. Sauer,R.(2010).StrahlentherapieundOnkologie(R.SauerEd.5thed.Vol.1).München:Elsevier. Shenkier,T.,Weir,L.,Levine,M.,Olivotto,I.,Whelan,T.,Reyno,L.,...TreatmentofBreast,C. (2004).Clinicalpracticeguidelinesforthecareandtreatmentofbreastcancer:15. TreatmentforwomenwithstageIIIorlocallyadvancedbreastcancer.CMAJ,170(6),983994. 63 Shrimpton,P.C.,Hillier,M.C.,Lewis,M.A.,&Dunn,M.(2005).DosesfromComputedTomography (CT)ExaminationsintheUK-2003Review(Vol.1).Chilton,Oxfordshire:Nationalradiological ProtectionBoard. Telli,Melinda(2015)EvolvingTreatmentStrategiesforTriple-NegativeBreastCancer.JNatlCompr CancNetw.2015May;13(5Suppl):652-4. TherasseP1,ArbuckSG,EisenhauerEA,WandersJ,KaplanRS,RubinsteinL,VerweijJ,VanGlabbeke M,vanOosteromAT,ChristianMC,GwytherSG.(2000).Newguidelinestoevaluatethe responsetotreatmentinsolidtumors.EuropeanOrganizationforResearchandTreatmentof Cancer,NationalCancerInstituteoftheUnitedStates,NationalCancerInstituteofCanada.J NatlCancerInst.2000Feb2;92(3):205-16. Tschoep-Lechner,K.E.,Milani,V.,Berger,F.,Dieterle,N.,Abdel-Rahman,S.,Salat,C.,&Issels,R.D. (2013).Gemcitabineandcisplatincombinedwithregionalhyperthermiaassecond-line treatmentinpatientswithgemcitabine-refractoryadvancedpancreaticcancer.IntJ Hyperthermia,29(1),8-16.doi:10.3109/02656736.2012.740764 U,R.,Noell,K.T.,Worde,B.T.,Woodward,K.T.,Fishburn,R.I.,Miller,L.S.,&Herskovic,A.M. (1982).Hyperthermiaincancertreatment:currentandfutureprospects.GanToKagaku Ryoho,9(3),343-356. Untch,M.(2010).TargetedTherapyforEarlyandLocallyAdvancedBreastCancer.BreastCare (Basel),5(3),144-152.doi:10.1159/000315047 Urano,M.,&Douple,E.B.(1988).HyperthermiaandOncology:Thermaleffectsoncellsandtissues (Vol.1):VSP. Verkooijen,H.M.,Fioretta,G.M.,Rapiti,E.,Bonnefoi,H.,Vlastos,G.,Kurtz,J.,...Bouchardy,C. (2005).Patients'refusalofsurgerystronglyimpairsbreastcancersurvival.AnnSurg,242(2), 276-280. Vici,P.,Colucci,G.,Giotta,F.,Sergi,D.,Filippelli,G.,Perri,P.,...DiLauro,L.(2011).Amulticenter prospectivephaseIIrandomizedtrialofepirubicin/vinorelbineversuspegylatedliposomal doxorubicin/vinorelbineasfirst-linetreatmentinadvancedbreastcancer.AGOIMstudy.J ExpClinCancerRes,30,39.doi:10.1186/1756-9966-30-39 Wang,S.,Saboorian,M.H.,Frenkel,E.,Hynan,L.,Gokaslan,S.T.,&Ashfaq,R.(2000).Laboratory assessmentofthestatusofHer-2/neuproteinandoncogeneinbreastcancerspecimens: comparisonofimmunohistochemistryassaywithfluorescenceinsituhybridisationassays.J ClinPathol,53(5),374-381. Williams,L.J.,Kunkler,I.H.,King,C.C.,Jack,W.,&vanderPol,M.(2011).Arandomisedcontrolled trialofpost-operativeradiotherapyfollowingbreast-conservingsurgeryinaminimum-risk population.Qualityoflifeat5yearsinthePRIMEtrial.HealthTechnolAssess,15(12),i-xi,157.doi:10.3310/hta15120 Wust,P.,Hildebrandt,B.,Sreenivasa,G.,Rau,B.,Gellermann,J.,Riess,H.,...Schlag,P.M.(2002). Hyperthermiaincombinedtreatmentofcancer.LancetOncol,3(8),487-497. Zagar,T.M.,Oleson,J.R.,Vujaskovic,Z.,Dewhirst,M.W.,Craciunescu,O.I.,Blackwell,K.L.,... Jones,E.L.(2010).Hyperthermiaforlocallyadvancedbreastcancer.IntJHyperthermia, 26(7),618-624.doi:10.3109/02656736.2010.501051 ZagarTM1,VujaskovicZ,FormentiS,RugoH,MuggiaF,O'ConnorB,MyersonR,StaufferP,HsuIC, DiederichC,StraubeW,BossMK,BoicoA,CraciunescuO,MaccariniP,NeedhamD,BorysN, BlackwellKL,DewhirstMW.)2014):TwophaseIdose-escalation/pharmacokineticsstudiesof lowtemperatureliposomaldoxorubicin(LTLD)andmildlocalhyperthermiainheavily pretreatedpatientswithlocalregionallyrecurrentbreastcancer.IntJHyperthermia.2014 Aug;30(5):285-94.doi:10.3109/02656736.2014.936049. 64 9Danksagung BeiProf.Dr.med.W.Hiddemann,DirektorderMedizinischenKlinikundPoliklinikIIIamKlinikumder UniversitätMünchen,möchteichmichdafürbedanken,dassichdiesesinteressanteThemafür meineDissertationwählenkonnte. FürdieäußerstkompetenteundgleichzeitigwohlwollendeUnterstützungsowiefürseinewertvollen AnregungendankeichHerrnProf.Dr.med.R.D.Issels.EbensomöchteichvonHerzenFrauDr.med. KatharinaLechnerfürihreBetreuungwährendzweiJahrendanken. EsunterstütztemichmitvielHerzlichkeitundEinsatzdasHyperthermie-Team,allenvoranHerrnDipl. Ing.S.Abdel-RahmannundFrauMartinaLahm,sowieHerrDr.rer.biol.hum.MichaelLausekerfür dieKlärungeinigerFragenimBereichderStatistik.IhnenallenmöchteichmeinenaufrichtigenDank aussprechen. MeinerMuttermöchteichdafürdanken,dasssiemeinerDoktorarbeitdenletztenstilistischenSchliff verliehenhat. MeinbesondererDankgiltFrauNelliDieterle,diemirmeineFragenvonderAktensuchebiszur statistischenAuswertungbeantwortenkonnte;dabeiunterstütztesiemichnichtnurmitgroßer fachlicherKompetenz,sondernauchmitihrerunerschöpflichenHilfsbereitschaftundFreundlichkeit. 65 Pernthaler, Nina