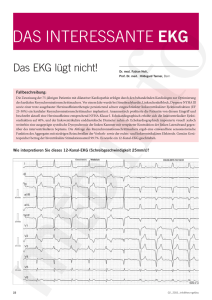
Psychiatrische Folgen der Tiefenhirnstimulation bei Parkinson
Werbung

Aus der Abteilung für Psychiatrie und Psychotherapie des Universitätsklinikums Freiburg (Direktor: Professor Dr. med. Mathias Berger) Psychiatrische Folgen der Tiefenhirnstimulation bei ParkinsonPatienten unter Einbezug ethischer Aspekte INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i. Br. vorgelegt 2006 von Constanze Abshagen geboren in Heidelberg 2 Dekan: Prof. Dr. Christoph Peters 1. Gutachter: Prof. Dr. Klaus Lieb 2. Gutachter: Prof. Dr. Guido Nikkhah Jahr der Promotion: 2007 3 Inhaltsverzeichnis Abkürzungsverzeichnis ......................................................................................................7 A. EINLEITUNG..................................................................................................................8 1. Indikationen der Tiefenhirnstimulation ...........................................................................8 2. Mögliche Wirkungsmechanismen der Tiefenhirnstimulation ..........................................8 3. Methodik ......................................................................................................................10 B. HAUPTTEIL .................................................................................................................11 1. Depression bei Tiefenhirnstimulation........................................................................11 1.1 Studienergebnisse.............................................................................................11 1.1.1 Verbesserung depressiver Symptomatik bei Tiefenhirnstimulation ............11 1.1.2 Verbesserung der Depression durch Stimulation und akute Verschlechterung depressiver Symptomatik, wenn die Stimulation ausgeschaltet wird......................................................................................12 1.1.3 Keine signifikante Veränderung depressiver Symptomatik bei Tiefenhirnstimulation ..................................................................................13 1.1.4 Auftreten leichter depressiver Symptomatik bei Tiefenhirnstimulation .......14 1.1.5 Auftreten moderater Depression bei Tiefenhirnstimulation.........................16 1.1.6 Auftreten schwerer Depression und Suizidalität bei Tiefenhirnstimulation .16 1.1.7 Auftreten von Depressionen, deren Schweregrad von den Autoren nicht definiert wurde, bei Tiefenhirnstimulation ...................................................18 1.1.8 Akute stimulationsinduzierte Depression....................................................20 1.1.9 Sonstiges....................................................................................................21 1.2 Depressionstests ...............................................................................................23 1.2.1 Auswertung der Artikel nach verwendeten Depressionstests.....................23 1.2.2 Verteilung der Depressionstests (unter Berücksichtigung der 38 Artikel, die einen Depressionstest angegeben haben) .................................................25 1.2.3 Verteilung der Depressionstests bei den Patienten mit verbesserter oder unveränderter Depression ..........................................................................25 1.2.4 Verteilung der Depressionstests bei den Patienten mit Depression ...........26 1.3 Mögliche Ursachen für Depression bei Tiefenhirnstimulation ............................27 1.3.1 Positive Anamnese für Depressionen.........................................................27 1.3.2 Depression durch Stimulation des Ncl. subthalamicus ...............................29 1.3.3 Depression durch Stimulation von Neuronen und Nervenbahnen, die den Ncl. subthalamicus umgeben .....................................................................30 1.3.4 Stimulation anderer Gehirnareale...............................................................32 1.3.5 Psychosoziale Aspekte...............................................................................33 1.3.6 Progression der Parkinson-Erkrankung......................................................34 1.3.7 Alter der Patienten......................................................................................37 1.3.8 Postoperative Reduktion der Parkinson-Medikation...................................37 4 1.4 Therapie und Verlauf der Depression ................................................................38 1.4.1 Ansprechrate auf Antidepressiva................................................................39 1.4.2 Ansprechrate auf Dopaminagonisten .........................................................40 1.4.3 Ansprechrate auf Änderungen der Stimulationsparameter bzw. Ausschalten der Stimulation ...........................................................................................40 1.4.4 Überblick: Verlauf der Depression ..............................................................41 1.4.5 Suizid und Suizidversuch ...........................................................................41 2. Euphorie/aggressives Verhalten, Hypersexualität/ enthemmtes Verhalten und Hypomanie/Manie bei Tiefenhirnstimulation .............................................................42 2.1 Studienergebnisse.............................................................................................42 2.1.1 Lachen, Euphorie, aggressives Verhalten ..................................................42 2.1.2 Hypersexualität und enthemmtes Verhalten...............................................43 2.1.3 Hypomanie, Manie und bipolare affektive Störung .....................................44 2.2 Mögliche Ursachen............................................................................................46 2.2.1 Positive Anamnese für psychiatrische Erkrankungen.................................46 2.2.2 Stimulation des Ncl. subthalamicus oder umgebender Strukturen und Beeinflussung von neuronalen Schleifensystemen ....................................48 2.2.3 Bedeutung von L-Dopa...............................................................................51 2.2.4 Verbesserung der Motorik ..........................................................................52 2.3. Therapie und Verlauf .........................................................................................53 2.3.1 Therapie von Lachen, Euphorie, aggressivem Verhalten ...........................53 2.3.2 Therapie und Verlauf von Hypersexualität, enthemmtem Verhalten und abnormal sexuellem Verhalten ..................................................................54 2.3.3. Therapie und Verlauf von Hypomanie, Manie und bipolarer affektiver Störung.......................................................................................................54 2.3.4 Suizidalität ..................................................................................................57 3. Angst bei Tiefenhirnstimulation.................................................................................58 3.1 Studienergebnisse.............................................................................................58 3.1.1 Verbesserung von Angst bei Tiefenhirnstimulation ....................................58 3.1.2 Verbesserung der Angst während Stimulation und Auftreten von AngstSymptomatik, wenn die Stimulation ausgeschaltet wurde ..........................59 3.1.3 Keine Veränderung von Angstsymptomatik bei Tiefenhirnstimulation........60 3.1.4 Angst bei Tiefenhirnstimulation ..................................................................61 3.2. 3.3 Verteilung der Tests zur Evaluation von Angst ..................................................62 Mögliche Ursachen für das Auftreten von Angst und für die Verbesserung von Angstsymptomatik bei Tiefenhirnstimulation......................................................63 3.3.1 Positive Anamnese für psychiatrische Erkrankungen.................................63 3.3.2 Stimulation bestimmter Gehirnareale .........................................................65 3.3.3 Bedeutung von L-Dopa...............................................................................66 3.3.4 Psychosoziale Aspekte...............................................................................68 5 3.4 Therapie und Verlauf der Angstsymptomatik.....................................................69 3.4.1 Änderungen der Stimulationsparameter .....................................................69 3.4.2 Medikamentöse Therapie ...........................................................................69 4. Psychotische Symptome bei Tiefenhirnstimulation...................................................70 4.1 Studienergebnisse.............................................................................................70 4.2 Mögliche Ursachen für psychotische Symptome bei Tiefenhirnstimulation ......72 4.2.1 Positive Anamnese.....................................................................................72 4.2.2 Stimulation des Ncl. subthalamicus ............................................................72 4.2.3 Bedeutung von L-Dopa...............................................................................73 4.2.4 Koexistenz von Lewy-Körperkrankheit bzw. Übergang der ParkinsonErkrankung in Lewy-Körperkrankheit.........................................................74 4.3. 5. Therapie und Verlauf der psychotischen Symptome ........................................75 Verwirrtheitszustände und Delir bei Tiefenhirnstimulation ........................................76 5.1 Studienergebnisse.............................................................................................76 5.1.1 Verwirrtheitszustände bei Tiefenhirnstimulation .........................................76 5.1.2 Delir bei Tiefenhirnstimulation ....................................................................78 5.2 Mögliche Ursachen für Verwirrtheit und Delir bei Tiefenhirnstimulation............78 5.2.1 Stimulation als Ursache..............................................................................78 5.2.2 Hirnschädigung ..........................................................................................79 5.2.3 Alter ............................................................................................................80 5.2.4 Bedeutung der Antiparkinson-Medikation...................................................81 5.3 6. Therapie und Verlauf von Verwirrtheitszuständen .............................................81 Kognitive Störungen und Demenz bei Tiefenhirnstimulation ....................................81 6.1 Studienergebnisse.............................................................................................81 6.1.1 Demenz bei Tiefenhirnstimulation ..............................................................82 6.1.2 Dramatische Verschlechterung der Kognition ............................................83 6.1.3 Verschlechterung der Kognition .................................................................84 6.1.4 Störung der Exekutivfunktion bei Tiefenhirnstimulation ..............................86 6.2 Mögliche Ursachen für das Auftreten von Störungen der Kognition und der Exekutivfunktion sowie von Demenz bei Tiefenhirnstimulation..........................87 6.2.1 Kognitive Defizite vor der Operation ...........................................................87 6.2.2 Stimulation des Globus pallidus internus....................................................88 6.2.3 Hirnschädigung ..........................................................................................89 6.2.4 Bedeutung von L-Dopa...............................................................................89 6.2.5 Alter der Patienten......................................................................................90 6.2.6 Bildungsstand der Patienten.......................................................................91 6.2.7 Koexistenz von Lewy-Körperkrankheit bzw. Übergang der ParkinsonErkrankung in Lewy-Körperkrankheit.........................................................92 6 6.2.8 6.3 C. 1. Natürliche Progression der Parkinson-Erkrankung.....................................92 Therapie und Verlauf von kognitiven Störungen und Demenz...........................93 DISKUSSION ...............................................................................................................95 Zusammenfassung der Studienergebnisse ..............................................................95 1.1 Depression bei Tiefenhirnstimulation.................................................................95 1.1.1 Keine Veränderung oder Verbesserung depressiver Symptomatik nach Tiefenhirnstimulation ..................................................................................95 1.1.2 Depressive Symptomatik bei Tiefenhirnstimulation ....................................96 1.2. Enthemmtes Verhalten ......................................................................................98 1.2.1 Lachen, Euphorie, aggressives Verhalten ..................................................98 1.2.2 Hypersexualität und enthemmtes Verhalten...............................................99 1.2.3 Hypomanie, Manie und bipolare affektive Störung .....................................99 1.3 Angst ...............................................................................................................100 1.3.1 Verbesserung von Angst ..........................................................................100 1.3.2 Verbesserung der Angst während Stimulation und Auftreten von Angstsymptomatik, nachdem die Stimulation ausgeschaltet wurde ..................101 1.3.3 Keine Änderung der Angstsymptomatik bei Tiefenhirnstimulation............101 1.3.4 Angst bei Tiefenhirnstimulation ................................................................101 1.4 Psychotische Symptome bei Tiefenhirnstimulation..........................................102 1.5 Verwirrtheitszustände und Delir bei Tiefenhirnstimulation ...............................103 1.6 Kognitive Störungen und Demenz bei Tiefenhirnstimulation ...........................104 2. Folgerungen für die Patientenauswahl ...................................................................105 3. Ethische Überlegungen ..........................................................................................107 D. ZUSAMMENFASSUNG .............................................................................................113 E. ANHANG....................................................................................................................114 Abkürzungsverzeichnis...........................................................................................114 Tabellarische Übersicht der verwendeten Artikel....................................................115 1. 2. F. LITERATURVERZEICHNIS .......................................................................................150 G. DANKSAGUNG..........................................................................................................168 7 Abkürzungsverzeichnis AMPD-AT Association of Methodology and Documentation in Psychiatric Anxiety BDI Beck Depression Inventory CT Computer-Tomogramm D Dopaminrezeptor (1, 2 ..) fMRI funktionelle Magnetresonanztomographie/ functional Magnetic Resonace Imaging GABA Gammaaminobuttersäure/ Gamma Amino Butyric Acid IDC-10 International Classification of Diseases, 10 th Revision:Klassifikation mentaler und Verhaltens-Störungen durch die Weltgesundheitsorganisation HDRS Hamilton Depression Rating Scale MMSE Mini-Mental State Examination MRI Magnetresonanztomographie/Magnetic Resonance Imaging Ncl Nucleus Na+ Natrium PET Positronen-Emmisions-Tomographie POMS Profile of mood States SSRI Selektiver Serotonin–Wiederaufnahmehemmer/Selective Serotinin Reuptake Inhibitor SPECT Single-Photon-Emmissions-Computer-Tomographie UPDRS Unified Parkinson´s Disease Rating Scale VIM (Nucleus) ventralis intermedius 8 A. EINLEITUNG 1. Indikationen der Tiefenhirnstimulation Bei der Methode der Tiefenhirnstimulation werden bestimmte Gehirnstrukturen durch dauerhaft implantierte Elektroden kontinuierlich stimuliert, wobei die Elektroden mit einem dauerhaft implantierten Stimulator verbunden sind. Ursprünglich wurde die Hirnstimulation bei Frequenzen zwischen 30 bis 60 Hertz - zur Schmerztherapie verwendet. Die Tiefenhirnstimulation (Frequenzen über 100 Hertz) wurde erstmals 1997 anstatt der bisher üblichen Thalamotomie angewendet, da man festgestellt hatte, dass die Stimulation des Thalamus mit hohen Frequenzen genau den gleichen Effekt aufwies wie die Thalamotomie, die zur Therapie von extrapyramidal- motorischen Erkrankungen, vor allem des Morbus Parkinson, eingesetzt wurde. Bald wurde die Tiefenhirnstimulation auch für andere Gehirnareale angewendet, vor allem für den Ncl. subthalamicus, der in der motorischen Kontrolle innerhalb der Basalganglien eine zentrale Rolle einnimmt und dessen Stimulation mit hohen Frequenzen die ParkinsonSymptome wirksam unterdrückt. Auch das Gebiet der zu therapierenden Krankheiten wurde nach und nach ausgeweitet: Die Tiefenhirnstimulation fand Anwendung in der Therapie der Epilepsie (Stimulation der anterioren Nuclei des Thalamus, des Ncl. subthalamicus und des Centrum medianum parafascicularis), des Cluster-Kopfschmerzes (Stimulation des posterioren Hypothalamus) und in der Psychochirurgie, hier vor allen Dingen zur Behandlung von Zwangserkrankungen (Stimulation des anterioren Schenkels der Capsula interna, des Ncl. accumbens und des Ncl. subthalamicus). 2. Mögliche Wirkungsmechanismen der Tiefenhirnstimulation Die Praxis zeigt, dass die Stimulation des Ncl. ventralis intermedius des Thalamus, des Globus pallidus internus und des Ncl. subthalamicus einen inhibitorischen Effekt auf diese Gehirnareale ausübt und somit eine ähnliche Wirkung hat wie operative Läsionen (z. B. durch Elektrokoagulation). Damit ebendiese Wirkung Tiefenhirnstimulation Frequenzen über 100 Hertz benötigt. eintritt, werden bei der 9 Es werden verschiedene Hypothesen zum Wirkmechanismus der Tiefenhirnstimulation diskutiert: Benabid und Mitarbeiter (2003) halten zwei Wirkmechanismen für möglich: Die Tiefenhirnstimulation könnte das pathologische Entladungsmuster der Neurone durch Membraninteraktionen oder synaptische Inhibition vollständig supprimieren oder aber so verändern, dass es quasi “neutralisiert" wird und einer Suppression gleichkommt: Zielneurone der stimulierten Neurone erhielten in beiden Fällen keine Impulse mehr. Einen weiteren möglichen Wirkmechanismus sehen Benabid et al. (2003) darin, dass die Tiefenhirn-stimulation, statt einen inhibitorischen Effekt auszuüben, einen exitatorischen Effekt auf eine Folge von Synapsen haben könnte, der in einem inhibitorischem Impuls resultieren würde. Zudem könnten Veränderungen wie neuronale Plastizität und Neuroprotektion bei den therapeutischen Erfolgen der Langzeittherapie mit Tiefenhirnstimulation von Bedeutung sein. Garcia et al. (2003) untersuchten die Effekte der Tiefenhirnstimulation auf Ncl. subthalamicus- Neurone von Ratten und fanden heraus, dass die Stimulation durch Aktivierung membranständiger Na+-Kanäle zwei Wirkungen hat: Sie unterdrückt die pathologische Spontanaktivität der Ncl. subthalamicus- Neurone und bewirkt ein anderes Aktivitätsmuster (Spike-Entladungen von 64-84 Hertz).Die Autoren vermuten, dass die veränderte neuronale Aktivität im Ncl. subthalamicus sich orthodrom und antidrom ausbreitet und somit die abnormale synchronisierte Aktivität, die bei der ParkinsonErkankung zwischen Globus pallidus externus und internus, Ncl. subthalamicus und corticothalamischen Schleifen besteht, günstig beeinflusst und verändert. Der genaue Wirkungsmechanismus der Tiefenhirnstimulation ist bis heute noch nicht vollständig verstanden und es ist auch nicht bekannt, wie weit sich die Tiefenhirnstimulation im Gehirn ausbreitet und andere Areale unerwünschterweise mit beeinflusst. Immer wieder wird in Artikeln von psychiatrischen Veränderungen oder kognitiven Störungen, die nach der Elektroden-Implantation auftraten, berichtet. Oft bleibt unklar, ob dies als Nebenwirkung der Tiefenhirnstimulation zu verstehen ist oder ob psychiatrischen und kognitiven Störungen eine andere Ursache zugrunde liegt. Ziel der vorliegenden Arbeit war daher, aus der verfügbaren Literatur einen Überblick zu gewinnen, wie oft psychiatrische und kognitive Störungen nach Tiefenhirnstimulation bisher auftraten und welche möglichen Ursachen sie haben könnten. Darüber hinaus sollten mögliche Konsequenzen für die Indikationsstellung 10 und ethische Vertretbarkeit dieser therapeutischen Intervention diskutiert werden. 3. Methodik Über pubmed und Ovid wurde in medline englische, deutsche, französische und niederländische Literatur bis einschließlich August 2004 überprüft. Als Suchbegriffe wurden eingegeben: Deep brain stimulation and parkinson, deep brain stimulation and obsessive compulsive disorder (unter den Artikeln, die über diese zwei Begriffe ermittelt wurden, wurden solche Artikel herausgesucht, die von psychiatrischen und/oder kognitiven Störungen nach Tiefenhirnstimulation berichteten und/oder die psychiatrische Symptome ihrer Patienten evaluiert hatten) , deep brain stimulation and depression, deep brain stimulation and affective, deep brain stimulation and mania, deep brain stimulation and cognition. Die über diese Suchbegriffe ermittelten Artikel wurden entsprechend der betreffenden und/oder der evaluierten Symptomatik folgenden Themen zugeordnet: Keine Veränderung oder Verbesserung depressiver Symptomatik, Depressive Symptomatik; Lachen/ Euphorie/ aggressives Verhalten, Hypersexualität/ enthemmtes Verhalten, Hypomanie/Manie/ bipolare affektive Störung; Verbesserung bzw. keine Änderung von Angstsymptomatik, Angstsymptomatik; Psychotische Symptome; Verwirrtheitszustände/ Delir; Kognitive Störungen/Demenz. 11 B. HAUPTTEIL 1. Depression bei Tiefenhirnstimulation 1.1 Studienergebnisse 1.1.1 Verbesserung depressiver Symptomatik bei Tiefenhirnstimulation In einigen Artikeln wird berichtet, dass die Komorbidität einer Depression bei Zwangspatienten von Tiefenhirnstimulation profitiert. So beschreiben Anderson and Ahmed (2003) bei einer Patientin, Gabriels et al. (2003) bei 2 von 3 Patienten und Nuttin et al. (1999) bei einem von vier Patienten eine Verbesserung depressiver Symptomatik nach unioder bilateraler Implantation von Elektroden in den anterioren Schenkel der Capsula interna. Mallet et al. (2002) beschreiben dies ebenfalls nach bilateraler Ncl. subthalamicusTiefen-hirnstimulations-OP bei zwei Zwangspatienten. Aber auch bei Parkinson-Patienten wird in einigen Artikel auf eine postoperative Verbesserung der Depression hingewiesen: Eine signifikante Besserung des Beck Depression Inventory (BDI) - Durchschnittwertes finden Woods et al. (2001) nach unilateraler Stimulation des Ncl. ventralis intermedius des Thalamus, Straits-Troster et al. (2000) nach Globus pallidus internus- Stimulation, Funkiewiez et al. (2004) und Pillon et al. (2000) nach bilateraler Ncl. subthalamicus - Stimulation. Funkiewiez et al. (2003) und Troster et al. (2003) stellen fest, dass sich im Durchschnitt das Ergebnis des BDI nach bilateraler Ncl. subthalamicus-Stimulation verbesserte ohne zu präzisieren, ob diese Verbesserung signifikant war oder nicht. Caparros-Lefebvre et al. (1992) beschreiben eine Verbesserung der durchschnittlichen Montgomery and Asberg Depression Rating Skala nach unilateraler Stimulation des Thalamus. Bei Burchiel et al. (1999) verbesserten sich postoperativ - nach Ncl. subthalamicus - bzw. Globus pallidus internus - Stimulation - die durch Selbstbeurteilung erfassten depressiven Symptome im Durchschnitt um 49%. Es muss darauf hingewiesen werden, dass sich hinter verbesserten DepressionsDurchschnittswerten trotzdem Patienten mit Depressionen verbergen können. Dies wird bei Funkiewiez et al. (2004) deutlich, die sowohl Depressions-Durchschnittswerte als auch individuelle Ergebnisse beschreiben: Hier verbesserte sich der durchschnittliche BDI, obwohl 9 der 77 Parkinson-Patienten postoperativ an einer Depression erkrankten, darunter 5 schwere Depressionen mit 4 Suizidversuchen und einem Suizid! Ebenso wird es berichtet bei Houeto et al. (2000) und Ardouin et al.(1999), die beide dasselbe 12 Patientengut beschreiben: Bei 23 Patienten, die eine bilaterale Elektrodenimplantation in den Ncl. subthalamicus erhielten, verbesserte sich nach 3 und 6 Monaten der durchschnittliche BDI signifikant, obwohl 4 Patienten innerhalb der ersten zwei Monate an einer moderaten bzw. schweren Depression erkrankten. Deshalb wäre es wichtig zu wissen, wie die individuellen Werte bei jedem einzelnen Patienten aussehen. Auf individuelle BDI - Werte gehen Fields and Troster (2000) ein, indem sie 2 von 6 Patienten beschreiben, die sich in ihrer depressiven Symptomatik nach bilateraler Globus pallidus internus - Stimulation besserten, ohne dass jedoch ein spezifischer Depressionstest erwähnt wird. 1.1.2 Verbesserung der Depression durch Stimulation und akute Verschlechterung depressiver Symptomatik, wenn die Stimulation ausgeschaltet wird Eine Zunahme depressiver Symptomatik, sobald die Stimulation der Elektroden ausgeschaltet wurde, berichten Funkiewiez et al. (2004) und Schneider et al. (2003) bei einigen ihrer Patienten nach bilateraler Ncl. subthalamicus - Stimulation, Lucas et al. (2000) bei einem Patienten mit essentiellem Tremor nach bilateraler Stimulation des Ncl. ventralis intermedius des Thalamus und Nuttin et al. (2003) bei 5 von 6 Zwangspatienten nach bilateraler Stimulation der anterioren Schenkel der Capsula interna. Während bei Schneider et al. (2003) und bei Lucas et al. (2000) die Patienten keine positive Vorgeschichte für Depressionen aufwiesen, litt bei Funkiewiez et al. (2004) der eine beschriebene Patient an einer depressiven Symptomatik, die sogar mit Elektrokrampftherapie in 6-wöchigem Intervall behandelt werden musste, und bei Nuttin et al. (2003) litten zwei ihrer Patienten präoperativ an einer Major Depression. In allen vier Artikeln wurden spezifische Depressionstests angewendet. Neben diesen Patienten, bei denen sich die Depression unter Stimulation verbesserte, beschreiben Funkiewiez et al. (2004) zusätzlich einen Patienten mit einer leichten Depression, 4 Patienten, die einen Suizidversuch begingen, einen Patienten, der sich das Leben nahm und einen Patienten mit einer Depression, deren Schweregrad von den Autoren nicht definiert wurde. Nuttin et al. (2003) beschreiben ebenfalls zusätzlich einen Patienten, der postoperativ an einer Depression litt. Beide eben genannten Artikel werden 13 bei der Auswertung unter Punkt 1.2. (Verteilung der Depressionstests), unter Punkt 1.3.1. (Ausschlusskriterien der Artikel) und unter Punkt 1.3.6. (Follow-up der Patienten) ausschließlich denjenigen Artikeln zugerechnet, bei denen ein Teil der Patienten an einer Depression erkranken. 1.1.3 Keine signifikante Veränderung depressiver Symptomatik bei Tiefenhirnstimulation In verschiedenen Artikeln wird berichtet, dass bei Parkinson-Patienten unter Tiefenhirnstimulation im Durchschnitt keine signifikante Veränderung einer mit Hilfe spezifischer Tests ermittelten depressiven Symptomatik festgestellt werden konnte: So beschreiben dies Castelli et al. (2004), Dujardin et al. (2004), Morrison et al. (2004), Moretti et al. (2003, 2002), Brusa et al. (2001), Lopiano et al. (2001) und Perozzo et al. (2001) nach bilateraler Ncl. subthalamicus - Stimulation; Fields et al. (2003), Straits-Troster et al. (2000) und Troster et al. (1998) nach Stimulation des Thalamus; Brusa et al. (2001), Ardouin et al (1999) und Fields et al. (1999) nach bilateraler Globus pallidus internus - Stimulation und Vingerhoets et al. (1999b) nach unilateraler Globus pallidus internus - Stimulation. In zwei Artikeln (Troster et al. 1998, 1997) wird berichtet, dass die Stimmung evaluiert worden sei, ohne einen spezifischen Depressionstest anzugeben. In beiden Artikeln wird kein Ergebnis der Untersuchung depressiver Symptome mitgeteilt. Unter der Annahme, dass das Ergebnis nicht erwähnt wurde, da keine Veränderung vorlag, wurden diese Artikel in die Gruppe “keine signifikante Veränderung depressiver Symptomatik bei Tiefenhirnstimulation” miteinbezogen. Volkmann et al. (2001) schreiben, ohne einen Depressionstest zu erwähnen, dass nach Globus pallidus internus -Stimulation keine Veränderung depressiver Symptomatik festgestellt wurde. Bei Fontaine et al. (2004) trat bei einem Parkinson-Patienten, der gleichzeitig an einer Zwangserkrankung litt, nach bilateraler Ncl. subthalamicus -Stimulation keine Veränderung der Stimmung auf. Auch hier wäre es wieder wichtig, anstatt Depressions-Durchschnittswerten individuelle Werte für jeden einzelnen Patienten zu wissen. Dass trotz durchschnittlich unveränderter Depressionswerte einige Patienten postoperativ an einer Depression erkrankten, zeigen die 14 Artikel von Krack et al. (2003), Thobois et al. (2002) und Ardouin et al. (1999). Nur Fields et al. (1999) berichten individuelle Ergebnisse, indem sie einen von 6 Patienten beschreiben, der sich in seiner depressiven Symptomatik nach bilateraler Globus pallidus internus Stimulation nicht signifikant veränderte, ohne dass jedoch ein spezifischer Depressionstest erwähnt wird. Unter den in diesem Abschnitt aufgeführten Artikeln beschreiben Volkmann et al. (2001) zusätzlich 8 Patienten mit Ncl. subthalamicus - Stimulation, die nach der Operation eine Depression entwickelten, deren Schweregrad von den Autoren nicht definiert wird. Dieser Artikel wird bei der Auswertung unter Punkt 1.2. (Verteilung der Depressionstests), unter Punkt 1.3.1. (Ausschlusskriterien der Artikel) und unter Punkt 1.3.6. (Follow-up der Patienten) ausschließlich denjenigen Artikeln zugerechnet, bei denen ein Teil der Patienten an einer Depression erkranken. 1.1.4 Auftreten leichter depressiver Symptomatik bei Tiefenhirnstimulation Funkiewiez et al. (2004), Monaca et al. (2004), Pahwa et al. (2003), Ostergaard et al. (2002), Thobois et al. (2002), Hariz et al. (2000), Molinuevo et al. (2000) und Moro et al. (1999) berichten, dass ein Teil der Parkinson-Patienten nach bilateraler Ncl. subthalamicus - Stimulation an einer leichten Depression litten. Ebenso berichten dies Houeto et al. (2003) nach Ncl. subthalamicus - Stimulation, wobei die Autoren nicht angeben, ob es sich um eine uni- oder bilaterale Stimulation handelt, und Koller et al. (2001) bei einem von 49 Patienten mit essentiellen Tremor nach unilateraler Stimulation des Ncl. ventralis intermedius des Thalamus. Aus drei Artikeln geht hervor, dass zur Diagnose der Depression kein spezifischer Depressionstest verwendet wurde, bei zwei weiteren Artikeln werden dazu, wie die Depression gestestet wurde, keine Angaben gefunden, während die restlichen vier Artikel spezifische Depressionstests zur Diagnose angeben. Nur die Hälfte dieser Artikel gibt an, dass Depression für die Operation ein Ausschlusskriterium war: Bei Thobois et al. (2002) wurden Patienten mit einer durch BDI diagnostizierten Major Depression von der Operation ausgeschlossen, Ostergaard et al. (2002) stellen fest, dass keiner ihrer zu operierenden Patienten an einer “signifikanten Depression” litt, während für Monaca et al. (2004) eine unbehandelte Depression und für 15 Moro et al. (1999) und Pahwa et al. (2003) “schwere psychiatrische Komplikationen” ein Ausschlusskriterium darstellten. Zur Vorgeschichte von Depressionen bei den zu operierenden Patienten äußern sich Thobois et al. (2002) und Monaca et al. (2004): Thobois et al. (2002) berichten, dass zwei von fünf Patienten, die nach der Operation an einer Depression litten, erst kurze Zeit zuvor depressiv gewesen waren, zum Zeitpunkt der OP bestand jedoch keine Depression mehr. Da aber in derselben Studie noch ein weiterer Patient postoperativ an einer schweren, wahnhaften Depression erkrankte (s. u.), ist nicht klar, ob die zwei Patienten mit positiver Anamnese nach der Elektrodenimplantation beide an einer leichten Depression litten oder ob einer von ihnen schwer depressiv wurde. Bei Monaca et al. (2004) werden drei Patienten beschrieben, die postoperativ an einer leichten Depression litten. Einer davon hatte diese schon einige Monate vor der Operation entwickelt. Was den Beginn der depressiven Symptomatik betrifft, geht aus Ostergaard et al. (2002) und aus Hariz et al. (2000) hervor, dass sie ein bis zwei Monate nach der Operation auftrat. Die Therapie der Depression umfasste verschiedene Maßnahmen: Bei Ostergaard et al. (2002) und Thobois et al. (2002) sprachen alle bis auf einen Patienten gut auf SSRIMedikation und Psychotherapie an, bei manchen Patienten besserte sich die Depression sogar spontan. Auch Monaca et al. (2004) beschreiben, dass einer der depressiven Patienten mit Antidepressiva behandelt wurde, äußern sich jedoch nicht zum Verlauf und der Dauer der Depression bei den betroffenen Patienten. Houeto et al. (2003) geben an, dass sich bei ihren Patienten leichte depressive Symptomatik durch Einnahme von Dopaminagonisten – die zunächst im postoperativen Verlauf abgesetzt worden waren - verbesserte. Koller et al. (2001) bekamen leichte Depressionen durch Anpassung der Stimulationsparameter in den Griff. Dagegen schreiben Molinuevo et al. (2000), dass die Depression eines Patienten auch noch bei der letzten Untersuchung 6 Monate nach der Operation persistierte. Funkiewiez et al. (2004) schildern, dass einer ihrer Patienten 6 Wochen nach Absetzen der dopaminergen Therapie eine durch BDI diagnostizierte milde Depression entwickelte und diese - nach erfolgloser Therapie mit einem Antidepressivum - sich nach Wiedereinnahme von Bromocriptin und 16 Levodopa rasch besserte und die Stimmung für zwei Jahre, in denen man den Patient nachuntersuchte, stabil blieb. In den o. g. Studien trat bei 1,3 % bis 30 % der operierten Patienten eine milde Depression auf. 1.1.5 Auftreten moderater Depression bei Tiefenhirnstimulation Rodriguez-Oroz et al. (2004) beschreiben das Auftreten moderater Depression bei einem von 10 Patienten nach Ncl. subthalamicus - Stimulation. Die Autoren geben keinen spezifischen Depressionstest an, mit dem sie die Symptomatik diagnostiziert hätten. Jahanshahi et al. (2000) berichten, dass zwei von 10 Patienten postoperativ an einer durch BDI diagnostizierten moderaten Depression litten. Stimulierte Gehirnareale waren in dieser Studie sowohl Ncl. subthalamicus, bilateral als auch Globus pallidus internus, bilateral. Leider geben die Autoren nicht an, wie viele Patienten sich in jeder Gruppe befanden und zu welcher Gruppe die beiden Depressiven gehörten. In keinem der beiden Artikel findet man Angaben zu Verlauf und Therapie der Depression, zu Ausschlusskriterien für die Operation und depressive Vorgeschichte der Patienten. Anders bei Houeto et al. (2000), in deren Studie 2 von 23 Patienten an einer moderaten Depression und weitere 2 Patienten an einer schweren Depression (s. 1.1.6) nach bilateraler Ncl. subthalamicus - Stimulation erkrankten. Hier berichten die Autoren, dass keiner der Patienten zum Zeitpunkt der Operation an einer Major Depression gelitten habe. Die depressive Symptomatik entwickelte sich bei allen 4 Patienten innerhalb der ersten 2 Monate nach der Elektrodenimplantation und war bei 3 von 4 Patienten nach 2-monatiger Therapie mit einem SSRI gut in den Griff zu bekommen. In den in diesem Abschnitt aufgeführten Artikeln erkrankten zwischen 8,7% bis 20% der Patienten an einer moderaten Depression. 1.1.6 Auftreten schwerer Depression und Suizidalität bei Tiefenhirnstimulation Linazasoro (2003) und Durif et al. (1999) beschreiben, dass ein Teil ihrer Patienten nach 17 bilateraler Globus pallidus internus - Stimulation bzw. Ncl. subthalamicus - Stimulation an einer schweren Depression litt. In beiden Artikeln werden weder Angaben zu Ausschlusskriterien für die Operation noch zur Vorgeschichte der Patienten gemacht. Zumindest beschreiben Durif et al. (1999), dass sich die depressive Symptomatik innerhalb des ersten Monats nach der Operation entwickelte und sich unter dauerhafter Therapie mit Clomipramin besserte. Bei Thobois et al. (2002) erkrankte einer von 18 Patienten nach bilateraler Ncl. subthalamicus - Elektrodenimplantation an einer schweren wahnhaften Depression (fünf weitere an einer leichten Depression (s. 1.1.4.)), die stationärer psychiatrischer Behandlung bedurfte und dennoch bei der Untersuchung 6 Monate nach der Operation keine Besserung zeigte. Die Autoren geben an, dass eine weitere Kontrolle 12 Monate nach der Operation stattfand, erwähnen aber nicht, wie es zu diesem Zeitpunkt dem schwer depressiven Patienten ging. Ausschlusskriterium für die Operation war unter anderem eine Major Depression, durch BDI diagnostiziert. Zur Vorgeschichte der Patienten findet man, dass zwei von fünf Patienten im präoperativen Verlauf erst kürzlich an einer Depression gelitten hatten, zum Zeitpunkt der OP jedoch nicht mehr depressiv waren. Leider wird nicht deutlich, ob diese Patienten postoperativ beide an einer leichten Depression litten oder aber ob einer von ihnen derjenige Patient war, der postoperativ schwer depressiv wurde. In einigen Artikeln werden Patienten beschrieben, die nach Elektrodenimplantation an einer schweren Depression erkrankten und von denen ein Teil suizidal war: So berichten dies Funkiewiez et al. (2004, 2001), Krack et al. (2003), Berney et al. (2002), Houeto et al. (2002, 2000) und Doshi et al. (2002) nach bilateraler Ncl. subthalamicus -Stimulation. Obwohl Krack et al. (2003) schreiben, dass eine schwerwiegende psychiatrische Erkrankung ein Ausschlusskriterium für die Operation war, litt derjenige Patient, der sich 6 Monate nach dem Eingriff das Leben nahm, schon präoperativ an einer Depression und hatte 3 Monate vor der Operation Suizidgedanken geäußert. Auch bei Berney et al. (2002), Houeto et al. (2002) und Thobois et al. (2002) galten aktuelle psychiatrische Erkrankungen als Ausschluss-kriterium für die Elektrodenimplantation. Während bei Berney et al. (2002) und Houeto et al. (2002) ein Teil der Patienten eine positive Anamnese für Depressionen aufwies, hatte der von Doshi et al. (2002) beschriebene Patient mit schwerer Depression 18 und Suizidversuch im postoperativen Verlauf vor der Operation noch nie an einer depressiven Episode gelitten. Die übrigen Artikel geben zu Ausschlusskriterien für die Operation und Vorgeschichte der Patienten keine Auskunft. Zum Verlauf der Depression beschreiben einige Autoren, dass sich depressive Symptome innerhalb der ersten 2 postoperativen Monate entwickelten. In einem Teil der Artikel wurde die Depression durch Therapie mit Antidepressiva, Psychotherapie, vorübergehende psychiatrische Hospitalisierung oder auch Bromocriptin und Levodopa innerhalb von einem Monat bis einem Jahr gebessert und verschwand in einigen Fällen sogar ganz, im anderen Teil der Artikel besserte sich die Depression nicht. Insgesamt 2 Patienten aus allen genannten Artikeln nahmen sich das Leben. Funkiewiez et al. (2004) und Berney et al. (2002) machen keine Angaben, ob sich die depressiven Symptome verbesserten, bestehen blieben oder sich verschlechtern. Linazasoro (2003) geht in seinem Artikel weder auf Therapie noch auf Verlauf der Depression ein. In den in diesem Abschnitt aufgeführten Artikeln erkrankten zwischen 2 % bis 25% der Patienten an einer schweren Depression, die Suizidalität lag zwischen 2 % und 29,2%. 1.1.7 Auftreten von Depressionen, deren Schweregrad von den Autoren nicht definiert wurde, bei Tiefenhirnstimulation Burn and Troster (2004), Volkmann et al. (2001) und Funkiewiez et al. (2004) berichten, dass ein Teil ihrer Patienten nach Elektrodenimplantation in den Ncl. subthalamicus an einer Depression litten, deren Schweregrad von den Autoren nicht benannt wird. In den beiden erstgenannten Artikeln findet man weder Angaben zu Therapie und Verlauf der Depression noch zur Vorgeschichte der Patienten und zum Einsatz eines spezifischen Depressionstests. Funkiewiez et al. (2004) diagnostizierten die Depression mit Hilfe des BDI und erwähnen als Therapie einen vorübergehenden stationären Aufenthalt. Über Ausschlusskriterien und Vorgeschichte der Patienten machen auch diese Autoren keine Angaben. Von einer vorübergehenden depressiven Episode bei einem Teil ihrer Patienten sprechen Krack et al. (2003) und Martinez-Martin et al. (2002) nach bilateraler Ncl.subthalamicus - 19 Stimulation. Eine schwere psychiatrische Erkrankung war in beiden Studien ein Ausschlusskriterium zur OP; die Diagnose der postoperativen Depression wurde mittels eines spezifischen Tests gestellt. Bei Martinez-Martin et al. (2002) wird keine Therapie der Depression erwähnt; die Autoren schreiben jedoch, dass am Ende der Studie - 6 Monate nach der Operation - der Durchschnittswert der Hamilton Depression Rating Scale signifikant gegenüber der Eingangsuntersuchung abgenommen habe. Bei Krack et al. (2003) sprachen alle Patienten mit Depression auf eine antidepressive Therapie an. Einige Autoren stellen bei einem Teil ihrer Patienten eine Verschlechterung depressiver Symptomatik nach der Operation fest: Vesper et al. (2002) beschreiben dies für 2 von 40 Patienten nach bilateraler Ncl. subthalamicus -Stimulation ohne einen spezifischen Depressionstest zu erwähnen. Beide Patienten litten bereits vor der Operation an einer seit kurzem bekannten Depression und entwickelten im postoperativen Verlauf eine progrediente Demenz. Nur einer der beiden depressiven Patienten - die Autoren erwähnen nicht, um welchen Patienten es sich handelt - wurde postoperativ mit Antidepressiva behandelt. Über den Verlauf der Depression findet man keine Angaben. Ausschlusskriterium bei dieser Studie war eine unbehandelte Depression. Ghika et al. (1998) berichten bei einem von sechs Patienten eine Verschlechterung des BDI, der bei den Patienten nur einmal im postoperativen Verlauf, und zwar 3 Monate nach bilateraler Globus pallidus internus - Stimulation, durchgeführt wurde. Zu Therapie der Depression und Vorgeschichte der Patienten werden keine Angaben gemacht. Von einer anhaltenden Depression nach bilateraler Ncl. subthalamicus- Stimulation bei einigen ihrer Patienten berichten Bejjani et al. (1999) ohne zu definieren, wie schwer die Depression war und was sie unter “anhaltend” verstehen. Zumindest sprach die Depression auf Antidepressiva an. In ihrem Artikel lassen sich keine Angaben finden, ob ein spezifischer Depressionstest eingesetzt wurde, ob die Patienten eine für Depressionen spezifische Vorgeschichte aufwiesen und welche Ausschlusskriterien für die OP bestanden. Bei Dujardin et al. (2001) findet man 2 von 9 Patienten, die an einer Depression erkranken, die 1 Jahr nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus immer noch besteht. Ein spezifischer Depressionstest zur Diagnose wurde nicht verwendet. Der Artikel enthält keine Angaben zur Vorgeschichte der Patienten und zu Ausschlusskriterien für die 20 OP. Ein Artikel von Nuttin et al. (2003) berichtet auch über postoperative Depression bei Zwangspatienten: Nach Stimulation der anterioren Schenkel der Capsula interna leidet einer von 6 Zwangspatienten an einer durch den BDI diagnostizierten Depression. Zwei Patienten hatten zum Zeitpunkt der Operation eine schwere Depression; leider geben die Autoren nicht an, ob es sich bei einem von ihnen um denjenigen Patienten handelt, der nach der Operation an einer Depression litt. Zu Therapie und Verlauf der Depression werden keine Angaben gemacht. In den in diesem Abschnitt aufgeführten Artikeln erkrankten zwischen 1,3% bis 50% der Patienten an einer Depression, deren Schweregrad durch die Autoren nicht definiert wurde. 1.1.8 Akute stimulationsinduzierte Depression Stefurak et al. (2003) und Bejjani et al. (1999) berichten von jeweils einer Patientin, die nach bilateraler Ncl. subthalamicus - Stimulation unter einer akuten Depression litt, sobald die Stimulation angeschaltet wurde. Die Stimmung normalisierte sich in beiden Fällen fast augenblicklich nach Abbruch der Stimulation. Analysen der genauen Lokalisation der Elektrode bzw. desjenigen Elektrodenkontaktes, bei dessen Stimulation es zur akuten Depression kam, ergaben, dass in beiden Fällen eine Stimulation von Arealen außerhalb des Ncl. subthalamicus erfolgte: Bei Bejjani et al. (1999) ging der Kontakt 0 der linken Elektrode über den Ncl. subthalamicus hinaus in die Substantia nigra, bei Stefurak et al. (2003) war die rechte Elektrode mitten in den Faserzügen der weißen Substanz, die den Ncl. subthalamicus umgibt, lokalisiert. Während bei Stefurak et al. (2003) die Patientin bereits seit ihrem 12. Lebensjahr immer wieder an Depressionen litt, wies die Patientin bei Bejjani et al. (1999) keinerlei positive Anamnese für Depressionen auf und hatte selbst unter Levodopa-Therapie nicht an Stimmungsschwankungen gelitten. In keinem der beiden Artikel wird ein spezifischer Depressionstest angegeben. In den in diesem Abschnitt aufgeführten Artikeln erkrankten zwischen 3,3% bis 6,5% der Patienten an einer akuten stimulationsinduzierten Depression. 21 1.1.9 Sonstiges Okun et al. (2003) überprüften mittels einer visuellen Stimmungs-Analog-Skala bei Patienten mit unilateraler Ncl. subthalamicus - und Globus pallidus internus - Stimulation die aktuelle Stimmungslage und zwar während Stimulation desjenigen Gehirnareals mit optimalem motorischem Benefit sowie dorsal und ventral davon. Bei Stimulation des Areals mit optimalem Benefit zeigten sich in beiden Gruppen überwiegend Verbesserungen von einem oder mehr Subskalen der Analog-Skala. Bei Stimulation dorsal und ventral des optimalen Areals verschlechterten sich bei den Ncl.subthalamicus - Patienten etwas mehr Subskalen als bei den Globus pallidus internus - Patienten. Präoperativ wurde mittels Hamilton Depression Scale und Geriatric Depression Scale eine psychiatrische Erkrankung ausgeschlossen. Tabelle 1: Inzidenz von Depressionen bei Tiefenhirnstimulation - Inzidenz von Depressionen, deren Schweregrad nicht definiert wurde 13,4% Inzidenz von akuten stimulationsinduzierten Depressionen 3,3% - 25% - - - - - 11,7% - 9,7% - - 3,2% - 6,5% 22,2% - - - 22,2% - 16,7% - - 16,7% - - 10,4% 1,3% - 7,8 % 1,3% - 16,7% - - - 16,7% - 17,4% - 8,7% 8,7% - - 29,2% - - 29,2% - - 17,1% 17,1% - - - - 20% - 20% - - - Artikel GesamtInzidenz von Depressionen Inzidenz von Inzidenz von moderaten leichten Depressionen Depressionen Inzidenz von schweren Depressionen Bejjani et al. 1999 Berney et al. 2002 Burn and Troster 2004 Doshi et al. 2002 Dujardin et al. 2001 Durif et al. 1999 Funkiewie z et al. 2004 Ghika et al. 1998 Houeto et al. 2000 Houeto et al. 2002 Houeto et al. 2003 Jahanshah i et al. 2000 16,7% - - 25% - 11,7% 22 Koller et al. 2001 Krack et al. 2003 Linazasoro 2003 MartinezMartin et al. 2002 Molinuevo et al. 2000 Monaca et al. 2004 Moro et al. 1999 Nuttin et al. 2003 Pahwa et al. 2003 RodriguezOroz et al. 2004 Thobois et al. 2002 Vesper et al. 2002 Volkmann et al. 2001 2% 2% - - - - 18,4% - - 2% 16,4% - 11,1% - - 11,1% - - 17,6% - - - 17,6% - 6,7% 6,7% - - - - 40% 30% - - 10% - 14,3% 14,3% - - - - 16,7% - - - 16,7% - 3% 3% - - - - 10% - 10% - - - 33,3 % 27,7% - 5,6% - - 5% - - - 5% - 50% - - - 50% - 23 1.2 Depressionstests 1.2.1 Auswertung der Artikel nach verwendeten Depressionstests Bei der Auswertung der Artikel in Hinblick darauf, wie viele Studien einen Depressionstest anwandten, wurden sowohl Artikel, die ihre Patienten mittels spezifischer Depressionstests untersuchten, als auch Artikel, die lediglich ganz unspezifisch angaben, dass “die Stimmung evaluiert wurde oder man darauf geachtet habe”, jedoch keinen spezifischen Depressionstest angaben, in die Gruppe “Depression getestet” mit einbezogen. Artikel, die entweder berichten, dass Patienten depressive Symptome im postoperativen Verlauf aufwiesen oder aber behaupten, dass ihre Patienten keine Depression entwickelten, ohne dass die Autoren dies mittels spezifischer Depressionstests genauer diagnostizierten, finden sich in den Graphiken in 1.2.3 und 1.2.4 unter der Säule “keine Angaben zu Depressionstests“. Unter Berücksichtigung der o. g. Aspekte konnten insgesamt 58 Artikel ausgewertet werden. Sowohl die Artikel von Fields et al. (2003) und Troster et al. (1999) als auch die Artikel von Houeto et al. (2000) und Ardouin et al. (1999) wurden jeweils nur als ein Artikel betrachtet, da sie sich auf dasselbe Patientengut beziehen. Die Auswertung ergab, dass 18 Artikel (31 %) nicht auf Depression getestet haben, während 38 Artikel (65,5 %) depressive Symptome mittels spezifischer Tests und 2 Artikel (3,4 %) ohne Angabe von Tests evaluiert haben. Tabelle 2: Artikel, die Depressionstests angeben Artikel Ardouin et al. 1999 und Houeto et al. 2000 Berney et al. 2002 Test Beck Depression Inventory, Profile of Mood States Montgomery and Asberg Depression Rating Scale, Hamilton Depression Rating Scale, UPDRS part 1 Brusa et al. 2001 Beck Depression Inventory, visuelle Stimmungs-Analogskala Caparros-Lefebvre et al. 1992 Montgomery and Asberg Depression Rating Scale Castelli et al. 2004 Beck Depression Inventory Doshi et al 2002 UPDRS part 1 Dujardin et al. 2004 Montgomery and Asberg Depression Rating Scale Fields et al. 1999 Beck Depression Inventory, Profile of Mood States Fields et al. 2003 und Troster et Profile of Mood States, Beck Depression Inventory al. 1999 Fontaine et al. 2004 Montgomery and Asberg Depression Rating Scale, strukturiertes und nichtstrukturiertes Interview Funkiewiez et al. 2003 Beck Depression Inventory Funkiewiez et al. 2004 Beck Depression Inventory 24 Gabriels et al. 2003 Ghika et al. 1998 Halbig et al. 2004 Houeto et al. 2002 Jahanshahi et al. 2000 Krack et al. 2003 Lopiano et al. 2001 Lucas et al. 2000 Mallet et al. 2002 Martinez-Martin et al. 2002 Monaca et al. 2004 Moretti et al. 2002 Moretti et al. 2003 Morrison et al. 2004 Nuttin et al. 1999 Nuttin et al. 2003 Okun et al. 2003 Ostergaard et al. 2002 Perozzo et al. 2001 Pillon et al. 2000 Schneider et al. 2003 Straits-Troster et al. 2000 Thobois et al. 2002 Troster et al. 2003 Vingerhoets et al. 1999b Woods et al. 2001 Brief Psychiatric Rating Scale Beck Depression Inventory, Habib´s Scale The Multidimensional Mood Questionnaire, Brief Symptom Inventory IOWA Scales of Personality Change, strukturiertes Interview Beck Depression Inventory Beck Depression Inventory Beck Depression Inventory, strukturiertes Interview Profile of Mood States Montgomery and Asberg Depression Rating Scale, strukturiertes und nichtstrukturiertes Interview Hamilton Depression Rating Scale Hospital Anxiety and Depression Scale, strukturiertes Interview Zung-self-evaluation for Depression Zung-self-evaluation for Depression Geriatric Depression Scale Profile of Mood States Beck Depression Inventory Visuelle Stimmungsanalogskala UPDRS part 1 Beck Depression Inventory, strukturiertes und nicht-strukturiertes Interview Beck Depression Inventory Hamilton Depression Rating Scale Beck Depression Inventory, Profile of Mood States UPDRS part 1, Beck Depression Inventory Beck Depression Inventory Beck Depression Inventory Beck Depression Inventory Tabelle 3: Artikel, die depressive Symptomatik evaluiert haben, ohne jedoch Depressionstests anzugeben Troster et al 1997 Troster et al. 1998 Tabelle 4: Artikel, die keine Depressionstests angeben Anderson and Ahmed 2003 Bejjani et al. 1999 Burchiel et al. 1999 Burn and Troster 2004 Dujardin et al. 2001 Durif et al. 1999 Funkiewiez et al. 2001 Hariz et al. 2000 Houeto et al. 2003 Koller et al. 2001 Linazasoro 2003 Molinuevo et al. 2000 Moro et al. 1999 Pahwa et al. 2003 Rodriguez-Oroz et al. 2004 Stefurak et al. 2003 Vesper et al. 2002 Volkmann et al. 2001 25 1.2.2 Verteilung der Depressionstests (unter Berücksichtigung der 38 Artikel, die einen Depressionstest angegeben haben) 50 Beck Depression Inventory 50 45 Montgomery and Asberg Depression Rating Scale Hamilton Depression Rating Scale UPDRS part 1 40 35 28,9 30 in % 25 13,5 15 7,9 10 strukturiertes Interview 15,8 20 13,2 10,5 nicht-strukturiertes Interview Profile of Mood States 7,9 5 Sonstige 0 Depressionstests Sonstige: Hospital Anxiety and Depression Scale Brief Psychiatric Rating Scale Zung-self-evaluation for depression Geriatric Depression Rating Scale Brief Symptom Inventory Multidimensional Mood Questionnaire IOWA scales of personality change Visuelle Analog-Skala Habib’s Scale (französische Skala für Abulie) 1 Artikel 1 Artikel 2 Artikel 1 Artikel 1 Artikel 1 Artikel 1 Artikel 2 Artikel 1 Artikel Abb.1: Verteilung der Depressionstests (%- Angaben = Anteil der Artikel, bezogen auf 38 Artikel) 1.2.3 Verteilung der Depressionstests bei den Patienten mit verbesserter oder unveränderter Depression 43,8 45 Beck Depression Inventory 40 Montgomery Asberg Depression Rating Scale HDRS 35 UPDRS part 1 30 21,9 25 in % 18,8 15 12,5 12,512,5 9,4 6,3 10 5 strukturiertes Interview nicht-strukturiertes Interview 20 3,1 0 POMS Stimmung evaluiert keine Angaben Sonstige 0 Depressionstests Sonstige: Zung self-evaluation for depression Visuelle Analog-Skala Brief Psychiatric Rating Scale Geriatric Depression Rating Scale Brief Symptom Inventory Multidimensional Mood Questionnaire 2 Artikel 1 Artikel 1 Artikel 1 Artikel 1 Artikel 1 Artikel Abb. 2.: Verteilung der Depressionstests bei den Patienten mit verbesserter/ unveränderter Depression (%- Angaben = Anteil der Artikel bezogen auf 32 Artikel –vgl. Anhang-Tab. 1-3) 26 2 Artikel gaben an, die Stimmung evaluiert zu haben ohne jedoch einen spezifischen Depressionstest zu nennen, 3 Artikel machten gar keine Aussagen, ob und wie depressive Symptomatik evaluiert wurde. 18 Artikel verwendeten einen Test, 9 Artikel verwendeten mehrere Tests zur Diagnostik von depressiven Symptomen. 1.2.4 Verteilung der Depressionstests bei den Patienten mit Depression 58,6 60 Beck Depression Inventory 50 Montgomery and Asberg Rating Scale Hamilton Depression Rating Scale UPDRS part 1 40 in % 30 20,7 strukturiertes Interview 20 10,3 10 6,9 6,9 10,3 keine Angaben Sonstiges 3,4 0 Depressionstests Sonstige: Hospital Anxiety and Depression Scale Habib’s Scale (französische Skala für Abulie) IOWA Scales of personality change 1 Artikel 1 Artikel 1 Artikel Abb.3.: Verteilung der Depressionstests bei den Patienten mit Depression (%- Angaben= Anteil der Artikel bezogen auf 29 Artikel, vgl. Anhang-Tab. 4-8) 17 Artikel machten keine Angaben, ob sie einen Test zur Diagnose der Depression verwendeten. 8 Artikel diagnostizierten die Depression mittels eines einzigen Testes, 4 Artikel setzten dazu mehr als einen Test ein. Beim Vergleich der Verteilung der Depressionstests fällt auf, dass nur 9,4 % der Artikel, die berichteten, dass sich die Stimmung der Patienten nach der Operation nicht änderte oder sich gar besserte, keinerlei Aussagen zu diagnostischen Tests machen. Dagegen erwähnen 58,6 % derjenigen Artikel, bei denen ein Teil der Patienten nach der Operation depressiv wird, keinen diagnostischen Test. Dieses Ergebnis ist erstaunlich, da man erwarten würde, dass die Autoren, die eine Depression diagnostizieren, häufiger geeignete Tests dazu einsetzen als diejenigen, die nicht von einer Depression bei 27 Tiefenhirnstimulation sprechen. In beiden Gruppen ist der BDI der am meisten verwendete Test. 1.3 Mögliche Ursachen für Depression bei Tiefenhirnstimulation 1.3.1 Positive Anamnese für Depressionen In mehreren Artikeln wird eine positive Anamnese für Depressionen als Risikofaktor für das postoperative Auftreten von Depressionen angesehen (Piasecki and Jefferson 2004, Krack et al. 2003, Landi et al. 2003, Stefurak et al. 2003, Berney et al. 2002, Houeto et al. 2002, Dujardin et al. 2001). Einige von diesen Autoren räumen jedoch gleichzeitig ein, dass dies nicht immer zutrifft. So schreiben Berney et al. (2002), dass in ihrer Studie diejenigen sechs Patienten, die postoperativ depressiv wurden, sich hinsichtlich vergangener oder gegenwärtiger depressiver Erkrankungen nicht vom Rest der Gruppe unterschieden. Bejjani et al. (1999) weisen darauf hin, dass Depressionen bei Tiefenhirnstimulation auch bei einigen ihrer Patienten auftraten, bei denen keine identifizierbaren Risikofaktoren zu finden waren und Mayberg and Lozano (2002) schreiben in ihrer Literaturübersicht, dass Patienten trotz positiver Vorgeschichte für Depressionen nach Tiefenhirnstimulation nicht an einer Depression erkrankten. 20,7 6,9 3,5 62 0 6,9 psychiatrische Erkrankung als Ausschlusskriterium Major Depression als Ausschlusskriterium Depression als Ausschlusskriterium unbehandelte Depression als Ausschlusskriterium Depression nicht als Ausschlusskriterium keine Angaben Abb. 4: Ausschlusskriterien für die Operation in den Artikeln, deren Patienten nach der OP an Depression erkrankten (%- Angaben = Anteil der Artikel an insgesamt 29 Artikeln) 28 psychiatrische Erkrankung als Ausschlusskriterium Major Depression als Ausschlusskriterium 18,8 Depression als Ausschlusskriterium 12,5 53,1 9,4 0 6,2 unbehandelte Depression als Ausschlusskriterium Depression nicht als Ausschlusskriterium keine Angaben Abb. 5 : Ausschlusskriterien für die Operation in den Artikeln, deren Patienten nach der OP nicht an einer Depression erkrankten (%- Angaben = Anteil der Artikel an insgesamt 32 Artikeln) Ein Vergleich der Ausschlusskriterien von den in dieser Arbeit erfassten Artikeln ergibt, dass 37,5 % derjenigen Studien, bei denen die Patienten postoperativ nicht an einer Depression erkrankten, Patienten mit psychiatrischen Symptomen von der Operation ausschlossen. Für 9,4 % der Artikel war eine bestehende Depression kein Auschlusskriterium. In denjenigen Studien, bei denen die Patienten postoperativ an einer Depression erkrankten, schließt ein vergleichbarer Prozentsatz von 38 % der Arbeiten Patienten mit den obigen Ausschlusskriterien von der OP aus, wobei eine bestehende Depression immer Ausschlusskriterium war. Tabelle 5: Vorgeschichte bei denjenigen Patienten, die postoperativ an einer Depression erkrankten (Bezugsmenge: n = 115; alle Patienten, die nach der Operation depressiv wurden) Patienten in % Depression in der Vorgeschichte* n = 5 – 18 4,3 – 15,7 Depression bereits zum Zeitpunkt der OP n=5 4,3 keine Vorgeschichte für Depressionen n=8 7,8 Affektive Erkrankung (nicht Depression) in der Vorgeschichte n=1 0,9 keine Angaben n = 83 72,2 Bei mindestens 17,3 bis höchstens 28,7 % derjenigen Patienten, die nach der Operation an einer Depression erkrankten, war eine Depression oder andere affektive Erkrankung in der 29 Vorgeschichte oder gar zum Zeitpunkt der Operation zu finden. Diese Schwankung erklärt sich daraus, dass bei den Patienten* mit „Depression in der Vorgeschichte“ die depressive Vorgeschichte nicht eindeutig den Patienten mit postoperativer Erkrankung zuzuordnen ist. Zudem ist mit 72,2 % der Anteil derer, zu deren Vorgeschichte keine Angaben gemacht werden, hoch. Deshalb kann man nicht schlussfolgern, ob eine positive Vorgeschichte für psychiatrische Erkrankungen einen Risikofaktor für das postoperative Auftreten von Depressionen darstellt oder nicht. 1.3.2 Depression durch Stimulation des Ncl. subthalamicus Piasecki and Jefferson (2004) und Trepanier et al. (2000) vermuten als Erklärung für das Auftreten von Depressionen nach Tiefenhirnstimulation, dass der Ncl. subthalamicus nicht nur motorische, sondern auch assoziative und limbisch cortiko-subcortikale Schaltkreise reguliert. Burn and Troster (2004), Doshi et al. (2002) und Vitek (2002) stellen fest, dass der kleinere Umfang des Ncl. subthalamicus – z.B. im Vergleich zum Globus pallidus internus - es wahrscheinlicher macht, dass die Elektrode ungenau platziert wird oder dass ungeeignete Kontakte gewählt werden, so dass auch nicht-motorische Schaltkreise inmitten des Ncl. subthalamicus stimuliert werden. So berichten Doshi et al. (2002) von zwei Patienten, bei denen die Depression nach Änderung der Kontaktpunkte ein Jahr nach der Operation auftrat. Der Anti-Parkinson-Effekt der Stimulation war auch bei diesen Kontaktpunkten gegeben. Krack et al. (2003), Schneider et al. (2003), Berney et al. (2002) und Kumar et al. (1999) schreiben, ihre Ergebnisse würden die Hypothese unterstützen, dass die Ncl. subthalamicus - Stimulation auf nicht-motorische limbische Schleifensysteme, die durch die Basalganglien zum Präfrontal-Cortex verlaufen, wirke und somit einen direkten Effekt auf die Stimmung habe. Berney et al. (2002) beschreiben dazu Ergebnisse der Bildgebung, die eine Veränderung der Aktivität des anterioren Cingulum während Stimulation des Ncl. subthalamicus zeigen, was diese Hypothese unterstütze. Ceballos-Baumann et al. (1999) und Moro et al. (1999) erwähnen PET-Untersuchungen, die eine Aktivierung von verschiedenen Arealen, einschließlich des linken Orbitofrontal-Cortex während bilateraler Ncl. Subthalamicus - Stimulation zeigen. 30 1.3.3 Depression durch Stimulation von Neuronen und Nervenbahnen, die den Ncl. subthalamicus umgeben Schneider et al. (2003) und Berney et al. (2002) geben zu bedenken, dass bei einigen Patienten mit suboptimal plazierten Elektroden im Ncl. subthalamicus neuropsychiatrische Symptome durch unbeabsichtigte Costimulation benachbarter Nuclei oder Faserbahnen hervorgerufen werden könnten. Piasecki and Jefferson (2004) schreiben in diesem Zusammenhang, dass dem Ncl. subthalamicus benachbarte Neurone zum anterioren Cingulum, ventralen Striatum und zu frontalen Regionen projizieren. Vitek (2002) weist darauf hin, dass der Ncl. subthalamicus vom mittleren Vorderhirnbündel, Hypothalamus und Zona incerta umgeben ist. Eine Beeinträchtigung dieser Strukturen durch fehlplazierte Elektroden könnte daher eine Ursache für das Auftreten affektiven Störungen darstellen. Zumindest Berney et al. (2002) haben bei ihren Patienten mittels postoperativem MRI eine Fehlplazierung der Elektroden ausgeschlossen. Stefurak et al. (2003) berichten in ihrem Artikel von einer Patientin mit bilateraler Ncl. subthalamicus - Stimulation. Stimulation der linken Elektrode, die nachweislich inmitten des Ncl. subthalamicus lokalisiert war, bewirkte eine deutliche Verbesserung motorischer Symptome und im fMRI eine spezifische Veränderung der primären und supplementären motorischen Cortices, des Putamen, des Thalamus und des Cerebellum. Stimulation der rechten Elektrode, die in der den Ncl. subthalamicus umgebenden Region lokalisiert war, induzierte eine markante Stimmungsveränderung und im fMRI eine Veränderung in limbischen, cortikalen und subcortikalen Regionen. Die Stimulation der rechten Elektrode führte nicht zu einer deutlichen Verbesserung der motorischen Symptome; im fMRI waren jedoch begrenzte Veränderungen in motorischen Regionen festzustellen (prämotorische und motorische Cortices, Putamen und Cerebellum), was darauf hindeutet - wie auch schon in anderen Studien beschrieben (Patel et al. 2003a , Henderson et al. 2002, Nandi et al. 2002, Voges et al. 2002) -, dass die Region um den Ncl. subthalamicus eine Funktion in motorischen Schaltkreisen hat. Die Ergebnisse des fMRI bei Stimulation der linken und der rechten Elektrode zeigen eine Konvergenz von motorischen und nicht-motorischen Bahnen inmitten des Ncl. subthalamicus und der umgebenden Regionen. Bemerkenswerterweise ist das Muster regionaler fMRI-Veränderungen (bei Stimulation der rechten Elektrode) beinahe identisch zu cortikalen Blutfluss-Veränderungen im PET bei Personen mit einer Vorgeschichte von remittierten Depressionen, wenn diese aufgefordert werden, sich eine 31 traurige Erinnerung ins Gedächtnis zu rufen. Die Autoren berichten, dass vier Wochen später bei gleichen Stimulationsparametern der rechten Elektrode keine Stimmungsänderungen mehr auftraten. Sie erklären sich dies anhand des Konzeptes der neuronalen Plastizität: neuronale Systeme, die die Stimmung fördern, wurden durch die Tiefenhirnstimulation moduliert, was zur depressiven Symptomatik führte. Ebendiese Systeme waren jedoch in der Lage, die Modulation wieder auszugleichen. Okun et al. (2003) fragten ihre Patienten mittels einer visuellen Analog-Skala nach ihrer Stimmung während Stimulation unterschiedlicher Elektroden-Kontakte. Stimulation dorsal und ventral des Areals mit optimalem motorischem Benefit war mit Stimmungsänderungen assoziiert (und zwar häufiger und stärker bei bilateraler Stimulation des Ncl. subthalamicus als des Globus pallidus internus). Eine weitere Struktur, die sich in unmittelbarer Nähe des Ncl. subthalamicus befindet, ist die Substantia nigra. Bejjani et al. (1999) beschreiben in ihrem Artikel eine Patientin mit bilateraler Ncl. subthalamicus - Stimulation. Kontakt 0 der linken Elektrode war in der zentralen Substantia nigra lokalisiert einschließlich eines Teiles der Pars compacta und der Pars reticulata. Stimulation dieses Kontaktes führte zu einer akuten depressiven Symptomatik, die nach Sistieren der Stimulation voll reversibel war. Die Autoren vermuten, dass die Stimulation die Aktivität GABA-erger Neurone in der Substantia nigra beeinflusst haben könnte. Diese Neurone innervieren die ventralen Nuclei des Thalamus, welche zu den Präfrontal- und Orbitofrontal-Cortices ziehen. Die PET- Untersuchung zeigte eine Aktivierung des linken Orbitofrontal-Cortex. Dieses Ergebnis spricht für eine Involvierung der nigrothalamischen Bahn, die sich bis zur linken Amygdala und zu limbischen Strukturen erstreckt und in die Entstehung unangenehmer Gefühle involviert ist. Dysfunktionen dieser Systeme führten zu affektiven Störungen und Traurigkeit bei gesunden Probanden. Patienten, die einen Schlaganfall erlitten hatten, der zu Läsionen der linken Basalganglien geführt hatte, wurden depressiv. Weiterhin beschreiben die Autoren, dass Neurone, die Norepinephrin, Serotonin, Dopamin und andere Neurotransmitter enthalten, von denen man vermutet, dass sie in der Pathogenese der Depression eine Rolle spielen, in der Substantia nigra zu finden sind. Piasecki and Jefferson (2004) überlegen ebenfalls, ob die Stimulation des Ncl. 32 subthalamicus und/oder umgebender Strukturen zu einer Störung von Neurotransmittern führen könnte. Beispielsweise könnte ein Ungleichgewicht zwischen GABA-ergen inhibitorischen Axonen des Globus pallidus und dem exzitatorischen Output des Ncl. subthalamicus entstehen. 1.3.4 Stimulation anderer Gehirnareale Vitek (2002) schreibt in seiner Literaturübersichtsarbeit, dass mehr Studien nach Ncl. subthalamicus -Operation von Stimmungsveränderungen, neuropsychologischen Veränderungen und signifikant mehr unerwünschten Ereignissen berichten als nach Globus pallidus internus - Operation. Als Ursache hierfür nennen sie - wie oben schon erwähnt den kleineren Umfang des Ncl. subthalamicus und die Tatsache, dass der Ncl. subthalamicus von Faserzügen umgeben ist (mittleres Vorderhirnbündel, Hypothalamus, Zona incerta). Tabelle 6: Verteilung der Gehirnareale bei denjenigen 115 Patienten, die nach der OP depressiv wurden, und bei dem Gesamtpatientengut aus den Anhang-Tabellen 1- 9 stimuliertes Gehirnareal Patienten, die an einer Depression erkrankten n = 109 (11,6 %) (82: bilateral; 27: uni- oder bilateral) n=2 Gesamtzahl Globus pallidus internus n = 2 (2,6 %) (bilateral) Capsula interna n=1 n = 77 (29 unilateral; 28 bilateral; 20 unioder bilateral) n = 14 (1 unilateral; 13 bilateral) Thalamus n = 1 (0,9 %) Ncl. subthalamicus Ncl. subthalamicus, bilateral oder Globus pallidus internus, bilateral n = 940 (907 bilateral; 33 uni- oder bilateral) n = 10 n = 108 (100 unilateral; 1 bilateral; 7 unioder bilateral) Die Tabelle zeigt, dass vor allem die Ncl. subthalamicus - Stimulation mit dem Risiko einer postoperativen Depression behaftet zu sein scheint (11,6 %), während das Risiko bei Globus pallidus internus - Stimulation (2,6%), Stimulation des Thalamus (0,9%) und der Capsula interna (1 von 14 Patienten) niedriger zu sein scheint. 33 1.3.5 Psychosoziale Aspekte Mehrere Autoren weisen darauf hin, dass die Tiefenhirnstimulation oft zu einer abrupten Veränderung der Lebenssituation führe und dies einen starken Einfluss auf die Psyche des Patienten habe. Einerseits kann die deutliche Besserung der Parkinson-Symptome zu einer Besserung der Stimmung führen. Vingerhoets et al. (1999a) schreiben von einer Art “honeymoon-Effekt” nach der Operation: Der Patient ist erleichtert, die Operation überstanden zu haben, er ist froh über den Therapieerfolg und genießt es, von Familie und Freunden mehr Aufmerksamkeit zu erfahren. Auch Funkiewiez et al. (2004, 2003), Woods et al. (2002) und Ardouin et al. (1999) führen die postoperativ bessere Stimmung der Patienten auf die Besserung der Parkinson-Erkrankung zurück. Analog dazu führt die Milderung chronischer Zwangssymptome durch die Tiefenhirnstimulations- OP zu einer Verbesserung depressiver Symptome bei Zwangspatienten (Gabriels et al. 2003). Andererseits kann eben diese drastische Besserung einer Erkrankung, die sich im Laufe vieler Jahre oder gar Jahrzehnte entwickelt hat, vom Patienten auch als Belastung erlebt werden. So schreiben Perozzo et al. (2001), dass die Patienten durch die abrupte Verbesserung motorischer Symptome verunsichert wurden. Sie hatten Angst, wieder in den präoperativen Zustand geraten zu können und auch die Pfleger der Patienten hatten Sorge, ihre soeben erhaltene Autonomie wieder zu verlieren. Anderen Patienten fiel es wiederum schwer, von einem Tag auf den nächsten ihre Krankenrolle und damit verbundene Vorteile wie z.B. mehr Aufmerksamkeit von Seiten ihrer Verwandten aufzugeben. Wenn die Erwartungen des Patienten bezüglich des Therapieerfolgs nicht erfüllt werden oder aber erfüllt werden, jedoch nicht lange anhalten, und wenn trotz verbesserter motorischer Symptome die funktionelle Unabhängigkeit nicht zunimmt, kann dies zu depressiven Symptomen führen (Burn and Troster 2004). So beobachteten auch Trepanier et al. (2000), dass Patienten, die nach der Operation eine deutlich verbesserte Motorik aufwiesen und deshalb versuchten, ihre früheren Aktivitäten wieder aufzunehmen, gerade diejenigen zu sein schienen, die diesbezüglich Grenzen und Frustrationen erlebten. Einige Autoren stellten fest, dass die Verbesserung motorischer Symptome nicht immer 34 ausschlaggebend für Stimmungsänderungen nach der Operation war: Berney et al. (2002) beobachteten, dass diejenigen, die nach der Operation an einer Depression erkrankten und diejenigen, die nicht depressiv wurden, vergleichbare motorische Ansprechraten auf die Tiefenhirnstimulation aufwiesen. Linazasoro (2003), Houeto et al. (2002) und Bejjani et al. (1999) konstatierten ebenfalls, dass das Auftreten von Depressionen nach Elektrodenimplantation unabhängig von motorischen Symptomen der Patienten war. Bei den hier erfassten Artikeln geben nur einige Autoren exakte Angaben zum prä- und post-operativen UPDRS motor score und dabei handelt es sich nicht um individuelle Werte, sondern Durchschnittswerte der gesamten Patientengruppe, weshalb ein Vergleich der UPDRS motor scores zwischen Depressiven und Nicht-Depressiven nicht möglich ist: Von den 29 Artikeln, die berichten, dass ein Teil ihrer Patienten nach der Elektrodenimplantation an einer Depression erkrankten, machen 11 Artikel Prozentangaben, um die sich der UPDRS motor score postoperativ (während Stimulation und ohne Medikation) im Vergleich zu präoperativ (ohne Medikation) durchschnittlich verbessert, 4 Artikel schreiben von einer signifikanten Verbesserung, 4 Artikel lediglich von einer Verbesserung des score unter den ebengenannten Bedingungen. Von den verbleibenden 10 Artikeln findet man in 8 Artikeln keine Angaben zum motorischen UPDRS score, 2 Artikel beschreiben Patienten mit essentiellen Tremor bzw. Zwangspatienten. Von den 32 Artikeln, die von verbesserten oder gleich bleibenden depressiven Symptomen berichten, geben 6 Artikel an, um wie viel Prozent sich der durchschnittliche UPDRS motor score besserte, während 6 weitere Artikel von einer signifikanten Verbesserung und 4 Artikel von einer nicht näher präzisierten Verbesserung des UPDRS motor score schreiben. 9 Artikel machen dazu keine Angaben, 2 Artikel beschreiben Patienten mit essentiellem Tremor und fünf weitere Artikel evaluieren in ihrer Studie Zwangspatienten nach Tiefenhirnstimulation. 1.3.6 Progression der Parkinson-Erkrankung Burn and Troster (2004) und Berney et al. (2002) stellen die Überlegung an, dass die Depression Folge der natürlichen Progression der Parkinson-Erkrankung sein könnte. 35 Berney et al. (2002) geben allerdings zu bedenken, dass dies keine Begründung für das plötzliche Auftreten von Stimmungsänderungen sei, wie es bei einem Teil ihrer Patienten nach der Operation der Fall war. Krack et al. (2003) bekräftigen die Überlegung, dass das Fortschreiten der Parkinson-Erkrankung die Ursache für das Auftreten von Depressionen darstellen könnte, indem sie berichten, dass innerhalb der ersten 3 postoperativen Monate nur einer von 49 Patienten (2%) an einer Depression litt, die schon vor der Operation begonnen hatte. Zwischen 3 Monaten und 5 Jahren nach der Operation zeigte sich bei 7 von 42 Patienten (17%) eine Depression. Dadurch, dass jedoch bei dieser Studie keine Kontrollgruppe vorhanden war, bleibt es unklar, ob das Auftreten von Depressionen lange Zeit nach der Operation die hohe Prävalenz von Depressionen bei einer ParkinsonErkrankung widerspiegelt oder nicht. 24,3 25 20 14,8 15 12,2 in % 7,8 10 6,1 7 3,5 5 1,7 0,9 0,9 0,9 0 0,9 0,9 2 Monate 3 Monate 6 Monate 8 Monate 9 Monate 11 Monate 12 Monate 15 Monate 18 Monate 19 Monate 24 Monate 36 Monate 48 Monate 60 Monate 0 Follow-up in Monaten Abb. 6: Follow-up der Patienten, die nach der Operation depressiv wurden (Bezugsmenge n = 115) (Bei Angabe von Zeitspannen wurde die jeweils kürzeste Nachbeobachtungszeit für die Berechnung herangezogen) 40 36 35 31,7 30 25 in % 20 15 8,9 10 5 2,2 7,7 0,5 0 0,2 0 0 0 0 0,2 0 0 0,3 Monate 3 Monate 6 Monate 8 Monate 9 Monate 11 Monate 12 Monate 15 Monate 18 Monate 19 Monate 24 Monate 36 Monate 48 Monate 60 Monate Follow-up in Monaten Abb. 7: Follow-up der Patienten, die nach der Operation nicht depressiv wurden bzw. deren Depression sich besserte (n = 417) (Bei der Angabe von Zeitspannen wurde die jeweils kürzeste Nachbehandlungszeit für die Berechnung herangezogen) 36 Bei den in dieser Arbeit erfassten Artikeln ergibt ein Vergleich des Follow-up der Patienten, die keine Veränderung oder eine Verbesserung ihrer Depression erlebten, und des Followup der Depressiven, dass in der Tat diejenigen Patienten, die nach der Operation depressiv wurden, im Durchschnitt ein längeres Follow-up von 18,7 Monaten aufwiesen im Gegensatz zu 7,8 Monaten bei den „Nicht-Depressiven“. Keine Angaben zum Follow-up machten in der Gruppe der Depressiven 18,3 % und in der Gruppe der „Nicht-Depressiven“12,5 % der Artikel. 3 Monate vor der OP 36,7 40 35 30 23,3 25 in % innerhalb der ersten 2 postoperativen Monate 16,7 20 innerhalb der ersten 3 postoperativen Monate 10 15 6,7 10 Beginn der Depression unmittelbar nach Beginn der Stimulation innerhalb des 1.postoperativen Monats 3,3 3,3 5 0 Beginn der Depression 1,5 Monate nach Absetzen dopaminerger Medikamente 3 bis 60 Monate nach der Operation Abb.8: Beginn der Depression (%-Angaben = Anteil der Patienten bezogen auf 30 Patienten) Leider geben nur wenige Autoren genaue Informationen zum Beginn der Depression bzw. nur bei wenigen Patienten ist der ungefähre Beginn der Depression ersichtlich. In den in dieser Arbeit gesichteten Artikeln findet man dazu Angaben bei insgesamt 30 Patienten. Von diesen 30 Patienten entwickelte die Mehrheit der Patienten (73,4 %) innerhalb der ersten 3 postoperativen Monate die Depression, während nur 23,3 % nach dem 3. postoperativen Monat depressiv wurden. Dieses Ergebnis scheint gegen die Argumentation von Burn and Troster (2004) und Berney et al. (2002) zu sprechen, die Progression der Parkinson-Erkrankung sei Ursache der Depression. Für die Tatsache, dass die Mehrheit der Depressionen nach Tiefenhirnstimulation erst innerhalb der ersten 3 postoperativen Monate nach der Operation und nicht unmittelbar nach dem Eingriff auftreten, liefern Mayberg and Lozano (2002) eine Erklärung: Sie schreiben, dass die zeitliche Abfolge dem Auftreten von Depressionen nach Schlaganfällen ähneln würde. Aus dieser Beobachtung ließe sich schließen, dass eher chronisch adaptive 37 Veränderungen als direkte Stimulationseffekte für die Entstehung depressiver Symptome von Bedeutung seien. 1.3.7 Alter der Patienten Landi et al. (2003), Berney et al. (2002) und Straits-Troster et al. (2000) geben zu bedenken, dass ein höheres Alter der Patienten ein Risikofaktor für das postoperative Auftreten von Depressionen darstellen könnte. Berney et al. (2002) stellen jedoch gleichzeitig fest, dass in ihrer Studie zwischen denjenigen Patienten, die postoperativ an einer Depression erkrankten, und dem Rest der Patienten keine signifikanten Altersunterschiede bestanden. Straits-Troster et al. (2000) schreiben, dass jüngere Patienten vom medizinischen Standpunkt aus bessere Kandidaten für eine Operation seien. Außerdem würden jüngere Patienten in Bezug auf ihre Parkinson-Symptomatik einen stärkeren Leidensdruck angeben als ältere Patienten, da sie die Erkrankung als ein vorzeitiges Altern erleben. In ihrer Studie jedoch gaben die jüngeren Patienten keinen höheren Leidensdruck vor der Operation an als die älteren Patienten. Nicht alle in dieser Arbeit erfassten Artikel nennen das Alter ihrer Patienten. Wenn sie es tun, geben sie meist das Durchschnittsalter der gesamten Patientengruppe und nicht das individuelle Alter an, weswegen ein Vergleich zwischen Depressiven und NichtDepressiven in Bezug auf das Alter nicht möglich ist. 1.3.8 Postoperative Reduktion der Parkinson-Medikation Burn and Troster (2004), Funkiewiez et al. (2004, 2003), Houeto et al. (2003), Krack et al. (2003), Doshi et al. (2002), Martinez-Martin et al. (2002), Mayberg and Lozano (2002) und Woods et al. (2002) sehen in der postoperativen Reduktion der dopaminergen Medikamente eine Ursache für das Auftreten von Depressionen nach Tiefenhirnstimulations- Operation. Burn and Troster (2004) schreiben, dass vor allem nach erfolgreicher Ncl. subthalamicus - Stimulation die dopaminergen Medikamente drastisch reduziert werden. Die Stimulation des Ncl. subthalamicus kompensiert zwar die verminderte 38 dopaminerge nigrostriatale Trans-mission und verbessert dadurch motorische Symptome, aber sie hat keinerlei Einfluss auf extrastriatale dopaminerge Systeme wie mesocorticale und mesolimbische Bahnen, die im Rahmen der Erkrankung ebenfalls einen Mangel an Dopamin aufweisen. Houeto et al. (2003) postulieren deshalb, dass es nötig sei, kleine Dosen dopaminerger Medikation postoperativ beizubehalten, um dadurch das Auftreten psychiatrischer Symptome zu vermeiden. Analog dazu berichten Houeto et al. (2003, 2002) und Funkiewiez et al. (2004) von insgesamt 16 Patienten, bei denen sich leichte depressive Symptome durch Wiedereinführen von Dopaminagonisten besserten. Im Gegensatz dazu schildern Doshi et al. (2002) das Auftreten von Depressionen bei 3 Patienten, obwohl bei allen 31 Patienten die präoperative L-Dopa-Dosis nach der Operation beibehalten wurde. Von den in dem Kapitel „Depression“ erfassten Artikeln geben zwar 24 Artikel exakte präund postoperative äquivalente Dosen von L-Dopa an, bei denen es sich jedoch um die durchschnittliche Dosis der gesamten Patientengruppe handelt. Deshalb ist ein Vergleich zwischen den Depressiven und den Nicht-Depressiven in Bezug auf die postoperative Reduktion der dopaminergen Medikation nicht möglich. 1.4 Therapie und Verlauf der Depression Zu 40,9 % der in dieser Arbeit erfassten Patienten sind keinerlei Angaben zur Therapie der Depression zu finden. Rund ein Drittel der Patienten (30,4 %) wird mit Antidepressiva therapiert. Bei 7 % wird nur erwähnt, dass eine stationäre psychiatrische Behandlung notwendig war, zu welcher sicherlich auch die Therapie mit einem Antidepressivum gehörte. Bei 13,9 % besteht die Therapie in der Wiedereinnahme von Dopaminagonisten. Bei 7,8 % wurde eine Änderung der Stimulationsparameter durchgeführt. 39 Antidepressiva 40,9 45 40 35 30,4 Dopaminagonisten 30 Änderung der Stimulationsparameter 25 in % 20 15 13,9 7,8 stationäre psychiatrische Behandlung keine Angaben zur Therapie 7 10 5 0 Therapieinterventionen Abb.9: Therapie der Depression (%-Angaben = Anteil der Patienten bezogen auf 115 Patienten) 1.4.1 Ansprechrate auf Antidepressiva Tabelle 7: Art der Medikation und deren Ergebnisse Antidepressiva SSRI Venlafaxin Clomipranin Keine Angaben zum Antidepressivum Anteil der behandelten Patienten n = 35 n = 13 (37,1 %) n = 1 (2,9 %) n = 1 (2,9 %) n = 20 ( 57,1 %) Ansprechrate Therapieversager n = 10 n=0 n=1 n = 12 n=3 n=1 n=0 n=1 (28,6 %) ( 0%) (2,9 %) (34,3 %) (8,5 %) (2,9 %) ( 0 %) (2,9 %) Keine Angaben über Ansprechrate n=7 (20 %) 13 Patienten (37,1 %) wurden mit einem selektiven Serotonin-Wiederaufnahmehemmer behandelt, jeweils 1 Patient mit Venlafaxin bzw. Clomipramin (jeweils 2,9 %). Bei 20 Patienten gaben die Autoren nicht an, um welches Antidepressivum es sich gehandelt hatte. Von den 13 mit SSRI behandelten Patienten sprachen 10 auf diese Therapie an. Der Patient, der Clomipramin bekam, zeigte unter dieser Medikation eine deutliche Besserung, während der Patient, der mit Venlafaxin therapiert wurde, keine Besserung zeigte. Von den 20 Patienten, die von den Autoren nicht näher bezeichnete Antidepressiva erhielten, besserte sich der Zustand von 12 Patienten. Vier von ihnen hatten zuvor auf Änderungen der Stimulationsparameter nicht angesprochen. Ein Patient sprach nicht auf die Therapie 40 an und zu den restlichen 7 Patienten machen die Autoren keine Angaben, ob sich die depressive Symptomatik besserte oder nicht. Das nachfolgende Diagramm veranschaulicht zusammenfassend, dass 65,8 % der 35 antidepressiv behandelten Patienten auf die Therapie ansprachen, bei 14,2 % das Medikament keine Erfolg hatte und zu 20 % der Patienten keine Angaben gemacht wurden, ob die Depression remittierte oder nicht. Patienten, die auf Antidepressiva ansprachen 20 14,2 Patienten, die nicht auf Antidepressiva ansprachen 65,8 keine Angaben, ob Patienten ansprachen oder nicht Abb.10: Gesamte Ansprechrate auf Antidepressiva 1.4.2 Ansprechrate auf Dopaminagonisten Alle 16 Patienten sprachen an, 2 von ihnen hatten zuvor auf Antidepressiva nicht angesprochen. 1.4.3 Ansprechrate auf Änderungen der Stimulationsparameter bzw. Ausschalten der Stimulation 5 Patienten sprachen an, bei weiteren 4 Patienten besserte sich die depressive Symptomatik nicht durch Änderungen der Stimulationsparameter oder der Seite der Stimulation. 41 1.4.4 Überblick: Verlauf der Depression 51,3 60 40,9 50 Besserung oder Remission keine Besserung 40 in % 30 Übergang in Demenz 20 5,2 10 keine Angaben 2,6 0 Verlauf der Depression Abb. 11: Verlauf der Depression (%- Angaben = Anteil der Patienten bezogen auf alle 115 Patienten, die an Depression erkrankten 47 Patienten (40,9 %) von 115 Patienten, die nach der Operation an einer Depression erkrankten, zeigten eine komplette oder zumindest eine Teil-Remission. Dagegen zeigten 6 Patienten (5,2%) keine Besserung, von 3 Patienten (2,6 %) wird berichtet, dass die depressive Symptomatik in eine Demenz überging. Bei 59 Patienten (51,3 %) werden keine Angaben zum Verlauf der Depression gemacht. 1.4.5 Suizid und Suizidversuch 9,6 10 7,8 9 8 7 6 in % 5 4 1,7 Suizidversuche Suizide Suizidalität 3 2 1 0 Suizidversuche, Suizide und Suizidalität Abb. 12: Suizidversuch, Suizide und Suizidalität (%-Angaben = Anteil der Patienten an allen 115 Patienten, die an Depression erkrankten) 42 Von Suizidalität ist bei 11 Patienten (9,6 %) die Rede. 9 Patienten (7,8 %) unternahmen einen Suizidversuch, 2 Patienten (1,7 %) nahmen sich das Leben. Die Suizidversuche bzw. Suizide erfolgten 2, 3, 5, 6 und 36 Monate nach der Operation. 2. Euphorie/aggressives Verhalten, Hypersexualität/enthemmtes Verhalten und Hypomanie/Manie bei Tiefenhirnstimulation 2.1 Studienergebnisse 2.1.1 Lachen, Euphorie, aggressives Verhalten Houeto et al. (2002), Romito et al. (2002) und Bejjani et al. (1999) berichten bei einem Teil ihrer Patienten, dass diese nach bilateraler Ncl. subthalamicus- Elektrodenimplantation vorübergehend euphorisch waren. Houeto et al. (2002) stellen noch zusätzlich fest, dass neben den 18 euphorischen Patienten 15 von 24 Patienten eine emotionale Hyperreaktivität nach der Operation aufwiesen. Zur Therapie der Euphorie machen die Autoren keine Angaben, vermutlich war eine Therapie nicht notwendig. Auch beschreiben die Autoren keinen konkreten Auslöser für das Auftreten der Euphorie. Anders bei Sensi et al. (2004), Funkiewiez et al. (2003), Bejjani et al. (2002), Krack et al. (2001) und Kumar et al. (1999): Sie berichten, dass ein Teil ihrer Patienten nach uni- bzw. bilateraler Ncl. subthalamicus-Elektrodenimplantation eine bemerkenswerte Stimmungsänderung durchlebte, die ganz klar mit dem Stimulationsbeginn bzw. mit Änderungen der Stimulationsparameter assoziiert war. Bejjani et al. (2002) beschreiben einen Patienten, der bei Applikation der Teststimulation 2,2 mm medial von der definitiven therapeutischen Elektrode ein aggressives Verhalten von ca. 5 min Dauer entwickelte. Nach Stimulationsende und Injektion von 50 mg Propofol sistierte das aggressive Verhalten und trat nicht mehr auf. Funkiewiez et al. (2003) erwähnen lediglich eine einmalige aggressive Episode bei einem ihrer Patienten mit bilateraler Ncl. subthalamicus-Stimulation. 43 Sensi et al. (2004) beschreiben einen Patienten, der 48 Stunden nach Stimulationsbeginn ein Verhalten entwickelte, das von Momenten des Wohlbefindens und der Euphorie im Wechsel mit Momenten großer Aggression gekennzeichnet war und sich innerhalb von Stunden oder Tagen nach Stimulationsende zurückbildete. Interessanterweise bedurfte es nach einigen Monaten einer höheren Stimulationsamplitude als unmittelbar nach der Operation, um das aggressive Verhalten auszulösen. Somit konnte nach 6 Monaten die Stimulationsamplitude erhöht werden und die dopaminerge Medikation wurde auf 30% der präoperativen Dosis reduziert. Es konnte sogar das Antipsychotikum, das zwischenzeitlich verabreicht worden war, abgesetzt werden, ohne dass die oben beschriebene Symptomatik wiedereinsetzte. Krack et al. (2001) berichten von 2 Patienten, die nach Erhöhung der Pulsspanne bzw. der Stimulationsamplitude in unkontrollierbares Gelächter ausbrachen. Nach Beendigung der Stimulation bzw. Reduktion der Stimulationsamplitude verschwand das Lachen unmittelbar oder nach einigen Minuten. Kumar et al. (1999) schildern zwei ihrer Patienten, die während Erhöhung der Stimulationsamplitude ein Wohlbefinden entwickelten und schließlich in fröhliches Gelächter ausbrachen, das noch für einige Minuten mit Unterbrechungen anhielt, nachdem die Stimulationsamplitude gesenkt oder die Stimulation ausgeschaltet worden war. 2.1.2 Hypersexualität und enthemmtes Verhalten Kleiner-Fisman et al. (2003) und Romito et al. (2003) berichten von jeweils einem Patienten, der nach bilateraler Implantation in den Ncl. subthalamicus ein hypersexuelles Verhalten entwickelte. Zu Verlauf und Therapie der Symptomatik machen beide Autoren keine Angaben. Roane et al. (2002) schildern einen Patienten, der 5 Monate nach Stimulationsbeginn des unilateralen Globus pallidus internus ein hypersexuelles Verhalten aufwies; ebenso entwickelte der Patient Ängste, Stimmungsschwankungen, motorische Unruhe, zeitweise Apathie, Hyperphagie und Verlangen nach L-Dopa. Eine Therapie mit Clozapin, die 4 Monate nach der Operation abgesetzt worden war, wurde wieder aufgenommen. Darunter 44 verschwand die Hypersexualität und die anderen Symptome besserten sich. Varma et al. (2003) berichten von einem Patienten, der nach bilateraler Ncl. subthalamicusElektrodenimplantation ein enthemmtes Verhalten aufwies, welches sich nach Reduktion von L-Dopa besserte. Houeto et al. (2002) beschreiben ebenfalls nach bilateraler Operation des Ncl. subthalamicus zwei Patienten, die eine Spielsucht entwickelten sowie abnormales sexuelles Verhalten mit Exhibitionismus. Zu einem Patienten wird erwähnt, dass die Ehefrau die Verhaltens-auffälligkeiten ihres Mannes 4 Monate nach der OP berichtete. Bei eben diesem Patienten werden leider keine Angaben zum Verlauf der Symptomatik und zur Therapie gemacht. Zum 2. Patienten wird nicht gesagt, wann die Verhaltensänderung begann, aber es wird berichtet, dass eine 4-monatige Therapie mit Lithium erfolglos blieb, ebenso wie zahlreiche Modifikationen der Stimulationsparameter. Auch eine Therapie mit Clozapin in Kombination mit Psychotherapie bewirkte keinerlei Besserung der Symptomatik. 2.1.3 Hypomanie, Manie und bipolare affektive Störung Funkiewiez et al. (2004) und Houeto et al. (2002) berichten, dass ein Teil ihrer Patienten nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus an einer Hypomanie erkrankten. Houeto et al. (2002) schreiben, dass die hypomane Episode einen Monat nach der Operation manifest wurde und sich innerhalb von zwei Wochen spontan zurückbildete. Funkiewiez et al. (2004) äußern sich ebenfalls zum Verlauf der Hypomanie: Die Symptomatik entwickelte sich bei fünf ihrer Patienten innerhalb der ersten 3 postoperativen Monate. Bei vier Patienten bildete sich die Hypomanie innerhalb von wenigen Wochen spontan zurück. Ein Patient jedoch zeigte in den folgenden 3 Jahren nach der Operation immer wieder eine hypomane Symptomatik; die Autoren erwähnen nicht, ob bei diesem Patienten eine pharmakologische Therapie, eine Reduktion der Antiparkinson -Medikation oder eine Änderung der Stimula-tionsparameter versucht wurde. Herzog et al. (2003) beschreiben ausführlich eine Patientin, die 7 Tage nach bilateralem Stimulationsbeginn des Ncl. subthalamicus hypoman wurde. Als Therapieversuch der Hypomanie wurde die bisherige Antiparkinson-Medikation reduziert, ca. 3 Wochen später 45 wies die Patientin jedoch manisch-psychotische Symptome auf, die sich unter Clozapintherapie besserten. Bald darauf entwickelte sie neben der manischen Symptomatik eine depressive Symptomatik. Mit einer Kombinationstherapie aus Carbamazepin und Clozapin war die bipolare affektive Störung in den Griff zu bekommen und die Patientin wies bis 3 Jahre nach der Operation nie wieder manische oder depressive Symptome auf. Krack et al. (2003, 2001), Tamma et al. (2003) und Romito et al. (2002) berichten ebenfalls, dass ein Teil ihrer Patienten nach bilateraler Operation des Ncl. subthalamicus hypomane bzw. manische Symptome entwickelte. Während Krack et al. (2001) und Tamma et al. (2003) über Verlauf und Therapie der Hypomanie keine Angaben machen, erwähnen Krack et al. (2003) zumindest, dass die Hypomanie vorübergehend gewesen sei. Romito et al. (2002) berichten, dass zwei ihrer Patienten 2 bzw. 3 Tage nach Implantation manisch wurden und sich die Manie bei dem einen Patienten nach sechs und bei dem anderen Patienten nach acht Monaten spontan zurückbildete. Eine Änderung der Stimulationsparameter hatte bei beiden Patienten keinerlei Einfluss auf die manische Symptomatik. Anders bei Kulisevsky et al. (2002), Miyawaki et al. (2000) und Berghmans et al. (2004): In allen genannten Artikeln war die manische Symptomatik ganz klar stimulationsabhängig. Kulisevsky et al. (2002) schildern drei Patienten, die 24 Stunden nach Beginn der bilateralen Stimulation des Ncl. subthalamicus manisch wurden. Nach Änderungen der Stimulations-parameter am Ende der 1. postoperativen Woche bildeten sich bei allen drei Patienten die manischen Symptome zurück. Eine zwischenzeitliche Reduktion der Antiparkinson-Medikation hatte keinen Einfluss auf die Manie gehabt. Miyawaki et al. (2000) berichten von einem Patienten, bei dem die Manie in Abhängigkeit von bilateraler Stimulation des Globus pallidus internus 15 Tage nach der Operation entstand und immer wieder dann auftrat, wenn die Stimulation reaktiviert wurde. Im Gegensatz zu den Patienten von Kulisevsky et al. (2002) sprach die Manie schließlich auf eine drastische Reduktion von L-Dopa - bei angeschalteter Stimulation - an. Berghmans et al. (2004) schildern ausführlich einen Patienten, der bald nach der Operation manisch wurde. Erst drei Jahre nach der Operation gelang eine Aufnahme in die Psychiatrie, da der Patient dies bis dahin immer abgelehnt hatte. Es wurde eine milde bis 46 mäßige Manie diagnostiziert, die sich nach Ausschalten der Stimulation rasch zurückbildete und nach Reaktivierung der Stimulation binnen weniger Minuten wieder entstand. Eine Änderung der Stimulationsparameter war als Therapie nicht möglich, weil dies sofort zu unannehmbaren motorischen Symptomen führte. Der Versuch, bei geringerer Stimulation die Antiparkinson -Medikation zu erhöhen schlug fehl, da der Patient selbst unter geringer Erhöhung der Medikamente manisch wurde. Es gelang auch nicht, die Manie pharmakologisch zu therapieren, da der Patient unter therapeutisch ausreichenden Dosen von Olanzapin mit oder ohne Kombination von Carbamazepin unter nicht akzeptablen Nebenwirkungen litt, eine Kombination von Valproat und Olanzapin bei einem adäquaten therapeutischen Spiegel keine Wirkung zeigte und Lithium angesichts einer möglichen Verschlechterung des Tremors kontraindiziert war. Die einzig mögliche Therapie bestand im Abschalten der Stimulation, was der Patient jedoch - im unstimulierten Zustand – ablehnte (s. auch Diskussion). Tabelle 8: Inzidenz von Euphorie, enthemmten Verhalten/Hypersexualität, Hypomanie und Manie bei Tiefenhirnstimulation Artikel Inzidenz von Euphorie/ Agression Bejjani et al. 1999 Funkiewiez 2003 Funkiewiez et al. 2004 Houeto et al. 2002 Kleiner-Fisman et al. 2003 Krack et al. 2003 Kulisevsky et al. 2002 Kumar et al. 1999 Romito et al 2002 Tamma et al. 2003 Varma et al. 2003 6,7 % 2% 75% 2% 3,3 % - 2.2 Inzidenz von Hypersexualität und enthemmten Verhalten - Inzidenz von Hypomanie Inzidenz von Manie - - 8,3 % 4% 3,3 % 14,3 % 6,5 % 4,2 % 8,2 % 3,3 % - 20 % 10 % - Mögliche Ursachen 2.2.1 Positive Anamnese für psychiatrische Erkrankungen Houeto et al. (2002) stellten erst nach der Operation fest, dass einer ihrer Patienten, der im postoperativen Verlauf ein abnormales sexuelles Verhalten entwickelte, eine positive Anamnese für eine Hypomanie aufwies. Auch Sensi et al. (2004) und Romito et al (2002) betonen, dass eine undiagnostizierte Vorgeschichte von psychiatrischen Erkrankungen 47 natürlich einen Faktor darstellt, der das postoperative Auftreten von Manien begünstigt. Tabelle 9: Vorgeschichte von psychiatrischen Erkrankungen, bei denjenigen Patienten, die Lachen, Euphorie und aggressives Verhalten nach der OP aufwiesen (Bezugsmenge n = 28) Vorgeschichte Depression in der Vorgeschichte* Depression zum Zeitpunkt der OP Angst zum Zeitpunkt der OP* Psychose in der Vorgeschichte* Keine Vorgeschichte für psychiatrische Erkrankungen keine Angaben zur psychiatrischen Vorgeschichte Zahl der Patienten n = 6 bis 11 n=2 n = 12 bis 16 n = 0 bis 2 n=1 n=4 *diese Patienten gehören zur selben Studie, d. h: 6 bis 11 Patienten haben eine Vorgeschichte für Depression und leiden zum Zeitpunkt der OP an Angst (der 2. Patient mit einer Vorgeschichte für Depression gehört zu einer anderen Studie), 4 bis 6 Patienten leiden zum Zeitpunkt der OP an Angst, 0 bis 2 Patienten haben eine Vorgeschichte für Psychosen. Tabelle 10: Vorgeschichte von psychiatrischen Erkrankungen bei denjenigen Patienten, die nach der OP hypersexuelles, abnormales sexuelles und enthemmtes Verhalten aufwiesen (Bezugsmenge n = 6 ) Vorgeschichte Depression in der Vorgeschichte* Angst zum Zeitpunkt der OP* Psychose in der Vorgeschichte* Hypomanie in der Vorgeschichte* Keine Vorgeschichte für psychiatrische Erkrankungen keine Angaben zur psychiatrischen Vorgeschichte Zahl der Patienten n = 2 bis 3 n = 0 bis 2 n = 0 bis 1 n=2 n=1 n=1 *diese Patienten gehören zur selben Studie, d. h: 1 Patient wies eine Vorgeschichte für Depressionen und Hypomanie auf (der 2.hypomanische Patient gehört zu einer anderen Studie), 0 bis 1 Patient eine Vorgeschichte für Depression und Angst, 0 bis 1 Patient eine Vorgeschichte für Depression, Angst und Psychose Tabelle 11: Vorgeschichte von psychiatrischen Erkrankungen bei den Patienten, die nach der OP an einer Hypomanie, Manie oder bipolaren affektiven Störung erkranken (Bezugsmenge n = 22 + 1*) Vorgeschichte Zahl der Patienten Depression in der Vorgeschichte** n = 1 -2 Depression zum Zeitpunkt der OP n=1 Angst zum Zeitpunkt der OP** n = 0 bis 1 Psychose in der Vorgeschichte** n = 0 bis 1 Keine Psychose in der Vorgeschichte n=1 Bipolare affektive Erkrankung in der Vorgeschichte n=2 Keine psychiatrische Erkrankung zum Zeitpunkt der OP n = 4 Keine Vorgeschichte für psychiatrische Erkrankungen n=7 Keine Angaben zur psychiatrischen Vorgeschichte n=6 * die Daten dieses Patienten sind nicht veröffentlicht ** Diese Patienten gehören zur selben Studie, d.h.: 0 bis 1 Patient hatte eine Vorgeschichte für Depression, Angst und Psychose zum Zeitpunkt der OP (der 2.Patient mit Depression in der Vorgeschichte gehört zu einer anderen Studie) Die Auswertung der Tabellen 9-11 ergeben, dass 11 bis 20 von 28 Patienten, die 48 postoperativ Lachanfälle, Euphorie oder gemischt euphorisch-aggressives Verhalten aufwiesen, entweder psychiatrische Symptome (und zwar Angst und Depression) zum Zeitpunkt der OP zeigten oder eine positive Vorgeschichte für psychiatrische Erkrankungen wie Psychosen oder Depressionen hatten. 2 bis 4 von 6 Patienten, die im postoperativen Verlauf ein hypersexuelles, abnormales sexuelles oder enthemmtes Verhalten entwickelten, wiesen entweder psychiatrische Symptome (nämlich Angst) zum Zeitpunkt der OP auf oder waren vor der Operation schon einmal an Psychosen, Hypomanien oder Depressionen erkrankt. Nur 4 bis 5 von 23 Patienten, die nach der Elektrodenimplantation an einer Hypomanie, Manie oder bipolaren affektiven Störung erkrankten, wiesen entweder ein psychiatrisches Symptom (nämlich Angst und Depression) oder eine positive Anamnese für Psychosen, Depressionen oder bipolaren affektiven Störungen auf. 2.2.2 Stimulation des Ncl. subthalamicus oder umgebender Strukturen und Beeinflussung von neuronalen Schleifensystemen Piasecki and Jefferson (2004), Herzog et al. (2003), Romito et al. (2002), Woods et al. (2002), Krack et al. (2001), Bejjani et al. (1999) und Kumar et al. (1999) nennen als Ursache für das Auftreten von manischen Symptomen, Euphorie und unwillkürlichen Lachanfällen, dass die Stimulation des Ncl. subthalamicus nicht-motorische Schleifensysteme, die durch den Ncl. subthalamicus hindurchgehen, beeinflussen könnte. Kumar et al. (1999) beschreiben, dass Schleifensysteme, die den Cortex mit den Basalganglien verbinden und den Ncl. subthalamicus und die benachbarte Substantia nigra miteinschließen, ebenso assoziative und limbische Funktionen beeinflussen. Die Autoren nehmen Bezug auf drei Studien von Fried et al. (1998), Arroyo et al (1993) und Talairach et al. (1973), die durch elektrische Stimulation der anterioren supplemtentären motorischen Area, des anterioren Gyrus cingulus und des basalen Temporallappens Lachen mit oder ohne empfundener Fröhlichkeit auslösten. Die Aktivität der supplementären motorischen Area und des Gyrus cingulus wird durch Stimulation des Ncl. subthalamicus modifiziert, während der Temporallappen ein Zielareal der Basalganglien darstellt. Herzog et al. (2003) verweisen auf zwei Studien, die berichten, dass durch Infarkt oder Tumor entstandene Läsionen des Ncl. subthalamicus psychische Veränderungen induzierten, die durch Agitiertheit, Manie und Logorrhoe charakterisiert waren. Gleichzeitig 49 geben die Autoren zu bedenken, dass es unwahrscheinlich sei, dass in Anbetracht des kleineren Umfangs des Ncl. subthalamcius die Tiefenhirnstimulation nur den sensomotorischen dorsolateralen Teil beeinflusse, ohne auf den limbischen Teil eine Wirkung auszuüben. Miyawaki et al. (2000) berichten, dass sie bei den drei Patienten, die postoperativ manisch wurden, eine PET-Untersuchung durchführten. Zum Zeitpunkt der PET-Untersuchung waren die Patienten allerdings nicht manisch, jedoch waren die Stimulationsparameter genau diejenigen, die sie auch im manischen Zustand gehabt hatten. Die PositronenEmissions-Tomographie zeigte regionale Blutflussabnahmen im linken Hippocampus und Parahippo-campus bei allen drei Patienten. Die Autoren nehmen Bezug auf andere Studien, die berichten, dass Patienten mit Manie, die mit fokalen Gehirnläsionen assoziiert war (Starkstein et al. 1990), Patienten mit medikamenten-induzierter Euphorie (Cohen et al. 1991) und gesunde Probanden mit vorübergehender Euphorie (George et al. 1995) reduzierte metabolische Aktivität oder reduzierten Blutfluss in limbisch assoziierten Regionen aufwiesen. Sensi et al. (2004) und Kulisevsky et al. (2002) stellen die Überlegung an, dass das Mikrotrauma, das durch die Elektrodenimplantation durch den anterioren Cortex cinguli oder durch den Thalamus gesetzt wurde, eine Möglichkeit für die psychiatrischen Symptome sein könnte. Sensi et al. (2004) schließen diese Hypothese jedoch im nächsten Satz wieder aus, da das postoperative MRI unauffällig gewesen sei und die Verhaltensauffälligkeiten nach Ausschalten der Stimulation voll reversibel gewesen seien. Piasecki and Jefferson (2004), Kulisevsky et al. (2002) und Romito et al. (2002) sehen in der Fehlplazierung der Elektroden eine weitere Ursache für die Entstehung von psychiatrischen Symptomen. Kulisevsky et al. (2002) mutmaßen - ohne dies mittels einer MRI zu verifizieren - dass die unteren Elektroden bei drei Patienten im Bereich des Mittelhirns platziert waren. Stimulation der unteren Elektroden beeinflusste Verbindungen vom Mittelhirn zum Orbitofrontalcortex oder zum anterioren Cingulum oder Faserzüge vom ventralen Tegmentum zum limbischen Striatum, was für eine Manie typische Symptome auslöst. Durch Stimulation der höheren anstatt der unteren Kontakte verschwand die manische Symptomatik bei allen drei Patienten. Piasecki and Jefferson (2004) überprüften 50 mittels postoperativem MRI die Elektrodenposition eines Patienten, der nach der Operation hypomane Symptome aufwies und stellten fest, dass die Elektroden auf beiden Seiten über den Ncl. subthalamicus hinaus bis in die Substantia nigra reichten. Eine Korrektur der Elektrodenposition wurde jedoch nicht vorgenommen. Das Befinden dieses Patienten besserte sich unter Therapie mit dem Antipsychotikum Olanzapin. Sensi et al. (2004) dagegen sind sich sicher, dass eine Fehlplazierung der Elektroden nicht Ursache des teils aggressiven teils euphorischen Verhaltens ihres Patienten war, da zwischen der Stimulation eines bestimmten Kontaktes und dem Entstehen der Symptomatik kein Zusammenhang bestand. Sensi et al. (2004), Burn and Troster (2004) und Krack et al. (2001) halten es für möglich, dass sich der von den Elektroden abgegebene Strom in nicht-motorische Areale ausgebreitet haben könnte. Sie stützen ihre Hypothese auf die Beobachtung, dass eine Erhöhung der Stimulationsamplitude die Aggressivität bzw. die Lachanfälle auslöste und dass beides durch Verringerung der Stimulationsamplitude oder Ausschalten der Stimulation sistierte. Sensi et al. (2004), deren Patient durch Erhöhung der Stimulationsamplitude ein aggressives Verhalten zeigte, verweisen auf Eichelmann et al. (1971), die beschreiben, dass Stimulation des posterolateralen Hypothalamus bei Ratten Angst und Wut auslöste und dass eine Stimulation der ventralen tegmentalen Area und des Ncl. accumbens mit niedriger Frequenz angriffslustiges Verhalten, das durch Stimulation des Hypothalamus hervorgerufen worden war, unterdrückte. Krack et al. (2001) nehmen Bezug auf Sturm et al. (2000), die von drei Patienten mit unwillkürlichen Lachanfällen berichten, die hypothalamische Hamartome am Boden des 3.Ventrikels und der Corpora mamillaria aufwiesen. Der Ncl. subthalamicus hat Verbindungen zum Ncl. accumbens, zum lateralen Hypothalamus und zur zentralen Amygdala und liegt in unmittelbarer Nähe zu diesen subcortikalen limbischen Strukturen. Piasecki and Jefferson (2004) halten ebenso wie für die Entstehung von Depressionen so auch für die Entstehung von Manien eine durch Stimulation induzierte Perturbation von Neurotransmittern für einen möglichen Pathomechanismus. (s.1.3.3) 51 Tabelle 12: Verteilung der stimulierten Gehirnareale der Patienten, die nach der OP Lachen und Euphorie entwickelten, und der dazugehörigen Gesamtgruppe (Anhang-Tabelle 10) Stimuliertes Gehirnareal Ncl. subthalamicus Patienten, die Lachen, Euphorie und Aggression aufwiesen n = 28 (11,8 %) (2: unilateral; 26: bilateral) Gesamte Patientengruppe n = 238 (2: unilateral; 236: bilateral) Tabelle 13: Verteilung der stimulierten Gehirnareale derjenigen Patienten, die nach der OP hypersexuelles, abnormales sexuelles oder enthemmtes Verhalten aufwiesen, und der dazugehörigen gesamten Patientengruppe (Anhang-Tabelle 11) Stimuliertes Gehirnareal Ncl. subthalamicus, bilateral Globus pallidus internus, unilateral Gesamte Patientengruppe Patienten, die an hypersexuellem, abnormal sexuellem oder enthemmtem Verhalten erkrankten n = 5 (5,8 %) n = 86 n=1 n=1 Tabelle 14: Verteilung der stimulierten Gehirnareale der Patienten, die nach der OP an einer Hypomanie oder Manie erkrankten, und der dazugehörigen gesamten Patientengruppe (Anhang-Tabelle 12) Stimuliertes Gehirnareal Ncl. subthalamicus, bilateral Globus pallidus internus, bilateral Patienten, die an einer Hypomanie oder Manie erkrankten n = 21 + 1* (9,6 %) n=1 Gesamte Patientengruppe n = 229 + 1* n=1 *die Daten dieses Patienten sind nicht veröffentlicht Wie auch schon bei Depressionen so scheint auch hier vor allen Dingen die Elektrodenimplantation in den Ncl. subthalamicus mit einem psychiatrischen Erkrankungsrisiko behaftet zu sein. Das Risiko, nach bilateraler Ncl. subthalamicus- Stimulation Lachen und Euphorie bzw. hypersexuelles, abnormales sexuelles oder enthemmtes Verhalten bzw. hypo-manisches oder manisches Verhalten zu entwickeln, betrug 11,8 % bzw. 5,8 % bzw. 9,6 %. 2.2.3 Bedeutung von L-Dopa Burn and Troster (2004), Funkiewiez et al. (2004), Krack et al. (2003) und Romito et al. (2002) vertreten die Meinung, dass ein additiver psychotroper Effekt von L-Dopa und Stimulation des Ncl. subthalamicus Ursache für das Auftreten von Manie und Hypomanie sein könnte. Was für diese Hypothese spricht - so sehen es Burn and Troster (2004) -, ist die Tatsache, dass hypomane und manische Symptome sehr bald nach der Operation auftreten (s. Tab. 18). 52 Romito et al. (2002) machen mit zwei ihrer Patienten, die nach der Operation manisch wurden, eine interessante Beobachtung, die die o. g. Hypothese bekräftigt: Bei dem einen Patienten wurde die dopaminerge Medikation einen Monat nach der Implantation abgesetzt, bei dem anderen Patienten erst 4 Monate nach der Operation. Bemerkenswerterweise hielten beim letzteren Patient die manischen Symptome länger an als beim erst genannten Patienten. Die Hypothese der Autoren würde auch zum Verlauf der Symptomatik eines Patienten, den Miyawaki et al. (2000) beschreiben, passen: Dieser Patient hatte eine durch Aktivierung der Stimulation ausgelöste Manie, die sich durch Deaktivierung der Stimulation wieder zurückbildete. Die Stimulation löste erst dann keine manischen Symptome mehr aus, als L-Dopa auf die niedrigst mögliche Dosis reduziert worden war. Im Gegensatz dazu berichten Kulisevsky et al. (2002), dass sich bei 3 Patienten im postoperativen Verlauf manische Symptome entwickelten, obwohl die postoperative LDopa- Äquivalenzdosis mit der präoperativen identisch war. Die Manie besserte sich auch nicht durch Reduktion der Antiparkinson-Medikamente. Woods et al. (2002) hingegen überlegen, ob die postoperative Reduktion der dopaminergen Medikamente Ursache für manische Symptome sein könnte. Sensi et al. (2004) glauben nicht, dass dies der Manie zugrunde liegt, da bei ihren Patienten die Wiederaufdosierung auf die präoperative L-Dopa-Dosis keinen Einfluss auf die Manie hatte. 2.2.4 Verbesserung der Motorik Herzog et al. (2003), Woods et al. (2002) und Bejjani et al. (1999), halten es für plausibel, dass die drastische Verbesserung der Parkinson-Symptome von einem Tag auf den nächsten einige Patienten in einen euphorischen oder gar manischen Zustand versetzt habe. Houeto et al. (2002) gehen sogar soweit, dass sie schreiben, die Verbesserung der Motorik ermögliche es nun einem Patienten, sein abnormales sexuelles Verhalten, das durch die Parkinson-Symptomatik vorher im Zaum gehalten wurde, voll auszuleben. Dagegen schließen Krack et al. (2001) die Verbesserung der motorischen Symptome als 53 Ursache für das fröhliche Gelächter, in das zwei ihrer Patienten unwillkürlich ausbrachen, als die Stimulationsamplitude erhöht wurde, aus. Die motorischen Symptome zeigten nämlich keine relevante Besserung während der Erhöhung der Stimulationsamplitude. Die Lachanfälle standen ganz klar mit der Stimulation in Zusammenhang. Die Tatsache, dass parallel zu den Lachanfällen Stereotypien und Dyskinesien auftraten, die zusammen mit den Lachanfällen auch wieder aufhörten, als die Stimulation beendet wurde, stellt einen weiteren Grund dar, der dafür spricht, dass das Gelächter stimulationsinduziert war. 2.3. Therapie und Verlauf 2.3.1 Therapie von Lachen, Euphorie, aggressivem Verhalten Tab.15: Therapiemaßnahmen bei den 28 Patienten, die nach der OP Euphorie, Lachen oder aggressives Verhalten aufwiesen Therapiemaßnahme Anteil der Patienten Abschalten der Stimulation Reduktion von L-Dopa Gabe von Quetiapin Spontane Rückbildung Keine Angaben n = 6 * (21,4 %) n = 1 * (3,6 %) n = 1* (3,6 %) n = 19 (67,9 %) n = 3 (10,7 %) Anteil der Patienten, der auf die Therapie ansprach n=6 n=1 n = 0 -1 n=0 Das Ausschalten der Stimulation zeigte bei allen 6 Patienten eine vollkommene Rückbildung der Symptome, die entweder unmittelbar nach Deaktivierung der Stimulation, nach einigen Minuten oder sogar nach Stunden bis Tagen eintrat. Bei einem Patienten* mit gemischt aggressiv-euphorischem Verhalten, der zu den 6 Patienten mit Stimulationsabschaltung gehörte, bewirkte die Reduktion der dopaminergen Medikation 6 Monate nach der Operation eine Remission der Symptomatik auch bei angeschalteter Stimulation. Bei eben diesem Patienten wurde auch eine pharmakologische Therapie mit dem Antipsychotikum Quetiapin versucht; die Autoren gehen nicht darauf ein, ob dadurch eine Besserung erzielt wurde oder nicht. Zu den 19 Patienten, deren Symptome sich spontan zurückbildeten, machen die Autoren über den zeitlichen Verlauf keine Angaben, zu den 3 übrigen Patienten werden weder zur Behandlung noch zum Verlauf Angaben gemacht. 54 2.3.2 Therapie und Verlauf von Hypersexualität, enthemmtem Verhalten und abnormal sexuellem Verhalten Tabelle 16: Therapiemaßnahmen bei den 6 Patienten mit Hypersexualität, enthemmten Verhalten und abnormal sexuellem Verhalten Therapiemaßnahme Anteil der Patienten Gabe von Lithium Gabe von Clozapin Reduktion von L-Dopa Psychotherapie Änderungen der Stimulationsparameter Keine Angaben n=1* n=2* n=1 n=1* n=1 n=3 Anteil der Patienten, der auf die Therapie ansprach n=0 n=1 n=1 n=0 n=0 Zu 3 von 6 Patienten werden in Hinblick auf die Therapie keine Angaben gemacht. Bei einem Patienten*, der ein abnormales sexuelles Verhalten nach der Operation aufwies, schlugen eine viermonatige Lithiumtherapie und ein Therapieversuch mit Clozapin und Psychotherapie fehl. Bei einem anderen Patienten sprach jedoch das hypersexuelle Verhalten auf Clozapin gut an. Enthemmtes Verhalten eines weiteren Patienten besserte sich durch Reduktion von L-Dopa. 2.3.3. Therapie und Verlauf von Hypomanie, Manie und bipolarer affektiver Störung Tabelle 17: Therapiemaßnahmen und ihre Wirksamkeit bei Patienten mit postoperativer Hypomanie oder Manie (Bezugsmenge n = 22 + 1*) Therapiemaßnahmen Ausschalten der Stimulation/ Änderungen der Stimulationsparameter Reduktion/ Änderung der Antiparkinson- Medikation Pharmakologische Therapie Spontane Rückbildung Keine Angaben Anteil der Patienten n = 8** (34,8 %) Besserung n =4 (17,4 %) n = 6** (26,1 %) n =1 (4,3 %) n = 5** (21,7 %) n = 7 (30,4 %) n = 8 (34,8 %) n =3 (13 %) Keine Besserung n =1 (4,3 %) * Die Daten dieses Patienten sind nicht veröffentlicht ** Mehrfachnennungen infolge Kombinationstherapien Bei 4 von 8 Patienten besserten sich die hypomanen oder manischen Symptome durch Ausschalten der Stimulation bzw. Änderungen der Stimulationsparameter. Die Symptomatik eines von 6 Patienten sprach auf Reduktion der Antiparkinson-Medikation an. 3 Patienten mit Hypomanie, Manie bzw. bipolarer affektiver Störung besserten sich vollständig unter pharmakologischer Therapie, ein Patient besserte sich nur teilweise, ein weiterer sprach nicht an auf pharmakologische Therapiemaßnahmen. Eine spontane Rückbildung der 55 Hypomanie oder Manie vollzog sich bei 7 Patienten. Zu 8 Patienten wurden keine Angaben in Hinblick auf die Therapie gemacht. Tabelle 18: Überblick über die pharmakologische Therapie von Hypomanie, Manie und bipolarer affektiver Störung bei 5 Patienten Pharmakon Olanzapin Symptomatik Patient 1: Hyomanie Patient 2* : Manie Manie* Manie* Olanzapin und Valproat Olanzapin und Carbamazepin Quetiapin Clozapin Manie Bipolare affektive** Störung Clozapin und Carbamazepin Bipolare affektive** Störung Valproinsäure Manie Patientenanzahl n=2 n=1 n=1 Therapeutischer Effekt Patient 1: Besserung, Patient 2: keine Besserung Keine Besserung Keine Besserung n=1 n=1 Unvollständige Besserung Besserung n=1 Besserung n=1 Besserung */** kennzeichnet 2 Patienten mit Mehrfachtherapie Tabelle 19: Zeitlicher Verlauf von Hypomanie, Manie und bipolarer affektiver Störung (Bezugsmenge n = 23) Anzahl der Patienten 4 1 3 Symptomatik Hypomanie Hypomanie Manie 1 Manie 1 Manie 1 Manie 1 1 1 Bipolare affektive Störung Hypomanie Hypomanie 4 Hypomanie 1 Hypomanie 1 1 1 1 Manie Manie Manie Hypomanie Beginn unmittelbar nach OP bald nach der OP 24 h nach Beginn der Stimulation (=24 h nach OP) 2 Tage nach der OP (1 Tag vor Beginn der Stimulation) 3 Tage nach der OP (wenige Stunden nach Beginn der Stimulation) 15 Tage nach OP 26 Tage nach Beginn der Stimulation 1 Monat nach OP 6 Wochen nach Beginn der Stimulation innerhalb der ersten 3 Monate nach der OP innerhalb der ersten 3 Monate nach der OP bald nach der Implantation bald nach der Implantation keine Angaben keine Angaben Ende keine Angaben keine Angaben 1 knappe Woche nach der OP ca. 3 Monate nach der OP 8 Monate nach der OP jenseits des 80. Tages nach der OP ca. 2-5 Monate nach der OP innerhalb von 2 Wochen keine Angaben innerhalb weniger Wochen chronisch chronisch chronisch keine Angaben keine Angaben Der zeitliche Verlauf zeigt, dass sich die Symptomatik bei 52,2 % der Patienten besserte, bei 13 % trat keine Besserung ein und für 34,8 % wurden keine Angaben gemacht. 56 60 52,2 Stunden bis wenige Tage nach der OP 0,5 Monate nach der OP 1 Monat nach der OP 50 40 in % 30 21,7 20 4,3 10 8,7 8,7 4,3 1,5 Monate nach der OP innerhalb der ersten 3 Monate keine Angaben 0 Abb.13: Beginn von Hypomanie, Manie oder bipolarer affektiver Störung 34,8 34,8 35 innerhalb von 1 bis wenigen Wochen 30 3 Monate nach der OP 25 2 bis 5 Monate nach der OP 20 in % 13 15 8,7 10 4,3 5 8 Monate nach der OP chronisch 4,3 keine Angaben 0 Abb.14: Zeitpunkt der vollständigen Rückbildung von Hypomanie, Manie und bipolarer affektiver Störung Die beiden oben stehenden Diagramme geben einen Überblick über durchschnittlichen Beginn und durchschnittlichen Zeitpunkt der vollständigen Rückbildung von Hypomanie, Manie und bipolarer affektiver Störung an. 52,2 % der Patienten entwickelten die Symptomatik Stunden bis wenige Tage nach der Operation, 39 % innerhalb der ersten 3 Monate und zu 8,7 % der Patienten werden keine Angaben gemacht, wann die psychiatrische Erkrankung begann. Bei 34,8 % der Patienten bildete sich die Symptomatik auch recht schnell wieder zurück, nämlich innerhalb von ein, zwei oder wenigen Wochen. Bei 13 % der Patienten findet keine Rückbildung der Symptome statt. Zu 34,8% werden über den Zeitpunkt der Genesung keine Aussagen gemacht. 57 2.3.4 Suizidalität Von Suizidalität und Fremdgefährdung ist bei einem Patienten mit hypomanen Symptomen die Rede, der vage Suizidgedanken äußerte und meinte, er wolle seiner Tochter etwas antun. Die Symptomatik besserte sich durch pharmakologische Therapie mit Olanzapin. 58 3. Angst bei Tiefenhirnstimulation 3.1 Studienergebnisse 3.1.1 Verbesserung von Angst bei Tiefenhirnstimulation Mehrere Autoren beschreiben eine signifikante Abnahme von Angstsymptomatik ihrer Patienten nach der Tiefenhirnstimulations-Operation. So berichten Dujardin et al. (2004) und Martinez-Martin et al. (2002), dass 3 bzw. 6 Monate nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus eine signifikante Reduktion des Wertes der AMPD-AT-Angst Skala bzw. der Hospital Anxiety Scale vorlag. Woods et al. (2001) erwähnen, dass die durch den Beck Anxiety Inventory ermittelte Angstsymptomatik ca. 1 Jahr nach unilateraler Operation des Thalamus signifikant abgenommen hatte. Fields et al. (1999) und Troster et al. (1997), die ihre Patienten bilateral bzw. unilateral am Globus pallidus internus operierten, berichten ebenfalls von einer signifikanten Abnahme der Angst ihrer Patienten. Fields et al. (1999) überprüften dies mit Hilfe des Beck Anxiety Inventory 3 Monate nach der Operation, während Troster et al. (1997), die ihre Patienten auch 3 Monate nach dem Eingriff evaluierten, keine Angaben zu einem entsprechenden Test machen. Mallet et al. (2002) schildern zwei Patienten nach bilateraler Operation des Ncl. subthalamicus, deren Brief Anxiety Scale-Wert 6 Monate nach der OP um 71% bzw. 100 % abnahm. Ebenso berichten Ford et al. (2004), dass zwei ihrer Patienten, die präoperativ an schwerer Angst während des “off-Zustandes” gelitten hatten, nach bilateraler Ncl. subthalamicus - Operation überhaupt keine Angstsymptomatik mehr entwickelten. Leider haben die Autoren dies nicht mittels eines spezifischen Tests verifiziert. Fontaine et al. (2004) dagegen schreiben von einer leichten Verbesserung der Angstsymptomatik nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus. Evaluiert wurden die Patienten zum letzten Mal 6 Monate nach der Operation, zur Evaluation psychiatrischer Symptome dienten ein nicht-strukturiertes und ein strukturiertes Interview. Fields et al. (2003) und Straits-Troster et al. (2000) machen keine Aussage zum Grad der Verbesserung der Angst-Symptomatik. Die Patienten wurden 3.26 und 12 Monate nach unilateraler Operation des Thalamus bzw. 3 Monate nach bilateraler Operation des Globus 59 pallidus internus mit Hilfe der Angst-Skala des Profile of Mood States bzw. des Beck Anxiety Inventory evaluiert. Higginson et al. (2001) nennen zwar genaue Prozentangaben, um die sich der durchschnittliche Brief Anxiety Inventory ca. 4 Monate nach der Operation reduzierte, jedoch umfasst ihr Patientengut 10 Patienten mit unilateraler Globus pallidus-Stimulation, 4 Patienten mit unilateraler Stimulation des Thalamus und 25 Patienten mit Pallidotomie bzw. Thalamotomie und die Autoren beziehen den Durchschnittswert leider auf die gesamte Gruppe, anstatt die eben genannten Untergruppen einzeln zu evaluieren. Sie beschreiben auch, dass 11 ihrer Patienten, bei denen präoperativ Angst diagnostiziert wurde, diese Diagnose nach der Operation nicht mehr aufwiesen, ohne aber zu präzisieren, welcher Operation diese 11 Patienten unterzogen wurden. Gabriels et al. (2003), Sturm et al. (2003) und Nuttin et al. (1999) berichten von Zwangspatienten, deren Angstsymptomatik sich nach der Operation besserte. Gabriels et al. (2003) und Nuttin et al. (1999) beschreiben jeweils eine Patientin, die sich nach bilateraler Elektrodenimplantation in die Capsula interna weniger ängstlich fühlte. Als diagnostischer Test wurde in beiden Artikeln der Profile of Mood States verwendet, und das postoperative follow-up betrug bei Gabriels et al. (2003) 1 Jahr, Nuttin et al. (1999) machen dazu keine Angaben. Bei Sturm et al. (2003) besserte sich bei 3 von 4 Patienten, die präoperativ unter schwerer Angst gelitten hatten, die Symptomatik beinahe vollständig nach unilateraler Operation des Ncl. accumbens, während beim vierten Patienten keine Besserung eintrat (s. 3.1.3). Das Follow-up der Patienten betrug 24 bis 30 Monate; die Autoren nennen keinen diagnostischen Test zur Evaluation der Angst. 3.1.2 Verbesserung der Angst während Stimulation und Auftreten von AngstSymptomatik, wenn die Stimulation ausgeschaltet wurde Schneider et al. (2003), die allgemeine psychiatrische Symptome mit der Brief Psychiatric Rating Scale und der Well-being-Scale bei ihren Patienten nach bilateraler Operation des Ncl. subthalamicus evaluierten, stellten fest, dass diese während Stimulation geringer waren als ohne Stimulation. Lucas et al. (2000) beschreiben einen Patienten, dessen Ergebnisse im State-Trait Anxiety 60 Inventory während bilateraler Stimulation des Thalamus im Normbereiche lagen, der aber während ausgeschalteter Stimulation von einer moderaten Zunahme (d.h. größer als zwei Standardabweichungen) der Angstsymptomatik berichtete. Das postoperative Follow-up dieses Patienten betrug 3 Monate. 3.1.3 Keine Veränderung von Angstsymptomatik bei Tiefenhirnstimulation Bei Brusa et al. (2001) ergab die Evaluation der Angstsymptomatik mittels visueller Analogskala, dass die Patienten, von denen die eine Hälfte eine bilaterale Elektrodenimplantation in den Globus pallidus internus und die andere Hälfte in den Ncl. subthalamicus erhielt, keine signifikanten Unterschiede in ihrer Angst zwischen prä- und postoperativer Untersuchung aufwiesen. Castelli et al. (2004), Perozzo et al. (2001a) und Lopiano et al. (2001), evaluierten 9 bis 12 bzw. 6 Monate und 3 Monate nach bilateraler Operation des Ncl. subthalamicus ihre Patienten mittels State-Trait Anxiety Inventory, Perozzo et al. (2001) und Lopiano et al. (2001) machten zusätzlich noch Gebrauch von strukturiertem (bei Perozzo et al. (2001a) auch nicht-strukturiertem) Interview. Alle drei Autoren stellten keine signifikanten Unterschiede zwischen prä- und postoperativer Angstsymptomatik ihrer Patienten fest Monaca et al. (2004) und Halbig et al. (2004) evaluierten ihre Patienten nach bilateraler Ncl. subthalamicus- Implantation mit Hilfe von strukturierten Interviews und der Hospital Anxiety and Depression Scale bzw. mittels Fragebögen, die unter anderem Angstsymptomatik abfragten. Beide Autoren erwähnen kein Ergebnis ihrer Evaluation, weswegen davon ausgegangen wird, dass keine Änderungen im Vergleich zu präoperativen Ergebnissen vorlagen. Wie unter 3.1.1 bereits erwähnt zeigt bei Sturm et al. (2003) ein Patient nach unilateraler Operation des Ncl. subthalamicus keine Besserung seiner schweren Angstsymptomatik. Bei Higginson et al. (2001), die ebenfalls bereits unter 3.1.1 erwähnt werden, wurde bei 17 Patienten sowohl prä- als auch postoperativ Angst mittels des Brief Anxiety Inventory diagnostiziert. Leider ist nicht klar, ob diese 17 Patienten zur Gruppe mit unilateraler Globus pallidus internus- Stimulation, unilateraler Thalamus- Stimulation oder Pallidotomie/ Thalamotomie gehören. 61 Houeto et al. (2002), die u. a. von 4 Patienten mit Agoraphobie berichten (s.3.1.4), schreiben, dass 17 ihrer Patienten präoperativ bereits an Angst gelitten hatten. Nach der Operation war Angstsymptomatik bei 18 Patienten zu diagnostizieren. Leider wird nicht deutlich, ob 17 dieser 18 Patienten dieselben Patienten waren, die auch präoperativ Angstsymptome aufwiesen. 3.1.4 Angst bei Tiefenhirnstimulation Houeto et al. (2002) und Dujardin et al. (2001) berichten, dass ein Teil ihrer Patienten nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus Angst entwickelte. Dujardin et al. (2001) beschreiben nicht näher die Angstsymptomatik ihres Patienten, während Houeto et al. (2002) präzisieren, dass es sich bei 4 ihrer Patienten, die unter Angst litten, um Agoraphobie handelte. Bei 2 von diesen 4 Patienten fand laut den Autoren eine dramatische Verschlech-terung der Symptomatik statt. Zur Evaluation psychiatrischer Symptome verwendeten Houeto et al. (2002) ein strukturiertes, semistrukturiertes und ein nicht-strukturiertes Interview sowie die IOWA-Skala für Änderungen der Persönlichkeitseigenschaften, während Dujardin et al. (2001) sich auf ein nichtstrukturiertes Interview beschränkten. Das postoperative Follow-up betrug bei Houeto et al. (2002) 19 und bei Dujardin et al. (2001) 12 Monate. Zu Therapie und Verlauf findet man in beiden Artikeln keine Angaben. Dagegen gehen Koller et al. (2001) und Roane et al. (2002), die jeweils von einem Patienten berichten, der nach unilateraler Stimulation des Thalamus bzw. des Globus pallidus internus Angstsymptomatik entwickelte, auf Therapie und Verlauf ein: Bei Koller et al. (2001) war die Angst mild und durch Änderungen der Stimulationsparameter in den Griff zu bekommen. Der Patient bei Roane et al. (2002) wies neben der Angst auch noch hypersexuelles Verhalten, motorische Unruhe, Schlaflosigkeit, Hyperphagie und Verlangen nach L-Dopa auf. Er erhielt Clozapin, das er schon früher eingenommen hatte und das 4 Monate nach der Operation abgesetzt worden war. Während unter 50 mg Clozapin das hypersexuelle Verhalten vollständig verschwand, besserten sich die anderen Symptome einschließlich der Angst. In beiden Artikeln werden keine Angaben zu einem diagnostischen Test gemacht. 62 Funkiewiez et al. (2004) berichten von einem Patienten, der nach bilateraler ElektrodenImplantation in den Ncl. subthalamicus eine Verschlechterung von Angstsymptomatik und Depression aufwies und erstmals nach der Operation unter Apathie litt. Die Autoren diagnostizierten die Symptome mit Hilfe eines nicht-strukturierten Interviews. Sie erwähnen, dass eine Therapie mit Fluoxetin und Amitryptilin keinen Erfolg erzielte, sich die Apathie jedoch im Laufe der Zeit besserte. Zum Verlauf der Angstsymptomatik und der leichten Verschlechterung der Depressionen machen sie keine Angaben. Okun et al. (2004) berichten von einer Patienten, die nach Stimulationsbeginn des bilateralen Ncl. subthalamicus in unkontrollierbares Weinen verfiel, das jedoch weder mit depressiver noch mit ängstlicher Symptomatik assoziiert war. Das unkontrollierbare Weinen war auf Dauer mit Sertralin in den Griff zu bekommen. Setzte die Patientin das Medikament jedoch ab, entwickelte sie binnen 24 bis 28 Stunden wieder die eben beschriebene Symptomatik. Bei der Stimulation jedes einzelnen Kontaktes (wobei bei jedem Kontakt das Weinen ausgelöst wurde) fiel auf, dass die Stimulation des distalen Kontaktes 0 bei der Patientin ein Gefühl von Angst und Panik auslöste. Auch führte die Stimulation mehr proximal und dorsal des Ncl. subthalamicus zu Angst. Bei Higginson et al. (2001), die schon unter 3.1.1 und 3.1.3 erwähnt wurden, wird bei 2 Patienten erstmals nach der Operation Angst diagnostiziert. Leider ist nicht klar, ob diese beiden Patienten zur Gruppe mit unilateraler Globus pallidus internus -Stimulation, unilateraler Thalamus -Stimulation oder Pallidotomie/Thalamotomie gehören. Als diagnostischer Test wurde der Brief Anxiety Inventory eingesetzt. Tabelle 19: Inzidenz von Angst bei Tiefenhirnstimulation Artikel Dujardin et al. 2001 Funkiewiez et al. 2004 Higginson et al. 2001 Houeto et al. 2002 Koller et al. 2001 3.2. Inzidenz von Angst 11,1 % 1,3 % 5,1 % 20,8 % 2,0 % Verteilung der Tests zur Evaluation von Angst 29 Artikel berichten von Patienten, die nach der Operation Angstsymptome entwickelten. 63 Davon wandten 24 Artikel mindestens einen der folgenden Tests zur Evaluation von Angst an: Tabelle 20: Verteilung der Tests zur Evaluation von Angst bezogen auf alle 24 Artikel, die solche Tests angaben. (10 Artikel verwendeten mehr als einen Test) Test Hamilton Anxiety and Depression Scale Beck Anxiety Inventory State Trait-Anxiety Inventory strukturiertes Interview Nicht-strukturiertes Interview Profile of Mood Scale Sonstige Anzahl der Artikel n=2 n=4 n=4 n=7 n=6 n=4 n=8 Sonstige: Brief Anxiety Scale AMDP-AT-Angst-Skala Brief Psychiatric Rating Scale Well-being-scale Visuelle Analog-Skala für Angst Brief Symptom Inventory Multidimensional Mood Questionnaire IOWA Scales of Personality Change 3.3 in % 8,3 16,7 16,7 29,2 25 16,7 33,3 1 Artikel 1 Artikel 1 Artikel 1 Artikel 1 Artikel 1 Artikel 1 Artikel 1 Artikel Mögliche Ursachen für das Auftreten von Angst und für die Verbesserung von Angstsymptomatik bei Tiefenhirnstimulation Als mögliche Ursachen werden in Bezug auf die Angstsymptomatik ähnliche Überlegungen angeführt wie für Depressionen, Manien etc. 3.3.1 Positive Anamnese für psychiatrische Erkrankungen Nur ein einziger Artikel stellt im Zusammenhang mit dem Auftreten von Angstsymptomatik die Überlegung an, ob die Tatsache, dass die betreffende Patientin eine positive Vorgeschichte für Depressionen aufwies, das Auftreten der Angstsymptomatik begünstigt haben könnte (Okun et al. 2004). 64 34,8 35 30 psychiatrische Erkrankung schwere psychiatrische Erkrankung Major Depression 25 Depression 20 in % 15,4 15,4 unbehandelte Depression Halluzinationen 11,5 15 7,7 10 3,8 5 3,8 3,8 3,8 Psychose Angserkrankung 0 Ausschlusskriterien keine Angaben Abb. 15: Ausschlusskriterien der Artikel, deren Patienten nach der OP eine Verbesserung bzw. keine Änderung von Angstsymptomatik aufweisen. (Bezugsmenge = 22 Artikel) Bei 65,2 % derjenigen Artikel, deren Patienten nach der Operation eine Verbesserung bzw. keine Änderung von Angstsymptomatik aufwiesen, stellte eine psychiatrische Erkrankung ein Ausschlusskriterium für die Operation dar, 34,8 % machen keine Angaben. Von denjenigen 6 Artikeln, deren Patienten nach der Implantation erstmals an Angst litten oder die eine Verschlechterung der Angstsymptomatik aufwiesen, war bei nur 2 Artikeln eine psychiatrische Erkrankung des Patienten als Ausschlusskriterium für die Operation genannt. Leider ist die Anzahl von 6 Artikeln zu klein, als dass eine Aussage über den möglichen Zusammenhang zwischen Ausschlusskriterien für die Operation und postoperativem Auftreten von Angstsymptomatik gemacht werden könnte. Ein Vergleich der Vorgeschichte in Bezug auf psychiatrische Erkrankungen zwischen den Patienten, die postoperativ weniger bzw. genauso viele Angstsymptome wie präoperativ aufwiesen, und den Patienten, die erstmals Angstsymptomatik zeigten oder eine Verschlechterung der Angst aufwiesen, ist leider nicht möglich, da die Autoren der erstgenannten Gruppe zu 76,3 % der Patienten keinerlei Angaben in Bezug auf psychiatrische Anamnese machen, und die Patientenzahl der letztgenannten Gruppe zu klein ist (10 Patienten). 65 3.3.2 Stimulation bestimmter Gehirnareale Okun et al. (2004) stellen fest, dass ihre Patienten während Stimulation bestimmter Kontakte, die sich außerhalb des eigentlichen Zielareals des Ncl. subthalamicus befanden, nämlich des ventralen Kontaktes 0 in der Region der Substantia nigra und des Kontaktes 3 im medialen Anteil des Thalamus, Angstsymptome entwickelten. Dieses Phänomen erklären sich die Autoren durch Diffusion des Stroms in umgebende Strukturen wie z.B. den lateralen Hypothalamus und den Hirnstamm. Sturm et al. (2003) berichten, dass 3 von 4 Patienten eine starke Verbesserung von schwerer Angst- und Zwangsymptomatik nach unilateraler Stimulation des Ncl. accumbens zeigten. Was die Pathophysiologie der Angst- und Zwangserkrankung betrifft, vermuten die Autoren, dass sich von der lateralen Amygdala ein pathologischer Informationsfluss zur basolateralen und zentralen Amygdala ausbreitet und schließlich in dem Shell Nukleus des Ncl. accumbens konvergiert. Der Shell Nukleus könnte einen “Engpass” für die Impulsausbreitung von der Amygdala zu den Basalganglien, den mediodorsalen Thalamus und den präfrontalen Cortex darstellen. Die Autoren nehmen Bezug auf Saxena et al. (2000), die zeigten, dass die genannten Areale in die Pathophysiologie der Zwangserkrankung involviert sind. Sturm et al. (2003) vermuten, dass eine durch Tiefenhirnstimulation des Shell Nukleus des Ncl. accumbens erreichte Blockade des vermuteten pathologischen Impulsflusses zu einer Verbesserung von Angst- und Zwangssymptomatik ihrer Patienten führte. Ein postoperatives MRI des 4.Patienten, dessen Symptome sich nach der Operation nicht besserten, zeigte eine Fehlplazierung der Elektrode nach caudoventral außerhalb des Zielareals, was das therapeutische Versagen erklärt. Die Beobachtung der beiden genannten Autoren wirft die Frage auf, ob eine Fehlplazierung von Elektroden der Entstehung von Angstsymptomatik zugrunde liegen könnte. Leider geben nur wenige Autoren Auskunft, ob sie mittels eines postoperativen MRI die korrekte Elektrodenposition verifiziert haben. So geben nur vier Autoren (Fontaine et al. 2004, Castelli et al. 2004, Sturm et al. 2003, Mallet et al. 2002) von denjenigen Autoren, die von einer Verbesserung oder keiner Veränderung der Angstsymptomatik ihrer Patienten sprechen, an, dass ein postoperatives MRI zur Verifizierung der Elektrodenposition 66 durchgeführt wurde. Von den Autoren, die vom erstmaligen Auftreten bzw. der Verschlechterung der Angstsymptomatik ihrer Patienten berichten, erwähnen nur Houeto et al. (2002), dass ein postoperatives MRI durchgeführt wurde. Tabelle 21: Verteilung der Gehirnareale bei denjenigen Patienten, die nach der OP Angstsymptome entwickelten, und bei dem Gesamtpatientengut aus den Anhang-Tabellen 13-16. Stimuliertes Gehirnareal Capsula interna Ncl. subthalamicus Ncl. accumbens Globus pallidus internus Vim-Ncl. desThalamus Patienten, die nach der OP Angstsymptome entwickelten n=0 n = 8 (2,9 %) (7: bilateral; 1: unilateral) n=0 n = 1 (2,6 %) (unilateral) n = 1 (1,1 %) (unilateral) Gesamte Patientengruppe n = 5 (bilateral) n = 272 (271: bilateral; 1: unilateral) n = 4 (unilateral) n = 38 (9: bilateral; 20: unilateral; 9: keine Angaben, ob uni- oder bilateral) n = 95 (81: unilateral; 1: bilateral) Aus der obigen Tabelle ist abzulesen, dass das Risiko, nach Elektrodenimplantation in den Thalamus, Ncl. subthalamicus und Globus pallidus internus Angstsymptome zu entwickeln, zwischen 1,1 und 2,9 % liegt. Anders als bei den bisher besprochenen psychiatrischen Komplikationen, die mit einer Prävalenz zwischen 5,7 % bis 11,8 % (je nach Art der psychatrischen Symptomatik) nach Stimulation des Ncl. subthalamicus auftraten, beträgt hier die Prävalenz von Angstsymptomatik nach Implantation in den Ncl. subthalamicus nur 2,9 %. 3.3.3 Bedeutung von L-Dopa Martinez-Martin et al. (2002) und Higginson et al. (2001) stellen die Überlegung an, ob die postoperative Reduktion der Levodopa-Äquivalenzdosis Ursache für die Verbesserung der Angstsymptomatik sein könnte. Houeto et al. (2002) dagegen schreiben, dass das postoperative Auftreten von Angstsymptomen bei ihren Patienten mit einer erheblichen Reduktion der L-Dopa-Äquivalenzdosis korrelierte. Nicht alle Autoren machen Angaben zu prä- und postoperativer dopaminergen Medikation ihrer Patienten. Solche, die Angaben machen, sind in Tabelle 22 und Tabelle 23 zusammengestellt. Auch hier ist ein Vergleich wieder nur bedingt aussagekräftig wegen der 67 geringen Patientenzahl der letzteren Gruppe. Bei Patienten “ohne Angst” wurde die dopaminerge Medikation nach der Operation um 64,1 % reduziert, bei den Patienten “mit Angst” betrug die Reduktion 58,5 %. Die Patienten „ohne Angst“ nahmen postoperativ eine niedrigere durchschnittliche L-Dopa-Äquivalenzdosis (416,3 ± 220,7 mg/d) ein als die Patienten “mit Angst” (578,8 ±299,6 mg/d). Houeto et al. (2002) meinen, die Tatsache, dass die Patienten, die nach der Operation an Angstsymptomen leiden, postoperativ höhere L-Dopa-Dosen einnähmen als die Patienten ohne Angst, könnte ein Hinweis dafür sein, dass die reduzierte dopaminerge Neurotransmission der Pathogenese von Angstsymptomen zugrunde liege. Dabei verweisen die Autoren auf Maricle et al. (1995). Tabelle 22: Postoperative L- Dopa- Äquivalent Reduktion in % und postoperative L-Dopa-Äquivalenzdosis von Patienten, die nach der Operation eine Verbesserung bzw. keine Änderung der Angstsymptomatik zeigten Patientenanzahl Artikel Brusa et al. 2001 Castelli et al. 2004 Dujardin et al. 2004 Fontaine et al. 2004 Ford et al. 2004b Lopiano et al. 2001 Martinez-Martin et al.2002 Monaca et al. 2004 Schneider et al. 2003 n=6 n = 31 n = 12 n=1 n=2 n = 16 n = 17 n = 10 n = 12 L-Dopa-Äquivalent Reduktion in % 100 % 68,1 % 47,2 % 100 % 30 % 72,3 % 62 % postoperative L-DopaÄquivalenzdosis 0 mg/d 307,2±216,7 mg/d 777 ± 323 mg/d 0 mg/d 1160 mg/d 321,3 mg/d 509±463 mg/d 50 % 59,6% Durchschnittswert: 64,1 % 562 ± 262 mg/d 330 ±207 Durchschnittswert: 416,3 ±220,7 mg/d Tabelle 23: Postoperative L-Dopa-Äquivalent Reduktion in % und postoperative L-Dopa-Äquivalenzdosis von Patienten, die nach der Operation unter Angst litten Artikel Patientenanzahl Dujardin et al. 2001 Funkiewiez et al.2004 Houeto et al. 2002 Roane et al. 2002 n=1 n=1 n=5 n=1 L-Dopa-Äquivalent Reduktion in % 34,2% 72,8 % 60,5 % Keine Angaben Durchschnittswert: 58,5 % postoperative L-DopaÄquivalenzdosis 100 ± 397 mg/d 1000 mg/d 550 ± 400 mg/d 780 mg/d Durchschnittswert: 578,8 ± 299,6 mg/d 68 3.3.4 Psychosoziale Aspekte Einige Autoren vermuten psychische Faktoren, die der Entstehung von Angst nach der Operation zugrunde liegen könnten. So schreiben Perozzo et al. (2001), dass die Patienten Angst davor bekamen, sie könnten wieder in den präoperativen Zustand zurückfallen. Houeto et al. (2002) beschreiben analog zu dieser Hypothese, dass 15 von 24 Patienten nach der Elektrodenimplantation unter Angst vor dem plötzlichen Versagen des Stimulators litten. Perozzo et al. (2001) weisen außerdem darauf hin, dass die Patienten Schwierigkeiten hatten, den sekundären Krankheitsgewinn wie vermehrte Aufmerksamkeit von Seiten der Verwandten aufzugeben. Wenn sich die Parkinson-Symptome nicht oder nur wenig nach der Elektrodenimplantation verbessern, könnte auch dies einen Auslöser für Angst darstellen; schließlich hofft und erwartet der Patient, der seit Jahrzehnten an einer chronisch progredienten Erkrankung leidet, dass die Tiefenhirnstimulation ihn zumindest teilweise von dieser Erkrankung wieder befreit. So stellen Houeto et al. (2002) fest, dass das postoperative Auftreten von Angst mit dem UPDRS part 4 score, der motorische Komplikationen ermittelt, korreliert. Dieselben Autoren berichten zugleich von vier Patienten, die postoperativ an Agoraphobie erkrankten. Bei zwei von ihnen verschlechterte sich die Symptomatik; diese beiden Patienten litten nach wie vor an Freezing-Zuständen. Alle anderen Parkinson-Symptome hatten sich jedoch nach der Operation zufrieden stellend verbessert. Auch Higginson et al. (2001) stellen die Überlegung an, ob ungenügende Verbesserung der motorischen Symptome nach der Operation im Zusammenhang stehen könnte mit dem Auftreten von Angstsymptomatik. Jedoch können die Autoren keine signifikante Korrelation zwischen prä- und postoperativen UPDRS part 3 score und dem Beck Anxiety Score feststellen. Ein Vergleich der postoperativen Verbesserung von Parkinson- bzw. essentiellen TremorSymptomen zwischen den Patienten “ohne Angst” und den Patienten “mit Angst” ist nicht möglich, da von den 23 Artikeln, die die Patienten der erstgenannten Gruppe beschreiben, nur 7 Artikel und von den 6 Artikeln, die die Patienten der letztgenannten Gruppe beschreiben, nur 2 Artikel genaue Prozentwerte angeben, um die sich der UPDRS motor score bzw. die Fahn-Tolosa-Marin Tremor Rating Scale besserte. Eine mögliche Ursache, warum Patienten nach der Operation eine Verbesserung ihrer 69 Angstsymptomatik angeben, könnte sein, dass sie Angst vor der bevorstehenden Elektrodenimplantation hatten und nun erleichtert sind, den Eingriff gut überstanden zu haben. Higginson et al. (2001) und Fields et al. (2003), deren Patienten nach der Operation eine Verbesserung der Angstsymptomatik aufwiesen, schließen diese Ursache jedoch aus, da genau derselbe Anteil der Patienten sowohl prä- als auch postoperativ Anxiolytika einnahm. 3.4 Therapie und Verlauf der Angstsymptomatik 3.4.1 Änderungen der Stimulationsparameter Nur sehr wenige Autoren äußern sich zur Therapie von Angstsymptomatik bei Tiefenhirnstimulation. Koller et al. (2001) berichten, dass die Angstsymptomatik eines ihrer Patienten mild war und durch Änderungen der Stimulationsparameter in den Griff zu bekommen war. Okun et al. (2004) schildern eine Patientin, bei der Stimulation bestimmter Elektrodenkontakte, und zwar des distalen Kontaktes 0 sowie proximal und dorsal des Ncl. subthalamicus, ein Gefühl von Angst und Panik auslöste. 3.4.2 Medikamentöse Therapie Roane et al. (2002) beschreiben einen Patienten, der nach unilateraler Globus pallidusImplantation ein hypersexuelles Verhalten, Angst, motorische Unruhe, Schlaflosigkeit, Hyperphagie und Verlangen nach L-Dopa entwickelte. Dieser Patient hatte bis vor kurzem Clozapin eingenommen, das 4 Monate nach der Operation abgesetzt worden war. Unter 50mg Clozapin verschwand die Hypersexualität vollständig, und die anderen Symptome einschließlich der Angst besserten sich. Funkiewiez et al. (2004) berichten von einem Patienten, der nach Operation des bilateralen Ncl. subthalamicus über Müdigkeit und eine Verschlechterung seiner Angstsymptomatik klagte; gleichzeitig war er apathisch, wies jedoch nur eine leichte Verschlechterung seiner depressiven Symptomatik auf. Die Autoren erwähnen, dass eine Fluoxetin- und Amitryptilintherapie ohne Erfolg war, nennen jedoch keine weiteren Therapieversuche. Zum Verlauf der Symptomatik berichten sie nur, dass 70 sich die Apathie besserte, über die anderen Symptome machen sie keine Angaben. Zwei Artikel von denen, die eine Verbesserung der Angstsymptomatik ihrer Patienten schildern, berichten, dass ein Teil ihrer Patienten Anxiolytika bzw. Antidepressiva gegen Angstsymptomatik erhielt. So schreiben Higginson et al. (2001), dass 9 Patienten sowohl prä- als auch postoperativ Anxiolytika erhielten, 2 Patienten, die vor der Operation Anxiolytika einnahmen, setzten diese nach der Elektrodenimplantation ab und 2 weitere Patienten begannen nach der Operation erstmals mit der Einnahme von Anxiolytika. Leider ist aus diesem Artikel nicht ersichtlich, ob die ebengenannten Patienten einer unilateralen Globus pallidus internus- Implantation, einer unilateralen Thalamus- Implantation oder einer Pallidotomie/Thalamotomie unterzogen wurden. Fields et al. (2003) berichten, dass sowohl in der Eingangs-Untersuchung als auch 12 Monate nach der Operation jeweils 8 Patienten Anxiolytika einnahmen und jeweils 2 Patienten mit SSRI behandelt wurden (s. AnhangTabelle 13), wobei die Autoren zu diesen beiden Patienten nicht präzisieren, ob die SSRIMedikation zur Therapie von Angstsymptomen oder aber zur Therapie von Depressionen eingesetzt wurde. 4. Psychotische Symptome bei Tiefenhirnstimulation 4.1 Studienergebnisse Rodriguez-Oroz et al. (2004), Varma et al. (2003), Ostergaard et al. (2002), Diederich et al. (2000) und Limousin et al. (1998) berichten, dass ein Teil ihrer Patienten nach bilateraler Ncl. subthalamicus- Operation Halluzinationen entwickelte. Ostergaard et al. (2002) und Limousin et al. (1998) schreiben, dass die Symptomatik 2 Tage bzw. bis zu 2 Wochen anhielt und sich dann spontan zurückbildete. Rodriguez-Oroz et al. (2004) erwähnen nur, dass das Ausschalten der Stimulation keinen Einfluss auf die Halluzinationen gehabt habe, machen aber ansonsten keine weiteren Angaben zu Therapie und Verlauf. Varma et al. (2003), die bei ihren Patienten präzisieren, dass es sich um optische Halluzinationen gehandelt habe, die sich mehrere Wochen nach der Operation entwickelte hatten, beschreiben, dass eine Reduktion der Antiparkinson-Medikamente keine Änderung der Symptomatik bewirkt habe, jedoch sei eine Therapie mit dem atypischen Neuroleptikum 71 Quetiapin (Seroquel) erfolgreich gewesen. Diederich et al. (2000) beschreiben einen Patienten, dem jeweils eine Elektrode in 2 Operationen, die 3 Jahre auseinander lagen, implantiert wurde. Nach beiden Operationen entwickelte er optische Halluzinationen, die nach der 1.Operation nach Absetzen von LDopa verschwanden, nach der 2.Operation unabhängig vom Einfluss dopaminerger Medikamente waren, jedoch nach Ausschalten der Stimulation verschwanden. Der Patient zog es vor, die Stimulation wieder anzuschalten, um dadurch seine schwere Tremorsymptomatik in den Griff zu bekommen, aber die visuellen Halluzinationen traten unter angeschalteter Stimulation wieder auf. 25 mg Clozapin/Tag ermöglichten es, die Stimulation angeschaltet zu belassen, ohne dass klinisch beeinträchtigende optische Halluzinationen auftraten. Roane et al. (2002) und Loher et al. (2002) beschreiben jeweils einen Patienten, der nach unilateraler Elektrodenimplantation in den Globus pallidus internus optische Halluzinationen entwickelte. Während Loher et al. (2002) keine Angaben zur Therapie der Symptomatik machen, berichten Roane et al. (2002), dass sich die Halluzinationen ihres Patienten nach Absetzen des Medikamentes Amantadin zurückbildete. Bei Houeto et al. (2002) und Funkiewiez et al. (2004, 2003) erkrankte ein Teil der Patienten nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus an einer Psychose. Houeto et al. (2002) beschreiben, dass die psychotischen Symptome ihres Patienten wenige Wochen nach der Operation auftraten; die Autoren erwähnen nicht, wie lange die Symptomatik dauerte und ob sie einer Therapie bedurfte. Funkiewiez et al. (2004), die von 4 postoperativ psychotischen Patienten berichten, machen in Bezug auf den Verlauf der Psychose nur zu 2 Patienten Angaben. Über einen Patienten schreiben sie, dass die psychotische Symptomatik chronisch sei, ohne genauer auf den Verlauf und die Therapie der Psychose einzugehen. Ein weiterer Patient entwickelte 6 Wochen nach der Operation psychotische Symptome und musste deswegen stationär aufgenommen werden. Die Symptomatik war jedoch “vorübergehend”; leider schreiben die Autoren nicht, welcher Therapie der Patient unterzogen wurde. Auch Funkiewiez et al. (2003) beschreiben die Psychose ihres Patienten als “vorübergehend”, ohne den zeitlichen Verlauf der psychiatrischen Erkrankung zu präzisieren und eventuelle therapeutische Maßnahmen 72 anzugeben. Im Gegensatz dazu gehen Merello et al. (1999) auf die Therapie der Psychose eines ihrer Patienten ein: Die Autoren berichten, dass einer von 6 Patienten nach unilateraler Operation des Globus pallidus internus eine Psychose entwickelte und eine Therapie mit Clozapin benötigte. 4.2 Mögliche Ursachen für psychotische Symptome bei Tiefenhirnstimulation 4.2.1 Positive Anamnese Houeto et al. (2002) stellten fest, dass derjenige ihrer Patienten, der nach der Operation an einer Psychose erkrankte, bereits vor der Operation schon einmal eine psychotische Episode durchlebt hatte. Die Autoren vermuten deshalb, dass eine positive Anamnese für Psychosen und ähnliche Symptomatik einen Risikofaktor dafür darstellt, dass solche Symptome auch nach der Operation auftreten können. Tabelle 24: Ausschlusskriterien von den 11 Artikeln, bei denen ein Teil der Patienten nach der Operation psychotische Symptome entwickelte Psychose, Halluzinationen als Ausschlusskriterium Psychose, Halluzinationen nicht als Ausschlusskriterium Keine Angaben 3 Artikel 2 Artikel 6 Artikel Von 11 Artikeln machen 6 Artikel keinerlei Angaben, ob psychotische Symptomatik ein Ausschlusskriterium für die Operation darstellte oder nicht. 2 Artikel erwähnen, dass auch Patienten mit psychotischen Symptomen zur Operation zugelassen wurden, während bei 3 Artikeln eine Psychose ein Ausschlusskriterium für die OP darstellte. 4.2.2 Stimulation des Ncl. subthalamicus Diederich et al. (2000) stellen die Überlegung an, dass die Stimulation des Ncl. subthalamicus eine Aktivierung der extrastriatalen Sehrinde oder des lateralen temporalen Cortex induzieren könnte und somit optische Halluzinationen hervorrufen könnte. Auch hier wird - wie bei den bisher besprochenen psychiatrischen Komplikationen nach Tiefenhirnstimulation - die Ver-mutung geäußert, dass die Stimulation des Ncl. Subthalamicus 73 limbische Areale beeinflussen könnte. Tabelle 25: Verteilung der Gehirnareale bei denjenigen Patienten, die nach der OP eine psychotische Symptomatik entwickelten, und bei dem gesamten Patientengut aus der Anhang –Tabelle 17 Stimuliertes Gehirnareal Patienten, die an einer Psychose erkrankten n = 11 ( 5 %) (bilateral) n = 3 (unilateral) Ncl. subthalamicus Globus pallidus internus Gesamte Patientengruppe n = 219 (bilateral) n = 8 (unilateral) 5 % derjenigen Patienten, die sich einer Elektrodenimplantation in den Ncl. subthalamicus unterzogen hatten, entwickelten im postoperativen Verlauf eine psychotische Symptomatik. 4.2.3 Bedeutung von L-Dopa Houeto et al. (2002) stellen fest, dass die Psychose eines ihrer Patienten gleichzeitig mit dem Absetzen des D1-und D2-Agonisten Apomorphin auftrat und vermuten einen Zusammenhang. Diederich et al. (2000) dagegen berichten genau das Gegenteil: Die optischen Halluzina-tionen, die ihr Patient nach der 1.Elektrodenimplantation entwickelte, verschwanden nach Absetzen von Levodopa. Loher et al. (2002) wiederum konstatieren, dass die optischen Halluzinationen ihres Patienten unabhängig von dopaminerger Medikation auftraten, da die L-Dopa-Dosis des Patienten nach der Operation nicht geändert wurde. Tabelle 26: Reduktion von prä- zu postoperativer L-Dopa-Äquivalenzdosis in % bei denjenigen Artikeln, die bei einem Teil der Patienten psychotische Symptome feststellten Patientenzahl der gesamten Patientengruppe Rodriguez-Oroz et al. 2004 n = 10 Funkiewiez et al.2004 n = 77 Funkiewiez et al.2003 n = 50 Reduktion von prä- zu postoperativer L-DopaÄquivalenzdosis in % 50 % 67% 67,8 % Ostergaard et al. 2002 Varma et al. 2003 Houeto et al. 2002 Loher et al.2002 Diederich et al. 2000 22 % 37,1 % 60,5 % 0% 0% Artikel n = 26 n=7 n = 28 n=1 n = 1* Zeitpunkt, an dem die Reduktion evaluiert wurde 4 Jahre nach der OP nach entweder 1 oder 3 Jahren durchschnittlich 12 Monate nach der OP 12 Monate nach der OP Unmittelbar postoperativ unmittelbar postoperativ unmittelbar postoperativ unmittelbar postoperativ *bei diesem Patienten wurde etwas später L-Dopa abgesetzt, woraufhin die Halluzinationen verschwanden Die durchschnittliche Reduktion dopaminerger Medikation bei denjenigen Patientengruppen aus Tabelle 26, bei denen ein Teil der Patienten psychotische Symptome im postoperativen 74 Verlauf entwickelte, beträgt 57,5 %. Der Zeitpunkt, an dem die Reduktion ermittelt wurde, variiert allerdings erheblich zwischen den einzelnen Studien. 4.2.4 Koexistenz von Lewy-Körperkrankheit bzw. Übergang der ParkinsonErkrankung in Lewy-Körperkrankheit Der Patient bei Loher et al. (2002) wies schon vor der Operation einen MMSE- Wert von 22 (von maximal 30 Punkten) auf und das präoperative MRI des Patienten zeigte eine moderate kortikale Atrophie und erweiterte Ventrikel. Nach der Operation trat bei ihm neben optischen Halluzinationen eine weitere kognitive Verschlechterung bis hin zur Demenz auf. Die Autoren vermuten bei diesem Patienten eine Koexistenz oder einen Übergang der Parkinson-Erkrankung in eine Lewy-Körperkrankheit. Charakteristisch für die LewyKörperkrankheit sind u.a. Parkinson-Symptome, Demenz und optische Halluzinationen. Die Verdachtsdiagnose der Autoren wurde zusätzlich durch eine SPECT-Untersuchung dieses Patienten untermauert, die eine für die Lewy-Körperkrankheit typische parieto-temporooccipitale Hypoperfusion sowohl während angeschalteter als auch während ausgeschalteter Stimulation zeigte. Aufgrund der Beobachtung von Loher et al. (2002) stellt sich die Frage, ob auch bei den anderen Patienten, die nach der Operation optische Halluzinationen hatten, eine Koexistenz oder ein Übergang der Parkinson-Erkrankung in eine Lewy-Körperkrankheit vorlag. Neben dem Patienten, der von Loher et al. (2002) beschrieben wird, zeigten sich noch bei einem weiteren Patienten, der von Rodriguez-Oroz et al. (2004) beschrieben wird, Halluzinationen, und ebenderselbe Patient entwickelte auch eine Demenz. Bei diesem Patienten kann somit ebenfalls die Verdachtsdiagnose der Lewy-Körperkrankheit gestellt werden. Ostergaard et al. (2002) berichten von einem Patienten mit Halluzinationen und erwähnen, dass zwei ihrer Patienten eine kognitive Verschlechterung aufwiesen ohne jedoch zu präzisieren, ob einer von diesen beiden derjenige Patient mit den Halluzinationen war. Keine Änderung der Kognition wurde bei 3 weiteren Patienten mit visuellen Halluzinationen festgestellt. Zu den verbleibenden 2 Patienten werden keine Angaben bezüglich der Kognition gemacht. 75 4.3. Therapie und Verlauf der psychotischen Symptome Tabelle 27: Therapiemaßnahmen und Ansprechraten derjenigen 14 Patienten, die nach der OP psychotische Symptome entwickelten Therapiemaßnahmen Ausschalten der Stimulation Spontane Rückbildung Absetzen/Reduktion der Anti-Parkinson-Medikation bzw. von L-Dopa Pharmakologische Therapie Stationäre Aufnahme Keine Angaben Anteil der Patienten n=2 n = 1 + x* n=5 n=4 n=1 n=5 Ansprechrate n=1 n=2 n=4 *Limounsin et al. (1998) nennen keine Patientenzahl Zu einem Patienten, der nach der Operation Halluzinationen entwickelte und zu 4 Patienten, die nach der Elektrodenimplantation an einer Psychose erkrankten, werden im Hinblick auf die therapeutische Maßnahmen keine Angaben gemacht. Während bei einem Patienten, der Halluzinationen entwickelte, das Ausschalten der Stimulation keinen Einfluss auf die Symptomatik hatte, bewirkte eben diese Maßnahme bei einem anderen Patienten, dass die Halluzinationen verschwanden. Bei einem weiteren Patienten mit Halluzinationen fand eine spontane Rückbildung statt. 2 von 5 Patienten sprachen auf eine Reduktion bzw. das Absetzen von Antiparkinson-Medikation bzw. L-Dopa an: Die Halluzinationen von zwei Patienten besserten sich, nachdem Amantadin bzw. L-Dopa abgesetzt worden war. Der zuletzt genannte Patient entwickelte nach der 2. Elektrodenimplantation, die 3 Jahre nach der 1. Operation erfolgte, abermals Halluzinationen, die diesmal nicht auf Änderungen der dopaminergen Medikation ansprachen. Bei 2 weiteren Patienten mit Halluzinationen zeigte eine Reduktion der Antiparkinson-Medikation keinen Erfolg. Eine erfolgreiche pharmakologische Therapie wurde bei insgesamt 4 Patienten durchgeführt: 2 Patienten mit Halluzinationen erhielten Quetiapin und jeweils ein Patient mit Halluzinationen und ein Patient mit psychotischer Symptomatik erhielten Clozapin. Ein Patient mit Psychose musste stationär aufgenommen werden. Tabelle 28: Verlauf der psychotischen Symptome (Bezugsmenge n = 14) Besserung Keine Besserung Keine Angaben n=8 n=1 n=5 Die psychotischen Symptome eines Patienten besserten sich nicht. Zu 2 Patienten mit 76 Halluzinationen und 3 Patienten mit Psychose werden keine Angaben gemacht, ob eine Besserung eintrat oder nicht. 5. Verwirrtheitszustände und Delir bei Tiefenhirnstimulation 5.1 Studienergebnisse 5.1.1 Verwirrtheitszustände bei Tiefenhirnstimulation Mehrere Autoren berichten, dass ein Teil ihrer Patienten nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus verwirrt war (Ford et al. 2004, Linazasoro 2003, Tamma et al. 2003, Houeto et al. 2002, Ostergaard et al. 2002, Vesper et al. 2002, Lopiano et al. 2001, Hariz et al. 2000, Pillon et al. 2000, Trepanier et al. 2000, Ardouin et al. 1999, Limousin et al.1998, 1995, Kumar et al. 1998, Krack et al. 1998a, b). Bei Krack et al. (1998a) erhält ein Patient eine unilaterale Elektrodenimplantation in den Ncl. subthalamicus. Die meisten Autoren berichten, dass sich die Symptomatik ihrer Patienten spontan zurückbildete. So berichten Houeto et al. (2002) und Krack et al. (1998a), dass die Verwirrtheit ihrer Patienten “vorübergehend” gewesen sei. Lopiano et al. (2001) berichten, dass sich Verwirrtheitszustände in der unmittelbaren postoperativen Periode entwickelten und ohne therapeutische Maßnahmen wieder verschwanden. Andere Autoren geben genauere Angaben zum zeitlichen Verlauf der Symptome: Ardouin et al. (1999) beschreiben, dass 3 von 23 Patienten unter Verwirrtheit litten und sich diese Symptomatik bei allen 3 Patienten spontan innerhalb eines Tages zurückbildete. Bei Krack et al. (1998b) waren 3 Patienten für wenige Tage nach der Operation verwirrt. Pillon et al. (2000), in deren Studie 63 Patienten eine bilaterale Implantation in den Ncl. subthalamicus erhielten und 13 Patienten in den Globus pallidus internus, berichten, dass alle Patienten nach der Operation einen gewissen Grad der Verwirrung aufwiesen und sich diese innerhalb weniger Stunden bis Tage zurückbildete bis auf 2 Patienten, bei denen die Symptomatik 1 Monat anhielt, wobei die Autoren nicht differenzieren, ob diese beiden Patienten am Ncl. subthalamicus oder am Globus pallidus internus operiert worden waren. Bei Tamma et al. (2003), Trepanier et al. (2000), Limousin et al. (1998), Kumar et al. (1998) und Limousin et al. (1995) hält die Verwirrtheit ein bis drei Wochen an, bis sie sich von 77 selber zurückbildete. Ostergaard et al. (2002) und Ford et al. (2004) schreiben, dass der Verwirrtheitszustand von einem bzw. zwei Patienten mehrere Wochen anhielt und sich dann spontan zurückbildete. 2 Artikel berichten, dass die Verwirrtheit ihres Patienten mit einer kognitiven Verschlechterung einherging: Linazasoro (2003) beschreibt einen Patienten mit milder kognitiver Verschlechterung und verwirrten Episoden, die eine Hospitalisierung notwendig machten. Hariz et al. (2000) berichten von einem Patienten, der nach der Operation eine moderate Verschlechterung des Gedächtnisses und der Sprache aufwies. Am ersten postoperativen Tag war der Patient agitiert und 2 Wochen später war er verwirrt. Ein Jahr nach der Operation wies er schließlich eine schwere Demenz auf. Die einzigen Autoren, die erwähnen, dass eine Therapie der Verwirrtheit notwendig gewesen sei, sind Vesper et al. (2002). Leider geben die Autoren jedoch nicht an, um welche Therapie es sich handelte. Sie beschreiben 4 Patienten, die aufgrund von Verwirrtheit therapiert wurden, wobei sich bei 2 von ihnen die Symptomatik nicht zurückbildete. Nur wenige Autoren berichten von Verwirrtheit nach bilateraler Operation des Globus pallidus internus. Pillon et al. (2000), deren Patientengut – wie oben berichtet - aus Patienten besteht, die am Ncl. subthalamicus operiert wurden und solchen, die am Globus pallidus internus operiert wurden, berichten, dass alle Patienten einen gewissen Grad an Verwirrtheit nach der Operation aufwiesen. Ghika et al. (1998) schreiben, dass während der Anpassung der Stimulationsparameter Verwirrtheit auftrat, die durch Reduktion der Stimulationsparameter reversibel war. Jedoch trat auch bei dauerhafter Stimulation Verwirrtheit als Nebenwirkung auf, die größtenteils durch Modifikationen der Stimulationsparameter zu kontrollieren war. Fraglich bleibt nur, was die Autoren unter “größtenteils” verstehen. Trepanier et al. (2000) schreiben, dass Verwirrtheit nach bilateraler Implantation in den Globus pallidus internus sehr “ungewöhnlich” gewesen sei. Auch hier bleibt die Frage offen, was das Wort “ungewöhnlich” in diesem Zusammenhang zu bedeuten hat 78 5.1.2 Delir bei Tiefenhirnstimulation Berney et al. (2002) und Krack et al. (2003) berichten, dass 5 von 24 bzw. 12 von 50 Patienten nach bilateraler Operation des Ncl. subthalamicus ein Delir entwickelten. Berney et al. (2002) machen keine Angaben zu Therapie und Verlauf des Delirs. Krack et al. (2003) schreiben dagegen, dass die Symptomatik während der ersten Tage nach der Operation auftrat und vorübergehend war. Tabelle 29: Inzidenz von Verwirrtheit und Delir bei Tiefenhirnstimulation Artikel Arduoin et al. 1999 Ford et al. 2004 Houeto et al. 2002 Krack et al. 1998a Krack et al. 1998b Kumar et al. 1998 Limousin et al. 1995 Limousin et al. 1998 Linazasoro 2003 Lopiano et al. 2001 Ostergaard et al. 2002 Tamma et al. 2003 Trepanier et al. 2000a Vesper et al. 2002 Berney et al. 2002 Krack et al. 2003 5.2 Inzidenz von Verwirrtheit 13% 6,7% 4,2% 14,8 % 50% 28,6% 33,3% 40% 5,6 % 12,5% 3,8% 30% 44,4% 25% - Inzidenz von Delir 20,8% 24% Mögliche Ursachen für Verwirrtheit und Delir bei Tiefenhirnstimulation 5.2.1 Stimulation als Ursache Ghika et al. (1998) stellten fest, dass Verwirrtheitszustände während der Anpassung der Stimulationsparameter auftraten und sich durch Reduktion derselben wieder zurückbildeten. Auch Verwirrtheit als Nebenwirkung der Stimulation war größtenteils durch Modifikationen der Stimulationsparameter kontrollierbar. Die Autoren sehen somit als Ursache für das postoperative Auftreten von Verwirrtheit einen zu hohen Grad der Stimulation an. Keiner der Autoren geht auf die Bedeutung des stimulierten Gehirnareals als Ursache für Verwirrtheitssymptome ein. Tabelle 30 gibt einen Überblick über die Verteilung der stimulierten Gehirnareale von denjenigen 152 Patienten, die nach der Operation verwirrt waren. 86,8 % der Erkrankten hatten sich einer bilateralen Elektrodenimplantation in den 79 Ncl. subthalamicus unterzogen. Wie schon bei den bisher besprochenen psychiatrischen Erkrankungen nach Tiefenhirnstimulation scheint auch hier vor allem die bilaterale Operation des Ncl. subthalamicus mit dem Risiko, nach der Operation Verwirrtheitszustände zu entwickeln, behaftet zu sein. Tabelle 30: Verteilung der stimulierten Gehirnareale bei denjenigen Patienten, die nach der Operation Verwirrtheitssymptome oder delirante Symptome aufwiesen, und bei dem gesamten Patientengut aus den Anhang-Tabellen 18-19 Stimuliertes Gehirnareal Ncl. subthalamicus Globus pallidus internus VIM Ncl. des Thalamus Patienten, die verwirrte oder delirante Symptomatik entwickelten n = 132* (33 %) (130: bilateral; 1: unilateral) n = 19 (bilateral) n=1 Gesamte Patientengruppe n = 400* (399: bilateral; 1: unilateral) n = 19 (bilateral) n=1 *Linazasoro gibt für seine 18 Patienten kein Gehirnareal an, so dass diese nicht mitgezählt werden 33 % derjenigen Patienten, die sich einer Elektrodenimplantation des Ncl. subthalamicus unterzogen hatten, entwickelten ein verwirrtes oder delirantes Verhalten. Alle 19 Patienten, zu denen in den Artikeln aus den Anhang –Tabellen 18-19 angegeben wird, dass sie eine Stimulation des Globus pallidus internus erhielten, zeigten im postoperativen Verlauf Symptome von Delir oder Verwirrheit. 5.2.2 Hirnschädigung Ardouin et al. (1999) stellen bei den drei Patienten, die postoperativ Verwirrtheitssymptome entwickelten, ein subdurales Hämatom fest und vermuten, dass dieses zur Entstehung der Verwirrtheit beigetragen haben könnte. Ebenso wiesen bei Tamma et al. (2003) 3 von 9 verwirrten Patienten im Computertomogramm ein hypodenses Areal um die implantierten Elektroden auf, bei dem es sich um eine Kontusion handeln könnte. Bei dem Patienten mit Verwirrtheitssymptomatik von Krack et al. (1998b) waren im MRI Hyperintensitäten zu sehen, die wahrscheinlich einen Infarkt darstellten und der Entstehung von Verwirrtheit zugrunde lagen. Ein Patient bei Kumar et al. (1998) erlitt ebenfalls einen cortikalen Infarkt an der Stelle, an der die Elektrode eingebracht worden war, und wies neben vorübergehender Dysarthrie und Hypophonie Verwirrtheitssymptome auf, die sich spontan zurückbildeten. Ein anderer Patient von Kumar et al. (1998) entwickelte eine kleine thalamische Läsion entlang des Kanals, durch den die Elektrode eingebracht worden war. Er zeigte neben einer milden Verschlechterung des verbalen Gedächtnisses ebenfalls eine 80 vorübergehende Verwirrt-heitssymptomatik, die einen Monat anhielt. Nur zu 12 von 152 Patienten, die nach der Operation unter Verwirrtheit oder deliranter Symptomatik litten, wird angegeben, dass ein postoperatives MRI oder CT angefertigt wurde. 6 Patienten zeigten Auffälligkeiten in der Bildgebung (s. o.), während bei den übrigen 6 Patienten das MRI bzw. CT unauffällig war. 5.2.3 Alter Kumar et al. (1998) meinen, dass das Alter bei der postoperativen Entwicklung von Verwirrtheit eine Rolle spiele. Patienten, die jünger als 60 seien, würden die Operation besser tolerieren und neigten weniger dazu, postoperativ Verwirrtheitszustände zu entwickeln. Tabelle 31: Individuelle Altersangaben von Patienten, die nach der OP Verwirrtheitssymptome entwickelten Artikel Lucas et al. 2000 Hariz et al. 2000 Tamma et al. 2003 Pillon et al. 2000 Patienten mit Verwirrtheitssymptomatik n=1 n=1 n=4 n = 48 n=8 n = 15 n=5 Alter in Jahren 80 53 >69 55,7 (7,5) 52,5 (6,5) 53,5 (9,7) 55,2 (10,2) Individuelle Altersangaben findet man nur in 3 Artikeln (Tamma et al. 2003, Lucas et al. 2000, Hariz et al. 2000). Durchschnittliche Altersangaben der gesamten Gruppe, die aber deshalb repräsentativ sind, weil die ganze Gruppe auch Verwirrtheitssymptome entwickelte, findet man bei Pillon et al. (2000). Wenn man nur das Alter dieser 82 Patienten betrachtet, ergibt sich ein Durchschnittsalter von 55,9 ± 8,7 Jahren. Berney et al. (2002) machen keine Angaben zum Alter ihrer Patienten. Die übrigen 7 Artikel, die ebenfalls Altersangaben machen, nennen nur das durchschnittliche Alter der gesamten Patientengruppe, von der jedoch nur ein Teil Verwirrtheits- oder delirante Symptome aufwiesen, so dass die durchschnittliche Altersangabe für diese Patienten nicht repräsentativ ist. 81 5.2.4 Bedeutung der Antiparkinson-Medikation Ardouin et al. (1999) vermuten, dass ein verlängerter Entzug der Antiparkinson-Medikation, der aufgrund der Operation unabdingbar war, zu einer Erschöpfung führte, die wiederum zum postoperativen Auftreten der Verwirrtheit beigetragen haben könnte. 5.3 Therapie und Verlauf von Verwirrtheitszuständen Die einzigen Autoren, die erwähnen, dass eine Therapie der Verwirrtheit notwendig gewesen sei, sind Vesper et al. (2002). Leider geben die Autoren jedoch nicht an, um welche Therapie es sich handelte. Tabelle 32: Dauer von Verwirrtheit und Delir (Bezugsmenge n = 152) Dauer Vorübergehend Stunden bis wenige Tage 1 bis 3 Wochen Mehrere Wochen 1 Monat Mindestens 3 Monate Chronisch oder Übergang in Demenz Keine Angaben Anzahl n = 19 n = 80 n = 22 n=3 n=3 n=2 n=3 n= 20 Anzahl in Prozent 12,5 % 52,6 % 14,5% 2% 2% 1,3 % 2% 13,6 % Ein Vergleich der Dauer der Verwirrtheit zeigt, dass sich bei 84.9 % der Patienten die Symptomatik zurückbildete und nur 2 % der Patienten einen chronischen Verlauf aufwiesen. Bei 52,6 % bildete sich die Verwirrtheit innerhalb von Stunden bis wenigen Tagen zurück. 6. Kognitive Störungen und Demenz bei Tiefenhirnstimulation 6.1 Studienergebnisse Die in diesem Kapitel beschriebenen Patienten wurden in Hinblick auf gestörte allgemeine kognitive Leistungen herausgesucht, auf Teilbereiche der Kognition soll hier nicht eingegangen werden. 82 6.1.1 Demenz bei Tiefenhirnstimulation Vesper et al. (2002), Rodriguez-Oroz et al. (2004), Funkiewiez et al. (2004, 2003), Krack et al. (2003,1998a) Morrison et al. (2004) und Hariz et al. (2000) berichten, dass ein Teil ihrer Patienten nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus ein dementielles Syndrom entwickelte. Bei Vesper et al. (2002) entwickelten 2 von 40 Patienten eine progrediente Demenz. Das postoperative Follow-up betrug in dieser Studie 12 Monate, Ausschlusskriterium für die Operation war unter anderem eine erhebliche Demenz gewesen. Rodriguez-Oroz et al. (2004) beschreiben einen Patienten, der im postoperativen Verlauf (Follow-up bis 4 Jahre nach der Operation) dement wurde. Die Symptomatik änderte sich auch nicht nach Ausschalten der Stimulation. Funkiewiez et al. (2004), die ihre Patienten bis 3 Jahre nach der Operation nachuntersuchten, stellten bei 3 Patienten eine Demenz fest, Hariz et al. (2000) berichten von einem Patienten, der 1 Jahr nach der Operation schwer dement wurde. Krack et al. (1998a) beschreiben einen Patienten, der nach der Operation ein subdurales Hämatom aufwies, das nach einem Sturz ausgeräumt werden musste. Diese Komplikation war wohl die Ursache dafür, dass der Patient eine permanente Dekompensation seiner kognitiven Fähigkeiten erlitt; zur Dauer des Follow-up findet man in den beiden letztgenannten Artikeln keine Angaben. Funkiewiez et al. (2003) dagegen, die bei einem von insgesamt 50 Patienten eine Demenz diagnostizieren, machen detaillierte Angaben über das Follow-up ihrer Patienten: 12 Patienten hatten ein Follow-up von 3 Monaten, 14 Patienten von 12 Monaten, 13 Patienten von 24 Monaten, 10 Patienten von 36 Monaten und 1 Patient wurde 48 Monate nach der OP zum letzten Mal evaluiert. Das durchschnittliche Follow-up betrug 12 Monate. Die vier zuletzt genannten Autoren - Rodriguez-Oroz et al. (2004), Hariz et al. (2000), Krack et al. (1998a) und Funkiewiez et al. (2003) - machen zu Ausschlusskriterien für die Operation oder Vorgeschichte der Patienten keine Angaben. Krack et al. (2003) beschreiben ebenfalls drei Patienten, die zwischen dem 3. und 5. postoperativem Jahr ein dementielles Syndrom entwickelten. Die Autoren untersuchten ihre Patienten bis 5 Jahre nach der Operation nach; Ausschlusskriterium für die Operation war 83 unter anderem eine Demenz. Loher et al. (2002) berichten von einem Patienten, bei dem sie über 1 Jahr nach unilateraler Elektrodenimplantation in den Globus pallidus internus ein dementielles Syndrom diagnostizieren. Dieses bestand sowohl während angeschalteter als auch während abgeschalteter Stimulation. Der Patient hatte schon vor der Operation einen MMSE - Wert von 22 gehabt und eine Verschlechterung des Kurzzeitgedächtnisses aufgewiesen. Analog dazu zeigte das präoperative MRI bereits eine moderate cortikale Atrophie und eine Erweiterung der Ventrikel. Auch bei Hariz et al. (2003) wiesen ein weiblicher und zwei männliche Patienten bereits präoperativ einen schlechten MMSE-Wert auf und entwickelten nach der Operation eine Demenz. Die Elektrodenimplantation erfolgte in den linken Globus pallidus internus, in den rechten Thalamus bzw. bilateral in den Ncl subthalamicus. Das Follow-up der Patientin betrug ca. 11,6 Monate, während die beiden letztgenannten Patienten durchschnittlich 10,3 Monate nach der Operation nachuntersucht wurden. 6.1.2 Dramatische Verschlechterung der Kognition Morrison et al. (2004), Morrison et al. (1998) und Kumar et al. (1998) berichten bei einem Teil ihrer Patienten von einer dramatischen Verschlechterung der Kognition nach bilateraler Operation des Ncl. subthalamicus, die deshalb nicht in das Unterkapitel “Demenz nach Tiefenhirnstimulation” eingeordnet werden kann, weil alle drei Autorengruppen die Symptomatik in ihrem Artikel selber nicht als Demenz bezeichnen und Kumar et al. (1998) keine Angaben zum postoperativen Follow-up machen, Morrison et al. (1998) ein postoperatives Follow-up von 1 Monat angeben und bei Morrison et al. (2004) die Patienten im Durchschnitt nach 13,3 Wochen nachuntersucht wurden. Wichtiges Diagnosekriterium des dementiellen Syndroms nach der ICD-10 ist jedoch, dass die Symptomatik mindestens 6 Monate besteht, was bei den betreffenden Patienten aus den drei genannten Artikeln nicht ersichtlich ist. Kumar et al. (1998) beschreiben einen von insgesamt 7 Patienten, der bereits präoperativ eine Verschlechterung der Kognition aufwies und nach der Operation einen abrupten Abfall in den meisten kognitiven Bereichen zeigte. Bei Morrison et al. (1998) verschlechterten sich 84 bei einem von 3 Patienten nach der Operation 7 von 8 Testvariablen, die verschiedene kognitive Bereiche evaluierten. Die Autoren machen weder zur eventuellen Vorgeschichte von kognitiven Störungen dieses Patienten noch zu Ausschlusskriterien für die Operation Angaben. Morrison et al. (2004), die Patienten mit einer Demenz von der Operation ausschlossen, beschreiben einen Patienten, der 16 Wochen nach der Operation während angeschalteter Stimulation nur 5 von 16 kognitiven Tests bearbeiten konnte. Aufgrund seiner kognitiven Verschlechterung war es ihm unmöglich, den Anforderungen der übrigen Tests nachzukommen. Während angeschalteter Stimulation zeigte der Patient eine Verbesserung der Kognition gegenüber ausgeschalteter Stimulation. Dennoch wies er sowohl während Aktivierung als auch während Deaktivierung der Stimulation im Vergleich zu seinen präoperativen kognitiven Fähigkeiten eine so gravierende Verschlechterung auf, dass der Patient, der vor der Operation alleine gewohnt und sich selbständig versorgt hatte, nach der Operation auf ein betreutes Wohnen angewiesen war, da er nicht mehr fähig war, alleine das Alltagsleben zu bewältigen. 6.1.3 Verschlechterung der Kognition Rodriguez-Oroz et al. (2004), Funkiewiez et al. (2004), Linazasoro (2003), Ostergaard et al. (2002), Krack et al. 2003 und Dujardin et al. (2001) berichten, dass ein Teil ihrer Patienten nach bilateraler Operation des Ncl. subthalamicus eine Verschlechterung der Kognition aufwies. Bei Rodriguez-Oroz et al. (2004) reduzierte sich bei 2 Patienten der MMSE-Wert im postoperativen Verlauf auf 24 bzw. 28. Leider nennen die Autoren nicht den präoperativen MMSE-Wert dieser Patienten. Die kognitiven Fähigkeiten der beiden Patienten besserten sich nicht durch Modifikationen der Stimulation. Obwohl das postoperative Follow-up der Patienten 4 Jahre betrug, machen die Autoren keine Angaben zum Verlauf der Symptomatik und äußern sich auch nicht zu Vorgeschichte bzw. Ausschlusskriterien für die Operation. Linazasoro (2003) beschreibt 3 Patienten mit kognitiver Verschlechterung, die bei einem 85 Patienten von klinischer Relevanz war. Die Patienten wurden bis 6 Monate nach der Operation nachuntersucht, trotzdem findet man auch hier keine Angaben zum Verlauf der Symptomatik. Anders Funkiewiez et al. (2004), bei denen 7 von 77 Patienten kognitive Verschlechterung nach der Operation aufwiesen. Die Autoren bescheiben die Symptomatik von zwei Patienten als “vorübergehend” und von drei Patienten als “dauerhaft”. Es bleibt jedoch offen, was sie unter “vorübergehend” und “dauerhaft” verstehen, da zwei der drei Patienten mit “dauerhafter” kognitiver Verschlechterung nicht zur Nachuntersuchung, die einmalig 3 Jahre nach der Operation stattfand, kommen konnten. Während die beiden zuletzt genannten Autoren keine Angaben zur Vorgeschichte ihrer Patienten oder zu Ausschlusskriterien für die Operation machen, gehen Ostergaard et al. (2002) auf diesen Punkt ein: Sie nennen als Ausschlusskriterium für die Operation unter anderem ein auffälliges präoperatives MRI und ein dementielles Syndrom. In ihrem Artikel schreiben Ostergaard et al. (2002), dass 2 von 26 Patienten nach der Operation über eine Verschlechterung des Gedächtnisses klagten, die mittels UPDRS Teil 1 Item 1 zumindest bei einem von diesen beiden Patienten bestätigt werden konnte. Zum Verlauf werden keine Angaben gemacht; Nachuntersuchungen fanden bis zu 12 Monate nach der Operation statt und danach ein- oder zweimal pro Jahr. Krack et al. (2003) berichten, dass 5 von insgesamt 49 Patienten unmittelbar nach der Operation eine Verschlechterung der Kognition aufwiesen. Leider erwähnen die Autoren nicht - obwohl das Follow-up der Patienten 5 Jahre betrug – wie lange die Symptomatik anhielt. Ausschlusskriterium für die Elektrodenimplantation war hier ein Alter über 70 Jahre und eine Demenz. Fields and Troster (2000) sind die einzigen Autoren, die explizit davon berichten, dass sich die kognitive Verschlechterung einer Patientin, die 3 Monate nach der Operation manifest wurde, vollständig zurückbildete und die kognitiven Fähigkeiten der Patientin 1 Jahr nach der Operation vergleichbar mit ihrer präoperativen Kognition waren. Zu Vorgeschichte und Ausschlusskriterien äußern sich die Autoren nicht. Vingerhoets et al. (1999b) berichten, dass bei 6 von 20 Patienten nach unilateraler Elektrodenimplantation in den Globus pallidus internus ein Abfall der kognitiven Leistungen 86 zu beobachten war. Die Patienten wurden bis 3 Monate nach der Operation nachuntersucht, zum Verlauf findet man keine Angaben. Ausschlusskriterien in dieser Studie waren u. a. ein präoperativer MMSE-Wert < 24, fokale Auffälligkeiten im präoperativen zerebralen MRI sowie ein dementielles Syndrom. Koller et al. (2001) berichten von einem von 49 Patienten, der nach unilateraler Operation des VIM- Ncl. des Thalamus ein mildes kognitives Defizit aufwies, das aber durch Adaptationen der Stimulationsparameter leicht in den Griff zu bekommen war. Das Followup in dieser Studie lag zwischen 11 und 68,8 Monaten. Die Autoren erwähnen Vorgeschichte des Patienten und Ausschlusskriterien für die Operation nicht. 6.1.4 Störung der Exekutivfunktion bei Tiefenhirnstimulation Dujardin et al. (2000) beschreiben in ihrem Artikel eine Patientin, die nach bilateraler Elektrodenimplantation in den Globus pallidus internus eine Störung der Exekutivfunktion entwickelte, die sie 6, 12 und 15 Monate nach der Operation aufwies. Auffällig war zuerst die Abnahme des Mattis Dementia Rating Scale - Wertes, wobei sich nach genauerer Testung zeigte, dass sich vor allem die exekutiven Funktionen der Patienten nach der Operation signifikant verschlechtert hatten. Bei der letzten Untersuchung 15 Monate postoperativ wurde getestet, inwiefern Beeinträchtigungen der Exekutivfunktion stimulationsabhängig waren. Die Patientin wurde deshalb während angeschalteter Stimulation, danach während ausgeschalteter Stimulation und abschließend nochmals während angeschalteter Stimulation getestet (s. Anhang-Tab. 20). Diese Evaluation ergab, dass sich 11 von 15 Parametern signifikant verbesserten, sobald die Stimulation ausgeschaltet wurde. Während bei der ersten und dritten Testung (während angeschalteter Stimulation) die Patientin 100 und 60 Minuten benötigte, um alle Aufgaben zu bearbeiten, benötigte sie bei der zweiten Testung (während ausgeschalteter Stimulation) nur 40 Minuten. Bei der präoperativen Untersuchung wies die Patientin keine Verschlechterung der Kognition auf. Tabelle 33: Inzidenz von kognitiver Verschlechterung und Demenz bei Tiefenhirnstimulation Artikel Inzidenz von Demenz Dujardin et al. 2001 Funkiewiez et al. 2003 2% Inzidenz von Verschlechterung der Kognition 11,1 % - 87 Funkiewiez et al. 2004 Hariz et al. 2003 Koller et al. 2001 Krack et al. 1998a Krack et al. 2003 Kumar et al. 1998 Morrison et al. 1998 Morrison et al. 2004 Ostergaard et al. 2002 Rodriguez-Oroz et al. 2004 Vesper et al. 2002 Vingerhoets et al. 1999b 6.2 2,6 % 13% 3,7% 6,1 % - 6,5 % 2% 10,2 % 14,3 % 33,3 % 5,9 % 3,8 % 20 % 30 % 10 % 5% - Mögliche Ursachen für das Auftreten von Störungen der Kognition und der Exekutivfunktion sowie von Demenz bei Tiefenhirnstimulation 6.2.1 Kognitive Defizite vor der Operation Rodriguez-Oroz et al. (2004) weisen darauf hin, dass eine bereits präoperativ bestehende leichte kognitive Verschlechterung ein Risikofaktor für die postoperative Verschlechterung der Kognition oder für das Auftreten eines dementiellen Syndroms darstellen könnte. Nur wenige Autoren machen Angaben über den kognitiven Zustand ihrer Patienten vor der Operation: Zu 2 Patienten, die postoperativ eine kognitive Verschlechterung bzw. ein dysexekutives Syndrom entwickelten, wird von Dujardin et al. (2002, 2001) erwähnt, dass präoperativ keine kognitiven Defizite vorlagen. Bei 5 Patienten, die nach der Operation ihre Kognition verschlechterten bzw. dement waren, wird beschrieben, dass sie schon vor der Operation kognitive Defizite aufwiesen: Dies erwähnen Kumar et al. (1998). Loher et al. (2002) präzisieren, dass der MMSE-Wert des Patienten, der postoperativ dement wurde, präoperativ bei 22 (von 30) lag und der Patient eine Verschlechterung des Kurzzeit- gedächtnisses aufwies. Ebenso erwähnen Hariz et al. (2003), dass drei Patienten, die nach der Operation ein dementielles Syndrom entwickelten, einen MMSE-Wert von 19 bis 30 hatten. Vingerhoets et al. (1999b) geben an, dass Patienten, die präoperativ einen MMSE-Wert < 24 aufwiesen, nicht zur Operation zugelassen wurden; dennoch wiesen in ihrer Studie 6 Patienten im postoperativen Verlauf kognitive Defizite auf. Zu den übrigen 30 Patienten werden zum präoperativem kognitven Zustand keine Angaben 88 gemacht. 6.2.2 Stimulation des Globus pallidus internus Dujardin et al. (2000) stellen die Überlegung an, ob die bilateral in den Globus pallidus internus implantierten Elektroden ihrer Patienten, die postoperativ ein stimulationsabhängiges dysexekutives Syndrom aufwiesen, nicht nur den ventromedialen Teil des Globus pallidus, der das eigentliche Zielareal darstellt und Bestandteil von motorischen Schleifensystemen ist, sondern auch den dorsomedialen Teil, der in kognitive Schleifensysteme involviert ist, stimulieren könnten. Eine Fehlplazierung der Elektroden schlossen die Autoren mittels Ventrikulographie aus. Weiterhin überlegen die Autoren, dass vielleicht auch der von den Elektroden ausgehende Strom sich auf umgebende Strukturen ausgebreitet und diese ebenfalls stimuliert haben könnte. Durch Ausschalten der Stimulation hatte sich die kognitive Verschlechterung der Patientin deutlich, aber nicht vollständig verbessert. Die Autoren erklären sich dieses Phänomen durch eine stimulationsinduzierte dauerhafte Veränderung. Im Gegensatz dazu folgern Loher et al. (2002) aus der Tatsache, dass ihr Patient sowohl während aktivierter als auch während deaktivierter Stimulation vergleichbar schwere kognitive Defizite aufwies, dass die Stimulation keine Ursache für die postoperativ verschlechterte Kognition sei. Tabelle 34: Verteilung der stimulierten Gehirnareale bei denjenigen Patienten, die nach der Operation eine Störung der Kognition oder eine Demenz aufwiesen, und bei der gesamten Patientengruppe aus der AnhangTabelle 20 StimuliertesGehirnareal Ncl. subthalamicus Patienten, die nach der OP eine Störung der kognitiven bzw.Exekutivfunktion aufwiesen n = 18 (5,6 %) (18: bilateral) Patienten, die nach der OP eine Demenz aufwiesen Gesamte Patientengruppe n = 322 (321: bilateral; 1: unilateral) n = 27 (1: bilateral; 26 unilateral) n = 64 (unilateral) Globus pallidus internus n = 7 (25,9 %) (1: bilateral, 6: unilateral n = 14 (4,3 %) (13:bilateral, 1: uni-oder bilateral) n = 2 (7,4 %) (2: unilateral) Thalamus n = 1 (1.6 %) (unilateral) n = 1 (1,6 %) (unilateral) 89 6.2.3 Hirnschädigung Funkiewiez et al. (2004), die von 7 Patienten berichten, die nach bilateraler Elektrodenimplantation in den Ncl. subthalamicus eine vorübergehende bzw. dauerhafte kognitve Verschlechterung oder sogar ein dementielles Syndrom entwickelten, stellten mittels eines postoperativ angefertigten MRI fest, dass 4 von diesen 7 Patienten Hämatome und die anderen 3 Patienten Kontusionen aufwiesen. Krack et al. (1998a) beschreiben einen Patienten mit subduralem Hämatom, das nach einem Sturz ausgeräumt werden musste; der Patient wies daraufhin dauerhaft kognitive Defizite auf. Morrison et al. (2004) dagegen, die einen Patienten mit dramatischer kognitiver Verschlechterung nach bilateraler Ncl. subthalamicus-Operation beschreiben, berichten von einem unauffälligen postoperativen MRI dieses Patienten. Die Autoren überlegen, ob sowohl die kognitive Verschlechterung dieses Patienten als auch die leichte Verschlechterung von Aufmerksamkeit und Sprache bei den anderen 16 Patienten dadurch verursacht wurde, dass die Elektroden quer durch das Gehirn und vor allem durch frontale Regionen eingebracht worden waren. Außer den oben genannten Autoren geben nur noch zwei weitere Autoren (Ostergaard et al. 2002 und Krack et al. 2003) in ihren Artikeln an, dass ein postoperatives MRI ihrer Patienten angefertigt wurde. Sowohl Ostergaard et al. (2002) als auch Krack et al. (2003) erwähnen keine Auffälligkeiten. 6.2.4 Bedeutung von L-Dopa Während Vingerhoets et al. (1999b) feststellen, dass diejenigen Patienten, die postoperativ kognitive Schwierigkeiten hatten, präoperativ höhere Dosen Levodopa einnahmen als die übrigen Patienten und Dujardin et al. (2001) sich fragen, ob die postoperative Reduktion des L-Dopa mit den kognitiven Ergebnissen interferiere, halten es Dujardin et al. (2000) und Loher et al.(2002) für unwahrscheinlich, dass zwischen dem dysexekutivem bzw. dementiellem Syndrom ihres Patienten und Modifikationen der L-Dopa-Dosis ein Zusammenhang besteht. Dujardin et al. (2000) schreiben, dass ihre Patientin immer unter Medikation und zwar während ihres optimalem motorischen Zustandes evaluiert wurde; die 90 L-Dopa-Dosis war während aktivierter und während deaktivierter Stimulation identisch. Außerdem seien die Änderungen der L-Dopa-Therapie zwischen prä- und postoperativ sehr gering gewesen. Loher et al. (2002) erwähnen, dass keine Änderung der Levodopa-Dosis bei ihrem Patienten nach der Operation vorgenommen wurde. Tabelle 35: Präoperative L-Dopa-Äquivalenz-Dosis in mg/d und Reduktion von prä- zu postoperativer L-DopaDosis in % bei denjenigen Artikeln, die berichten, dass ein Teil ihrer Patienten nach der Operation kognitive Verschlechterung, Störung der Exekutivfunktion bzw. dementielles Syndrom aufwiesen. Artikel Anzahl der Patienten Vingerhoets et al. 6 1999b Dujardin et al. 1 2000 Loher et al. 2002 1 Durchschnittswert: Individuelle präoperative LDopaÄquivalenzDosis in mg/d 987,5 Reduktion von präzu postoperativer LDopa-Dosis in % Zeitpunkt, an dem postoperative L-Dopa-Dosis bestimmt wurde - - 550 9,1 1560 1004,4 mg/d 0 4,6 % 6 bis 15 Monate nach der Operation 1 Jahr nach der OP Nur drei Artikel geben individuelle präoperative L-Dopa-Dosen an und/ oder individuelle Prozentwerte, um die die L-Dopa-Medikation im postoperativen Verlauf reduziert wurde. Dagegen nennen 7 Artikel (Funkiewiez et al. 2004, 2003, Krack et al. 2003, Hariz et al. 2003, Ostergaard et al. 2002, Vesper et al. 2002, Dujardin et al. 2001) nur Durchschnittswerte für die gesamte Patientengruppe. 8 Artikel machen keinerlei Angaben zu prä- oder postoperativer L-Dopa-Dosis. 6.2.5 Alter der Patienten Vingerhoets et al. (1999b) stellen fest, dass die 6 Patienten, die nach der Operation kognitive Defizite aufwiesen, älter waren als der Rest der Gruppe. Ebenso berichten Morrison et al. (2004), dass das Alter ihres Patienten mit postoperativ dramatischer kognitiver Verschlechterung 14 Jahre über dem durchschnittlichen Alter der anderen Patienten lag und Morrison et al. (1998) konstatieren, dass der eine kognitiv verschlechterte Patient älter war als die anderen beiden Patienten. Dujardin et al. (2001) dagegen schreiben, dass in ihrer Studie die Patienten, bei denen postoperativ ein Abfall der kognitiven Leistungen zu sehen war, nicht älter waren als der Rest der Gruppe. 91 Tabelle 36: Alter der Patienten, die nach der Operation eine Verschlechterung der Kognition, eine Störung der Exekutivfunktion bzw. eine Demenz entwickelte Artikel Dujardin et al. 2000 Hariz et al. 2000 Hariz et al. 2003 Loher et al. 2002 Morrison et al. 2004 Vingerhoets et al. 1999b Durchschnittsalter Patienten mit kognitiver Verschlechterung, Störung der Exekutivfunktion bzw. dementiellem Syndrom n=1 n=1 n=3 n=1 n=1 n=6 Individuelles Alter in Jahren 52 53 53; 76; 76 75 74 58; 67; 67; 62; 57; 62 64 Jahre 6 Artikel nennen individuelle Altersangaben, weitere 6 Artikel (Funkiewiez et al. 2004, 2003, Rodriguez-Oroz et al. 2004, Krack et al. 2003, Ostergaard et al. 2002, Dujardin et al. 2001) geben nur das Durchschnittsalter der Patientengruppe an, während 6 Artikel keinerlei Angaben zum Alter ihrer Patienten machen. 6.2.6 Bildungsstand der Patienten Morrison et al. (1998) stellen fest, dass derjenige Patient, der schwere kognitive Defizite nach der Operation aufwies, weniger gebildet war als die anderen Patienten. Leider gehen nur drei weitere Autoren auf den Bildungsstand ihrer Patienten ein, davon machen zwei Autoren individuelle Angaben zu den einzelnen Patienten: Dujardin et al. (2000) berichten, dass ihre Patientin, die postoperativ an einem stimulationsabhängigem dysexekutivem Syndrom litt, 8 Jahre Schulausbildung aufwies, und Vingerhoets et al. (1999b) nennen für diejenigen 6 Patienten, die postoperativ kognitive Defizite aufwiesen, individuelle Angaben der Ausbildungsjahre (Tab. 39). Im Gegensatz dazu geben Dujardin et al. (2001) für die “years of education” einen durchschnittlichen Wert von 11,67 (± 2,83) Jahren an, der sich auf alle 9 Patienten und nicht nur auf den einen Patienten mit postoperativer kognitiver Verschlechterung bezieht. Die restlichen 15 Artikel machen zum Bildungsstand keine Angaben. Tabelle 37: Ausbildungsjahre derjenigen Patienten, die nach der Operation eine kognitive Verschlechterung, eine Störung der Exekutivfunktion bzw. eine Demenz entwickelten Artikel Vingerhoets et al. 1999b Dujardin et al. 2000 Patienten mit kognitiver Verschlechterung, dysexekutivem bzw. dementiellem Syndrom n=6 n=1 Ausbildungsjahre 10; 12; 10; 12; 10; 8 8 92 Durchschnittswert 10 Jahre 6.2.7 Koexistenz von Lewy-Körperkrankheit bzw. Übergang der ParkinsonErkrankung in Lewy-Körperkrankheit Von kognitiver Verschlechterung bis hin zur Demenz berichten von jeweils einem Patienten Loher et al. (2002) und Rodriguez-Oroz et al. (2004) und von zwei Patienten mit kognitiver Verschlechterung Ostergaard et al. (2002).Bei den zwei erstgenannten Patienten sind gleichzeitig optische Halluzinationen aufgetreten. Es handelt sich dabei um dieselben Patienten, die bereits ausführlich unter 4.2.4. vorgestellt wurden. Wie dort ausgeführt, darf man annehmen, dass bei diesen Patienten eine Koexistenz oder ein Übergang der Parkinson-Erkrankung in eine Lewy-Körperkrankheit vorliegt. 6.2.8 Natürliche Progression der Parkinson-Erkrankung Krack et al. (2003) sehen als Ursache des postoperativen Auftretens kognitiver Defizite einiger ihrer Patienten die natürliche Progression der Parkinson-Erkrankung, die mit einer fortschreitenden kognitiven Verschlechterung einhergeht. Die Autoren diagnostizierten nämlich bei 3 Patienten zwischen dem 3. und dem 5. postoperativem Jahr eine progrediente Demenz, die den natürlichen Verlauf der Parkinson-Erkrankung widerspiegeln könnte. Allerdings berichten sie auch von 2 Patienten, die unmittelbar nach der Operation eine Verschlechterung der Kognition aufwiesen. Es ist eher unwahrscheinlich, dass diese abrupte Verschlechterung auf das Fortschreiten der Erkrankung zurückzuführen ist. Ebenso berichten Kumar et al. (1998) und Morrison et al. (2004) von einem unmittelbar auf die Operation folgendem Abfall kognitiver Leistungen von jeweils einem ihrer Patienten. Bei dem Patienten von Morrison et al. (2004) bessert sich die Kognition während Deaktivierung der Stimulation, allerdings wird das präoperative Niveau nicht mehr erreicht. Auch bei Dujardin et al. (2000) liegt eine klare Stimulationsabhängigkeit des dysexekutiven Syndroms ihrer Patientin vor: Während Stimulation sind ihre Leistung wesentlicher schlechter als bei ausgeschalteter Stimulation. Diese stimulationsabhängigen Phänomene können nicht durch einen Einfluss der Parkinson-Erkrankung erklärt werden. Schließlich berichten auch einige Autoren (Funkiewiez et al. 2004 und Dujardin et al. 2001), dass ein Teil ihrer Patienten postoperativ kognitive Defizite entwickelten, die sich aber 93 wieder zurückbildeten. 6.3 Therapie und Verlauf von kognitiven Störungen und Demenz Therapeutische Maßnahmen bei kognitiver Verschlechterung, Störungen der Exekutivfunktion oder dementiellem Syndrom werden von keinem Autor erwähnt. Einige Autoren geben an, ob die Symptomatik stimulationsabhängig war oder nicht. Tabelle 38: Stimulationsabhängigkeit von kognitiver Verschlechterung, Störungen der Exekutivfunktion bzw. Demenz (Bezugsmenge n = 43) Stimulationsmodus Verbesserung der Symptomatik durch Änderungen der Stimulationsparameter oder Ausschalten der Stimulation Verschlechterung der Symptomatik durch Ausschalten der Stimulation Unveränderte Symptomatik auch nach Änderungen der Stimulationsparameter oder Auschalten der Stimulation Keine Angaben Zahl der Patienten n=2 n=1 n=5 n = 35 Bei einer Patientin mit Störung der Exekutivfunktion verbesserte sich die Symptomatik gravierend durch Ausschalten der Stimulation und bei einem weiteren Patienten mit milder kognitiver Verschlechterung trat nach Modifikationen der Stimulationsparameter eine Besserung ein. Dagegen zeigte ein anderer Patient mit dramatischer postoperativer Verschlechterung der Kognition eine leichte Verbesserung seiner kognitiven Fähigkeiten, sobald die Stimulation angeschaltet wurde. Allerdings wies er im Vergleich zu seinen präoperativen kognitiven Fähigkeiten auch bei angeschalteter Stimulation eine dramatische Verschlechterung der Kognition auf. Zu 5 Patienten wird angegeben, dass Änderungen der Stimulationsparameter oder Deaktivierung der Stimulation auf die verschlechterte Kognition bei 3 Patienten und das dementielles Syndrom bei 2 Patienten keinerlei Einfluss hatte. Zu 35 Patienten werden keine Angaben gemacht, ob die Symptomatik dieser Patienten stimulationsabhängig war oder nicht. Tabelle 39: Verlauf von kognitiver Verschlechterung, dysexekutivem Syndrom und Demenz (Bezugsmenge n = 43) Besserung n=4 9,3 % Keine Besserung n = 18 41,9 % Keine Angaben n = 21 48,8 % 94 Vier Patienten litten an einer vorübergehenden kognitiven Verschlechterung; zu einer Patientin dieser Gruppe wird erwähnt, dass sich bei ihr eine sogar signifikante Verschlechterung wieder vollständig zurückbildete. Zu der Gruppe von 18 Patienten mit chronischem Verlauf wurden alle 14 Patienten gerechnet, die postoperativ an einer Demenz erkrankten; vier weitere Patienten mit kognitiver Verschlechterung zeigten ebenfalls keine Besserung. Zu 21 Patienten werden keine Angaben gemacht, ob sich ihre Symptomatik besserte oder nicht. 95 C. DISKUSSION 1. Zusammenfassung der Studienergebnisse 1.1 Depression bei Tiefenhirnstimulation Insgesamt berichten in der gesichteten Literatur 58 Artikel mit einem Patientengut von 1149 Personen von depressiver Symptomatik. Zwei Drittel der Artikel (65,5 %) evaluierten die Symptomatik mittels spezifischer Tests. 1.1.1 Keine Veränderung oder Verbesserung depressiver Symptomatik nach Tiefenhirnstimulation Es werden 175 Patienten beschrieben, deren depressive Symptomatik sich nach der Operation verbesserte.141 von ihnen hatten sich einer bilateralen Elektrodenimplantation in den Ncl. subthalamicus unterzogen, neun Patienten waren am Globus pallidus operiert worden (bei weiteren 6 Patienten wird nicht deutlich, ob sie am Ncl. subthalamicus oder am Globus pallidus internus operiert wurden), 15 Patienten hatten eine Operation des Thalamus hinter sich und bei vier Zwangspatienten war eine Elektrodenimplantation in die Capsula interna erfolgt. Zu 20 Patienten wird berichtet, dass depressive Symptomatik nach Ausschalten der Stimulation ausgeprägter war als bei aktivierter Stimulation. Bei 13 von ihnen fand sich eine bilaterale Ncl. subthalamicus- Stimulation, ein Patient wies eine bilaterale ThalamusStimulation auf und bei sechs Zwangspatienten war eine Elektrodenimplantation in die Capsula interna erfolgt. Von 176 Patienten wird eindeutig angegeben, dass keine Änderung depressiver Symptomatik zwischen prä- und postoperativ zu finden war. 96 Patienten waren am bilateralen Ncl. subthalamicus operiert worden, 62 Patienten hatten eine Elektrodenimplantation in den Globus pallidus erhalten, bei sieben Patienten war eine Operation des Thalamus erfolgt. (Bei weiteren 47 Patienten berichten die Autoren zwar von einem Depressionstest, teilen aber kein Ergebnis mit, so dass man eine unveränderte depressive Symptomatik vermuten kann.) 96 1.1.2 Depressive Symptomatik bei Tiefenhirnstimulation Insgesamt werden 115 Patienten beschrieben, die nach der Operation an einer Depression erkrankten. 109 Patienten hatten sich einer Elektrodenimplantation in den Ncl. subthalamicus unterzogen, bei jeweils zwei Patienten waren die Elektroden in den Globus pallidus bzw. den Thalamus implantiert worden. (Bei zwei Patienten wird nicht deutlich, ob sie eine Implantation in den Ncl. subthalamicus oder in den Globus pallidus erhalten hatten.) Eine Betrachtung der nach der Operation an einer Depression Erkrankten im Verhältnis zu der gesamten Patientengruppe , in der sich die Erkrankten befanden, ergibt Folgendes: Es entwickelten 11,6 % der Patienten, die eine Elektrodenimplantation in den bilateralen Ncl. subthalamicus erhielten (Bezugsmenge 940 Patienten), 2,6 % der Patienten, die eine Elektrodenimplantation in den Globus pallidus internus erhielten (Bezugsmenge 77 Patienten) und 1,9 % der Patienten, bei denen die Elektroden in den Thalamus operiert wurden (Bezugsmenge 108 Patienten), eine Depression im postoperativen Verlauf. Zu 30 von 115 Patienten werden Angaben zum Beginn der Depression genannt: 70,1 % der Patienten erkrankten innerhalb eines Zeitraumes von unmittelbar nach der Operation bis 3 Monate postoperativ. 23,3 % erkrankten zwischen 3 bis 60 Monate nach der Operation. Zu einem Patienten wir angegeben, dass er bereits vor der Operation an einer Depression gelitten habe. Was den Verlauf der Depression betrifft, findet man nur zu ca. der Hälfte der Patienten Angaben: 47 Patienten zeigten eine Besserung der Symptomatik, bei sechs Patienten fand keine Besserung statt und bei drei Patienten erfolgte ein Übergang in eine Demenz. Insgesamt 21 von 115 Patienten waren suizidal, neun von ihnen unternahmen einen Suizidversuch, zweiPatienten nahmen sich das Leben. Therapeutische Maßnahmen der depressiven Symptomatik umfassten eine medikamentöse Therapie mit einem Antidepressivum (bei 35 Patienten), Wiedereinführen von Dopamin-agonisten (bei 16 Patienten) und Änderungen der Stimulationsparameter (bei neun Patienten). Bei acht Patienten wird erwähnt, dass eine stationäre psychiatrische 97 Behandlung notwendig war. Bei 47 Patienten sind keine Angaben zur Therapie der Depression zu finden. 35 Patienten wurde mit einem Antidepressivum behandelt: 13 Patienten erhielten einen SSRI, jeweils ein Patient wurde mit Venlafaxin bzw. Clomipramin behandelt. Bei 20 Patienten gaben die Autoren nicht an, um welches Antidepressivum es sich gehandelt hatte. Fünf Patienten sprachen auf das Antidepressivum nicht an. Bei allen 16 Patienten, deren Depression durch Wiedereinnahme von Dopaminagonisten therapiert wurde, besserte sich die depressive Symptomatik; zwei von ihnen hatten vorher nicht auf eine Therapie mit einem Antidepressivum angesprochen. Änderungen der Stimulationsparameter bewirkte bei fünf Patienten eine Besserung der Depression, weitere vier Patienten sprachen auf diese Maßnahme nicht an. Mehrere Autoren diskutieren als Risikofaktor für das postoperative Auftreten von Depressionen ein höheres Alter sowie eine positive Vorgeschichte für psychiatrische Erkrankungen. In Bezug auf das Alter ihrer Patienten machen nur ein Teil der Autoren Angaben, meist in Form von Durchschnittswerten, die nicht repräsentativ sind. Was die psychiatrische Vorgeschichte der Patienten betrifft, sind zu 72,2 % der Patienten keinerlei Angaben zu finden. Auf die Ermittlung von Ausschlusskritereien verzichten 62 % der Artikel, die von depressiven Erkrankungen bei Tiefenhirnstimulation berichten. Bei 31,1 % der Artikel galt eine depressive oder psychiatrische Erkrankung unterschiedlichen Schweregrades, bei 6,9 % eine unbehandelte Depression als Ausschlusskriterium. Als mögliche Ursachen für das postoperative Auftreten von Depression werden folgende Überlegungen angestellt: Mehrere Autoren vermuten, dass eine Stimulation von nichtmotorischen Schleifensystemen oder unbeabsichtigte Kostimulation (durch Ausbreitung des von der Elektrode abgegebenen Stromes bzw. durch Fehlplazierung der Elektrode) von benachbarten Faserzügen der depressiven Symptomatik zugrunde liegen könnte. Der Ncl. subthalamicus scheint aus zwei Gründen zur unerwünschten Stimulation nicht-motorischer Areale prädestiniert zu sein: Auf der einen Seite stellt der Ncl. subthalamicus ein relatives kleines Zielareal dar, so dass es schwierig ist, eine Elektrode so exakt zu platzieren, dass sie nur die motorische Anteile des Ncl. subthalamicus stimuliert. Auf der anderen Seite ist der Ncl. subthalamicus von Strukturen wie Hypothalamus, mittlerem Vorderhirnbündel und Zona incerta umgeben, deren Beeinträchtigung zu affektiven Störungen führen kann. 98 Als weitere Ursache wird diskutiert, ob die Progression der Parkinson-Erkrankung, die mit psychopathologischen Symptomen einhergeht, dem postoperativen Auftreten von Depressionen zugrunde liegen könne. Wie schon oben beschrieben, werden nur zu 30 von 115 Patienten Angaben zum Beginn der Depression gemacht. Von diesen 30 Patienten erkrankte jedoch die Mehrheit (73,3 %) innerhalb eines Zeitraumes von unmittelbar nach der Operation bis drei Monate postoperativ. Der kurze Zeitraum zwischen Operation und Erkrankungsbeginn spricht eher gegen das Argument einer Progression der ParkinsonErkrankung. Ein Vergleich des Follow-up der Patienten, die nach der Operation nicht an einer Depression erkrankten und derjenigen, die im postoperativen Verlauf depressiv wurden, ergibt Folgendes: Das durchschnittliche Follow-up der Depressiven ist mit 18,7 Monaten länger als das Follow-up der Nicht-Depressiven, das 7,8 Monate betrug. Dieser Vergleich spricht wiederum eher für das Argument einer Progression der ParkinsonErkrankung. Des Weiteren werden als Gründe für das postoperative Auftreten von Depressionen psychosoziale Aspekte und die postoperative Reduktion der Antiparkinson- Medikation diskutiert. Nicht alle Artikel geben prä- und postoperative äquivalente Dosen von L-Dopa an. Wenn sie es tun, dann handelt es sich meist um durchschnittliche Werte für die gesamte Patientengruppe, die für den jeweiligen einzelnen Patienten, der nach der Operation an einer Depression erkrankt, nicht repräsentativ sind. 1.2. Enthemmtes Verhalten 1.2.1 Lachen, Euphorie, aggressives Verhalten In 7 Artikeln mit insgesamt 238 Patienten zeigen 28 Patienten die o.g. Symptomatik: 25 Patienten wiesen nach der Operation ein euphorisches Verhalten auf oder brachen in fröhliches Gelächter aus, drei Patienten entwickelten ein aggressives Verhalten. 26 von ihnen hatten sich einer bilateralen, zwei von ihnen einer unilateralen Elektrodenimplantation in den Ncl. subthalamicus unterzogen. Bei 19 Patienten bildete sich diese Symptomatik spontan zurück, bei weiteren sechs Patienten zeigte sich nach Ausschalten der Stimulation eine vollständige Rückbildung der Symptome, bei drei Patienten wird nichts zum Verlauf gesagt. Eine Betrachtung der Patienten, die nach der Operation die oben genannte Symptomatik entwickelten, im Verhältnis zu der gesamten Patientengruppe , in der sie sich 99 befanden, zeigt, dass bei 11,8 % der Patienten nach Elektrodenimplantation in den Ncl. subthalamicus ein euphorisches Verhalten manifest wurde. 1.2.2 Hypersexualität und enthemmtes Verhalten 5 Artikel mit insgesamt 87 Patienten berichten von Hypersexualität /enthemmten Verhalten bei fünf Patienten nach bilateraler Ncl. subthalamicus-Operation und bei einem Patienten nach unilateraler Globus pallidus internus-Operation. Eine Betrachtung derjenigen Patienten, die nach der Operation die geschilderte Symptomatik entwickelten, im Verhältnis zu der gesamten Patientengruppe, in der sie sich befanden, ergibt, dass 5,8 % der Patienten, die sich einer Elektrodenimplantation in den Ncl. subthalamicus unterzogen hatten, im postoperativen Verlauf Hypersexualität oder enthemmtes Verhalten aufwiesen. 1.2.3 Hypomanie, Manie und bipolare affektive Störung In 11 Artikeln mit 230 + 11 Patienten werden 23 Patienten beschrieben, die nach der Operation eine Hypomanie bzw. Manie oder eine bipolare affektive Störung entwickelten. 22 von ihnen hatte sich einer bilateralen Implantation in den Ncl. subthalamicus unterzogen, nur ein Patient war am bilateralen Globus pallidus internus operiert worden. Eine Betrachtung der nach der Operation an Hypomanie, Manie bzw. bipolarer affektiver Störung Erkrankten im Verhältnis zu der gesamten Patientengruppe , in der sich die Erkrankten befanden, ergibt Folgendes: Es entwickelten 9,6 % der Patienten, die eine Elektrodenimplantation in den bilateralen Ncl. subthalamicus erhielten, eine Hypomanie, Manie oder bipolare affektive Störung. Die Symptomatik begann zwischen 2 bis 90 Tagen nach der Operation, bei 52,2 % der Patienten bildete sich die Symptomatik zurück, während sich bei 13 % keine Besserung zeigte; zu 34,8 % der Patienten werden hinsichtlich des Verlaufs der Symptome keine Angaben gemacht. Bei sieben Patienten bildeten sich die Symptome spontan zurück, bei acht Patienten wurde entweder durch Änderungen der Stimulationsparameter oder durch Reduktion der Antiparkinson-Medikation oder durch pharmakologische Therapie eine Besserung erzielt; zu den restlichen acht Patienten werden keine Angaben bezüglich therapeutischer Maßnahmen gemacht. 1 Daten nicht veröffentlicht 100 52,2 % der Patienten wiesen eine negative psychiatrische Anamnese auf, 17,4 bis 21,7 % hatten eine positive Vorgeschichte für psychiatrische Erkrankungen, während zu 26 % der Patienten in Bezug auf die psychiatrische Anamnese keine Angaben gemacht werden. Neben einer positiven psychiatrischen Vorgeschichte werden als weitere mögliche Ursachen für das postoperative Auftreten von hypomanen/manischen Symptomen bzw. bipolarer affektiver Störung folgende Überlegungen genannt: Mehrere Autoren vermuten eine unbeabsichtigte Costimulation nicht-motorischer Schleifensysteme, einige Autoren gehen von einem additiven psychotropen Effekt von L-Dopa und Stimulation aus, andere halten es für plausibel, dass die stimulationsbedingte Verbesserung der motorischen Symptome die Patienten in einen manischen Zustand versetzt haben könnte. 1.3 Angst 29 Artikel mit einer Gesamtzahl von 414 Patienten berichten von Angst. 1.3.1 Verbesserung von Angst Bei insgesamt 118 Patienten wird beschrieben, dass sich bei ihnen nach der Operation die Angstsymptome verbesserten. 34 (28,8 %) von ihnen hatten sich einer bilateralen Elektrodenimplantation in den Ncl. subthalamicus, 45 (38,1 %) einer unilateralen Elektrodenimplantation in den Thalamus, 34 (28,8 %) einer uni- oder bilateralen Implantation in den Globus pallidus internus, drei einer unilateralen Implantation in den Ncl. accumbens und zwei einer bilateralen Implantation in die Capsula interna und unterzogen. Während bei 103 Patienten spezifische Tests zur Evaluation von Angstsymptomatik herangezogen wurden, wurden bei 15 Patienten keine spezifischen Tests angewendet bzw. die Autoren machten dazu keine Angaben. Zu 50 von den insgesamt 118 Patienten wird angegeben, dass sich die Angstsymptomatik nach der Operation signifikant verbesserte. 101 1.3.2 Verbesserung der Angst während Stimulation und Auftreten von Angstsymptomatik, nachdem die Stimulation ausgeschaltet wurde Insgesamt 13 Patienten werden beschrieben, bei denen nach Ausschalten der Stimulation die Angstsymptomatik zunahm. 12 Patienten waren am bilateralen Ncl. subthalamicus operiert worden, ein Patient am bilateralen Thalamus. 1.3.3 Keine Änderung der Angstsymptomatik bei Tiefenhirnstimulation Zu 86 Patienten wird explizit berichtet, dass keine Änderung der Angstsymptomatik nach der Operation festzustellen war. Bei 86 von ihnen wurden die Angstsymptome mittels spezifischer Tests evaluiert und es wurde angegeben, dass bei allen 86 Patienten keine signifikante Veränderung der Angst vorlag. 82 von ihnen hatten sich einer bilateralen Elektrodenimplantation in den Ncl. subthalamicus unterzogen, drei von ihnen waren am bilateralen Globus pallidus internus operiert worden, einer am Ncl. accumbens. (Bei weiteren 22 Patienten berichten die Autoren zwar von einem postoperativen Test, teilen aber kein Ergebnis mit, so dass man eine unveränderte Angstsymptomatik vermuten kann.) 1.3.4 Angst bei Tiefenhirnstimulation Bei acht Patienten wird deutlich, dass sie im postoperativen Verlauf eine Angstsymptomatik zeigten, die nicht Bestandteil eines anderen psychiatrischen Krankheitsbildes war. 4 von den acht Angstpatienten litten an einer Agoraphobie. Zu drei Patienten wird angegeben, dass sie schon vor der Operation an Angst litten, die sich aber nach der Operation dramatisch verschlechterte. Ein Patient litt im postoperativen Verlauf zum ersten Mal an Angstsymptomen. Bei einem weiteren Patienten war die Angstsymptomatik eindeutig stimulationsinduziert und war leicht durch Änderungen der Stimulationsparameter in den Griff zu bekommen. 7 der 8 Angstpatienten hatten sich einer bilateralen Elektrodenimplantation in den Ncl. subthalamicus unterzogen, einer war am unilateralen Thalamus operiert worden. Eine Betrachtung der Patienten, die nach der Operation Angstsymptome aufwiesen, im Verhältnis zu der gesamten Patientengruppe , in der sie sich befanden, ergibt Folgendes: Es entwickelten 2,9% der Patienten, die eine Elektrodenimplantation in den bilateralen Ncl. 102 subthalamicus erhielten (Bezugsmenge n = 272), und 1,1 % der Patienten, die eine Elektrodenimplantation in den unilateralen Thalamus erhielten (Bezugsmenge n = 95 Patienten), im postoperativen Verlauf Angstsymptome. Als mögliche Ursachen für das postoperative Auftreten von Angstsymptomen werden Fehlplazierung von Elektroden, ein Zusammenhang mit der dopaminergen Medikation und psychosoziale Aspekte diskutiert. 1.4 Psychotische Symptome bei Tiefenhirnstimulation In 11 Artikeln mit insgesamt 227 Patienten werden 14 Patienten beschrieben, die nach der Operation psychotische Symptome entwickelten. 5 von ihnen entwickelten optische Halluzinationen. 11 Patienten waren am bilateralen Ncl. subthalamicus operiert worden, 3 Patienten hatten eine Elektrodenimplantation in den unilateralen Globus pallidus internus erhalten. Betrachtet man die Patienten, die nach der Operation psychotische Symptome aufwiesen, im Verhältnis zu der gesamten Patientengruppe, in der sie sich befanden, wird deutlich, dass 5 % derjenigen Patienten, die sich einer Elektrodenimplantation in den Ncl. subthalamicus unterzogen hatten (Bezugsmenge n = 219), im postoperativen Verlauf psychotische Symptome entwickelten (bei 3 von 8 Patienten wurde nach unilateraler Operation des Globus pallidus internus eine Psychose festgestellt). Zu 8 Patienten wird angegeben, dass sich die Symptomatik einige Tage bis mehrere Wochen nach der Operation entwickelte. Bei 8 Patienten besserte sich die Symptomatik: bei 1 Patienten fand eine spontane Rückbildung innerhalb von 2 Tagen statt, bei 2 weiteren Patienten sprachen die Symptome auf ein Absetzen bzw. eine Reduktion der Antiparkinson- Medikation an, bei 4 Patienten sprach die Psychose auf Quetiapin bzw. Clozapin an und bei einem Patienten bildeten sich die Symptome nach Ausschalten der Stimulation zurück. Bei einem Patienten besserte sich die Symptomatik nicht, und zu den verbleibenden 5 Patienten werden keine Angaben gemacht, ob sich die Psychose zurückbildete oder nicht. Als Risikofaktoren für das postoperative Auftreten von Psychosen erwähnen Houeto et al. (2002) eine positive Anamnese für Psychosen. Sie sehen auch, ebenso wie Diederich et al. 103 (2000), einen Zusammenhang zwischen dem Auftreten von psychotischer Symptomatik und L- Dopa. Zur Pathogenese der psychotischen Symptome überlegen Diederich et al. (2000) und Krack et al. (1998 a/b), dass durch die Stimulation des Ncl. subthalamicus auch andere Areale wie z. B das limbische System unbeabsichtigt mitstimuliert werden könnten. 1.5 Verwirrtheitszustände und Delir bei Tiefenhirnstimulation 20 Artikel mit insgesamt 438 Patienten beschrieben bei 152 Patienten Verwirrtheits- symptome oder delirante Symptome nach der Operation. In der Regel bildete sich die Symptomatik innerhalb von Stunden bis wenigen Tagen und in seltenen Fällen innerhalb von mehreren Wochen bis zu 3 Monaten (bei 8 Patienten) zurück. Bei 3 Patienten fand ein Übergang in eine Demenz statt; zu 20 Patienten werden in Hinsicht auf den Verlauf der Verwirrtheitssymptome keine Angaben gemacht. 132 von 152 Patienten hatten sich einer Elektrodenimplantation in den Ncl. subthalamicus unterzogen, 19 Patienten wurden am bilateralen Globus pallidus internus operiert. Bei einem Patienten wurden die Elektroden in den VIM- Ncl. des Thalamus implantiert. Eine Betrachtung der Patienten, die nach der Operation Verwirrtheitszustände aufwiesen, im Verhältnis Patientengruppe , in der sie sich befanden, zeigt, dass 33 zu der gesamten % der Patienten, die eine Elektrodenimplantation in den Ncl. subthalamicus erhielten (Bezugsmenge n= 400), im postoperativen Verlauf Verwirrtheitssymptome entwickelten (19 von 19 Patienten, die am bilateralen Globus pallidus operiert wurden, waren nach der Operation verwirrt). Als mögliche Ursachen für das postoperative Auftreten von Verwirrtheit und Delir werden folgende Überlegungen angestellt: Mehrere Autoren sehen in einer durch die Implantation verursachten Hirnschädigung (subdurales Hämatom, Infarkte o. ä.) die Ursache für Verwirrtheitssymptome. Kumar et al. (1998) vermuten, dass ein höheres Alter einen Risikofaktor darstelle und Ardouin et al. (1999) schreiben, dass ein Zusammenhang bestünde zwischen den Verwirrtheitssymptomen und dem durch die Operation bedingten vorübergehenden Entzug von Antiparkinson-Medikamenten. 104 1.6 Kognitive Störungen und Demenz bei Tiefenhirnstimulation 18 Artikel mit 413 Patienten berichten bei 43 Patienten von kognitiven Störungen im postoperativen Verlauf. Bei 18 Patienten erwiesen sich die kognitiven Defizite als irreversibel. Bei 4 Patienten bildete sich die kognitive Störung wieder zurück. Zu 21 Patienten werden keine Angaben gemacht. 32 von 43 Patienten hatten sich einer Elektrodenimplantation in den Ncl. subthalamicus unterzogen, bei 9 Patienten war ein Globus pallidus-Operation erfolgt und 2 Patienten waren am Thalamus operiert worden. Betrachtet man die Patienten, die nach der Operation kognitive Defizite aufwiesen, im Verhältnis zu der gesamten Patientengruppe, in der sie sich befanden, wird Folgendes deutlich: 9,9 % derjenigen Patienten, die sich einer Elektrodenimplantation in den Ncl. subthalamicus unterzogen hatten (Bezugsmenge n = 322), 33,3 % der Patienten, die am Globus pallidus operiert worden waren (Bezugsmenge n =27) und 3,1 % der Patienten, bei denen eine Operation am Thalamus vorgenommen worden war (Bezugsmenge n = 64), entwickelten im postoperativen Verlauf kognitive Störungen. Davon fanden sich schwere kognitive Defizite in Form einer Demenz bei 4,3 % der Ncl. subthalamicus- Patienten, bei 7,4 % der Globus pallidus- Patienten und bei 1,6 % der Thalamus- Patienten. Als Risikofaktoren sehen mehrere Autoren vorbestehende kognitive Störungen, niedriger Bildungsstand und höheres Alter. Als mögliche Ursachen werden durch die Implantation verursachte Hirnschädigungen wie subdurales Hämatom, Kontusion u.ä., eine unbeabsichtigte Kostimulation nicht-motorischer Gehirnareale, ein Zusammenhang mit der dopaminergen Medikation, eine Koexistenz bzw. ein Übergang in eine Körperkrankheit und die natürliche Progression der Parkinson-Erkrankung diskutiert. Lewy- 105 2. Folgerungen für die Patientenauswahl Die oben aufgeführten Risikofaktoren und mögliche Ursachen (Topographie der Stimulation, psychiatrische Anamnese, vorbestehende kognitive Defizite, Bildungsstand, Alter, Dosis und postoperative Reduktion der Antiparkinson-Medikation) für das postoperative Auftreten von psychiatrischen und kognitiven Komplikationen beruhen überwiegend nur auf Überlegungen der Autoren. Trotzdem lassen sich einige vorläufige Schlussfolgerungen für die Patientenauswahl für eine Tiefenhirnstimulation ziehen und vor allem Forderungen für weitere Untersuchungen zu deren Erhärtung ableiten. Offenbar hängt das Risiko der verschiedenen berichteten psychiatrischen Nebenwirkungen deutlich vom Ort der Tiefenhirnsimulation ab. So scheint nach Elektrodenimplantation und Stimulation des Ncl. subthalamicus das Risiko, verschiedene psychiatrische Symptome zu entwickeln, besonders ausgeprägt zu sein. Bei Eingriff in den Ncl. subthalamicus scheint daher eines besonders strenge Indikationsstellung bis hin zum Ausschluss von Patienten bei Vorliegen weiterer Risikofaktoren und eine sorgfältige Aufklärung über die eventuellen Risiken erforderlich. Zusätzlich zu dem Ort der Tiefenhirnstimulation machen einige Autoren weitere Angaben zu ihren Überlegungen bezüglich der Patientenauswahl: Der Risikofaktor “positive psychiatrische Anamnese” wird beispielsweise immer wieder diskutiert. Zu mindestens 17,3 % bis höchstens 28,7 % der Patienten, die an einer Depression erkranken, und zu 73,9 % der Patienten, die manische Symptome entwickeln, geben die Autoren an, ob eine positive psychiatrische Vorgeschichte vorlag oder nicht. Dies ist der einzige Risikofaktor, zu dem genügend Angaben gemacht wurden, so dass eine Auswertung möglich war. Die Auswertung der psychiatrischen Vorgeschichte dieser zuletzt genannten Patientengruppe ergab, dass 56,5 - 52,2 % eine negative psychiatrische Anamnese aufwiesen, was den prädiktiven Wert des Risikofaktors “positive psychiatrische Anamnese” relativiert. Damit vereinbar ist, dass einige Autoren betonen, dass trotz positiver Risikofaktoren keine psychiatrischen oder kognitiven Komplikationen aufgetreten seien und umgekehrt. Dies beschreiben für das Nicht-Auftreten von Depressionen Berney et al. (2002), Bejjani et al. (1999) und Mayberg and Lozano (2002) (vgl.1.3.1.) und für das Auftreten von 106 Kognitionsstörungen Dujardian et al. (2001) (vgl.6.2.5). In Zukunft wäre es also notwendig, für jeden einzelnen Patienten präzise Angaben zu den diskutierten Risikofaktoren und möglichen Ursachen zu machen, um anschließend eine sinnvolle Auswertung der Bedeutung dieser Faktoren vornehmen zu können, z. B. mit Hilfe einer retrospektiven Fall-Kontroll-Studie. Wenn sich bei dieser Auswertung herausstellte, dass ein Zusammenhang zwischen den vermeintlichen Risikofaktoren und dem Auftreten von psychiatrischen und kognitiven Komplikationen immer noch fraglich ist, wäre es wichtig, dies prospektiv mit kontrollierten, randomisierten und soweit möglich verblindeten Studien zu untersuchen. Aber auch um zu überprüfen, welche psychiatrischen und kognitiven Symptome wirklich eine Folge der Stimulation und nicht etwa der Progression der Parkinson-Erkrankung oder der Reduktion der Antiparkinson- Medikation sind, bedürfte es randomisierter, kontrollierter und soweit möglich verblindeter Longitudonal-Studien2. 2 Bis einschließlich 2004 sind in medline nur 17 doppelblinde randomisierte Studien zu finden, von denen nur 2 von psychiatrischen Symptomen berichten und daher für diese Arbeit aufgenommen wurden: Burchiel et al. (1999) berichten von einer Verbesserung depressiver Symptomatik nach Tiefenhirnstimulation, und Rodriguez-Oroz et al. (2004) beschreiben einen Patienten mit moderater Depression sowie einen Patienten mit Demenz und Halluzinationen im postoperativen Verlauf. In beiden Artikeln ist jedoch die psychiatrische Symptomatik und die kognitive Störung eher als “Nebenbefund” erwähnt, in erster Linie geht es in beiden Artikeln um motorische Symptome. So fand bei Burchiel et al. (1999) die Randomisierung zwischen Patienten mit Ncl. subthalamicus- und Patienten mit Globus pallidus internus- Stimulation statt, und bei Rodriguez-Oroz et al. (2004) zwischen Patienten mit Ncl. subthalamicus-Stimulation/ mit Medikation und Patienten mit Ncl. subthalamicus-Stimulation/ ohne Medikation statt. 107 3. In Ethische Überlegungen Anbetracht der bisher aufgeführten psychiatrischen Komplikationen, die in Zusammenhang mit der Tiefenhirnstimulation auftreten, stellt sich die Frage, ob es überhaupt gerechtfertigt ist, diese Therapiemethode anzuwenden. In Anlehnung an den Artikel “A proposed ethical framework for interventional cognitive neuroscience: A consideration of deep brain stimulation in impaired consciousness” von Fins et al. (2000) möchte ich auf folgende ethische Überlegungen eingehen: In Bezug auf therapeutische und in diesem speziellen Fall neurochirurgische Maßnahmen sollten zwei ethische Prinzipien gelten: Das eine Prinzip beinhaltet, dass dem Patienten kein Schaden zugefügt werden darf; das andere Prinzip sieht eine gerechte und bestmögliche Behandlung des Patienten vor. Die ethische Verpflichtung, den Patienten vor Schaden zu schützen, kann jedoch die unbeabsichtigte Konsequenz haben, dass dem Patienten die bestmögliche Behandlung vorenthalten wird. Bietet man dem Parkinson-Patienten die Tiefenhirnstimulations-Operation nicht als Therapieoption an, so schützt man ihn auf der einen Seite vor den oben beschriebenen psychiatrischen und kognitiven Komplikationen wie Depressionen, Suizid, Angsterkrankungen, Psychosen, Verwirrtheitszustände, manische Symptome und kognitive Störungen bis hin zur Demenz. Auf der anderen Seite hält man ihm die Möglichkeit einer gravierenden Verbesserung seiner Parkinson-Symptome vor: Benabid et al. (2003) berichten in ihrem Übersichtsartikel von der durchschnittlichen Verbesserung motorischer Symptome nach bilateraler Stimulation des Ncl. subthalamicus: Nach einem Follow-up von 12 Monaten zeigt sich im Durchschnitt eine Verbesserung des UPDRS part 3 (motorische Symptome) um 55%, des UPDRS part 2 (Alltagsaktivitäten) um 45 % und der Schwab and England Scale um 142 % jeweils ohne Medikation (off drug condition). Eine durchschnittliche Verbesserung von Dyskinesien während Einnahme von Antiparkinson-Medikation (on drug condition) beträgt Durchschnitt die dopaminerge Medikation um 50% 40%. Außerdem kann im reduziert werden. Diese Verbesserungen bleiben konstant bestehen, selbst während Perioden, die länger als 5 Jahre waren. Die fundamentale ethische Herausforderung für Wissenschaftler, Bioethiker, Ärzte und die 108 Gesellschaft insgesamt besteht darin, die richtige Balance zwischen Schutz vor neuen Therapiemethoden (scientific progress) und Zugang zu neuen Therapiemethoden zu finden. Um die richtige Balance zu finden, ist es unerlässlich, die Relation zwischen Risiko und Benefit der Therapiemaßnahme zu betrachten: Betrachtet man diese Relation als einen Bruch, mit dem Risiko im Zähler und dem Benefit im Nenner (Risiko/Benefit), wird deutlich, dass der Bruch einer Therapiemethode - selbst wenn sie mit einem minimalem Risiko verbunden wäre - aber keine Aussicht auf einen Benefit hätte, ins Unendliche ginge und undefinierbar würde. Im Falle der Tiefenhirnstimulation besteht aber sehr wohl Aussicht auf einen Benefit, wie es Benabid et al. (2003) ausführen. Weiterhin zeigt die Relation Risiko/Benefit, dass der Bruch einer Therapiemethode - selbst wenn diese mit einem theoretischen Benefit verbunden wäre -, ins Unendliche ginge und undefinierbar würde, sobald das Risiko unproportioniert groß und die Intervention zu gefährlich wäre. Fins et al. (2000) berichten, dass die Mortalität der Elektrodenimplantation in die Basalganglien bei weniger als 1 % liegt und die Morbidität bei beinahe 2-3 %: die Intervention an sich stellt also ein vertretbares Risiko dar. Zum Vergleich sei angeführt, dass die Operationsletalität bei einer Appendektomie ebenfalls <1% beträgt. (Harder und von Flüe 2000). Um die Höhe des Risikos, nach einer Tiefenhirnstimulations-Operation an einer psychiatrischen oder kognitiven Störung zu erkranken, besser einzuschätzen, folgt ein Vergleich mit epidemiologischen Daten der betreffenden Erkrankungen: Die Punktprävalenz von Major Depression und depressiven Episoden im engeren Sinne beträgt 3-7 %. Die Prävalenz sämtlicher depressiver Störungen unter Einbeziehung auch leichterer Formen wie Dysthymien und Minor Depression weisen in der Erwachsenenbevölkerung einen Punktprävalenz von 15-30 % auf (Berger und van Calker 2004). Die Prävalenz depressiver Erkrankungen nach Stimulation des Globus pallidus internus und des Thalamus liegt mit 2,6 und 1,9 % unterhalb der angegebenen Punktprävalenzen. Die Prävalenz sämtlicher depressiver Störungen bei Stimulation des Ncl. subthalamicus liegt mit 11,6 % unter der Punktprävalenz von 15-30 % in der Erwachsenenbevölkerung. Die Prävalenz schwerer depressiver Erkrankungen liegt mit 3,3 % innerhalb der Punktprävalenz von Major Depressionen und Depressionen im engeren Sinne. Ein Vergleich der Prävalenz von Depressionen bei Ncl.subthalamicus-Stimulation mit den epidemiologischen Daten ist 109 jedoch nur bedingt möglich, will die Autoren zu 44 Patienten keinen Schweregrad der Depression angeben. Eine genaue Punktprävalenz für manische Episoden ist in der Literatur nicht zu finden, Berger und van Calker (2004) schreiben, dass ausschließlich manische Episoden selten auftreten. Daher ist lediglich zu vermuten, dass die Prävalenz von Hypomanien/Manien bei Stimulation des Ncl. subthalamicus mit 9,6 % deutlich über der Punktprävalenz von manischen Episoden in der Erwachsenenbevölkerung liegt. Die Punktprävalenz von Angststörungen beträgt etwa 7 % (Angenendt et al. 2004). Die Prävalenz von Angstsymptomen bei Stimulation des Thalamus, Ncl. subthalamicus und des Globus pallidus internus ist mit 1,1 %, 2,9 % und 2,6 % niedriger. Die Punktprävalenz von psychotischer Symptomatik beträgt 0,01 % (Olbrich et al. 2004). Die Prävalenz psychotischer Symptomatik bei Stimulation des Ncl. subthalamicus ist wesentlicher höher: Sie liegt bei 5 %. Für mittelgradige und schwere Demenzen beschreiben Förstl und Hüll (2004), dass der Anteil von Patienten mit einer Demenz jeglicher Genese bei allen über 65jährigen ca. 5 % beträgt. Die Punktprävalenz für dementielle Syndrome liegt bei Stimulation des Ncl. subthalamicus mit 4,3 % und bei Stimulation des Thalamus mit 1,6 % unterhalb des genannten Wertes. (2 von 27 Patienten mit Globus pallidus internusStimulation entwickelten eine Demenz, die Bezugsmenge ist zu klein.) Zusammenfassend lässt sich also festhalten, dass die Prävalenz von Manien, Psychosen und - mit Einschränkung - von Depressionen bei Stimulation des Ncl. subthalamicus höher ist als die Punktprävalenz dieser Erkrankungen in der Erwachsenenbevölkerung, und dass das Risiko, diese Erkrankungen zu entwickeln durch Tiefenhirnstimulation des Ncl. subthalamicus erhöht ist. An dieser Stelle könnte man jedoch einwenden, dass die Tiefenhirnstimulation eine reversible Therapiemethode sei, und dadurch auch die eben genannten Symptome reversibel und somit leicht zu beheben seien. Dies trifft jedoch nur für einen Teil der Patienten zu: Bei 8 depressiven und 8 manischen Patienten wurde als therapeutische Maßnahme eine Änderung der Stimulationsparameter bzw. ein Ausschalten der Stimulation vorgenommen und bei jeweils der Hälfte der Patienten besserte sich dadurch die Symptomatik. Einer von zwei Patienten mit psychotischer Symptomatik zeigte nach Deaktivierung der Stimulation eine Besserung der Symptomatik. Bei einem weiteren Patienten mit milder Angstsymptomatik im postoperativen Verlauf war die Angst durch Änderungen der Stimulationsparameter in den Griff zu bekommen. Okun et al. (2004) schildern eine Patientin, bei der die Stimulation bestimmter Elektrodenkontakte ein Gefühl 110 von Angst und Panik auslöste, das nach Beendigung der Stimulation dieses Kontaktes voll reversibel war. Ebenso berichten Ghika et al. (1998), dass bei allen 6 Patienten während der Anpassung der Stimulationsparameter Nebenwirkungen wie Verwirrung oder allgemeines Unwohlgefühl auftraten, die durch eine Reduktion der Stimulationsparameter reversibel waren. Selbst wenn psychiatrische Symptome durch Änderungen der Stimulationsparameter oder Deaktivierung der Stimulation reversibel sind, bedeutet dies noch nicht, dass sie dadurch leicht zu beheben sind. Dass dem nicht so ist und dass sich in solchen Fällen neue ethische Probleme und Fragestellungen auftun, wird eindrucksvoll von Leentjens et al. (2004) geschildert: Sie berichten von einem Patienten, der bald nach der Operation manisch wurde. Erst drei Jahre nach der Operation gelang eine Aufnahme in die Psychiatrie, da der Patient bis dahin immer dagegen gewesen war. Es wurde eine milde bis mäßige Manie diagnostiziert, die sich nach Ausschalten der Stimulation rasch zurückbildete und nach Reaktivierung der Stimulation binnen weniger Minuten wieder entstand. Eine Änderung der Stimulationsparameter war als Therapie nicht möglich, weil dies sofort zu unannehmbaren motorischen Symptomen führte. Der Versuch, bei geringerer Stimulation die AntiparkinsonMedikation zu erhöhen, schlug fehl, da der Patient selbst unter geringer Erhöhung der Medikamente manisch wurde. Es gelang auch nicht, die Manie pharmakologisch zu therapieren, da der Patient unter therapeutisch ausreichenden Dosen von Olanzapin mit oder ohne Kombination von Carbamazepin unter nicht akzeptablen Nebenwirkungen litt, eine Kombination von Valproat und Olanzapin bei einem adäquaten therapeutischen Spiegel keine Wirkung zeigte und Lithium aufgrund einer möglichen Verschlechterung des Tremors kontraindiziert war. Bei dem beschriebenen Patienten schien ein akzeptabler Kompromiss zwischen dem somatischen und dem psychiatrischen Zustand unmöglich. Aufgrund der manischen Symptomatik im stimulierten Zustand war der Patient nicht in der Lage, beispielsweise alleine seinen Haushalt zu führen. Im unstimulierten Zustand jedoch war er aufgrund der schweren Parkinson-Symptomatik ebenfalls nicht dazu in der Lage. Demnach wurde das klinische Dilemma auf eine Wahl zwischen zwei möglichen Optionen reduziert: Entweder würde der Patient vollkommen pflegebedürftig, aber mit klarem Verstand in ein somatisches Pflegeheim aufgenommen werden, oder er würde mit einer richterlichen Vollmacht in einem motorisch akzeptablen Zustand aber manisch in ein psychiatrisches Krankenhaus aufgenommen werden. In Anbetracht dieser beiden 111 Wahlmöglichkeiten stellten die Autoren u. a. folgende Überlegungen an: Aus der Sicht des Arztes muss die ethische Verpflichtung “Primum non nocere” jedes ärztlichen Handelns betrachtet werden. Der Arzt ist dazu verpflichtet, den Patienten vor Schaden zu schützen. Deshalb wird er z. B. bei einem Patienten, der aufgrund einer Behandlung mit einem Antidepressivum manisch wird, dieses Antidepressivum absetzen und nach einer anderen Therapiemöglichkeit suchen. Schaltet man jedoch in diesem Fall die Stimulation aus, um die manische Symptomatik zu beheben, wird dem Patienten dadurch geschadet, dass er aufgrund verschlechterter motorischer Symptomatik bettlägerig wird und wie oben geschildert steht keine gleichwertige Therapiealternative der motorischen Symptomatik zur Verfügung. Darf aber eine behandelbare iatrogene Komplikation wie die stimulationsinduzierte Manie akzeptiert werden, wenn die Behandlung zu einem besseren somatischen Zustand führt? Aus der Sicht des Patienten hat dieser ein Recht auf Selbstbestimmung und Autonomie. Die Frage ist jedoch, inwieweit der Patient fähig ist, eine Wahl zwischen den beiden o. g. Alternativen zu treffen. Während Deaktivierung der Stimulation besaß der Patient Krankheitseinsicht und Selbstreflexion; während aktivierter Stimulation bestand jedoch die manische Symptomatik mit Kritikstörung und Mangel an Selbstreflexion. Man könnte nun beschließen, den Patienten in unstimulierten Zustand eine Entscheidung treffen zu lassen über die weiter zu verfolgende medizinische Behandlungspolitik. Dieser Beschluss wäre dann sehr wahrscheinlich stark beeinflusst durch den Leidensdruck, den der Patient in diesem Zustand erfährt. Im weiteren Verlauf der Krankengeschichte des Patienten von Leentjens et al. (2004) entschied die Ethikkommission, dass das Procedere soweit als möglich auf dem Willen des Patienten basieren müsse und dass dies allein möglich wäre, wenn die Stimulation ausgeschaltet würde. In diesem Zustand gab der Patient unzweideutig an, dass ihm seine körperliche Gesundheit wichtiger sei als seine geistige Gesundheit, selbst wenn dies in einer dauerhaften psychiatrischen Aufnahme resultieren würde. Die Überlegungen zu einer vertretbaren Relation zwischen Risiko und Benefit sowie der geschilderte Fall von Leentjens et al. (2004) unterstreichen die Notwendigkeit, bei der 112 Tiefenhirnstimulation nach einem wahrhaften “informed consent” zu streben. Letztlich muss der Patient entscheiden, ob die Relation zwischen Risiko und Benefit für ihn tragbar ist. Dies impliziert, dass der Arzt sich optimal einsetzt, um durch eine Aufklärung über mögliche Vorteile und Risiken der Tiefenhirnstimulation in einem Dialog mit dem Patienten letzteren in die Lage zu versetzen, eine realistische Abwägung zu treffen. 113 D. ZUSAMMENFASSUNG Die Methode der Tiefenhirnstimulation wird zur Therapie verschiedener Erkrankungen, vor allem des M. Parkinson, eingesetzt. Immer wieder wird in Artikeln von unerwünschten psychiatrischen Veränderungen oder kognitiven Störungen berichtet, die nach der Elektrodenimplantation auftreten. Ziel der vorliegenden Arbeit war es, einen Überblick über Prävalenz, Verlauf und Therapie von psychiatrischen und kognitiven Störungen bei Tiefenhirnstimulation zu geben und mögliche Risikofaktoren bzw. Ursachen aufzudecken. Über pubmed und Ovid wurde in medline englische, deutsche, französische und niederländische Literatur bis einschließlich August 2004 in Hinblick auf folgende Suchbegriffe überprüft: deep brain stimulation and Parkinson/ obsessive compulsive disorder/ depression/ mania/ cognition. Die Auswertung ergab, dass die Prävalenz von Manien (9,6 %) und Psychosen (5 %) bei Stimulation des Ncl. subthalamicus höher, bei Stimulation von Globus pallidus internus und Thalamus dagegen niedriger ist als die Punktprävalenz dieser Erkrankungen in der Erwachsenenbevölkerung. Die Prävalenz sämtlicher depressiver Störungen bei Ncl. Subthalamicus-Stimulation liegt mit 11,6 % unter der Punktprävalenz von 15-30 % in der Erwachsenenbevölkerung. Die Prävalenz schwerer depressiver Erkrankungen liegt mit 3,3 % innerhalb der Punktprävalenz von Major Depressionen und Depressionen im engeren Sinne. Ein Vergleich der Prävalenz von Depressionen bei Ncl. subthalamicus-Stimulation mit den epidemiologischen Daten ist jedoch nur bedingt möglich, weil die Autoren zu 44 Patienten keinen Schweregrad der Depression angeben. Dagegen ist das Auftreten von Depressionen bei Stimulation des Globus pallidus internus und des Thalamus weit unter dem epidemiologischen Erwartungswert. Als Risikofaktoren bzw. mögliche Ursachen werden unbeabsichtigte Costimulation anderer Gehirnareale bzw. durch die Implantation verursachte Hirnschädigungen, höheres Alter der Patienten, Progression der ParkinsonErkrankung, psychosoziale Aspekte, post-operative Reduktion der Antiparkinson- Medikation und positive Vorgeschichte diskutiert. Kritisch muss angemerkt werden, dass die mangelnde Standardisierung des Vorgehens sowie dessen Dokumentation eine Interpretation der Ergebnisse erschwert. Trotz dieser Einschränkungen lässt sich jedoch sagen, dass vor allen Dingen die Stimulation des Ncl. subthalmicus mit dem Auftreten von Manien, Psychosen und - eventuell - von Depressionen behaftet ist. 114 E. ANHANG 1. Abkürzungsverzeichnis ARCI Addiction Research Centre Inventory: ein Fragebogen zur Erfassung der subjektiven Effekte von Drogen BAI Beck Anxiety Inventory BAS Brief Anxiety Scale BDI Beck Depression Inventory BRMAS Beck-Rafaelsen Mania Scale BPRS Brief Psychiatric Rating Scale BSI Brief Symptom Inventory: ein Fragebogen zur Selbstbeurteilung DSM -IV Diagnostic and Statistical Manual of Mental Disorder, 4th Edition GDS Geriatric Depression Scale GPi Globus pallidus internus HAD Hospital Anxiety and Depression Scale HDRS Hamilton Depression Rating Scale ICD International classification of diseases (durch die Weltgesundheitsorganisation) ISPC IOWA Scales of Personality Changes MADRS Montgomery and Asberg Depression Rating Scale MDBF Mehrdimensionaler Befindlichkeits-Fragebogen MINI Mini International Neuropsychiatric Inventory MMSE Mini Mental States Examination POMS Profile of Mood States SAS Social Adjustment Scale SD Standard Deviation/ Standardabweichung SCID II Structural Clinical Interview, Disorder II UPDRS Unified Parkinson´s Disease Rating Scale VIM (Ncl) ventralis intermedius YMRS Young Mania Rating Scale 2. Tabellarische Übersicht der verwendeten Artikel Tab.1: Verbesserung depressiver Symptomatik bei Tiefenhirnstimulation Autor Anzahl der Patienten 1 Zwangspatientin Postoperatives Follow-up Mind. 3 Monate postoperativ Test Gehirnareal Symptomatik nach OP Keine Angaben Capsula anterior unilateral Postoperativ deutliche Verbesserung Burchiel et al. 1999 6 ParkinsonPatienten 3,6 und 12 Monate nach OP Keine Angaben Ncl.subthala- Durch Selbstbeurteilung erfasste depressive micus /GPi, Symptome durchschnittlich verbessert um 49 % Verteilung und Seite nicht genannt Ausschlusskriterium: Psychiatrische Erkrankung CaparrosLefebvre et al. 1992 9 ParkinsonPatienten 4 –10 Tage nach OP MADRS Thalamus, unilateral 5 li, 4 re Verbesserung der Depression Keine Angaben Gabriels et al. 2003 2 von 3 Zwangspatienten Während des 1. BPRS Jahres nach OP oder nach 1 Jahr anteriore Schenkel der Capsula interna, bilateral Die meisten der in der Eingangsuntersuchung erhöhten Punktwerte der BPRS normalisierten sich am Ende des 1.postoperativen Jahres Vorgeschichte Fall 2: 3 Jahre vor der OP fast kontinuierlich hospitalisiert wegen Zwangserkrankung und Major Depression Anderson and Ahmed 2003 Funkiewiez et al. 2003 Mallet et al. 2002 50 ParkinsonPatienten 2 Zwangspatienten Nuttin et al. 1999 1 von 4 Zwangspatienten Pillon et al. 2000 63 ParkinsonPatienten Im Durchschnitt nach 12 Monaten 6 Monate nach OP und 9 bzw.15 Monate nach OP zum letzten Mal Keine Angaben BDI Nichtstrukuriertes und strukturiertes Interview, MADRS POMS 48 Pat:3 und 12 BDI Monate nach OP 15 Pat: 6 Monate nach OP Ncl. subthala- BDI-Punktwerte leicht verbessert micus, bilateral Ncl. subthala- Verbesserung im MADRS um 75 % bzw. micus, um 100 % bilateral anteriore Die Vitalitäts-Skala des POMS nahm während Schenkel der Stimulation zu Capsula interna,bilateral Ncl. subthala- Verbesserung des BDI micus, bilateral Vorgeschichte/ Ausschlusskriterien Vorgeschichte: Niemals Suizidversuch,aber am Tag vor der Aufnahme Suizidgedanken Ausschlusskriterien: gegenwärtige oder vergangene psychiatrische Erkrankung Keine Angaben Keine Angaben Keine Angaben Vorgeschichte: Keine signifikante Verschlechterung der Stimmung vor OP 116 Straits9 Troster et al. Parkinson2000 Patienten 3 Monate nach OP BDI, POMS Troster et al. 26 2003 ParkinsonPatienten Woods et al. 6 2001 ParkinsonPatienten Keine Angaben BDI 1 Jahr nach OP BDI GPi (ob unioder bilateral, ist nicht angegeben Ncl. subthalamicus, bilateral VIM-Ncl. des Thalamus, unilateral Verbesserung des BDI Ausschlusskriterium: Major Depression Verbesserung de BDI von 11.2 ± 6.7 zu 7.0 ± 4.9 Vorgeschichte: Keine Major Depression Signifikante Verbesserung des BDI Vorgeschichte: Kein Patient war je wegen Depression behandelt worden 117 Tab.2 : Verbesserung der Depression durch Stimulation und akute Verschlechterung der depressiven Symptomatik bei ausgeschalteter Stimulation Autor Anzahl der Patienten Funkiewiez et 1 von 77 al. 2004 Parkinsonpatienten Postoperatives Follow-up Mindestens 3 Jahre nach OP Test Lucas et al. 2000 1 Patient mit essentiellem Tremor POMS Nuttin et al. 2003 5 von 6 ZwangsPatienten 3 Monate nach OP (präoperativ keine Untersuchung mit POMS) zwischen 3 und 31 Monaten 1 Pat.:1bis 60 Mon. Keine Angaben HDRS, Well-being Skala Schneider et al. 2003 12 ParkinsonPatienten BDI BDI Gehirnareal Symptomatik nach OP Vorgeschichte/ Ausschlusskriterien Ncl. subthala- Zunahme depressiver Symptome bei „stim Vorgeschichte: Depression in Verlauf der micus, off“ Parkinsonerkrankung. bilateral Präoperativ: Elektrokrampftherapie in 6wöchigem Intervall. Zum Zeitpunkt der OP keine Depression VIM-Ncl., Selbstberichtete depressive Symptome waren Patient verneinte eine psychiatrische bilateral größer im „stim off „ (aber veränderten sich Vorgeschichte nicht mehr als 1 SD ) Anteriore Schenkel der Capsila interna, bilateral Ncl. subthalamicus, bilateral 5 Pat.: Verbesserung bei „stim on“ 1 Patient: Depression nicht genau definiert Zunahme depressiver Symptome bei „stim off“ Vorgeschichte:2 Patienten mit Major Depression Ausschlusskriterien: gegenwärtige oder vorausgegangene psychotische Erkrankung Vorgeschichte: keine relevanten psychiatrischen Symptome Ausschlusskriterium: diagnostizierte psychiatrische Erkrankung 118 Tab.3: Keine signifikante Veränderung depressiver Symtomatik bei Tiefenhirnstimulation Autor Anzahl der Patienten 13 Parkinsonpatienten Postoperatives Follow-up 3 und 6 Monate nach OP Test Gehirnareal Symptomatik nach OP BDI GPi, bilateral. Keine signifikante Veränderung des BDI Brusa et al. 2001 6 Parkinsonpatienten 6 Monate nach OP BDI, visuelle Analog-Skala für Depression Castelli et al. 2004 31 Parkinsonpatienten 12 Parkinsonpatienten 6 Parkinsonpatienten 9-12 Monate nach OP BDI 3Pat.:Ncl.subKeine signifikante Veränderung der Stimmung Keine Angaben thalamicus, bilateral 3 Pat.: GPi, bilateral Ncl.subthalami- Abnahme der BDI-Punkte, aber keine Ausschlusskriterium: Major Depression cus, bilateral signifikante Veränderung 3 Monate nach OP MADRS Ncl.subthalami- Keine Veränderung cus, bilateral 2 Monate nach 1.OP(unilateral) und 3 Monate nach 2.OP(bilateral) BDI, POMS GPi , bilateral Ardouin et al. 1999 Dujardin et al. 2004 Fields et al. 1999 Fields et al. 2003 35 Patienten mit essentiellem Tremor Fontaine et al. 2004 1 Parkinsonund ZwangsPatient Halbig et al. 12 2004 Lopiano et 16 al. 2001 Parkinsonpatienten 1Pat.:22 Monate zw.Untersuchung nach OP 1 und OP 2 3,26 (0,94) BDI, POMS Monate nach OP 6 Monate nach der OP, ein letztes Mal nach 12 Monaten Nichtstrukturiertes und strukturiertes Interview, MADRS Ncl. subthalamicus, bilateral Keine Angaben BSI, MDBF 3 Monate nach OP BDI, SCID II Ncl. subthalamicus, bilateral Ncl. subthalamicus, bilateral Depression war kein Ausschlusskriterium Tendenzielle Verbesserung in BDI und POMS, aber nicht signifikant Ausschlusskriterium: schwere psychiatrische Beeinträchtigungen mit Ausnahme Minor Depression Obwohl Depression getestet wurde, wird kein Ergebnis erwähnt. Ich gehe davon aus, daß keine Veränderung der depressive Symptomatik vorlag. Erwähnt wird nur, daß sich die Tension/Anxiety Subscales des POMS nach 12 Monaten leicht verbesserten. Keine Veränderung der Stimmung; die präoperative antidepressive Medikation wurde beibehalten Ausschlusskriterium: Schwere psychiatrische Erkrankungen; Depression mittels BDI getestet 1.Elektrode: 5 Pat.: links 1 Pat.: rechts 2.Elektrode: mind.3 Monate später VIM-Ncl. des Thalmus, unilateral 30 Pat.: links 5 Pat.: rechts Vorgeschichte/ Ausschlusskriterien Vorgeschichte: Patienten wiesen präoperativ keine signifikante Verschlechterung der Stimmung auf Keine signifikante Veränderung Keine signifikante Veränderung in neuropsychologischen Tests Vorgeschichte: Positive Eigen- und Familienanamnese für affektive Erkrankungen: dysthymes Temperament, 1983 hypomane Episode. Mutter: unipolare Depression, Suizid Ausschlusskriterium: Depression (BDI>15) Ausschlusskriterium: Depression 119 Moretti et al. 2002 2 Parkinsonpatienten 3 Monate und 8 Monate nach OP Zung-selfevaluation für Depression Ncl. subthalamicus, bilateral Moretti et al. 2003 9 Parkinsonpatienten 1,6, und 12 Monate nach der OP Zung- self evaluation für Depression Ncl. subthalamicus, bilateral Morrison et al. 2004 17 Parkinsonpatienten GDS Ncl. subthalamicus, bilateral Perrozo et al. 2001 a 15 Parkinsonpatienten 2 Untersuchungen im Durchschnitt 13,3 (7,8) Wochen nach OP. Im Durchschnitt lagen 9,7 (7,4) Wochen zw. den Untersuchungen 6 Monate nach OP BDI, SCID II, psychologische Interviews Ncl. subthalamicus, bilateral StraitsTroster et al. 2000 7 Parkinsonpatienten 3 Monate nach OP BDI, POMS Troster et al. 1997 9 Parkinsonpatienten 3 Monate nach OP Troster et al. 1998 1 Parkinsonpatienten Keine Angaben Vingerhoets 20 et al. 1999b Parkinsonpatienten Volkmann 11 et al. 2001 Parkinsonpatienten 3 Monate nach OP 6 und 12 Monate nach OP Thalamus (ob uni- oder bilateral ist nicht angegeben) Stimmung GPi, unilateral, wurde 6 Pat: links evaluiert, kein 3 Pat: rechts spezif. Test angegeben Stimmung Thalamus wurde unilateral, evaluiert, kein Seite wird nicht spezif. Test genannt angegeben Kognitive/ GPi, unilateral affektive Sub- 13 Pat: links skala des BDI 7 Pat: rechts Keine GPI (ob uniAngaben oder bilateral wird nicht angegeben Obwohl Depression getestet wurde, wird kein Ergebnis erwähnt; daher gehe ich davon aus, dass keine Veränderung depressiver Symptomatik vorlag Obwohl Depression getestet wurde, wird kein Ergebnis erwähnt; daher gehe ich davon aus, dass keine Veränderung depressiver Syptomatik vorlag Keine signifikante Veränderung Keine Angaben Keine signifikanten Unterschiede prä- und postoperativ. In den psychologischen Interviews ergab sich eine Verschlechterung der Stimmung postopertiv nach einer anfänglichen Verbesserung Keine signifikante Veränderung des BDI Ausschlusskriterium: Major Depression Tendenzielle Verbesserung, aber keine signifikante Veränderung Keine Angaben Keine Angaben Depression war kein Ausschlusskriterium Ausschlusskriterium: Major Depression Obwohl Depression getestet wurde, wird kein Keine Angaben Ergebnis erwähnt; daher gehe ich davon aus, dass keine Veränderung depressiver Symptomatik vorlag Keine signifikante Veränderung Depression war kein Ausschlusskriterium Keine Veränderung Keine Angaben 120 Tab.4: Auftreten leichter depressiver Symptomatik bei Tiefenhirnstimulation Autor Anzahl der Patienten 1 von 77 Parkinsonpatienten Postoperatives Follow-up Mindestens 3 Jahre nach OP Test Gehirnareal Symptomatik nach OP/ Therapie BDI Ncl. subthalamicus, bilateral Depressive Symptome 6 Wochen nach Absetzen dopaminerger Medikamente. Suizidgedanken. Mit Venlafaxin (150 mg) und Levodopa (200 mg ) weiterhin depressiv für 3 Monate. Nach Absetzen von Venlafaxin und Behandlung mit 15 mg Bromocriptin und 200 mg Levodopa rasche und bleibende Besserung für die nächsten 2 Jahre 1 Parkinsonpatienten 14 von 82 Parkinsonpatienten Mindestens bis 1 Jahr nach OP Keine Angaben Ncl. subthalamicus, bilateral Depression entwickelte sich 2 Monate nach OP. Schwere Demenz 1 Jahr nach OP Keine Angaben Im Durchschnitt 18 ± Monate nach OP Keine Angaben Ncl.subthalamicus, (ob unioder bilateral wird nicht angegeben) Keine Angaben Koller et al. 2001 1 von 49 Patienten mit essentiellem Tremor Keine Angaben VIM-Ncl. des Thalamus, unilateral , 23 Pat.: links 2 Pat.: rechts Molinuevo et al. 2000 1 von 15 Parkinsonpatienten 3 von 10 Parkinsonpatienten 3 und 12 Monate nach OP; dann jährlich. Durchschnitts Follow-up 40,2 ± 14,7 Mon. 11 Pat. hatten DurchschnittsFollow-up von nur 11 Monaten bis 6 Monate nach OP Die 14 Patienten benötigten postoperativ keine dopaminerge Therapie. Dennoch wurden Dopaminagonisten oder Levodopa wieder 16 ± 14 Wochen nach der OP eingeführt (levodopaäquivalente Dosis 250 ± 134 mg/d) um eine leichte depressive Symptomatik zu verbessern Depression war leicht in den Griff zu bekommen durch Anpassung der Stimulationsparameter Keine Angaben Ncl.subthalami- Depression hielt bis zur letzten Untersuchung 6 cus, bilateral Monate nach OP an Keine Angaben 3 Monate nach OP MINI, HAD, SCID II Ncl.subthalami- Nur 1 Patient wurde postoperativ mit Antidepressiva cus, bilateral behandelt Vorgeschichte: milde Depression bei 1 Patienten schon einige Monate vor OP Ncl.subthalami- Depression verschwand nach Abbruch der cus, bilateral Stimulation Ausschlusskriterium: Unbehandelte Depression Ausschlusskriterium: schwere psychiatrische Komplikation Funkiewiez et al. 2004 Hariz et al. 2000 Houeto et al. 2003 Monaca et al. 2004 Moro et al. 1999 Ostergaard et al. 2002 1 von 7 Parkinsonpatienten 2 von 26 Parkinsonpatienten 9 Monate nach der OP Keine Angaben 1,3,6,12 Monate UPDRS nach OP, danach part 1 ein- oder zweimal pro Jahr Ncl.subthalamic Depression entwickelte sich 4 Wo. nach OP. us, bilateral Behandlung mit Citalopram für 1-2 Monate. Depression verschwand Davor: Vorgeschichte/ Ausschlusskriterien Vorgeschichte: Stimmungsschwankungen während Levodopa-Therapie. Bald nach Erkrankungsbeginn entwickelte er eine Manie mit Hypersexualität unter Bromocriptin. Absetzen der Medikamente provozierte eine Depression Keine Angaben Ausschlusskriterium: signifikante Depression (lag bei keinem Patienten vor) 121 Pahwa et al. 2003 1 von 35 Parkinsonpatienten Thobois et al. 2002 5 von 18 Parkinsonpatienten 33 Pat. nach 12 Monaten, 19 Pat. nach 27,8 Monaten 6 und 12 Monate nach OP Keine Angaben UPDRS part 1, wies im Durchschnitt keine signifikante Veränderung auf 2 Pat: unilaterale Thalamotomie 3 Pat (davon 1 aus den obigen 2): unilaterale Elektrode in den VIM-Ncl. des Thalamus wegen Tremor. Die Elektrode im VIM-Ncl. wurde vor OP entfernt Ncl. subthalamicus, bilateral Ncl. subthalamicus, bilateral 1 Patient hatte 8 Jahre zuvor linksseitige Elektrode im VIM-Ncl., aktuell nicht mehr suffizient. Es wird nicht erwähnt, ob dieser Patient depressiv wurde. Depression war durch Anpassung der Stimulationsparameter in den Griff zu bekommen Ausschlusskriterium: schwere psychiatrische Erkrankung Alle Patienten außer einem besserten sich spontan oder nach Behandlung mit einem SSRI in Kombination mit Psychotherapie Vorgeschichte: 2 von 5 Patienten waren vor kurzem depressiv gewesen, zum Zeitpunkt der OP aber nicht depressiv Ausschlusskriterium: Major Depression, diagnostiziert durch BDI 122 Tab.5: Auftreten moderater Depression bei Tiefenhirnstimulation Autor Houeto et al. 2000 Jahanshahi et al. 2000 Rodriguez et al. 2004 Anzahl der Patienten 2 von 23 moderate D. und 2 Patienten schwere D. (23 Parkinsonpatienten) 2 von 10 ParkinsonPatienten 1 von 10 ParkinsonPatienten Postoperatives Follow-up 6 Monate nach OP, bei 11 Pat.: 12 Monate nach OP Test Gehirnareal Symptomatik nach OP/ Therapie Keine Angaben Ncl. subthalamicus, bilateral, Depression entwickelte sich in den ersten 2 Monaten nach OP; bei 3 von 4 Patienten verschwand die Depression nach 2-monatiger Behandlung mit SSRI Zw. 2 und 26 BDI Monate nach OP: Ncl. subthalamicus, bilateral Keine Angaben Keine Angaben Ncl. subthalamicus- Gruppe:11,7 (7,7) Monate GPi, bilateral Keine Angaben Keine Angaben GPi- Gruppe 6,0 (5,8) Monate 1 und 4 Jahre nach OP Keine Angaben (unklar, aus welcher Gruppe die Depressiven stammen) Ncl. subthalamicus, bilateral Vorgeschichte Ausschlusskriterien Vorgeschichte: Kein Patient hatte eine Major Depression 123 Tab.6: Auftreten schwerer Depression und Suizidalität infolge Depression bei Tiefenhirnstimulation Autor Anzahl der Patienten Berney et al. 6 von 24 2002 Parkinsonpatienten Doshi et al. 2002 Durif et al. 1999 3 von 31 Parkinsonpatienten Postoperatives Follow-up Nachdem Stimulationspara meter und Medikation für mind. 2 Wochen stabil waren, wurden die Patienten nach 3 und 6 Monaten untersucht 1 Jahr nach OP Test Gehirnareal Symptomatik nach OP/ Therapie MADRS, HDRS, UPDRS part 1 Ncl. subthalamicus, bilateral Bei 5 von 6 Patienten im 1. Monat nach OP signifikante Verschlechterung bis in den schweren depressiven Bereich, 3 Patienten suizidal. Therapie: Alle 6 Patienten benötigten Antidepressiva Zur Dauer: keine Angaben UPDRS Ncl. subthalamicus, bilateral 1 Patient schwere Depression mit Suizidalität. Symptome entwickeln sich schrittweise nach OP. Peak nach 6 Monaten > Suizidversuch. Therapie: Fluoxetin bis 1 Jahr nach OP 1 von 6 Parkinsonpatienten 3 von 98 Parkinsonpatienten 6 von 77 Parkinsonpatienten 1,3 und 6 Monate nach OP Keine Angaben GPi, bilateral 1 Jahr nach OP Keine Angaben Mindestens 3 Jahre nach OP BDI Ncl. subthalamicus, bilateral Ncl. subthalamicus, bilateral 2 von 23 Parkinsonpatienten Follow-up für 6 Monate, bei 11 Patienten für 11 Monate Keine Angaben Houeto et al. 7 von 24 2002 Parkinsonpatienten 19 Monate nach OP (SD 11) (range 3-38) Ncl. subthaMINI lamicus, (franz.Verbilateral sion), nicht standardisiertes psycholo- Funkiewiez et al. 2001 Funkiewiez et al. 2004 Houeto et al 2000 Ncl. subthalamicus, bilateral 2 Patienten: Stimulationsabhängige akute Depression Schwere Depression begann innerhalb des 1 Monats nach OP und verbesserte sich deutlich unter dauerhafter Therapie mit Clomipramin Suizidversuch 4 Patienten: Suizidversuch 1 Patient starb durch Suizid 1 Patient schwere Depression Suizidversuche nach 2,3,5,6,36 Monaten Therapie: zeitweilige Hospitalisierung 2 Patienten mit schwerer Depression (bei 1 Pat. Suizidversuch) (bei 2 Patienten > moderat) Depression entwickelte sich in den ersten 2 Monaten nach OP. Bei 3 von 4 Patienten verschwand sie nach 2monatiger Therapie mit SSRI 5 Pat.: depressive Episode mit Suizidalität 2 Pat.: Suizidalität Therapie: Pat.3:Behandlung der Depression mit Psychotherapie und Antidepressivum – abgebrochen wegen Suizidalität wieder aufgenommen Vorgeschichte/ Ausschlusskriterien Vorgeschichte :von 24 Patienten hatten 9 eine Major Depression Ausschlusskriterium: psychiatrische Erkrankung definiert mittels DSM-IV Vorgeschichte: keine Depression Keine Angaben Keine Angaben Keine Angaben Vorgeschichte: keine schwere Depression Vorgeschichte: 12 von 24 Patienten vor der OP depressive Episode Ausschlusskriterium: bei keinen Patienten signifikante psychiatrische Erkrankung 124 gisches Interview SAS, ISPC Krack et al. 2003 Linazasoro 2003 Thobois et al. 2002 1 von 48 Parkinsonpatienten 1, 3 und 5 Jahre nach OP 2 von 18 Parkinsonpatienten 6 Monate nach OP 1 von 18 schwere D. 6 und 12 Monate nach OP 5 von 18 leichte D. (18 Parkinsonpatienten) BDI Keine signifikante Veränderung Keine Angaben UPDRS part 1, BDI Pat.5: erfolglose Therapie wd. 3Monate mit Paroxetin (20 mg) Erfolgreiche Therapie nach 1 Monat Bromocriptin Ncl. subthala- Beginn: mindestens 3 Monate vor OP micus, Suizid 6 Monate nach OP/ Durchschnitts-BDI bilateral dennoch ohne signifikante Veränderung Ncl. subthalamicus (ob uni- oder bilateral wird nicht berichtet) Ncl. subthalamicus, bilateral. 1 von 18 (unklar welcher) hatte 8 Jahre zuvor Elektrodenimplantation im linken Ncl.VIM des Thalamus, zum Zeitpunkt der OP inaktiv Therapie: Keine Angaben Schwere Depression Vorgeschichte: Der Patient war schwer depressiv und hatte 3 Mon. vor OP Suizidgedanken Ausschlusskriterium: akute schwere psychiatrische Erkrankung Keine Angaben Therapie: Keine Angaben Schwere wahnhafte Depression ohne signifikante Veränderung des UPDRS part 1Durchschnittswertes Therapie: stationäre psychiatr. Behandlung > ohne Besserung nach 6 Monaten. Keine Angaben zum Befinden nach 12 Monaten Vorgeschichte: 2 von 5 Patienten, die nach der OP depressiv waren, waren es schon einmal, allerdings nicht zum Zeitpunkt der OP Ausschlusskriterium: Major Depression, diagnostiziert durch BDI 125 Tab.7: Auftreten von Depressionen bei Tiefenhirnstimulation, deren Schweregrad nicht definiert wird Autor Anzahl der Patienten 4 von 30 Parkinsonpatienten Postoperatives Follow-up Keine Angaben Test Gehirnareal Keine Angaben Ncl. subthalamicus, bilateral Burn and 16 von 137 Troster 2004 Parkinsonpatienten Dujardin et 2 von 9 al. 2001 Parkinsonpatienten Funkiewiez 1 von 77 et al. 2004 Parkinsonpatienten Ghika et al. 1 von 6 1998 Parkinsonpatienten Keine Angaben Keine Angaben 3 Monate und 1 Jahr nach OP Keine Angaben Bejjani et al. 1999 Krack et al. 2003 8 von 49 Parkinsonpatienten MartinezMartin et al. 2002 3 von 17 Parkinsonpatienten Nuttin et al. 2003 1 von 6 Zwangspatienten Vesper et al 2002 2 von 40 Parkinsonpatienten Volkmann et al. 2001 8 von 16 Parkinsonpatienten Symptomatik nach OP/ Therapie Anhaltende Depression Therapie: durch Änderung der Stimulationsbedingungen oder der -seite keine Besserung. Besserung durch Antidepressiva Ncl. subthaDepression, lamicus,bilateral Schweregrad nicht benannt Ncl. subthalamicus, bilateral Ncl, subthalamicus, bilateral GPi, bilateral Depression, Schweregrad unbenannt, Fortbestehen auch nach 1 Jahr. Therapie: keine Angaben Mindestens 3 BDI Depression, Schweregrad unbenannt, aber im Jahre nach OP Durchschnitt signifikante Verbesserung des BDI Therapie: vorübergehende Hospitalisierung 1,3,6,12,15,18, BDI, Verschlechterung des BDI, wobei 24 Monate nach Habib´s scale neuropsycholog. Evaluation einschließlich BDI der OP (franz. Skala für nur einmal 3 Monate nach OP durchgeführt wurde Abulie) Therapie: keine Angaben 1, 3, 5 Jahre BDI Ncl. subthalaVorübergehende depressive Episode, keine nach OP micus, signifikante Veränderung der BDIbilateral Durchschnittswerte 1 Pat: innerhalb 3 Monate nach OP 7 Pat: 3 Monate bis 5 Jahre nach OP Therapie: Ansprechen auf Antidepressiva 4 Tage und 6 HDRS Ncl. subthalaVorübergehende depressive Episode. Monate nach micus (ob uni6 Monate nach OP signifikante Abnahme der OP oder bilateral, Hamilton Depression Scale verglichen mit ist unklar) Eingangsuntersuchung zwischen 3 und BDI Anteriore 1 Patient: hoher BDI-Wert sowohl während wie 31 Monate Schenkel der ohne Stimulation Capsula interna (5 Patienten: Depression unter „stim off“, Verbesserung durch „stim on“) Therapie: keine Angaben 1,6,12 Monate Keine Angaben Ncl. subthalami- Verschlechterung einer seit kurzen bekannten nach OP cus, bilateral Depression >Entstehen einer progredienten Demenz Therapie: bei 1 Patienten Antidepressiva 6 und 12 Keine Angaben Ncl.subthalaDepression, Schweregrad nicht benannt Monate nach micus ( ob uniOP oder bilateral Therapie: keine Angaben ist unklar) Vorgeschichte/ Ausschlusskriterien Keine Angaben Keine Angaben Keine Angaben Keine Angaben Keine Angaben Ausschlusskriterium: akute schwere psychiatrische Erkrankung Ausschlusskriterium: Major Depression Vorgeschichte: 2 Patienten zum Zeitpunkt der OP Major Depression Ausschlusskriterium: gegenwärtige oder vergangene psychotische Erkrankung Vorgeschichte: seit kurzem bekannte Depression Ausschlusskriterium: unbehandelte Depression Keine Angaben 126 Tab.8: Akute stimulationsinduzierte Depression bei Tiefenhirnstimulation Autor Bejjani et al. 1999 Stefurak et al. 2003 Anzahl der Patienten 1 von 30 Parkinsonpatienten 1 Parkinsonpatient Postoperatives Follow-up 8 Monate nach OP Test Areal Symptomatik nach OP/ Therapie Keine Angaben Ncl.subthalamicus, bilateral. Kontact 0 der linken Elektrode war in der zentralen substantia nigra lokalisiert einschl. eines Teiles der Pars compacta und der Pars reticulata Akute stimulationsabhängige Depression, verschwand in weniger als 90 sec, nachdem die Stimulation des Kontact 0 gestoppt wurde, 8 Monate nach der OP löste die Stimulation von Kontact 0 abermals eine akute –aber schwächere – Traurigkeit aus Keine Angaben, Keine Angaben nach 6 Monaten Neupositionierung der rechten Elektrode Kontakt 1 und 2 der linken Elektrode, die für die kontinuierliche Antiparkinsontherapie verwendet wurden, war im Ncl. subthalamicus lokalisiert Ncl.subthalamicus bilateral. Analyse der rechten Elektrode ergab folgende Koordinaten: x,y,z:14 –14 - 8, lokalisiert mitten in Faserzügen der weißen Substanz, die den Ncl. subthalamicus umgeben. Nach 6 Monaten neu plaziert mehr in den Ncl. subthalamicus Akute depressive Beeinträchtigung bei Stimulation der untersten Kontakte (0, -1) der rechten Elektrode (Parameter: 2,5V/ 60 microsec, 130 Hertz) binnen 30 sec nach Anschalten. Nach Abbruch der Stimulation sofortige Rückkehr zur Ausgangsstimmung. Nach Neupositionierung motorischen Verbesserung ohne emotionale Beeinträchtigung Vorgeschichte/ Ausschlusskriterien Vorgeschichte: Keine psychiatrische Erkrankung, Keine Depression selbst nach Beginn der Parkinsonerkrankung Keine Stimmungsschwankungen unter Levodopa-Therapie Signifikante psychiatr. Vorgeschichte: Mit 12 Jahren 1. Depression Über 22 Jahre immer wiederkehrende Depression Zum Zeitpunkt der Parkinsondiagnose: Depression und allgemeine Angsterkrankung Unter Parkinsontherapie mit Amantadin kurzzeitig Panikattacken. 2 Jahre vor der OP: Stimmung stabil, Patientin in klinischer Remission. Psychiatr. Evaluation 4 Monate vor OP ergab keine aktiven psychiatrischen Symptome 127 Tab.9: Sonstige Autor Okun et al. 2003 Anzahl der Patienten 9 Postoperatives Follow-up Keine Angaben Test Gehirnareal Symptomatik nach OP Visuelle StimmungsAnalog-Skala Stimulation der optimalen Stelle: 5 Patienten: Ncl. subthalami- 4 von 5 Ncl. subthalamicus- Patienten: cus, unilateral Verbesserung von 1-2 Subskalen 2 von 5:Verschlechterung von 1 Subskala 4 Patienten: 2 von 4 GPi- Patienten: Verbesserung in 4 GPi, unilateral Subskalen Verschlechterung von 1 Subskala Stimulation dorsal oder ventral der optimalen Stelle: Bei den Ncl subthalamicus -Patienten verschlechterten sich etwas mehr Subskalen als bei GPi- Patienten Vorgeschichte/ Ausschlusskriterien Ausschlusskriterium: Screening mit HDRS und GDS, um aktive psychiatrische Erkrankungen auszuschließen 128 Tab.10: Lachen, Euphorie, aggressives Verhalten Autor Anzahl der Patienten Bejjani et al . 1 2002 Parkinsonpatient postoperatives Follow-up Keine Angaben Test Gehirnareal Keine Angaben Ncl. subthala- Bei Applikation der Teststimulation 2,2mm medial micus, von der definitiven therapeutischen Elektrode bilateral entwickelte der Patient innerhalb von Sekunden ein aggressives Verhalten von ca. 5 min Dauer. Keine Vorgeschichte für psychiatrische Erkrankungen außer sexuelle Abnormalität (Exhibitionismus, erhöhte Libido), die im Laufe der Parkinsonerkrankung verschwand. Die Stimulation wurde sofort beendet und 50 mg Propofol injiziert. Das aggressive Verhalten trat nicht mehr auf Bejjani et al. 1999 Keine Angaben Keine Angaben Ncl. subthala- Vorübergehende Euphorie mit Lachen micus, bilateral Ncl. subthala- Eine einzige Episode von impulsiver Aggressivität micus, bilateral Keine Angaben Funkiewiez et al. 2003 2 von 30 Parkinsonpatienten 1 von 50 Parkinsonpatienten Durchschnittlich ARCI, ein 12 Monate nach Falsch/richtigOP Fragebogen zur Differenzierung von 4 verschiedenen psychoaktiven Medikamenten bzw. Drogengruppen Houteo et al. 18 von 24: 6 Monate nach SAS 2002 transiente OP MINI Euphorie ISPC 15 von 24: Nicht-stanemotionale dardisiertes Hyperreakti Interview vität (24 Parkinsonpatienten) Krack et al. 2 Keine Angaben Keine Angaben 2001 Parkinsonpatienten Ncl.subthala micus, bilateral Symptomatik nach OP Keine Angaben Bei 18 Patienten moderate Euphorie, Therapie nicht notwendig bei 15 Patienten moderate emotionale Hyperreaktivität, vorübergehend, wenige Tage nach OP. Ehepartner berichten, daß die Emotionalität zunahm und von trivialeren Faktoren ausgelöst wurde als vor der OP Patient 1:Das Lachen entstand, nachdem die Pulsspanne auf 90 microsec auf beiden Seiten umgestellt worden war. Nach Beendigung der linken Stimulation verschwand das Lachen innerhalb von Minuten, nach Beendigung der bilateralen Stimulation unmittelbar. Bei Absenken auf 60 microsec verschwanden die Lachanfälle. Neuerliches 3 Jahre zuvor:Thala- Heraufsetzen auf 90 microsec nach 2 Monaten motomie links löste Lachanfälle aus. (4 Monate nach OP: Hypomanie diagnostiziert, Pat.1:Ncl.sub thalamicus,bilateral Pat.2:Ncl.sub -thalamicus, unilateral (re) Therapie Ausschalten der bilateralen Stimulation auf Wunsch des Patienten 129 Kumar et al. 1999 2 von 100 Parkinsonpatienten Keine Angaben Keine Angaben Romito et al. 1 von 30 2002 Parkinsonpatienten 1 Woche und 1, 3 ,6, 12 Monate nach OP Keine Angaben DSM-IV Sensi et al. 2004 1 Parkinsonpatient Vor OP u. nach 6 Mon.: BDI, NeuroPsychiatric Inventory, Cognitive Behavioral Assement 4 Jahre nach OP: vorübergehende Depression) Patient 2: während chronischer Stimulation emotional labiler als vor der OP. Bei Erhöhung der Stimulationsamplitude auf 5,0 V Gelächter, das erst bei Absenken auf 3,2 V aufhörte Bei einem 2. Versuch mit 5,0 –5,5 V 1 Woche später erneut Gelächter Stufenweise Erhöhung der Stimulationsamplitude 1 Pat: Ncl. löste Wohlbefinden aus, weitere Erhöhung subthalamicus, unilateral fröhliches Gelächter. Das Lachen hielt für einige Minuten an nach Absenkung der Amplitude oder Ausschalten der Stimulation. 1 Pat: Ncl. Identische Stimulationsparameter lösten abermals subthalamicus, bilateral Lachen aus Ncl. subthaTransiente Euphorie lamicus, bilateral Ncl. subthalamicus, bilateral Wechsel von Momenten der Euphorie und der Aggressivität. Aggression entwickelte sich innerhalb von 48 Stunden nach Stimulationsbeginn von verbaler zu körperlicher Aggression Testsituation: In 4 Varianten: stim on/med on; stim on/ med off; Patient bat um Beendigung der Stimulation Ausschalten der Stimulation Keine Therapie notwendig Antipsychotikum Quetiapin. Nach einiger Zeit wurde das Antipsychotikum abgesetzt: Aggressivität trat erst auf, wenn die Stimulationsamplitude jeden Kontaktes der linken Elektroden auf über 3,3, V erhöht wurde. stim off/ med on; stim off/ med off) Aggression: Getestet mittels Buss-Durkee Hostility Inventory Die Erhöhung der Stimulationsamplitude jeden Kontaktes der linken Elektrode(nicht der rechten) sowohl uni- wie bipolar >2,4-2,55 V löste aggressives Verhalten aus. Erhöhung der Spannungsamplitude auf 4 V von jeglichem Kontakt löste Aggression aus. Abschalten der linken Elektrode beendete Aggression innerhalb Minuten. Buss-Durkee Hostility Inventory Score: bei stim off 32/75 / bei stim on 69/75 6 Monate nach OP wurde die Stimulationsamplitude auf 3,0 V festgesetzt, die dopamine Medikation auf 30% der präoperativen Dosis gesenkt, Antipsychotikum komplett abgesetzt 130 Tab.11: Hypersexualität, abnormales sexuelles und enthemmtes Verhalten Autor Houeto et al.2002 Anzahl der Patienten 2 von 24 Parkinsonpatienten postoperatives Follow-up 6 Monate nach OP Test Gehirnareal Symptomatik nach OP SAS, MINI ISPC, nichtstandardisiertes Interview Ncl. subthala- Patient 1: 4 Monate nach OP berichtet Ehefrau von abnormalen sexuellem micus, Verhalten mit Exhibitionismus und erhöhter bilateral Libido > Scheidung Interesse an Glücksspielen Patient 2: Stimmungsschwankungen von Aggressivität zu depressiver Verstimmung, Spielsucht, abnormales sexuelles Verhalten/Exhibitionismus Therapie Patient 1: Keine Angaben Patient 2: 4-monatige Therapie mit Lithium und mehrere Modifikationen der Stimulationsparameter ohne Erfolg, ebenso Clozapin und Psychotherapie erfolglos Kleiner1 von 25 Fishman et al. Parkinson2003 patienten Keine Angaben Keine Angaben Ncl.subthalamicus, bilateral Hypersexualität Keine Angaben Roane et al. 2002 Keine Angaben Keine Angaben GPi , unilateral (li), früher: Pallidotomie unilateral, rechts 5 Monate nach OP: hypersexuelles Verhalten, Clozapin, das 4 Monate nach der OP abgesetzt worden war, wurde wiedereingeführt. Ncl. subthalmicus, bilateral Hypersexualität 1 Parkinsonpatient Romito et al. 2002 1 von 30 Parkinsonpatienten Varma et al. 2003 1 von 7 Parkinsonpatienten 1 Woche und 1,3,6,12 Monate nach der OP 6 Monate nach OP DSM-IV aber auch Ängste, Mit 50 mg/d Clozapin verschwand das Stimmungsschwankungen, motorische hypersexuelle Verhalten, die anderen Unruhe, Schlaflosigkeit, gesteigerten Appetit, Symptome nahmen ab Verlangen nach Levodopa, zeitweise Apathie Kein Test zur Ncl. subthala- Enthemmtes Verhalten Evaluierung micus, bilateral Keine Angaben Verbesserung durch Reduktion von Levadopa 131 Tab.12: Hypomanie, Manie und affektive bipolare Störung Autor postoperatives Follow-up Bis über 3 Jahre nach OP Test Gehirnareal Berghmans et al. 2004 Anzahl der Patienten 1 Parkinsonpatient YMRS Ncl. subthalami- Leichte bis mäßige Manie (YMRS=17) bald cus, bilateral nach OP Stationäre Aufnahme in die Psychiatrie gelang erst 3 Jahre nach OP Beim stationären Aufenthalt wurde die Stimulation abgeschaltet: Die Manie bildete sich schnell zurück (YMRS = 6) > aber unannehmbare motorische Symptome. Pharmakologische Behandlung des Tremor mit leicht erhöhter Carbidopa-, Levodopa-, Ropinirol- Dosis verstärkt Manie Lithium war kontraindiziert wegen des Tremor Pharmakologische Behandlung der Manie: Olanzapin,2,5 mg/d >Gleichgewichtsprobleme. Olanzapin kombiniert mit Valproat bzw. mit Carbamazepin verbesserte die Manie nicht bzw. bereitete Gleichgewichtsprobleme Abschalten der Stimulation als einzige effektive Therapie der Manie wurde vom Patienten abgelehnt Funkiewiez et al. 2004 5 von 77 Parkinsonpatienten Mindestens 3 Jahre nach OP BDI Bei 4 Patienten spontane Rückbildung Herzog et al. 2003 1 Parkinsonpatient Bis 3 Jahre nach OP Ncl. subthalami- Hypomanie innerhalb der ersten 3 Monate cus, bilateral nach OP bei allen 5 Patienten Bei 1 Patienten trat über 3 Jahre periodisch hypomanes Verhalten auf Ncl. subthalami- 7Tage nach Beginn der Stimulation setzte cus bilateral eine von der Patientin als abnormal empfundene gehobene Stimmung ein. Vor 10 Jahren 26 Tage nach OP entwickelte sich aus der Thalamotomie Hypomanie eine Manie mit psychotischen rechts Symptomen 49 Tage nach OP: depressive Symptomatik dominierte BRMAS: Präoperativer Wert geschätzt: auf 6/44, In manischer Periode gemessen: 25/44 Symptomatik nach OP In den nächsten 3 Monate: bipolare Symptomatik bildet sich zurück Bis 3 Jahre nach OP: keine weitere manische oder depressive Episode Houeto et al. 2002 1 von 24 Parkinsonpatienten 6 Monate nach OP SAS, MINI,ISPC Nichtstandardisiertes Interview Ncl. subthalami- Hypomanie begann 1 Monat nach OP und cus, bilateral bildete sich innerhalb von 2 Wochen zurück Therapie Bei 1 Patienten: keine Angaben zur Therapie Bisherige Antiparkinsonmedikation abgesetzt (Perigolid, Selegilin, Amantadin), statt dessen 5 mal 150mg L-Dopa/d. Therapie der Hypomanie/Manie mit niedriger Dosis Clozapin, die allmählich auf 150 mg/d erhöht wurde Therapie der depressiven Symptome (nicht beschrieben) Clozapin wurde auf 25 mg reduziert und Carbamazepin neu eingeführt. Mit dieser Kombination bildete sich die bipolare affektive Störung innerhalb von 3 Monaten zurück. Carbamazepin wurde 14 Monate später abgesetzt, 25 mg Clozapin beibehalten Spontane Rückbildung 132 Krack et al. 2001 1 Parkinsonpatient 4 von 49 Parkinsonpatienten Keine Angaben Keine Angaben 1,3,5 Jahre nach OP BDI, Jährliches Interview durch denselben Neuropsychologen Kulisevsky 3 von 15 et al. 2002 Parkinsonpatienten Keine Angaben DSM-IV, YMRS (für Schweregrad) Miyawaki 1 et al. 2000 Parkinsonpatient ca. 1 Jahr nach OP BPRS GPi, bilateral 1 Wo. nach linken und 3 Wo. nach rechten Im plantation, in stim on/ med on Wiederkehrende manische Episoden ab 40 Tage nach OP: Clonazepam(1 mg)als 15.Tag nach der 2. Elektrodenimplantation: Einschlafhilfe 2 Monate nach OP: Valproinsäure für 6 Wochen Verschiedene Stimulationsparameter > Besserung (22.Tag: bilateral, 27.Tag: rechte Seite, Seit dem 29. Tag nach OP: L- Dopa-Gabe 29.Tag: linke Seite mit reduzierter langsam reduziert auf niedrigst mögliche Dosis Frequenz und erhöhter Spannung, rechte (1250 mg/d) Seite deaktiviert) durchprobiert. Damit besserte sich Manie langfristig bei Schließlich entwickelte sich unter beidseiBeibehaltung der Stimulation und es folgten tiger Stimulation ab 76.Tag wieder Manie über 12 Monate keine weiteren Episoden 1 Parkinsonpatient Keine Angaben Keine Angaben 6 Wochen nach Beginn der Stimulation entwickelte der Patient eine hypomane Symptomatik, wies aber nicht alle Kriterien für Hypomanie auf (initial Schlaflosigkeit, erhöhte Irritabilität, sexuell unpassendes Verhalten, weitschweifige Äußerungen u.a. ca. 2 Wochen vor der Diagnose) Präoperativ: Der Patient war seit Mitte 70-er Jahre unter Lithiumtherapie euthym, hatte seit beinahe 2 Jahren keine psychiatrische Medikation erhalten Patient 1,2 und 5 entwickelten Manie ohne psychotische Symptome. Patient 1: 2 Tage nach Implantation und 1 Tag vor Beginn der Stimulation manische Symptome, bildeten sich nach 3 Monaten spontan zurück Patient 5: keine Angaben Krack et al. 2003 Piasecki and Jefferson 2004 Romito et al. 2002 3 von 30 Parkinsonpatienten 1 Woche und 1,3,6,12 Mon nach OP DSM-IV Ncl.subthalamic Bald nach der OP hypomane Symptome us, bilateral 4 Jahre nach OP vorübergehend depressive Episode (Eheprobleme) Unmittelbar nach der OP entwickelten 4 Ncl. subthalamicus, bilateral Patienten eine „vorübergehende“ Hypomanie Bei 46 Pat. in 1 OP, bei 3 Pat. 1-12 Monate nach 1.Elektrodenimplantation Ncl.subthalamic Initial monopolare Stimulation der unteren us, bilateral Kontakte 24 Std nach OP Beginn der manischen Symptome innerhalb 48 Std. Ncl. subthalamicus, bilateral. MRI nach OP: Elektroden gingen auf beiden Seiten bis in Substantia nigra nahe Pedunculi cerebrales Ncl. subthalamicus, bilateral Keine Angaben Keine Angaben Manische Symptome persistieren nach Reduktion der Antiparkinsonmedikation Änderung der Stimulation (>höhere Kontakte) nach 1 Woche bewirkt Rückbildung der Manie innerhalb der folgenden Wochen Postoperativ: Erfolgreiche Therapie mit 5 mg Olanzapin/d Pat. 1 und 2:spontane Rückbildung Keine pharmakologische Therapie angesetzt. Veränderung der Stimulationsparameter hatte 133 Patient 2: 3 Tage nach Implantation und wenige Std. vor Stimulation man. Symptome, bildeten sich 8 Monate nach Implantation spontan zurück Tamma et al. 2003 1 von 30 Parkinson Keine Angaben Keine Angaben Ncl. subthalami- Hypomanie, mild und reversibel cus, bilateral keinen Einfluß auf Manie (Abschalten wurde wegen der unangenehmen motorischen Symptome von beiden Patienten nicht toleriert) Keine Angaben 134 Tab.13: Verbesserung der Angst Autor Anzahl der Patienten 12 Parkinsonpatienten 6 Parkinsonpatienten postoperatives Test Follow-up 3 Monate nach 0P AMPD-AT Angst Skala Fields et al. 2003 Ford et al. 2004 Dujardin et al. 2004 Fields et al. 1999 Gehirnareal Symptomatik nach OP/ Therapie Ncl. subthalamicus, bilateral Signifikante Reduktion der AMDP-AT Angst Skala nach der OP 2 Mon. nach 1.OP BAI (unilateral) 3 Mon. nach 2. OP (bilateral) Bei 1 Patienten lagen 22 Monate zw. den Untersuchungen nach OP GPi, bilateral 1.Elektrode: 5 Pat.: links 1 Pat.: rechts 2.Elektrode: mind.3 Monate später Signifikante Abnahme von Angst sowohl nach der Ausschlusskriterium: Demenz, 1. wie nach der 2. OP psychiatrische Erkrankung außer Minor Depression 35 Patienten mit essentiellem Tremor 3,26 (0,94) und 12 POMS, BAI Monate nach OP VIM des Thalamus, unilateral 30 li/ 5 re Die Anspannungs- und Angst Subskala des POMS verbesserte sich zw. Eingangs- und 12 Monate -Untersuchung Angst-Medikation eingangs Je 1 Patient Clorazepat, Hydroxyzin, Imipramin, Paroxetin, Sertralin Je 3 Patienten Lorazepam, Diazepam 3 Monate nach OP: Je 1 Patient Fluoxetin, Hydroxyzin, Imipramin Sertralin, Je 2 Patienten Lorazepam, Paroxetin 3 Patienten Diazepam 12 Monate nach OP: Je 1 Patient Clorazepat, Hydroxyzin,Paroxetin, Sertralin, Temazepam, 2 Patienten Diazepam 3 Patienten Lorazepam 2 von 30 Parkinsonpatienten 1 Jahr nach OP (außer 2 Patienten, nicht erreichbar) Ncl. subthalami2 Patienten, die präopertiv unter schwerer Angst cus, bilateral im „off-Zustand“ gelitten hatten, berichten, daß Davor: dieses Symptom nach der OP verschwunden sei 3 Pat.Implantation von embryonalem putaminalem Gewebe Kein Angsttest 2 Pat: unilaterale Pallidotomie 1 Pat: bilaterale Pallidotomie Vorgeschichte/ Ausschlusskriterien Ausschlusskriterium: Demenz Vorgeschichte: BAI - Gesamtscore eingangs: 8.43 (5.76) Ausschlusskriterium: Schwere psychiatrische Erkrankung, Demenz Ausschlusskriterium: Schwere Demenz (MMSE >22) 135 Fontaine et al. 2004 1 Parkinsonpatient 6 Monate nach OP Nichtstrukturiertes und strukturiertes Interview Ncl. subthalamicus, bilateral Leichte Verbesserung der Angstsymptomatik nach OP Gabriels et al. 2003 1 Parkinsonpatient 1 Jahr nach der OP POMS Anteriore Schenkel der Capsula interna, bilateral Sofort verminderte Angstgefühle nach OP Higginson et al. 2001 14 Tiefenhirnstimulation 25 Pallidotomie/ Thalamotomie 4,0 (2,4) Monate nach der OP BAI 10 Pat. GPi (7 li, 3 re) 4 Pat. VIM des Thalamus (3 li, 1 re) Signifikante Reduktion des Gesamtscore des BAI aber nicht des Panikfaktors des BAI nach OP. Bei 19 von 39 Patienten: Angst diagnostiziert 17 Patienten sowohl prä- wie postoperativ 2 Patienten erst postoperativ 11 Patienten zwar prä-, aber nicht postoperativ Mallet et al. 2002 (39 Parkinsonpatienten) 2 Zwangs6 Monate nach patienten OP MartinezMartin et al. 2002 17 Parkinsonpatienten Nuttin et al. 1999 1 von 4 Zwangspatienten Straits-Troster et al. 2000 9 Parkinsonpatienten 6 Monate nach OP 3 Monate nach OP BAS, strukturiertes und nichtstrukturiertes Interview HAD Ncl. subthalamicus, bilateral Behandlung mit Anxiolytika bei 11 Patienten vor und nach OP. 2 Patienten setzten nach OP ab, 2 Patienten begannen neu Patient 1:BAS verbesserte sich um 71 % Patient 2: BAS verbesserte sich um 100% Ncl. subthalamicus, bilateral Signifikante Abnahme der Angst am Ende der Studie POMS Anteriore Schenkel der Capsula interna, bilateral 1 Patientin berichtet, daß sie beinahe unmittelbar nach Stimulationsbeginn das Gefühl hatte, von der Angst befreit zu sein BAI, POMS GPi (ob uni-oder bilateral, wird nicht gesagt) Verbesserung des BAI Vorgeschichte: unipolare Depression und Suizid der Mutter Dysthymes Temperament des Patienten 1983 nach dem Tode der Eltern: hypomane Episode 1987 Beginn der Zwangserkrankung Vorgeschichte: Positive Familienanamnese für Zwangserkrankungen> abhängige Persönlichkeitsstörung Ausschlusskriterium: frühere oder aktuelle psychiatrische Erkrankung; jede andere klinisch signifikante Erkrankung, die die Gehirnstruktur oder -funktion beeinträchtigt Vorgeschichte: Bei 28 von 39 Patienten wurde Angst vor der OP diagnostiziert Ausschlusskriterium: Demenz Keine Angaben Ausschlusskriterien: Major Depression Deutliche zerebrale Atrophie Kognitive Verschlechertung Keine Angaben Ausschlusskriterien: Demenz, Psychose, Major Depression 136 Sturm et al. 2003 3 von 4 Troster et al. 9 1997b Parkinsonpatienten Woods et al. 6 2001 Parkinsonpatienten 24 –30 Monate nach OP Keine Angaben Ncl. accumbens, unilateral (re) 3 Monate nach OP Keine Angaben GPi unilateral (3 re, 6 li) 1 Jahr nach OP BAI VIM d. Thalamus, unilateral Beinahe vollständige Genesung von 3 Patienten, Die klinische Verbesserung wurde wenige Tage bis einige Wochen nach OP manifest. Bei dem Patienten ohne Besserung zeigte das MRI Fehlplazierung der Elektrode nach caudoventral Signifikante Verbesserung von Angstsymptomatik Vorgeschichte; schwere Angstund Zwangserkrankung, die nicht auf Pharmako- und Psychotherapie ansprach Keine Angaben Signifikante Verbesserung von Angstsymptomatik Keine Vorgeschichte für Depression 137 Tab 14: Verbesserung der Angst während Stimulation und Auftreten von Angst bei abgeschalteter Stimulation Autor Lucas et al. 2000 Anzahl der Patienten 1 Patient mit essentiellem Tremor Schneider et 12 al. 2003 Parkinsonpatienten postoperatives Follow-up 3 Monate nach der OP Test Gehirnareal Symptomatik nach OP/Therapie State-Trait Anxiety Inventory VIM d. Thalamus, bilateral Mit „stim on“ lagen die Ergebnisse des Stimmungs-Fragebogen im Normbereich, Mit „stim off“ ergab sich eine moderate Zunahme des Angstgefühls (d.h. >2 SD) Keine Angaben BPRS, Well-being Scale Ncl.subthalamicus, bilateral Zunahme von allgemeinen psychiatrischen Symptomen während „stim off“ im Vergleich zu „stim on“ Vorgeschichte/ Ausschlusskriterien Vorgeschichte: Keine positive Eigen- oder Familienanamnese für psychiatrische Erkrankungen Ausschlusskriterien: relevante psychiatrische Symptome 138 Tab.15 Keine signifikante Änderung der Angst Autor Brusa et al. 2001 Castelli et al. 2004 Halbig et al. 2004 Houeto et al. 2002 Anzahl der Patienten 6 Parkinsonpatienten postoperatives Follow-up Mindestens 6 Monate nach OP 17 von 24 Parkinsonpatienten Symptomatik nach OP/Therapie Visuelle Analog-Skala für Angst 3 Pat.: GPi, bilateral 3Pat.: Ncl. subthalamicus, bilateral Ncl. subthalamicus, bilateral Keine signifikanten Unterschiede prä- und postoperativ 10 Parkinson- Keine Angaben patienten 1 von 4 Ncl. subthalamicus, bilateral 19 (SD11) Monate SAS,MINI Ncl. subthalami(3-38) nach OP 500 (franz. cus, bilateral Version) ISPC, nichtstandardisiertes psychiatr. Interview Perozzo et al. 15 Parkinson- 6 Monate nach 2001a patienten OP Sturm et al. 2003 Gehirnareal 31 Parkinson- 9-12 Monate nach State-Trait patienten OP Anxiety Inventory, 12 Parkinson- Keine Angaben MDBF, BSI patienten Lopiano et al. 16 Parkinson- 3 Monate nach 2001 patienten OP Monaca et al. 2004 Test 24 – 30 Monate nach OP State-Trait Anxiety Inventory, SCID II MINI, HAD, SCID II Ncl. subthalamicus, bilateral State-Trait Anxiety Inventory, SCID II, psycholog. Interview Keine Angaben Ncl. subthalamicus, bilateral Ncl. subthalamicus, bilateral Ncl. accumbens unilateral (re) Vorgeschichte/ Ausschlusskriterien Keine Angaben Keine signifikante Verbesserung des State-Trait Anxiety Inventory Ausschlusskriterien: Demenz, Major Depression Psychosen Keine Angaben zur Angstsymptomatik, daher wird Ausschlusskriterium: angenommen, dass nach OP keine Änderung Signifikante Depression vorlag Postoperativ litten 18 Patienten an Angst, Vorgeschichte: Keine signifikante psychia15 Patienten verbunden mit der Furcht vor dem trische Erkrankung, keine Versagen des Stimulators, Demenz. 3 weitere ohne erkennbare Ursache Während der Parkinsonerkrankung hatten 17 von 24: Angstsymptomatik 12 von 24:depressive Episoden (4 mit medikant. Behandlung) 2 Pat :psychotische Episoden Keine signifikanten Unterschiede prä- und Ausschlusskriterien: postoperativ Demenz, Depression Psychose Keine Angaben zur Angstsymptomatik, daher wird angenommen, dass nach OP keine Änderung vorlag Keine signifikanten Unterschiede prä- und postoperativ Beinahe vollständige Genesung von Angst- und Zwangserkrankung bei 3 Patienten Bei dem Patienten ohne Besserung zeigte das postoperative MRI eine Fehlplazierung der Elektrode nach caudo-ventral Ausschlusskriterien: Unbehandelte Depression, persistierende Halluzinationen Ausschlusskriterien: Ernste kognitive Verschlechterung, Major Depression, Psychosen, schwere Angsterkrankungen, andere schwere psychopathol. Erkrankungen Vorgeschichte: Präoperativ: schwere Angst-und Zwangserkrankung, die nicht mehr auf Pharmako- und Psychotherapie ansprach 139 Tab.16: Auftreten von Angst Autor Anzahl der Patienten Dujardin et al. 1 von 9 2001 Parkinsonpatienten Funkiewiez et 1 von 77 al. 2004 Parkinsonpatienten postoperatives Follow-up 12 Monate Mindestens 3 Jahre nach OP Test Gehirnareal Symptomatik nach OP/Therapie Nichtstrukturiertes Interview Nicht strukturiertes Interview, UPDRS p 1 Ncl. subthalamicus, bilateral Erstmals Angst bei 1 Patienten Therapie: keine Angabe Ncl. subthalamicus, bilateral Müdigkeit und Verschlechterung der Angstsymptomatik; Apathie; aber nur leichte Verschlechterung der Depression Vorgeschichte/ Ausschlusskriterien Vorgeschichte: Hypersexualität, milde Depression Therapie mit Fluoxetin und Amitryptilin erfolglos, Keine Angaben über Verlauf der Angstsymptomatik. Apathie besserte sich. Houeto et al. 2002 5 von 24 ParkinsonPatienten 19 (SD11) Monate (3-38) nach OP Koller et al. 2001 1 von 49 Patienten mit essentiellem Tremor 25 Pat: 40,2 ± Keine Angaben 14,7 Monate (zw.22,4 – 68,8) 11Pat: durchschnittlich 11 Monate nach OP 2 Jahre nach GDS OP Okun et al. 2004 1 SAS, MINI 500 Ncl. subthalami(franz. Version) cus, bilateral ISPC, nichtstandardisiertes psychiatrisches Interview VIM - Ncl. des Thalamus, unilateral Ncl. subthalamicus, unilateral (li) 8 Jahre zuvor: Pallidotomie Bei 4 Patienten postoperative Agoraphobie (dramatische Verschlechterung bei 2 Patienten trotz verbesserter Parkinsonsymptomatik) Bei 1 Patient tritt erstmals Angst auf Vorgeschichte: Keine signifikante psychiatrische Erkrankung, keine Demenz Während der Parkinsonerkrankung hatten 17 von 24: Angstsymptomatik 12 von 24:depressive Episoden (bei 4 medikament. Behandlung) 2 Pat :psychotische Episoden Ausschlusskriterium: bei keinem Patienten signifikante psychiatrische Erkrankung Milde Angst, Therapie: durch Änderung der Stimulationsparameter Anschalten eines jeden beliebigen Elektrodenkontaktes versetzte die Patientin in unkontrolliertes Weinen. Stimulation des distalen Kontaktes (Kontakt 0) > Angst und Panik Stimulation mehr proximal und dorsal des Ncl. subthalamicus in medialen Teilen des Thalamus > Angst und Palpitationen. Unter Sertralin verbesserte sich die Symptomatik binnen 24-28 Std., Absetzen über 1 Woche führte zu unkontrolliertem Weinen Vorgeschichte: 2 Jahre vor OP Depression, über 1 Jahr mit Medikamenten behandelt, symptomfrei. Präoperatives Screening mit HDRS, GDS zeigte keine Depression, keine Angst Ausschlusskriterium: akute psychiatrische Erkrankung 140 Roane et al. 2002 1 Parkinsonpatient Keine Angaben Keine Angaben GPi, unilateral (li) davor: Pallidotomie rechts 5 Monate nach OP: Ängste, aber auch hypersexuelles Verhalten, Stimmungsschwankungen, motorische Unruhe, Schlaflosigkeit, gesteigerten Appetit, Verlangen nach Levodopa, zeitweise Apathie Clozapin, das 4 Monate nach der OP abgesetzt worden war, wurde wiedereingeführt. Mit 50 mg/d Clozapin verschwand das hypersexuelle Verhalten, die anderen Symptome nahmen ab. Vorgeschichte: keine positive Familienanamnese, keine psychiatrische Erkrankung vor Parkinsonerkrankung. Während Parkinsonerkrankung depressive Verstimmung, Schlaflosigkeit, Angst, herabgesetzte Aktivität 141 Tab.17: Psychotische Symptomatik bei Tiefenhirnstimulation Autor Diederich et al. 2000 Anzahl der Patienten 1 Parkinsonpatient postoperatives Follow-up Test Areal Symptomatik nach OP Verlauf und Therapie Psychiatrische Symptome wurden nicht evaluiert Ncl. subthalamicus, bilateral 1.OP: 2 neg. Pole 2.OP: ein 3.Pol in die Zona incerta nach der 1.OP: visuelle Halluzinationen Nach 1. OP: Halluzinationen verschwanden nach Absetzen von L-Dopa 3 Jahre nach der 2.OP: Halluzinationen waren sehr detailliert, nicht lateralisiert zu einer Hälfte des Gesichtsfeldes, beschränkt auf definiertes Umfeld (Wohnzimmer). Für den Patienten waren sie real. Psychomotorische Verlangsamung, keine Verwirrtheit oder Depression Nach 2. OP: Halluzinationen unabhängig von dopaminergen Medikamenten. Verschwinden bei „Stim off“. Patient entscheidet sich für „stim on“ wegen schwerer Tremorsymptomatik 25 mg Clozapin/d ermöglichen es, die Stimulation eingeschaltet zu lassen ohne klinisch beeinträchtigende visuelle Halluzinationen Funkiewiez et al. 2003 1 von 50 Parkinsonpatienten Im Durchschnitt nach 12 Monaten ARCI: ein Falsch/richtig Fragebogen zur Differenzierung von4 psychoaktiven Medikamentenbzw. Drogengruppen Ncl. subthalamicus, bilateral Vorübergehende Psychose vorübergehend Funkiewiez et al. 2004 4 von 77 Parkinsonpatienten 3 Monate, 1,2,3 Jahre nach OP UPDRS part 1, nichtstrukturiertes Interview Ncl. subthalamicus, bilateral 1.Pat: vorübergehende floride Psychose 1.Pat: Erkrankung 6 Wo nach OP, stationäre Aufnahme 2. Pat: chronischer Verlauf Houeto et al.2002 1 von 28 Parkinsonpatienten Limousin et x von 20: al. 1998 Parkinsonpatienten (keine Zahl für Halluzination genannt) 19 (SD 11) Monate (zw. 3-38 Monate) nach OP SAS, MINI, ISPC, nichtstandardisiertes Interview Ncl. subthalamicus, bilateral (überprüft mit MRI nach OP) 12 Monate nach OP Psychiatrische Symptome wurden nicht evaluiert Ncl. Subthalamicus, bilateral 2. Pat: dauerhafte Psychose 3. Pat: Halluzinationen ohne Krankheitseinsicht 4. Pat.: Wahnvorstellungen ohne Krankheitseinsicht 2 Patienten aus 2-4 waren dement Floride Psychose mit mystischen Wahnvorstellungen Vorübergehende Zustände von Halluzinationen, Verwirrung, Räumlichzeitlicher Desorientierung, Abulie Bei Patient 3 und 4 keine Angaben zu Verlauf und Therapie Symptome traten wenige Wochen nach OP auf. Keine Angaben zu Verlauf und Therapie Alle Symptome bildeten sich bis zu 2 Wochen nach OP spontan zurück 142 Loher et al. 1 2002 Parkinsonpatient 1 Jahr nach OP Psychiatrische Symptome wurden nicht evaluiert GPi unilateral (li) Merello et al. 1999 1 von 6 Parkinsonpatienten 1 von 26 Parkinsonpatienten Psychiatrische Symptome wurden nicht evaluiert UPDRS part 1 GPi unilateral (1 li, 5 re) Ostergaard et al. 2002 2 – 3 Tage nach OP, (2 Pat. 30 Tage nach OP) 1,3, 6 und 12 Monate nach OP und dann 1-2 mal/ Jahr 1 Parkinsonpatient Keine Angaben Psychiatrische Symptome wurden nicht evaluiert RodriguezOroz et al. 2004 1 von 10 Parkinsonpatienten 3 und 6 Monate, 1 und 4 Jahre nach OP Varma et al. 2003 2 von 7 Parkinsonpatienten 6 Monate nach OP (1 Pat. 8 Monate nach OP) Roane et al. 2002 Psychiatrische Symptome wurden nicht evaluiert Psychiatrische Symptome wurden nicht evaluiert Ncl. subthalamicus, bilateral vorausgehend: Bei 2* Pat. Thalamotomie Bei 3 Pat.(1 aus 2*) unilaterale Elektrode im VIMNcl.des Thalamus - vor OP entfernt GPi unilateral (li), Bei der Evaluation nach 1 Jahr berichteten Angehörige von visuellen Halluzinationen unabhängig von Medikamenteneinnahme. Gleichzeitig: kognitive Verschlechterung, zeitl.-räuml. Desorientierung, Apraxie, Einschränkung des Kurzzeitgedächtnisses >Alzheimer-Erkrankung diagnostiziert Psychose und Halluzinationen Vorübergehende Halluzinationen Keine Angaben Therapie mit Clozapin Nach einer Dauer von 2 Tagen spontane Rückbildung Vorübergehende visuelle Halluzinationen Rückbildung nach Absetzen von Amantadin vorausgehend: unilaterale Pallidotomie (re) Ncl. subthalamicus, bilateral Symptome einer Demenz mit Halluzinationen und sozialem Fehlverhalten Ausschalten der Stimulation änderte die Symptomatik nicht Ncl. subthalamicus, bilateral Bei 1 Pat. 3 Jahre davor unilaterale Pallidotomie (li) Visuelle Halluzinationen entwickelten sich mehrere Wochen nach OP Reduktion der Antiparkinson- Medikation erfolglos Therapie mit Quetiapin 143 Tab. 18: Verwirrtheitszustände bei Tiefenhirnstimulation Autor Anzahl der Patienten 3 von 23 Parkinsonpatienten postoperatives Follow-up 6 Monate nach OP (11 Pat. über 12 Monate) Ford et al. 2004 2 von 30 Parkinsonpatienten 1 und 6 Wochen, 3und 6 Monate, 12 Monate nach OP ( 2 von 30 Patienten kamen nach 12 Monaten nicht) Ghika et al. 1998 6 Parkinsonpatienten 1,3,6,12,15,18 und 24 Monate Hariz et al. 2000 1 Parkinsonpatient Keine Angaben Ncl.subthalamicus bilateral 19 (SD 11) Monate (zw.3-38) nach OP Ncl.subthalamicus bilateral Ardouin et al.1999 Houeto et al. 1 von 24 2002 Parkinsonpatienten Krack et al. 1998a 4 von 27 Parkinsonpatienten Test Gehirnareal Symptomatik nach OP/Therapie Ncl.subthalamicus bilateral Postoperative Verwirrtheit bildete sich innerhalb 1 Tages spontan zurück Ncl. subthalamicus ,bilateral Vorausgehend bei 3 Pat.:bilaterale putaminale embryonale Gewebetransplantation Bei 2 Pat.: unilaterale Pallidotomie Bei 1Pat: bilaterale Pallidotomie GPi, bilateral 2 Patienten, die bereits präoperativ eine milde kognitive Verschlechterung aufwiesen (MMSE 26/30), litten nach der OP unter Verwirrheitszuständen, die mehrere Wochen anhielten und sich schließlich spontan zurückbildeten Ncl.subthalamicus 26 bilateral, 1 unilateral Während der Anpassung der Stimulationsparameter traten Verwirrung und andere Nebenwirkungen (Dysarthrie, Dystonie, Unwohlgefühl) bei andauernder Stimulation oder bei hoher Spannung auf. Nebenwirkungen wurden größtenteils durch Modifikation der Stimulationsparameter kontrolliert. Nach der OP wies der Patient eine moderate Verschlechterung von Gedächtnis und Sprache auf. 1 Tag nach OP war er agitiert, 2 Wochen nach OP verwirrt.1 Jahr nach OP: schwere Demenz Zur Therapie keine Angaben Vorübergehende akute Episode von Verwirrheit. Zur Therapie keine Angaben Vorübergehende Verwirrtheit Vorgeschichte/ Ausschlusskriterien Vorgeschichte: Keine Abnormität im präoperativen MRI, keine kognitive Verschlechterung keine Major Depression Ausschlusskriterium: schwere Demenz (MMSE<22) Keine Angaben Keine Angaben Vorgeschichte: Keine signifikante psychiatrische Erkrankung, keine Demenz. Während der Parkinsonerkrankung hatten 17 von 24: Angstsymptomatik 12 von 24:depressive Episoden 2 Pat :psychotische Episoden 144 Krack et al. 1998b Kumar et al. 1998 Limousin 1995 Limousin 1998 Linazasoro et al. 2003 Lopiano et al. 2001 4 von 8 Parkinsonpatienten 2 von 7 Parkinsonpatienten Ncl.subthalamicus, bilateral Verwirrtheitszustand, der bei 3 Patienten wenige Tage, bei 1 Patienten 1 Monat anhielt Keine Angaben Ncl.subthalamicus, bilateral 1 von 3 Parkinsonpatienten 8 von 20 Parkinsonpatienten 3 Monate nach OP Ncl.subthalamicus, bilateral Pat.1: cortikaler Infarkt an der Eintrittsstelle der Elektrode > Dysarthrie, milde Hypophonie Pat.2: Thalamische Läsion am Einführungskanal > milde Verschlechterung des verbalen Gedächtnisses Pat.1+2: vorübergehende Verwirrtheit für 1-2 Wochen Vorübergehende Verwirrtheit für 2 Wochen 12 Monate nach OP Ncl.subthalamicus, bilateral Vorübergehende Verwirrtheit (neben räuml.-zeitl. Desorientiertheit und Abulie), bildete sich bis zu 2 Wochen nach OP zurück 1 von 18 Parkinsonpatienten 2 von 16 Parkinsonpatienten Keine Angaben Keine Angaben Milde kognitive Verschlechterung mit verwirrten Episoden > Hospitalisierung notwendig Keine Angaben Ncl.subthalamicus, bilateral Vorübergehende Verwirrtheit unmittelbar nach OP spontane Rückbildung. Keine signifikanten Unterschiede der neuropsychologischen Testvariablen nach OP Bei ausgeschalteter Stimulation empfand der Bildgebung des Gehirn vor OP Patient eine milde Zunahme der Verwirrtheit negativ Keine Vorgeschichte bezüglich Kopfverletzung, Schlaganfall, Infektion des Gehirns, psychiatrische Erkrankung Verwirrtheit trat während der ElektrodenimplanVorgeschichte: tation auf und dauerte über mehrere Wochen an, Keine Demenz, keine Depression besonders nach dem Schlafen. Präoperatives MRI normal Spontane Rückbildung Lucas et al. 2000 1 Patient mit essentielle m Tremor Ostergaard et al. 2002 1 von 26 Parkinsonpatienten Pillon et al. 2000 76 ParkinsonPatienten VIM-Ncl. des Thalamus, bilateral 1,3,6, und 12 Monate nach der OP, dann 1-2mal pro Jahr Ncl. subthalamicus. bilateral. Vorausgehend: Bei 2 Pat: unilaterale Thalamotomie Bei 3 Pat: unilaterale Elektrode in den VIMNcl. des Thalamus wegen Tremor. Die Elektrode im VIMNcl. wurde vor OP entfernt 63 Pat: Ncl subthalamicus bilateral 13 Pat.: GPi, bilateral Geistige Verlangsamung und Verwirrtheit, die wenige Stunden bis Tage anhielt. Bei 2 Patienten 1 Monat andauernd Auffälligkeiten des MRI Demenz Vorgeschichte: Präoperatives MRI normal Keine signifikante Verschlechterung der Stimmung oder Kognition wd. 145 der Erkrankung Tamma et al. 2003 Trepanier et al. 2000 9 von 30 Parkinsonpatienten 4 von 9 Parkinsonpatienten, alle älter als 70 J. Vesper et al. 10 von40 2002 Parkinsonpatienten Ncl. subthalamicus, bilateral 3 Monate nach OP einige Patienten 12 Monate nach OP Ncl. subthalamicus, bilateral, 1,6 und 12 Monate nach OP Ncl.subthalamicus bilateral Milder Verwirrtheitszustand über 1-3 Wochen bei unveränderten neuropsychologischen Testvariablen nach der OP Tendenz zu intra- und postoperativer Verwirrtheit bei Patienten älter >70. bei 2 Patienten für 1-2 Wochen, bei 2 Patienten noch nach 3 Monaten. Verwirrheit von unterschiedlicher Dauer und Schwere bei 10 Patienten. 4 Patienten benötigten eine Therapie. Über den Verlauf bei 8 Patienten keine Angaben, bei 2 Patienten keine Rückbildung Ausschlusskriterium: Demenz, bestehende psychiatrische Erkrankungen, die eine Kooperation gefährden könnten Ausschlusskriterium: Psychose, erhebliche Demenz, Verdacht auf multiple Systematrophie oder schwere Begleiterkrankung 146 Tab. 19: Delir bei Tiefenhirnstimulation Autor Berney et al. 2002 Krack et al. 2003 Anzahl der Patienten 5 von 24 Parkinsonpatienten Follow-up nach OP 3 – 6 Monate nach OP Test 12 von 49 Parkinsonpatienten 1,3 und 5 Jahre nach OP Nichtstrukturiertes Interview MASDRS, HDRS Stimuliertes Gehirnareal Ncl.subthalamicus bilateral Symptomatik nach OP/ Therapie Ncl.subthalamicus bilateral Beide Elektroden in 1 OP. Bei 3 Pat. eine 2.OP 1-12 Monate nach 1.OP Vorübergehendes postoperatives Delir, das von zeitl.-räumlicher Desorientierung bis zur Psychose reichte, während der ersten Tage nach OP. Postoperatives Delir Vorgeschichte/ Ausschlußkriterien Vorgeschichte: 8 Patienten hatten ein positive Vorgeschichte für Major Depression (7 von 18 nach der OP Nichtdepressive, 1 von 6 nach der OP Depressiven) Ausschlusskriterium: Demenz (DSM-IV) Vorgeschichte: bei 1 Patienten Suizidgedanken 3 Monate vor OP und Selbstmord 6 Monate nach OP Ausschlusskriterium: Demenz, schwere psychiatrische Erkrankung 147 Tab.20: Kognitive Verschlechterung, dysexekutives Syndrom und Demenz bei Tiefenhirnstimulation Autor Anzahl der Patienten postoperatives Follow-up Test Dujardin et al. 2000 1 Parkinsonpatient 6,12 und 15 Monate nach OP Dujardin et al. 2001 1 von 9 Parkinsonpatienten 1 von 50 Parkinsonpatienten 7 von 77 Parkinsonpatienten 3 Monate und 1 Jahr nach OP Durchschnittlich 12 Monate MMS,MDRS GPi, bilateral VIQ; Tests für Intelligenz, Informationsverarbeitung Kurzzeit-/ Langzeitgedächtnis, exekutive Funktion u. a. MMS, MDRS, Ncl. subthalaVIQ micus, bilateral Funkiewiez et al. 2003 Funkiewiez et al. 2004 Hariz et al. 2000 1 Parkinsonpatient Hariz et al. 2003 3 von 23 Parkinsonpatienten MDRS 1 von 49 Patienten Ncl. subthalamicus, bilateral Symptomatik nach OP/ Therapie Vorgeschichte Ausschlußkriterien Dysexekutives Syndrom 6 Monate nach OP: signifikante Veränderung der exekutiven Funktionen, gemessen an den scores des MDRS. Testanordnung unter „stim of/ stim on“ nach 15 Monaten zeigt signifikante Verbesserung bei abgeschalteter Stimulation ( 3 Sitzungen, jeweils 18 Stunden nach Änderung der Stimulation und mit alternativen Tests, wenn möglich) Vorgeschichte: Präoperativ keine Verschlechterung der Kognition Signifikante kognitive Verschlechterung 3 Monate nach OP. Nach 1 Jahr vollständige Rückbildung Progrediente Demenz Vorgeschichte: präoperativ keine kognitiven Defizite Keine Angaben 3 Jahre nach MDRS OP (7 Pat. kamen nicht zur Schlussuntersuchung) 1,2,6,12 Monate Keine nach OP Angaben Ncl. subthalamicus, bilateral 2 Pat: vorübergehende kognitive Verschlechterung 3 Pat: dauerhafte kognitive Verschlechterung (2 von ihnen kamen nicht zur Schlussuntersuchung) 2 Pat: Demenz nach OP Keine Angaben Ncl. subthalamicus, bilateral Keine Angaben Frauen: 11,6+/4,2 Mon (7-25) Männer:10.3 +/2,0 Mon (5-14) MMSE GPi, unilateral (li) bei 1 Frau Unmittelbar nach OP: moderate Verschlechterung des Gedächtnisses, Sprachdefizite, Patient war agitiert 4 Wochen nach OP: Aphonie, vermehrte Salivation, verminderte Kognition. MMSE- Wert von 27 >23,5 2 Monate nach OP: Durchschlafstörungen, Apathie, depressive Verstimmung, Angst, subjektive Dyspnoe 6 Monate nach OP: zusätzlich Dyspraxie 12 Monate nach OP: schwere Demenz 1Patientin und 2 männliche Patienten wiesen Demenz auf 25 Pat: 40,2+/14,7 Monate Keine Angaben 1 v.5 GPi 1 v 3 NclS 1 v 15Thal Koller et al. 2001 Gehirnareal Ncl.subthlamicus, bilateral Thalamus, unilateral (Männer) VIM-Ncl. des Thalamus, Milde kognitive Verschlechterung, leicht durch Adaptation der Stimulationsparameter zu beheben Vorgeschichte: präoperativ bereits schlechte MMSEscores (19-22) Keine Angaben 148 mit essentiellem Tremor Krack et al. 1998a 1 von 27 Parkinsonpatienten Krack et al. 2003 8 von 49 Parkinsonpatienten Kumar et al. 1998 1 von 7 Parkinsonpatienten 3 Parkinsonpatienten 1 Parkinsonpatient Linazasoro 2003 Loher et al. 2002 unilateral (zw.22,4 – 68,8) 11Pat: durchschnittlich 11 Monate nachOP Ncl. subthalamicus bilateral (26) unilateral (1) Ncl. subthalamicus, bilateral 1,3, und 5 Jahre nach OP (7 Pat. nach 5 Jahren nicht eva-luiert) Keine Angaben MDRS, Evaluation der Frontallappen dysfunktion Keine Ncl. subthalaAngaben micus, bilateral 6 Monate nach OP Nicht genau evaluiert 1 Jahr nach OP Neuropsychol GPi, unilateral Testung nach (li) den Kriterien des Konsortiums zur Etablierung einer Re gistrierung für Alzheimer Morrison et al. 1998 1 von 3 Parkinsonpatienten 1 Monat nach OP Morrison et al. 2004 1 von 17 Parkinsonpatienten 13,8 (7,8) Wochen nach OP Ncl. subthalamicus, bilateral 4 TestvariaNcl. subthalablen für micus, bilateral Aufmerksamkeit, Sprache, exekutive Funktion, visuell-räuml. Funktion 4 Testvariablen für Gedächtnis Siehe unten* Ncl. subthalamicus, bilateral Dementielles Syndrom: Bei 1 Patienten, bei dem nach einem Sturz ein subdurales Hämatom ausgeräumt werden mußte, kam es zu dauerhafter kognitiver Beeinträchtigung 5 Pat: Verschlechterung der Kognition, bei 2 Patienten unmittelbar nach OP 3 Pat: progressive Demenz zwischen 3 und 5 Jahren nach OP Nach der OP abrupter Abfall in den meisten kognitiven Teilbereichen Kognitive Verschlechterung, die bei 1 Patienten klinisch relevant wurde 1 Jahr nach OP Dementielles Syndrom: starke Schwankungen der kognitiven Fähigkeiten mit räuml.-zeitl. Desorientierung, Einschränkung des Kurzzeitgedächtnisses, schwerer Apraxie; visuelle Halluzinationen (unabhängig von Medikation) Während eines stationären Aufenthaltes: Sowohl bei an- wie ausgeschalteter Stimulation ist das Ergebnis der neuropsychologischen Evaluation gleich schlecht. MMSE- Wert zwischen 8 und 16 innerhalb von 3 Tagen. Vorübergehender Bewußtseinsverlust, ideomotorische Apraxie 8 Testvariablen wurden überprüft sowohl nach der Implantation wie nach der Stimulation. Bei 1 Patienten zeigte sich eine Verschlechterung in 7 Variablen Ausschlusskriterien: Demenz, schwere psychiatrische Erkrankung, Alter > 70 Vorgeschichte: Präoperative kognitive Verschlechterung Keine Angaben Vorgeschichte: Präoperativer MMSE-Wert: 22 von 30 präoperatives MRI: moderate cortikale Atrophie und erweiterte Ventrikel Keine Angaben Dementielles Syndrom: dramatische Verschlechterung der Ausschlusskriterium: Demenz kognitiven Fähigkeiten. 16 Wochen nach OP: bei abgeschalteter Stimulation nur 5 Davor bei 2 Pat. von 16 kognitiven Tests, bei eingeschalteter Stimulation unilaterale leichte Verbesserung. Insgesamt eine solche Verschlech- 149 Pallidotomie Ostergaard et al. 2002 1 von 26 Parkinsonpatienten 1,3,6 und 12 Mo-nate nach OP, dann 1-2 mal pro Jahr UPDRS part 1 item 1 Ncl. subthalamicus bilateral RodriguezOroz et al. 2004 3 von 10 Parkinsonpatienten 3 und 6 Monate 1 und 4 Jahre nach OP Keine Angaben Ncl. subthalamicus, bilateral Vesper et al. 2 von 40 2002 Parkinsonpatienten 1, 6 und 12 Monate nach OP Keine Angaben Ncl. subthalamicus, bilateral Vingerhoets et al. 1999b 3 Monate nach OP Siehe unten** GPi, unilateral (13 li, 7 re) 6 von 20 Parkinsonpatienten terung, daß der Patient in ein betreutes Wohnen eingewiesen werden mußte 2 Patienten klagten über eine Verschlechterung des Gedächtnisses, die sich bei einem von ihnen auch in einer Verschlechterung des Tests widerspiegelte 1 Patient: Zeichen einer Demenz mit Halluzinationen und sozialem Fehlverhalten 2 Pat.: kognitive Verschlechterung: MMSE 24 bzw. 28. Modifikation der Stimulation brachte bei allen 3 Patienten keine Besserung Progrediente Demenz (und permanente Verschlechterung einer seit kurzem bekannten Depression) Nach der OP Abfall der allgemeinen kognitiven Leistung, gemessen an einem „Verschlechterungs-Index“ * *die Autoren definieren einen „Verschlechterungs-Index“, der den Prozentwert wiedergibt, um den die Ergebnisse der verschiedenen kognitiven Tests unterhalb des „Verschlechterungs-Kriteriums“ lagen. Dieses „Verschlechterungs-Kriterium“ wurde definiert als ein Testwert, der 1SD oder mehr unterhalb des durchschnittlichen Testwertes einer normativen Gruppe liegt, die in Alter, Ausbildung und Geschlecht vergleichbar mit der Patientengruppe in dieser Studie ist Vorgeschichte: Präoperatives MRI unauffällig, Keine signifikante Depression, Demenz oder andere Erkrankung Keine Angaben Ausschlusskriterium: Psychose, erhebliche Demenz, Verdacht auf Multisystematrophie oder schwere Begleiterkrankung Ausschlusskriterium: Vorgeschichte für Enzephalitiden, Demenz, Neuroleptika- Behandlung Fokale Auffälligkeiten im zerebralen MRI, MMSE < 24 *Morrison et al. 2004: Randt Memory Test (RMT)-Digit Span, Passages and Pictures subtests (Randt & Brown, 1984), Brief Test of Attention (BTA; Schretlen 1989), Hopkins Verbal Learning Test-R (HVLT-R)-modified administration 1 (Bendict, Schretlen, Groninger & Brandt, 1998), Boston Naming Test (BNT)-short version (Mack, Freed, Williams & Henderson, 1992), Verbal Fluency (Benton & Hamsher, 1989), Visual Form Discrimination Test (VFDT; Benton, Hamsher,Varney & Spreen, 1983), Judgement of Line Orientation Test (JLOT) – short form (Woodard et al.1997) Standardized Test of Direction Sense (STDS, Money 1976), Odd Man Out Test (OMOT; Richards,Cote &Stern, 1993), Stroop Colour and Word Test (SCWT; Stroop,1935), Alternating Verbal Fluency (newcombe, 1969), Geriatric Depression Scale (GDS; Yesavage et al. 1983) **Vingerhoets et al 1999b: 1. Gedächtnis: Rey auditory verbal learning test (AVLT), recognition form (motor free) of the Benton Visual Retention Test (BVRT) 2. Visuell-motorische Koordination: Purdue Pegboard Test (PPT), Visual Reaction Time (VRT) 3. Räumliche Orientierung: Untertests von Visual Object and Space Perception Battery (VOSP) und Moneys standardised road map Test for direction sense (MRMT) 4. Executive Funktion: standardisierte niederländische Version des Stroop Coloured Word Test (SCWT), Controlled Oral Word Association Test (COWAT), Wisconsin Card Sorting Test (WCST) F. LITERATURVERZEICHNIS Alegret M, Junque C, Valldeoriola F, Vendrell P, Pilleri M, Rumia J, Tolosa E (2001) Effects of bilateral subthalamic stimulation on cognitive function in Parkinson disease. Arch Neurol 58: 1223-1227 Angenendt J, Frommberger U, Berger M (2004) Angsstörungen in: Berger M (Hg) Psychische Erkrankungen. Klinik und Therapie. 2.Aufl. Urban und Fischer, München, S. 637-690 Anderson D and Ahmed A (2003) Treatment of patients with intractable obsessive-compulsive disorder with anterior capsular stimulation. Case report. J Neurosurg 98: 1104-1108 Ardouin C, Pillon B, Peiffer E, Bejjani P, Limousin P, Damier P, Arnulf I, Benabid AL., Agid Y, Pollak P (1999) Bilateral subthalamic or pallidal stimulation for Parkinson's disease affects neither memory nor executive functions: a consecutive series of 62 patients. Ann Neurol 46: 217-223 Arroyo S, Lesser RP, Gordon B, Uematsu S, Hart J, Schwerdt P, Andreasson K, Fisher RS, (1993) Mirth, laughter and gelastic seizures. Brain 116: 757-780 Ashkan K, Wallace B, Bell BA, Benabid AL (2004) Deep brain stimulation of the subthalamic nucleus in Parkinson's disease 1993-2003: where are we 10 years on? Br J Neurosurg 18: 19-34 Benabid AL (2003) Deep brain stimulation for Parkinson´s disease. Curr Opin Neurobiol. 13: 696-706 151 Bejjani BP, Houeto JL, Hariz M, Yelnik J, Mesnage V, Bonnet AM, Pidoux B, Dormont D, Cornu P, Agid Y (2002) Aggressive behavior induced by intraoperative stimulation in the triangle of Sano. Neurology 59: 1425-1427 Bejjani BP, Damier P, Arnulf I, Thivard L, Bonnet AM, Dormont D, Cornu P, Pidoux B, Samson Y, Agid Y (1999) Transient acute depression induced by high-frequency deep-brain stimulation. N Engl J Med 340: 1476-1480 Berger M und van Calker D (2004) Affektive Störungen in: Berger M. (Hg) Psychische Erkrankungen. Klinik und Therapie. 2.Aufl. Urban und Fischer, München, S. 541-636 Berghmans RL, De Wert GM (2004) [Mental competence in the context of deep brain stimulation] Ned Tijdschr Geneeskd. 148 (28): 1373 -1375 Berney A, Vingerhoets F, Perrin A, Guex P, Villemure JG, Burkhard PR, Benkelfat C, Ghika J (2002) Effect on mood of subthalamic DBS for Parkinson's disease: a consecutive series of 24 patients. Neurology 59:1427-1429 Brusa L, Pierantozzi M, Peppe A, Altibrandi MG, Giacomini P, Mazzone P, Stanzione P. (2001) Deep brain stimulation (DBS) attentional effects parallel those of l-dopa treatment. J Neural Transm 108: 1021-1027 Burchiel KJ, Anderson VC, Favre J, Hammerstad JP (1999) Comparison of pallidal and subthalamic nucleus deep brain stimulation for advanced Parkinson's disease: results of a randomized, blinded pilot study. Neurosurgery 45: 1375-1382 Burn DJ and Troster AI (2004) Neuropsychiatric complications of medical and surgical therapies for Parkinson's disease. J Geriatr Psychiatry Neurol 17: 172-180 152 Caparros-Lefebvre D, Blond S, Pecheux N, Pasquier F, Petit H (1992) Neuropsychological evaluation before and after thalamic stimulation in 9 patients with Parkinson disease. Rev Neurol (Paris) 148: 117-122 Castelli L, Perozzo P, Genesia ML, Torre E, Pesare M, Cinquepalmi A, Lanotte M, Bergamasco B, Lopiano L (2004) Sexual well being in parkinsonian patients after deep brain stimulation of the subthalamic nucleus. J Neurol Neurosurg Psychiatry 75: 1260-1264. Ceballos-Baumann AO, Boecker H, Bartenstein P, von Falkenhayn I, Riescher H, Conrad B, Moringlane JR, Alesch F (1999) A positron emission tomographic study of subthalamic nucleus stimulation in Parkinson disease: enhanced movement-related activity of motorassociation cortex and decreased motor cortex resting activity. Arch Neurol 56: 997-1003 Cohen SR, Kimes AS, London ED (1991) Morphine decreases cerebral glucose utilization in limbic and forebrain regions while pain has no effect. Neuropharmcology 30: 125-134 Diederich NJ., Alesch F, Goetz CG (2000) Visual hallucinations induced by deep brain stimulation in Parkinson´s disease. Clin Neuropharmacol.23: 287-289 Doshi PK, Chhaya N, Bhatt MH (2002) Depression leading to attempted suicide after bilateral subthalamic nucleus stimulation for Parkinson's disease. Mov Disord 17: 1084-1085 Dujardin K, Blairy S, Defebvre L, Krystkowiak P, Hess U, Blond S, Destee A (2004) Subthalamic nucleus stimulation induces deficits in decoding emotional facial expressions in Parkinson's disease. J Neurol Neurosurg Psychiatry 75: 202-208 Dujardin K, Defebvre L, Krystkowiak P, Blond S, Destee A (2001) Influence of chronic bilateral stimulation of the subthalamic nucleus on cognitive function in Parkinson's disease. J Neurol 248: 603-611 153 Dujardin K, Krystkowiak P, Defebvre L, Blond S., Destee A (2000) A case of severe dysexecutive syndrome consecutive to bilateral pallidal stimulation. Neuropsychologia 38: 1305-1315 Durif F, Lemaire JJ, Debilly B, Dordain G (1999) Acute and chronic effects of anteromedial globus pallidus stimulation in Parkinson's disease. J Neurol Neurosurg Psychiatry 67: 315322. Eichelmann B (1971) Effect of subcortical lesions on shock induced aggression in the rat. J Comp Physiol Psychol 75: 331-339 Fields JA, Troster AI, Woods SP, Higginson CI, Wilkinson SB, Lyons KE, Koller WC, Pahwa R (2003) Neuropsychological and quality of life outcomes 12 months after unilateral thalamic stimulation for essential tremor. J Neurol Neurosurg Psychiatry 74: 305-311 Fields JA and Troster AI (2000) Cognitive outcomes after deep brain stimulation for Parkinson's disease: a review of initial studies and recommendations for future research. Brain Cogn 42: 268-293 Fields JA, Troster AI, Wilkinson SB, Pahwa R, Koller WC (1999) Cognitive outcome following staged bilateral pallidal stimulation for the treatment of Parkinson's disease. Clin Neurol Neurosurg 101: 182-188 Fins JJ (2000) A proposed ethical framework for interventional cognitive neuroscience: a consideration of deep brain stimulation in impaired consciousness. Neurol Res. 22: 273-278 Förstl H und Hüll M (2004) Organische (und symptomatische) psychische Störungen in: Berger M. (Hg) Psychische Erkrankungen. Klinik und Therapie. 2.Aufl. Urban und Fischer, München, S. 301-388 154 Fontaine D, Mattei V, Borg M, von Langsdorff D, Magnie MN, Chanalet S, Robert P, Paquis P (2004) Effect of subthalamic nucleus stimulation on obsessive-compulsive disorder in a patient with Parkinson disease. Case report. J Neurosurg 100: 1084-1086. Ford B, Winfield L, Pullman SL, Frucht SJ, Du Y, Greene P, Cheringal JH, Yu Q, Cote LJ, Fahn S, McKhann GM, Goodman RR (2004) Subthalamic nucleus stimulation in advanced Parkinson's disease: blinded assessments at one year follow up. J Neurol Neurosurg Psychiatry 75: 1255-1259 Fried I, Wilson CL, McDonald KA, Behnke EJ (1998) Electric current stimulates laughter. Nature 391: 650 Funkiewiez A, Ardouin C, Caputo E, Krack P, Fraix V, Klinger H, Chabardes S., Foote K, Benabid AL, Pollak P (2004) Long term effects of bilateral subthalamic nucleus stimulation on cognitive function, mood, and behaviour in Parkinson's disease. J Neurol Neurosurg Psychiatry 75: 834-839 Funkiewiez A, Ardouin C, Krack P, Fraix V, Van Blercom N, Xie J, Moro E, Benabid AL, Pollak P (2003) Acute psychotropic effects of bilateral subthalamic nucleus stimulation and levodopa in Parkinson's disease. Mov Disord 18: 524-530 Funkiewiz A, Caputo E, Ardouin C, Krack P, Fraix V, Benabid AL, Pollak P.(2001) Behavioural and mood changes associated with bilateral stimulation of the subthalamic nucleus: a consecutive series of 98 parkinsonian patients. Neurology 56 (Suppl.3): A 274. 155 Gabriels L, Cosyns P, Nuttin B, Demeulemeester H, Gybels J (2003) Deep brain stimulation for treatment-refractory obsessive-compulsive disorder: psychopathological and neuropsychological outcome in three cases. Acta Psychiatr Scand 107: 275-282. Galvez-Jimenez N, Lozano A, Tasker R, Duff J, Hutchinson W, Lang AF (1998) Pallidal stimulation in Parkinson´s disease patients with a prior unilateral pallidotomy. Can J Neurol Sci 25: 300-305 Garcia, L, Audin, J, D´Alessandro, G, Bioulac, B, Hammond, D (2003) Dual effect of highfrequency stimulation on subthalamic neuron activity. Ther Journal of Neuroscience 25: 87438751 George MS, Ketter TA, Parekh PI, Horwitz B, Herscovitch P, Post RM (1995) Brain activity during transient sadness and happiness in healthy women. Amercan Journal of Psychatry 152: 341-351 Ghika J, Villemure JG, Fankhauser H, Favre J, Assal G, Ghika-Schmid F (1998) Efficiency and safety of bilateral contemporaneous pallidal stimulation (deep brain stimulation) in levodopa-responsive patients with Parkinson's disease with severe motor fluctuations: a 2year follow-up review. J Neurosurg 89: 713-718 Halbig TD, Gruber D, Kopp UA, Scherer P, Schneider GH, Trottenberg T, Arnold G, Kupsch A (2004) Subthalamic stimulation differentially modulates declarative and nondeclarative memory. Neuroreport 15: 539-543 Hariz GM, Lindberg M, Hariz MI, Bergenheim AT (2003) Gender differences in disability and health-related quality of life in patients with Parkinson´s disease treated with stereotactic surgery. Acta Neurol Scand 108: 28-37 156 Hariz MI, Johansson F, Shamsgovara P, Johansson E, Hariz GM, Fagerlund M. (2000) Bilateral subthalamic nucleus stimulation in a parkinsonian patient with preoperative deficits in speech and cognition: persistent improvement in mobility but increased dependency: a case study. Mov Disord 15: 136-139 Harder F und Flüe M von (2000) Kolon. In: Siewert JR (Hg.) Chirurgie. 7. Aufl. Springer Verlag, Berlin Heidelberg NewYork, S. 633-654 Henderson JM., Pell M, O'Sullivan DJ, McCusker EA, Fung VS, Hedges P, Halliday GM (2002) Postmortem analysis of bilateral subthalamic electrode implants in Parkinson's disease. Mov Disord 17: 133-137 Herzog J, Volkmann J, Krack P, Kopper F, Potter M, Lorenz D, Steinbach M, Klebe , Hamel W, Schrader B, Weinert D, Muller D, Mehdorn HM, Deuschl G (2003) Two-year follow-up of subthalamic deep brain stimulation in Parkinson´s disease. Mov Disord 17: 1332-1337 Higginson CI, Fields JA, Troster AI. (2001) Which symptoms of anxiety diminish after surgical interventions for Parkinson disease? Neuropsychiatry Neuropsychol Behav Neurol 14: 117121 Houeto JL, Damier P, Bejjani PB, Staedler C, Bonnet AM, Arnulf I, Pidoux B, Dormont D, Cornu P, Agid Y. (2000) Subthalamic stimulation in Parkinson disease: a multidisciplinary approach. Arch Neurol 57: 461-465 Houeto JL, Mesnage V, Mallet L, Pillon B, Gargiulo M, du Moncel ST, Bonnet AM., Pidoux B, Dormont D, Cornu P, Agid Y. (2002) Behavioural disorders, Parkinson's disease and subthalamic stimulation. J Neurol Neurosurg Psychiatry 72: 701-707 157 Houeto JL, Mesnage V, Welter ML, Mallet L, Agid Y, Bejjani BP (2003) Subthalamic DBS replaces levodopa in Parkinson's disease: two-year follow-up. Neurology 60: 154-155 Jahanshahi M, Ardouin CM, Brown RG, Rothwell JC, Obeso J, Albanese A, Rodriguez-Oroz MC, Moro E, Benabid AL, Pollak P, Limousin-Dowsey P (2000) The impact of deep brain stimulation on executive function in Parkinson's disease. Brain 123: 1142-1154 Kleiner-Fisman G, Fisman DN, Sime E, Saint-Cyr JA, Lozano AM, Lamg AE (2003) Longterm follow up of bilateral deep brain stimulation of the subthalamic nucleus in patients with advanced Parkinson disease. J Neurosurg 99: 489-495 Koller WC, Lyons KE, Wilkinson SB, Troster AI, Pahwa R (2001) Long-term safety and efficacy of unilateral deep brain stimulation of the thalamus in essential tremor. Mov Disord 16: 464-468 Krack P, Batir A, Van Blercom N, Chabardes S., Fraix V., Ardouin C, Koudsie A, Limousin PD, Benazzouz A, Lebas JF, Benabid AL, Pollak P (2003) Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson's disease. N Engl J Med 349: 1925-1934 Krack P, Kumar R, Ardouin C, Dowsey PL, McVicker JM, Benabid AL, Pollak P (2001) Mirthful laughter induced by subthalamic nucleus stimulation. Mov Disord 16: 867-875 Krack P, Benazzouz A, Pollak P, Limousin P, Piallat B, Hoffmann D, Xie J, Benabid AL (1998a) Treatment of tremor in Parkinson´s disease by subthalamic nucleus stimulation. Mov Disord 13: 907-914 158 Krack P, Pollak P, Limousin P., Hoffmann, D, Xie J, Benazzouz A, Benabid AL (1998b) Subthalamic nucleus or internal pallidal stimulation in young onset Parkinson`s disease. Brain 121: 451-457 Kulisevsky J, Berthier ML, Gironell A, Pascual-Sedano B, Molet J, Pares P.(2002) Mania following deep brain stimulation for Parkinson's disease. Neurology 59: 1421-1424 Kumar R, Krack P, Pollak P (1999) Transient acute depression induced by high-frequency deep-brain stimulation. N Engl J Med 341: 1003-1004 Kumar R, Lozano AM, Kim YJ, Hutchison WD, Sime E, Halket E, Lang AE (1998) Doubleblind evaluation of subthalamic nucleus deep brain stimulation in advanced Parkinson´s disease. Neurology 51: 850-855 Landi A, Parolin M, Piolti R, Antonini A, Grimaldi M, Crespi M, Iurlaro S, Aliprandi A, Pezzoli G, Ferrarese C, Gaini SM (2003) Deep brain stimulation for the treatment of Parkinson's disease: the experience of the Neurosurgical Department in Monza. Neurol Sci 24: 43-44 Limousin P, Krack P, Pollak P, Benazzouz A, Ardouin C, Hoffmann D, Benabid AL (1998) Electrical stimulation of the subthalamic nucleus in advanced Parkinson´s disease. N Engl J Med 399: 1105-1111 Limousin P, Pollak P, Benazzouz A, Hoffmann D, Le Bas JF, Broussolle E, Perret JE, Benabid AL (1995) Effect on parkinsonian signs and symptoms of bilateral subthalamic nucleus stimulation .Lancet 345: 91-95 Linazasoro G (2003) Subthalamic deep brain stimulation for advanced Parkinson's disease: all that glitters is not gold. J Neurol Neurosurg Psychiatry 74: 827 159 Loher TJ, Krauss JK, Wielepp JP, Weber S, Burgunder JM (2002) Pallidal deep brain stimulation in a parkinsonian patient with late-life dementia: sustained benefit in motor symptoms but not in functional disability. Eur Neurol 47: 122-123 Lopiano L, Rizzone M, Bergamasco B, Tavella A, Torre E, Perozzo P, Valentini MC, Lanotte M (2001) Deep brain stimulation of the subthalamic nucleus: clinical effectiveness and safety. Neurology 56: 552-554 Lucas JA, Rippeth JD, Uitti RJ, Shuster EA, Wharen RE (2000) Neuropsychological functioning in a patient with essential tremor with and without bilateral VIM stimulation. Brain Cogn 42: 253-267 Mallet L, Mesnage V, Houeto JL, Pelissolo A, Yelnik J, Behar C, Gargiulo M, Welter ML, Bonnet AM, Pillon B, Cornu P, Dormont D, Pidoux B, Allilaire JF, Agid Y (2002) Compulsions, Parkinson's disease, and stimulation. Lancet 360: 1302-1304 Martinez-Martin P, Valldeoriola F, Tolosa E, Pilleri M, Molinuevo JL, Rumia J, Ferrer E (2002) Bilateral subthalamic nucleus stimulation and quality of life in advanced Parkinson's disease. Mov Disord 17: 372-377 Mayberg HS and Lozano AM (2002) Penfield revisited? Understanding and modifying behavior by deep brain stimulation for PD. Neurology 59: 1298-1299 Merello M, Nouzeilles MI, Kuzis G, Cammarota A, Sabe L, Betti O, Starkstein S, Leiguarda R (1999) Unilateral radiofrequency lesion versus electrostimulation of posteroventral pallidum: a prospective randomized comparison. Mov Disord 14: 50-56 Miyawaki E, Perlmutter JS, Troster AI., Videen TO, Koller WC. (2000) The behavioral complications of pallidal stimulation: a case report. Brain Cogn 42: 417-434 160 Molinuevo JL, Valldeoriola F, Tolosa E, Rumia J, Valls-Sole J, Roldan H, Ferrer E (2000) Levodopa withdrawal after bilateral subthalamic nucleus stimulation in advanced Parkinson disease. Arch Neurol 57: 983-988 Monaca C, Ozsancak C, Jacquesson JM, Poirot I, Blond S, Destee A, Guieu JD, Derambure P (2004) Effects of bilateral subthalamic stimulation on sleep in Parkinson's disease. J Neurol 251: 214-218 Moretti R, Torre P, Antonello RM, Capus L, Marsala SZ, Cattaruzza T, Cazzato G, Bava A (2003) Neuropsychological changes after subthalamic nucleus stimulation: a 12 month followup in nine patients with Parkinson's disease. Parkinsonism Relat Disord 10: 73-79 Moretti R, Torre P, Antonello RM, Capus L, Gioulis M, Marsala SZ, Cazzato G, Bava A (2002) Cognitive changes following subthalamic nucleus stimulation in two patients with Parkinson disease. Percept Mot Skills 95: 477-486 Moro E, Scerrati M, Romito LM, Roselli R, Tonali P, Albanese A (1999) Chronic subthalamic nucleus stimulation reduces medication requirements in Parkinson's disease. Neurology 53: 85-90 Morrison CE, Borod JC, Perrine K, Beric A, Brin MF, Rezai A, Kelly P, Sterio D, Germano I, Weisz D, Olanow CW (2004) Neuropsychological functioning following bilateral subthalamic nucleus stimulation in Parkinson's disease. Arch Clin Neuropsychol 19: 165-181 Morrison CE, Borod JC, Raskin, N (1998) Cognitive effects of brain surgery and stimulation in Parkinson’s disease. Paper presented at the Annual Convention of the American Psychological Association, august 14-17, 1998, San Francisco, CA 161 Nandi D, Chir M., Liu X., Bain P, Parkin S, Joint C, Winter J, Stein J, Scott R, Gregory R, Aziz T (2002) Electrophysiological confirmation of the zona incerta as a target for surgical treatment of disabling involuntary arm movements in multiple sclerosis: use of local field potentials. J Clin Neurosci 9: 64-68 Nuttin BJ, Gabriels LA, Cosyns PR, Meyerson BA, Andreewitch S, Sunaert SG, Maes AF, Dupont PJ, Gybels JM, Gielen F, Demeulemeester HG (2003) Long-term electrical capsular stimulation in patients with obsessive-compulsive disorder. Neurosurgery 52: 1263-1272 Nuttin B, Cosyns P, Demeulemeester H, Gybels J, Meyerson B (1999) Electrical stimulation in anterior limbs of internal capsules in patients with obsessive-compulsive disorder. Lancet 354: 1526 Okun M.S, Green J, Saben R, Gross R, Foote KD, Vitek JL (2003) Mood changes with deep brain stimulation of STN and GPi: results of a pilot study. J Neurol Neurosurg Psychiatry 74: 1584-1586 Okun, MS ,Rajy DV, Walter BL, Juncos JL, DeLong MR, Heilman K, McDonald WM, Vitek JL (2004) Pseudobulbar crying induced by stimulation in the region of the subthalamic nucleus. J Neurol Neurosurg Psychiatry 75: 921-923 Olbrich HM, Leucht S, Fritze J, Lanczik MH, Vauth R (2004) Schizophrenien und andere psychotische Störungen in: Berger M (Hg) Psychische Erkrankungen. Klinik und Therapie. 2.Aufl. Urban und Fischer, München, S. 453-540 Ostergaard K, Sunde N, Dupont E (2002) Effects of bilateral stimulation of the subthalamic nucleus in patients with severe Parkinson's disease and motor fluctuations. Mov Disord 17: 693-700 162 Pahwa R, Wilkinson SB, Overman J, Lyons KE (2003) Bilateral subthalamic stimulation in patients with Parkinson disease: long-term follow up. J Neurosurg 99: 71-77 Patel NK, Heywood P, O'Sullivan K, McCarter R, Love S, Gill SS (2003a) Unilateral subthalamotomy in the treatment of Parkinson's disease. Brain 126: 1136-1145 Patel NK, Plaha P, O'Sullivan K, McCarter R, Heywood P, Gill SS (2003b) MRI directed bilateral stimulation of the subthalamic nucleus in patients with Parkinson's disease. J Neurol Neurosurg Psychiatry 74: 1631-1637 Perozzo P, Rizzone M, Bergamasco B, Castelli L, Lanotte M, Tavella A, Torre E, Lopiano L (2001a) Deep brain stimulation of subthalamic nucleus: behavioural modifications and familiar relations. Neurol Sci 22: 81-82 Perozzo P, Rizzone M, Bergamasco B, Castelli L, Lanotte M, Tavella A, Torre E, Lopiano L (2001b) Deep brain stimulation of the subthalamic nucleus in Parkinson's disease: comparison of pre- and postoperative neuropsychological evaluation. J Neurol Sci 192: 9-15 Piasecki SD and Jefferson JW (2004) Psychiatric complications of deep brain stimulation for Parkinson's disease. J Clin Psychiatry 65: 845-849 Pillon B, Czernecki V, Dubois B (2003) Dopamine and cognitive function. Curr Opin Neurol 16 (Suppl 2): S17-S22. Pillon B, Ardouin C, Damier P, Krack P, Houeto JL, Klinger H, Bonnet AM, Pollak P, Benabid AL, Agid Y (2000) Neuropsychological changes between “off” and “on” STN or GPi stimulation in Parkinson´s disease. Neurology 55: 411-418 163 Roane DM, Yu M, Feinberg TE, Rogers JD (2002) Hypersexuality after pallidal surgery in Parkinson disease. Neuropsychiatry Neuropsychol Behav Neurol 15: 247-251 Rodriguez-Oroz MC, Zamarbide I, Guridi J, Palmero MR, Obeso JA (2004) Efficacy of deep brain stimulation of the subthalamic nucleus in Parkinson's disease 4 years after surgery: double blind and open label evaluation. J Neurol Neurosurg Psychiatry 75: 1382-1385 Romito LM, Raja M, Daniele A, Contarino MF, Bentivoglio AR, Barbier A, Scerrati M, Albanese A (2002) Transient mania with hypersexualiy after surgery for high frequency stimulation of the subthalamic nucleus in Parkinson´s disease. Mov Disord 17: 1371-1374 Roth RM, Flashman LA, Saykin AJ Roberts DW (2001) Deep brain stimulation in neuropsychiatric disorders. Curr Psychiatry Rep 3: 366-372 Saxena S, Rauch SL (2000) Functional neuroimaging and the neuroanatomy of obsessivecompulsive disorder. Psychiatr Clin North Am 23: 563-586 Schneider F, Habel U, Volkmann J, Regel S, Kornischka J, Sturm V, and Freund HJ (2003) Deep brain stimulation of the subthalamic nucleus enhances emotional processing in Parkinson disease. Arch Gen Psychiatry 60: 296-302 Sensi M, Eleopra R, Cavallo MA, Sette E, Milani P, Quatrale R, Capone JG, Tugnoli V, Tola MR, Granieri E, Data PG (2004) Explosive-aggressive behavior related to bilateral subthalamic stimulation. Parkinsonism relat Disord 10: 247-251 Starkstein SE, Mayberg HS, Berthier ML, Fedoroff P, Price TR, Dannals RF, Wagner HN, Leiguarda R, Robinson RG (1990) Mania after brain injury: neuroradiological and metabolic findings. Ann Neurol 27: 652-659 164 Stefurak T, Mikulis D, Mayberg H, Lang AE, Hevenor S, Pahapill P, Saint-Cyr J, Lozano A (2003) Deep brain stimulation for Parkinson's disease dissociates mood and motor circuits: a functional MRI case study. Mov Disord 18: 1508-1516 Straits-Troster K, Fields JA, Wilkinson SB, Pahwa R, Lyons KE, Koller WC, Troster A I. (2000) Health-related quality of life in Parkinson's disease after pallidotomy and deep brain stimulation. Brain Cogn 42: 399-416 Sturm V, Lenartz D, Koulousakis A, Treuer H, Herholz K, Klein JC, Klosterkotter J (2003) The nucleus accumbens: a target for deep brain stimulation in obsessive-compulsive- and anxietydisorders. J Chem Neuroanat 26: 293-299 Sturm JW, Andermann F, Berkovic SF (2000) „Pressure to laugh“: an unusual epileptic symptom associated with small hypothalamic hamartomas. Neurology 54: 971-973 Talaraich J, Bancaud J, Geier S et al. (1973) The cingulate gyrus and human behaviour. Electroencephalogr Clin Neurophysiol 34: 45-52 Tamma F, Rampini P, Egidi M, Caputo , Locatelli M, Pesenti A, Chiesa V, Ardolino G, Foffani G, Meda B, Pellegrini M, Priori A (2003) Deep brain stimulation for Parkinson's disease: the experience of the Policlinico-San Paolo Group in Milan. Neurol Sci 24 (Suppl 1): 41-42 Tass PA, Klosterkotter J, Schneider F, Lenartz D, Koulousakis A, Sturm V (2003) Obsessivecompulsive disorder: development of demand-controlled deep brain stimulation with methods from stochastic phase resetting. Neuropsychopharmacology 28 (Suppl 1): 27-34 Thobois S, Mertens P, Guenot M, Hermier M, Mollion H, Bouvard M, Chazot G, Broussolle E, Sindou M (2002) Subthalamic nucleus stimulation in Parkinson's disease: clinical evaluation of 18 patients. J Neurol 249: 529-534 165 Trepanier LL, Kumar R, Lozano AM, Lang AE, Saint-Cyr JA.(2000) Neuropsychological outcome of GPi pallidotomy and GPi or STN deep brain stimulation in Parkinson's disease. Brain Cogn 42: 324-347 Troster AI, Fields JA, Wilkinson S, Pahwa R, Koller WC, Lyons KE (2003) Effect of motor improvement on quality of life following subthalamic stimulation is mediated by changes in depressive symptomatology. Stereotact Funct Neurosurg 80: (1-4):43-47 Troster AI, Fields JA, Pahwa R, Wilkinson SB, Strait-Troster KA, Lyons , Kieltyka J, Koller WC (1999) Neuropsychological and quality of life outcome after thalamic stimulation for essential tremor. Neurology 53: 1774-1780 Troster AI, Wilkinson SB, Fields JA, Miyawaki K, and Koller WC (1998) Chronic electrical stimulation of the left ventrointermediate (Vim) thalamic nucleus for the treatment of pharmacotherapy-resistant Parkinson's disease: a differential impact on access to semantic and episodic memory? Brain Cogn 38: 125-149 Troster AI, Fields JA, Wilkinson SB, Pahwa R. Miyawaki E, Lyons KE, Koller WC (1997) Unilateral pallidal stimulation for Parkinson's disease: neurobehavioral functioning before and 3 months after electrode implantation. Neurology 49: 1078-1083 Vandewalle V, van den Linden C, Groenewegen HJ, Caemaert J (1999) Stereotactic treatment of Gilles de la Tourette syndrome by high frequency stimulation of thalamus. Lancet 353: 724 Varma TR, Fox SH., Eldridge PR., Littlechild P, Byrne P, Forster A, Marshall A, Cameron H, McIver K, Fletcher N, Steiger M (2003) Deep brain stimulation of the subthalamic nucleus: 166 effectiveness in advanced Parkinson's disease patients previously reliant on apomorphine. J Neurol Neurosurg Psychiatry 74: 170-174 Vesper J, Klostermann F, Stockhammer F, Funk T, Brock M (2002) Results of chronic subthalamic nucleus stimulation for Parkinson's disease: a 1-year follow-up study. Surg Neurol 57: 306-311 Vingerhoets G, Lannoo E, van den Linden C, Caemaert J, Vandewalle V, van den Abbeele D, Wolters M (1999a) Changes in quality of life following unilateral pallidal stimulation in Parkinson's disease. J Psychosom Res 46: 247-255 Vingerhoets G, van den Linden C, Lannoo E, Vandewalle V, Caemaert J, Wolters M, van den Abbeele D (1999b) Cognitive outcome after unilateral pallidal stimulation in Parkinson's disease. J Neurol Neurosurg Psychiatry 66: 297-304 Visser-Vandewalle V, Temel Y, Boon P, Vreeling F, Colle H, Hoogland G, Groenewegen H J, van den Linden C (2003) Chronic bilateral thalamic stimulation: a new therapeutic approach in intractable Tourette syndrome. Report of three cases. J Neurosurg 99: 1094-1100 Vitek JL (2002) Deep brain stimulation for Parkinson's disease. A critical re-evaluation of STN versus GPi DBS. Stereotact Funct Neurosurg 78: 119-131 Voges J, Volkmann J, Allert N, Lehrke R, Koulousakis A, Freund HJ, Sturm V (2002) Bilateral high-frequency stimulation in the subthalamic nucleus for the treatment of Parkinson disease: correlation of therapeutic effect with anatomical electrode position. J Neurosurg 96: 269-279 Volkmann J, Allert N, Voges J, Weiss PH, Freund HJ, Sturm V (2001) Safety and efficacy of pallidal or subthalamic nucleus stimulation in advanced PD. Neurology 56: 548-551 167 Witt K, Pulkowski U, Herzog J, Lorenz D, Hamel W, Deuschl G, Krack P (2004) Deep brain stimulation of the subthalamic nucleus improves cognitive flexibility but impairs response inhibition in Parkinson disease. Arch Neurol 61: 697-700 Woods S. P., Fields J. A., Lyons K. E., Pahwa R., and Troster A. I. (2003) Pulse width is associated with cognitive decline after thalamic stimulation for essential tremor. Parkinsonism Relat Disord 9: 295-300 Woods SP, Fields JA, Troster AI (2002) Neuropsychological sequelae of subthalamic nucleus deep brain stimulation in Parkinson's disease: a critical review. Neuropsychol Rev 12: 111126 Woods SP, Fields JA, Lyons KE, Koller WC, Wilkinson SB, Pahwa R, Troster AI (2001) Neuropsychological and quality of life changes following unilateral thalamic deep brain stimulation in Parkinson's disease: a one-year follow-up. Acta Neurochir (Wien ) 143: 12731277. 168 G. DANKSAGUNG Herrn Prof. Dr. med. Mathias Berger danke ich für die Überlassung des Themas dieser Arbeit, für seine Hilfsbereitschaft und Unterstützung. Besonderen Dank schulde ich Herrn Prof. Dr. med. Klaus Lieb für seine Hilfsbereitschaft, Großzügigkeit und Geduld, die er mir, trotz seiner Belastung in Klinik und Forschung, entgegenbrachte. Nicht zuletzt danke ich meinem Vater und meiner Mutter für ihre Hilfe und Unterstützung bei der Entstehung dieser Arbeit.