Lösungen Seite 153
Werbung

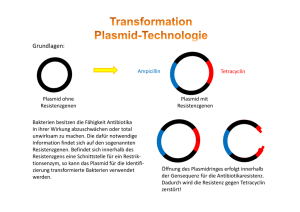
Lösungen zur Kompetenzen-Seite Die Aminosäuresequenz von Somatostatin lautet: Alanin – Glycin – Cystein – Lysin – Asparagin – Phenylalanin – Phenylalanin – Tryptophan – Lysin – Threonin – Phenylalanin – Tryptophan – Serin – Cystein. Wegen der Redundanz des genetischen Codes sind – bis auf Tryptophan – mehrere Codons in der mRNA für Somatostatin möglich. Eine mögliche Nucleotidsequenz der mRNA wäre: GCCGGCUGUAAAAACUUCUUCUGGA AAACAUUCUGGUCCUGU © 2010 Cornelsen Verlag, Berlin. Alle Rechte vorbehalten. Daraus ergibt sich die komplementäre Sequenz für den codogenen Strang der DNA: CGGCCGACATTTTTGAAGAAGACCTT TTGTAAGACCAGGACA Die meisten menschlichen Gene sind – mit wenigen Ausnahmen – Mosaikgene, die aus codierenden Exons und nicht codierenden Introns bestehen ( S. 99 im Lehrbuch). In menschlichen Zellen werden die Introns während der Proteinsynthese aus der zunächst transkribierten Prä-mRNA durch Spleißen entfernt und die Exons zu einer kontinuierlichen Nucleotidsequenz verbunden. Dazu sind Bakterien nicht in der Lage, da deren Gene keine Introns enthalten und daher auch die Enzyme für diesen Vorgang fehlen. Die Herstellung eines künstlichen Gens nach der Aminosäuresequenz hat den Vorteil, dass die Notwendigkeit des Spleißens entfällt. Bei dieser Methode besteht die Nucleotidsequenz nur aus den Exons. Die Nucleotidsequenz für Methionin wird in das Startcodon AUG der mRNA transkribiert. An dieses Startcodon bindet die Start-tRNA mit Methionin. Erst unter dieser Voraussetzung lagert sich die große Untereinheit eines Ribosoms an die bereits angelagerte kleine Untereinheit, sodass ein funktionsfähiges Ribosom entsteht und die Translation der gesamten mRNA durchgeführt werden kann ( S. 98/99 im Lehrbuch). Ohne Startcodon AUG, das für die Aminosäure Methionin steht, keine Translation! Plasmide sind kleine, doppelsträngige DNA-Ringe, die im Zellplasma von Bakterien vorkommen und wenige Gene enthalten. Die Plasmidgene sind in der Regel für spezielle Funktionen zuständig (Antibiotika-Resistenz, Konjugationseigenschaften). Die Bedeutung der Plasmide für die Gentechnik liegt darin, sie als Vektoren zur Übertragung von DNA in Bakterienzellen zu nutzen. Der Plasmidring wird mit einem Restriktionsenzym geöffnet, das sogenannte „klebrige Enden“ erzeugt (z. B. EcoRI). Die dazu komplementären Enden werden enzymatisch an das künstliche Gen angefügt. Angewandte Biologie Angewandte Genetik Seite 1 von 3 Lösungen zur Kompetenzen-Seite © 2010 Cornelsen Verlag, Berlin. Alle Rechte vorbehalten. (siehe Tabelle) Aufbau Funktion Begründung Erkennungssequenzen mit Schnittstellen für bestimmte Restriktionsenzyme (hier EcoRI, BamHI, PStI) Durch Behandlung mit den entsprechenden Restriktionsenzymen kann die DNA an Stellen mit definierter Basenfolge aufgeschnitten werden. Abschnitte fremder DNA, die mit dem gleichen Enzym geschnitten wurde, lassen sich hier in das Plasmid einfügen. regulatorischer Teil (Regler- An den Promotor bindet die einheit) des lac-Operons (aus RNA-Polymerase zur Promotor und Operator) Transkription der dahinter folgenden Strukturgene. Der Operator reguliert die Tätigkeit der RNA-Polymerase, in diesem Fall blockiert er sie, bis ein an ihn gebundenes Repressorprotein durch den Zucker Lactose als Induktor inaktiviert wurde (Substratinduktion; S. 102 im Lehrbuch). Die Reglereinheit ist Voraussetzung dafür, dass m-RNA gebildet wird. Der Operator wird als Schalter für die Genexpression genutzt, in diesem Fall durch Zusatz von Lactose in das Substrat der Bakterien. exprimierbare Gene (Strukturgene) für die Proteine -Galactosidase und Somatostatin Diese Gene codieren für die Synthese von Proteinen. (Hinweis: Das Galactosidase-Gen erwies sich im Verlauf der Experimente als notwendig, da Bakterien kleine Proteine wie Somatostatin als „Fehlprodukte“ sofort abbauen, während das „Fusionsprotein“ aus -Galactosidase und Somatostatin erhalten bleibt. Es kann an der zusätzlich eingebauten Aminosäure Methionin mit Bromcyan gespalten werden.) Ampicillinresistenz-Gen Es ermöglicht Bakterien mit diesem Gen, auf ampicillinhaltigem Substrat zu wachsen. Antibiotikaresistenzgene werden genutzt, um Bakterien mit dem betreffenden Plasmid zu selektieren. (Hinweis: Das „historische“ Plasmid ist ein reines Expressionsplasmid, wie es 1977 von den Wissenschaftlern IKATURA, BOLIVAR und BOYER aus dem Plasmid pBR322 konstruiert wurde und mit dem sich erstmals ein Säugetierprotein in E.-coli-Bakterien herstellen ließ.) Angewandte Biologie Angewandte Genetik Seite 2 von 3 Lösungen zur Kompetenzen-Seite Die markierten Stellen sind Schnittstellen für bestimmte Restriktionsenzyme, deren abgekürzte Bezeichnungen vermerkt sind. (Die Bezeichnungen beziehen sich auf Bakterien, aus denen die Enzyme isoliert wurden, z. B. Eco für Escherichia coli). Die Schnittstellen liegen innerhalb einer für jedes Restriktionsenzym spezifischen Erkennungssequenz der DNA, deren Basenfolge meist ein Palindrom darstellt (DNA-Abschnitt mit gleichen Basen in gegenläufiger Leserichtung auf den beiden Strängen). Für das Restriktionsenzym BamHI lautet die im Bild blau unterlegte Erkennungssequenz in 5'-3'-Richtung GGATCC. Die Schnittstellen, an denen das Enzym die Bindungen der beiden Desoxyribose-Phosphat-Ketten trennt, liegen zwischen den beiden Guaninbasen. Dadurch entsteht (wie bei den meisten Restriktionsenzymen) DNA mit einzelsträngigen, zueinander komplementären Enden (in diesem Fall mit der Sequenz GATC von 5' nach 3'). © 2010 Cornelsen Verlag, Berlin. Alle Rechte vorbehalten. Somatostatin hemmt die Freisetzung von Wachstumshormon aus der Hypophyse. Da das Wachstumshormon das Körperwachstum steuert, könnte es als Medikament bei Riesenwuchs eingesetzt werden. In der Bauchspeicheldrüse hemmt Somatostatin die Freisetzung von Insulin und Glucagon. Diese beiden Hormone sind als Antagonisten an der Regulation des Blutzuckerspiegels beteiligt. Insulin senkt den Blutzuckerspiegel, Glucagon erhöht ihn. Als Medikament könnte Somatostatin daher bei Menschen mit großen Schwankungen des Blutzuckerspiegels eingesetzt werden. Vorteile der gentechnischen Gewinnung von Somatostatin: Bei der konventionellen Gewinnung müsste eine unvorstellbar große Anzahl von Tiergehirnen aufgearbeitet werden. Das wäre nicht nur sehr teuer, sondern auch von den Zufällen des Markts abhängig. Außerdem bestünde ein mögliches Infektionsrisiko mit Viren und Prionen. Die gentechnische Herstellung liefert demgegenüber ein Produkt mit großem Reinheitsgrad und günstigem Preis. Nachteile der gentechnischen Gewinnung von Somatostatin: Unmittelbar sind keine zu erkennen. Grundsätzlich befürchten Kritiker, dass Produktionsorganismen aus gentechnischen Anlagen entweichen oder die Medikamente mit Produktionsorganismen oder deren Inhaltsstoffen verunreinigt sein könnten. Befürchtet wird ein möglicher horizontaler Transfer der eingebauten Resistenz-Gene gegen Antibiotika, die zu einer weiteren Zunahme von Antibiotikaresistenzen beitragen könnte. Angewandte Biologie Angewandte Genetik Seite 3 von 3