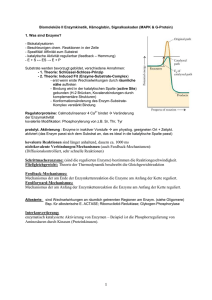
Hemmung der Proteinbiosynthese
Werbung

Block 2 Toxikologie für Chemiker und andere Naturwissenschaftler Die Vorlesungsunterlagen wurden nach bestem Wissen und Gewissen zusammengestellt, erheben aber nicht den Anspruch auf Vollständigkeit. Keine Gewähr für eventuelle Fehler! Stand: 21.01.10 PD Dr. Gunter P. Eckert Pharmakologisches Institut für Naturwissenschaftler Universität Frankfurt [email protected] Toxische Wirkung auf molekularer Ebene Toxische Wirkung auf molekularer Ebene !! Hemmung der Proteinbiosynthese !! Hemmung der Nucleinsäuresynthese !! Hemmung des Energiestoffwechsels !! Störung der Homöostase !! Störung membranassoziierter Strukturen !!Targets: z.B. Enzyme, Carrier, Rezeptoren Hemmung der Proteinbiosynthese Die Proteinbiosynthese, früher auch Eiweißsynthese genannt, ist die Herstellung eines Proteins oder Polypeptids in Lebewesen. Sowohl Proteine als auch Polypeptide sind Ketten aus Aminosäuren, die sich in ihrer Länge und ihrer Abfolge unterscheiden. Sie werden auf Grund der in der Desoxyribonukleinsäure (DNA) gegebenen Erbinformation an den Ribosomen lebender Zellen gebildet. Hemmung der Proteinbiosynthese Chloramphenicol X Hemmung der Proteinbiosynthese Beispiel Diphterie-Toxin: !!Corynebacterium !!Stämme !!Toxin diphteriae (grampositive Stäbchen) Vergiftungsbild: Probleme mit Atmung, Arrythmien am Herzen, Lähmungserscheinungen. die mit bestimmten Bakteriophagen befallen sind besteht aus 535 Aminosäuren (ADP-Ribosyltransferase) Mechanismus: ADP-Ribose-Gruppenübertragung vom NAD+ auf den Elongationsfaktor 2 > verhindert Translokation > Hemmung der Proteinbiosynthese LD: 7 !g Gegenmaßnahmen: Gabe von Diphtherie-Antitoxin, aktive Immunisierung Toxische Wirkung auf molekularer Ebene !! Hemmung der Proteinbiosynthese !! Hemmung der Nucleinsäuresynthese !! Hemmung des Energiestoffwechsels !! Störung membranassoziierter Strukturen !!Targets: z.B. Enzyme, Carrier, Rezeptoren Hemmung der Nucleinsäuresynthese Nukleinsäuren sind die Träger des Erbguts (! DNA) oder dienen als Blaupause für die Proteinbiosynthese in der Zelle (! RNA). Kurze Nukleinsäurefragmente (Oligonukleotide) spielen eine große Rolle in der Nukleinsäureprozessierung oder zellinternen Signalverarbeitung. Die bekanntesten Nukleinsäuren sind DNA (dt.: DNS) und RNA (dt.: RNS). Nukleinsäuren bestehen aus Nukleotid-Untereinheiten, die wiederum aus jeweils einer Nukleinbase einem Phosphat und einem Zucker (Ribose bei RNA und Desoxyribose bei DNA) - aufgebaut sind. Hemmung der Nucleinsäuresynthese Amanitin X Hemmung der Nucleinsäuresynthese Beispiel Amatoxine: !! grüner !! !-, Knollenblätterpilz "-, #-, $- Amanitin, Amanin, Amanullin Mechanismus: Hemmung der DNA abhängigen RNA-Polymerase II. V.a. Leber und Niere. LD: 0,1 mg bei Erwachsenen, Mortalität:10-15% (Kinder bis 50 %). In 100g Knollenblätterpilz ca. 17 mg Amanitin. Gegenmaßnahmen: Erbrechen, Magenspülung, Gabe von Penicillin G und Silibinin (hemmen Aufnahme in Hepatozyten), Lebertransplantation Toxische Wirkung auf molekularer Ebene !! Hemmung der Proteinbiosynthese !! Hemmung der Nucleinsäuresynthese !! Hemmung des Energiestoffwechsels !! Störung membranassoziierter Strukturen !!Targets: z.B. Enzyme, Carrier, Rezeptoren Mit Energiestoffwechsel bezeichnet man den Teil des Stoffwechsels von Lebewesen, der der Gewinnung von Energie für energieverbrauchende Prozesse dient. Er unterscheidet sich vom energieverbrauchenden Baustoffwechsel (Anabolismus), der dem Aufbau von Körperbestandteilen der Lebewesen dient. Hemmung des Energiestoffwechsels Atmungskette: Mit Hilfe von ElektronenTransportvorgängen und durch Anreicherung von Wasserstoffionenwird ein elektrochemischer Gradient aufgebaut, der dazu dient, mittels spezieller, in die innere Membran eingebundener Enzyme (ATPasen), ATP herzustellen. Die zur Herstellung des Gradienten benötigten Elektronen und Wasserstoffatome werden durch oxidativen Abbau aus den vom Organismus aufgenommenen Nährstoffen (z.B. Glucose) gewonnen. Hemmung des Energiestoffwechsels Beispiel Blausäure (Cyanide): !! Galvanisierungsbetriebe, Verbrennung von organischen Stoffen, CN-haltige Glykoside (Bittermandeln, Pfirsichkerne) !! Aufnahme von HCN über Lunge oder Magen Mechanismus: Hoch affine, reversible Bindung von CN- an Fe3+ der mitochondrialen Cytochrome und anderer Metalloenzyme > Hemmung der Atmungskette > „innere Erstickung“. LD: 200-300 ml/m3 HCN bzw. 1 mg/kg KCN, Gegenmaßnahmen: Gabe von Methämogloboinbildner* > Bindung von CN-; Gabe von Hydroxocobalamin; Schwefelsubstitution durch Thiosulfatgabe > hohe Umsatzrate des Enzyms Rhodanase entgiftet CN- zu Rhodanit (SCN-) > renale Exkretion *Methämoglobinbildner: z.B. 4Dimethylaminophenol, Hydroxocobalamin Toxische Wirkung auf molekularer Ebene !! Hemmung der Proteinbiosynthese !! Hemmung der Nucleinsäuresynthese !! Hemmung des Energiestoffwechsels !! Störung membranassoziierter Strukturen !!Targets: z.B. Enzyme, Carrier, Rezeptoren Störung membranassoziierter Strukturen Die Zellmembran (Membrana cellularis) ist eine elastisch verformbare, häutchenartige Struktur, die die lebende Zelle umgibt und ihr inneres Milieu aufrechterhält. Bei einer Stärke von etwa 6- 10 nm ist sie lichtmikroskopisch höchstens als vage Linie erfassbar. Sie besteht also chemisch aus Lipiden, vor allem Phospholipiden und Glykolipiden, die eine Doppellipidschicht bilden und deren polare, hydrophile Enden dem wässrigen Umgebungsmilieu entgegenragen, während die apolaren, lipophilen Schwänze einander zugekehrt sind, Proteinen, die in den Lipidfilm eintauchen, z.T. aber auch zur Innen- bzw. Außenfläche der Membran hin gelagert sind oder als Transmembranproteine die Lipidschicht völlig durchdringen. Grundlegend für die Funktion biologischer Membranen ist, dass sie in der Lage sind, Stoffe auslesend passieren zu lassen. Für den Austausch zwischen Cytosol und Extrazellulärraum sorgen spezielle Strukturen in der Membran: Transporter (Carrier), ATP-abhängige Pumpen und Ionenkanäle. Störung membranassoziierter Strukturen !! Veränderung der Membranviskosität und Ionenpermeabilität (GABAA-Rezeptor) Alkohol Inhalationsnarkotika Benzol X Toxische Wirkung auf zellulärer Ebene !! Hemmung der Zellproliferation !! Störung der Zellreifung/-differenzierung !! Hemmung der Zelladhäsion oder Zellaggregation !! Hemmung der Signalübertragung Toxische Wirkung auf zellulärer Ebene !! Hemmung der Zellproliferation Praktisch alle Gifte zeigen ab einer bestimmten Konzentration eine Hemmwirkung auf Zellwachstum und Zellteilungsaktivität. Rückschlüsse auf Wirkmechanismus nicht unbedingt möglich Toxische Wirkung auf zellulärer Ebene !! Hemmung der Zellproliferation !! Störung der Zellreifung/-differenzierung !! Hemmung der Zelladhäsion oder Zellaggregation !! Hemmung der Signalübertragung Toxische Wirkung auf zellulärer Ebene !!Störung der Zellreifung/-differenzierung Besonders betroffen Gewebe mit hohem turn over und Stammzellen: !!Knochenmark (Leukämie) !!Blutzellen (z.B. Erythropenie, Agranulozytose, Thrombozytopenie) Beispiele: Methotrexat (Folsäureantagonist) beeinträchtigt Blutzellreifung, Phenothiazine (Schmerzmittel) kann zur Agranulozytose führen, Antiphologistika (Entzündungshemmer) können zu Thrombozytopenien führen. Agranulocytose das Fehlen bestimmter weißer Blutzellen, der Granulozyten, die für die körpereigenen Abwehrvorgänge bedeutungsvoll sind; häufig ausgelöst durch Überempfindlichkeitsreaktion gegenüber Arzneimitteln. Thrombozytopenien – Beruhen auf Störungen der Speicherfähigkeit der Thrombozyten. Zeichen: u.a. spontane Haut- oder Schleimhautblutungen. Toxische Wirkung auf zellulärer Ebene Benzol X Sulfonamide X X Bildung von Blutzellen aus pluripotenten Stammzellen des Knochenmarks Toxische Wirkung auf zellulärer Ebene !! Hemmung der Zellproliferation !! Störung der Zellreifung/-differenzierung !! Hemmung der Zelladhäsion oder Zellaggregation !! Hemmung der Signalübertragung Toxische Wirkung auf zellulärer Ebene !!Hemmung der Zelladhäsion oder Zellaggregation Mechanische und elektrische Kopplung der Zellen untereinander durch Proteine, die an der Plasmamembran verankert sind (Cadherine, Connexine, Integrine) oder im Cytosol (Mikrofilamente, Mikrotubuli) das Zytoskelett bilden. Wichtiger Faktor: Calciumionen! Bei Störungen gehen Zusammenhalt, die Polarität oder gar die Vitalität einzelner Zellen verloren. Thalidomid (Contergan®) Molekularer Mechanismus: Verminderung der Expression von Adhäsionsrezeptoren (z.B. Integrinen). Wichtig für Zell- Zell – Kontakte. Sehr geringe Toxizität. Kritische Phase: 24-35 Tage nach Konzeption Toxische Wirkung auf zellulärer Ebene !! Hemmung der Zellproliferation !! Störung der Zellreifung/-differenzierung !! Hemmung der Zelladhäsion oder Zellaggregation !! Hemmung der Signalübertragung Toxische Wirkung auf zellulärer Ebene Toxische Wirkung auf zellulärer Ebene Toxische Wirkung auf zellulärer Ebene !!Hemmung der Signalübertragung Gifte können auf vielen Stufen der Signalverarbeitung eingreifen und eine Blockade oder Verfälschung des Signals bewirken! Beispiele: Ouabain (Strophanthin) Ouabain (Pflanzengift, hemmt Na+/K+-ATPase) [Verwendung in Neurowiss.] Curare (Alkaloide [Tubocurarin, Toxiferin], blockiert Na+-Kanäle) [starke Affinität zu nAChRezeptoren, quartäre Gruppen blockieren die äußere Ach-Bindungsstelle am Kanal] Nikotin (Tabak, Depolarisation vegetativer Synapsen durch Bindung an nikotinische Acetylcholin-Rezeptoren) Grundbegriffe "!Toxikodynamik "!Toxikokinetik Grundbegriffe !! Toxikodynamik: Wirkungen des Stoffes auf den Organismus !!Dosis !!Empfindlichkeit des Organismus !!Dosis-Wirkungs-Kurve Grundbegriffe !!Toxikokinetik: Einflüsse des Organismus auf den Stoff !!Aufnahme !! Verteilung !!Umwandlung !!Ausscheidung Toxikodynamik Verschiedene Phasen bei einer Vergiftung Giftquelle Giftfreisetzung Gifttransfer Exposition -äußere -innere Aufnahme Toxische Wirkung Verteilung -akut Biotransformation -chronisch Exkretion Expositionsphase Toxokinetische Phase Toxodynamische Phase Toxikodynamik Arten und Charakteristika von Wirkungen !! zeitlich und räumlicher Zusammenhang zwischen Einwirkung des Stoffes und dem Auftreten der Wirkung !! akut und chronisch !! lokal und systemisch !! Mechanismus !! reversibel und irreversibel !! primär und sekundär Dosis-Wirkungsbeziehungen !!Zusammenhang zwischen der wirksamen Konzentration einer Substanz und der Intensität oder Häufigkeit der untersuchten Wirkung als Graphik !!Ablesen !!Lineare informativer Kennzahlen (z.B. LD50) Kurven werden oft in Logit oder Probit transformiert. Dosis-Wirkungsbeziehungen 5% = 0,05 Toxikodynamik Toxikologische Kenngrößen !! EDx (effektive Dosis) bzw. ECx (effektive Konz.) !! ED50 (effektive Dosis für 50% Wirkung) !! LDx (letale Dosis) bzw. LCx (letale Konz.) !! LD50: Einzeldosis, bei der ein Absterben von 50% der Versuchstiere erwartet wird Dosis: z.B mg/kg Körpergewicht Konzentration: z.B.mg/l Atemluft !! LDL0: Letale Dosis low: niedrigste publizierte Dosis, die zum Tod eines Versuchstieres führte !! ICx (Hemmkonzentration) Toxikodynamik ED50 und LD50 Dosis-Wirkungsbeziehungen Reversibilität - Irreversibilität !! Für Stoffe, die reversible Schäden auslösen, lassen sich unwirksame Konzentrationen (Dosen) festlegen !! NO(A)EL - no observed (adverse) effect level !! Für irreversible (gentoxische) Wirkungen gibt es keine Wirkungsschwelle NOEL Wirkungsschwelle Effekt Maximaldosis 100 50 Grenzwert NOEL 0 Sicherheitsfaktor Dosis Toxikodynamik !! zur qualitativen und quantitativen Beschreibung der Wirkung werden die Begriffe !! Wirkungsqualität (oder Wirkungsart), !! Wirkungsstärke (Ausmaß der Abweichung vom Ausgangszustand) und !! Wirkungsdauer (Zeit zwischen Beginn und Ende der Wirkung) benutzt. Grundbegriffe "!Toxikodynamik "!Toxikokinetik Toxikokinetik Aufnahme (Resorption) Verteilung (Distribution) Wirkort Speicherung Bindung Elimination Biotransformation Ausscheidung (Exkretion) Vorgänge, die die Konzentration eines Fremdstoffes am Wirkort beeinflussen Toxikokinetik Resorption Aufnahme (Resorption) oral, inhalativ, dermal Verteilung (Distribution) Durchdringen der Deckgewebe von Darm, Lunge, Haut Wirkort Speicherung Bindung Elimination Biotransformation Ausscheidung (Exkretion) Resorption Lipophilie passiv Resorption Der Gastrointestinaltrakt als Resorptionsorgan !!Große innere Oberfläche (ca. 200 m2) !!unterschiedliche pH-Werte einzelner Abschnitte Organ/Körperflüss. pH-Wert Blut 7,35- 7,45 Mundhöhle 6,2 - 7,2 Magen (aktiv) 1,0 - 3,0 (nüchtern bis 7,0) Duodenum 4,8 - 8,2 Jejunum 6,3 - 7,3 Kolon/Rektum 7,9 - 8,0/ 7,8 Rückenmark 7,3 - 8,0 Harn 4,8 - 7,5 Schweiß 4,0 - 6,8 Die Lunge als Resorptionsorgan !! Große innere Oberfläche (ca. 90 m2) !! kurzer Diffusionweg !! gute Durchblutung !!rasche Resorption lipophiler Stoffe mit hohem Dampfdruck !!gasförmige Stoffe !!Aerosole (Staub, Nebel) !! Teilchen % < 2 !m bis in die Alveolen Die Haut als Resorptionsorgan !! Resorption durch die Haut verläuft wegen der vielen Zellschichten und der niedrigen Durchblutung deutlich langsamer als in Darm und Lunge Resorption Eintritt von Xenobiotika in Zellen: Diffusion Erleichterte Diffusion (Carrier-vermittelt) Aktiver Transport (Transporter-vermittelt) Resorption Bioverfügbarkeit Bioverfügbarkeit in Kinetik: Ausmaß und Geschwindigkeit mit der das Gift nach Resorption am Wirkort erscheint. Bioverfügbarkeit unter praktischen Gesichtspunkten: Der resorbierte Bruchteil einer ingestierten Giftmenge, der im Plasma bzw. Blut nachgewiesen werden kann. Definitionsgemäß: 100% Bioverfügbarkeit nach intravenöser Injektion: AUCextravasal (oral, subkutan etc.) / AUCintravenös = absolute Bioverfügbarkeit [%] Toxikokinetik Resorption Aufnahme (Resorption) oral, inhalativ, dermal Verteilung (Distribution) Durchdringen der Deckgewebe von Darm, Lunge, Haut Wirkort Speicherung Bindung Elimination Biotransformation Ausscheidung (Exkretion) Lipophilie passiv Toxikokinetik Verteilung Aufnahme (Resorption) Durchblutung Verteilung (Distribution) Wirkort Speicherung Bindung Elimination Biotransformation Ausscheidung (Exkretion) Verteilung Kapillartypen Toxikokinetik Bindung/Speicherung Aufnahme (Resorption) Plasmaproteine Verteilung (Distribution) Speicherung Bindung Wirkort Gewebe Elimination Biotransformation Ausscheidung (Exkretion) Verteilung (Distribution)/Speicherung und Bindung Toxikokinetik Elimination Aufnahme (Resorption) Verteilung (Distribution) Wirkort Speicherung Bindung Elimination Biotransformation Ausscheidung (Exkretion) Verminderung der Lipidlöslichkeit zur Verbesserung der Ausscheidung 2 Phasen der Biotransformation Exkretion: renal, biliär Biotransformation !! Biotransformation: Metabolische Umwandlung von Xenobiotika (Fremdstoffe) !! vorwiegend: Leber! (hepatische Elimination) daneben: Darmmukosa, Niere, Lunge, Haut, Plasma Biotransformation Sonderfälle der hepatischen Elimination: !! First-Pass-Metabolismus !! Enterohepatischer Kreislauf Toxikokinetik Elimination von Fremdstoffen durch Stoffwechsel Funktionalisierung: Konjugation mit: Glucuronsäure, Schwefelsäure, Carbonsäuren, Aminosäuren, Glutathion Metabolit Metabolit Oxidation, Hydrolyse, Reduktion Fremdstoff Phase I Phase II Polarität Toxikokinetik Elimination von Fremdstoffen durch Stoffwechsel Funktionalisierung: Oxidation, Hydrolyse, Reduktion Metabolit Fremdstoff Harmlos! Toxisch! Phase I Metabolit Phase II Biotransformation Phase I Oxidation durch Monooxygenasen !! Monooxygenasen: Gruppe von Enzymen Cytochrom P450 Superfamilie !! molekularer Sauerstoff: !! ein Sauerstoffatom auf Substrat (Oxidation) !! ein Sauerstoffatom & H2O (Reduktion) !! mischfunktionelle Oxygenase (ER-Membran) NADPH + H+ NADP+ O=O ROCH3 H2O (ROCH2OH) ROH + HCHO Bilanz der Oxidation, am Beispiel der O-Demethylierung Cytochrom P450 !! Charakteristika !!Hämprotein !!Familie 1-3 wichtig für Fremdstoffmetabolismus !!unspezifisch !!relativ langsam !!induzierbar / hemmbar !!Aktivität abhängig von Spezies, Organ, Alter, Geschlecht, Nahrung, Medikamente Klassifizierung der humanen CYP Enzyme Relative Beteiligung der wichtigsten CYP Enzyme an der Metabolisierung von Arzneimittel Induktion von fremdstoffmetabolisierenden Enzymen !! Induktion: Erhöhung der Proteinmenge aufgrund gesteigerter Transkriptionsrate !!hauptsächlich in Leber !!tritt nicht sofort auf, Induktionszeit !! Nikotin - erhöht CYP1A1 (Placenta) !! EtOH, Aceton - erhöhen CYP2E1 !! Dioxin u.a. planare polycycl. aromatische KH – induzieren CYP1A1/2 Inhibition von fremdstoffmetabolisierenden Enzymen !! Dosis- bzw. konzentrationsabhängig !! klinisch relevante Hemmung tritt in der Regel rasch auf !! bewirkt eine Erhöhung der Spiegel der entsprechenden Substrate, da sie durch das gehemmte Enzym nicht metabolisiert werden !! reversible und irreversible Bindung Biotransformation Phase I weitere Funktionalisierungsreaktionen !! Oxidation durch flavinhaltige Monooxygenasen (FMO) !! Oxidation durch Peroxidasen !! Oxidation durch Alkoholdehydrogenase !! (Nebeneffekt des oxidativen Abbaus: erhöhte Belastung der Zelle mit reaktionsfähigen Sauerstoffspezies) !! Reduktion !! Hydrolyse Kovalente Bindung reaktiver Metabolite an Makromoleküle !! Viele Fremdstoff-Metabolite sind elektrophil ' reagieren mit allen Molekülen in unmittelbarer Nähe ihrer Entstehung !!mit dem metabolisierenden Enzym selbst !!mit Makromolekülen (Protein, DNA) !!mit nucleophilen niedermolekularen Substanzen Metabolit Fremdstoff Harmlos! Phase I Toxisch! Metabolit Phase II Kovalente Bindung reaktiver Metabolite an Makromoleküle !! Durch kovalente Bindung verursachte Veränderungen sind entscheidend für die Toxizität !! Toxische Effekte oft erst bei erschöpften Schutzmechanismen (Bsp. Paracetamol) Fremdstoffmetabolismus Spezies-Auffälligkeiten !! Meerschwein: keine Bildung von Merkaptursäure !! Katze: kann schlecht oder gar nicht Glucuronidieren !! Schwein: kann schlecht Sulfatieren !! Hund: kann schlecht Acetylieren !! Embryonalentwicklung Mensch: CYP bereits im 4. Schwangerschaftsmonat Nagetiere: erst 2-3 Tage vor Geburt Toxikokinetik Elimination Aufnahme (Resorption) Verteilung (Distribution) Speicherung Bindung Elimination Biotransformation Ausscheidung (Exkretion) Wirkort Verminderung der Lipidlöslichkeit zur Verbesserung der Ausscheidung 2 Phasen der Biotransformation Exkretion: renal, biliär Toxikokinetik Elimination durch Exkretion !! Niere (& Harn) - renale Exkretion !! Galle (Leber-Galle-Darm & Fäzes) biliäre Exkretion !! Lunge (& Atemluft) !! Mund - Speicheldrüsen (& Speichel) !! Brust - Milchdrüsen (& Milch) !! Haut - Schweißdrüsen (& Schweiß, Haare) Toxikokinetik Renale Exkretion !! Physiologische Funktion der Niere: Aufrechterhaltung von Osmolalität und Flüssigkeitsvolumen durch !!Rückgewinnung von Salzen, Wasser, Glukose, Aminosäuren, u.a. !!Ausscheidung von Produkten des Intermediärstoffwechsels, z.B. Harnstoff !! Glomeruläre Filtration (120 ml Ultrafiltrat/min vs. 1 ml Urin/min) !! Tubuläre Rückresorption !! Tubuläre Sekretion Toxikokinetik Bau der Niere Glomerulus Proximaler Tubulus Toxikokinetik Renale Exkretion !! Glomerulus: große Poren in Basalmembran (r=3 nm), Filtration bis Molmasse 5000 Da aus Plasma in Primärharn / Ultrafiltrat !! Proximaler Tubulus: Konzentrierung des Primärharns auf 40% des Ausgangsvolumens !! Tubuläre Resorption: !! von lipophilen Stoffen durch passive Diffusion !! Glucose, Aminosäuren, Plasmabestandteile: durch aktive Transportmechanismen !! Säuren und Basen: pH-Wert des Harns !! Tubuläre Sekretion: aktiver Transport für org. Säuren/Basen !! entscheidend für Ausscheidung mit Harn ist, dass die Fremdstoffe ausreichend polar sind Toxikokinetik Biliäre Exkretion !! Aktiver Sekretionsprozeß !! Voraussetzungen: !!Mindestmolekulargewicht (spezies-, geschlechts- und strukturabhängig: Ratte: 325 Da, Meerschwein 400 Da, Mensch 475 Da) !!ausreichende Polarität (z.B. Carboxyl-, Sulfat-Reste) !!bestimmte Strukturmerkmale: modulieren Affinität zum Transportprotein !! gut gallengängige Stoffe > Gallekanälchen !! schlecht gallengängig > venöse Blut> Gewebe> Niere !! Hydrolyse der biliär ausgeschiedenen Produkte durch Darmbakterien (ß-Glucuronidase) - erneute Resorption: enterohepatischer Kreislauf Toxikokinetik Billäre Exkretion Toxikokinetik Exkretion über Lunge Flüchtige Substanzen mit niedrigem Dampfdruck Bsp. FCKW, Ethanol, org. Selenverbindungen