Plasmide und Austausch genetischer Information zwischen Bakterien
Werbung

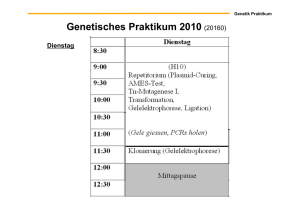
Plasmide und Austausch genetischer Information zwischen Bakterien MPM 4 Austausch genetischer Information Lederberg & Tatum 1946 Minimalmedium: - organische Kohlenstoffquelle - anorganische Salze Vollmedium: Biotin– Methionin– auxotroph Leucin– Threonin– auxotroph - komplexe organische Verbindungen: Aminosäuren, Vitamine, Nucleoside z.B. Hefeextrakt + Proteinlysate prototroph: kann alles selbst synthetisieren und wächst daher auf Minimalmedium auxotroph: kann nicht alles selbst synthetisieren und wächst daher nicht auf Minimalmedium MPM 5 Mechanismus der Reversion zu Prototrophie Warum konnten die Bakterien wachsen, wenn sie miteinander gemischt wurden? Rückmutation? Unwahrscheinlich! Mutationrate in Bakterien: 10-7 pro Gen 1 Bakterium in 107 könnte spontan zur Prototrophie in einem Gen zurück mutieren. Bei zwei Genen würde man nur 1 in 1014 erwarten. Daher bei 108 Zellen keine Kolonien auf Kontrollplatten! Austausch genetischer Information: Konjugation MPM 6 MPM 7 Konjugation Bei der Konjugation wird genetisches Material vom Donor zum Rezipienten transferiert. Der Informationsaustausch ist also asymmetrisch. Was bestimmt, welches von 2 Bakterien Donor und welches Rezipient ist? Der Donor enthält einen Fertilitätsfaktor (d.h. der Donor ist F+), der Rezipient nicht (F–). Dieser Faktor wird heute als F-Plasmid bezeichnet. MPM 8 Plasmide Definition: Plasmide sind extra-chromosomale doppelsträngige, zirkuläre DNAs, die autonom replizieren und unabhängig vom bakteriellen Chromosom vererbt werden. Chromosome Plasmid MPM 9 Plasmide Definition: Plasmide sind extra-chromosomale doppelsträngige, zirkuläre DNAs, die autonom replizieren und unabhängig vom bakteriellen Chromosom vererbt werden. Es gibt viele verschiedene Typen von Plasmiden. F-Plasmide sind nur ein Beispiel. Größe: 1 kBP bis über 1000 kBP (kilo-Basenpaare; oft kb abgekürzt) Plasmide enthalten einen autonomen Replikations-Ursprung, der sich vom Origin des Chromosoms unterscheidet und die Kopienzahl des Plasmids bestimmt (1-800 Kopien pro Zelle). Die genetische Information auf natürlich vorkommenden Plasmiden ist normalerweise nicht essentiell, aber in der Regel von Vorteil für den bakteriellen Wirt. Plasmide können für Antibiotika-Resistenzen, Enzyme zur AntibiotikaProduktion oder zur Nutzung spezieller Nahrungsquellen, für bakterielle Toxine u.a. kodieren. MPM 10 Konjugation: F-Plasmid MPM 11 Mechanismus der Konjugation • • • • • • Viele natürliche Plasmide können zwischen Bakterien durch Konjugation ausgetauscht werden Dazu verbinden sich Donor (F+) und Rezipient (F-) über so genannte Sex-Pili Die Konjugation ist an die Replikation des Plasmids vom Ori T aus gekoppelt. Übertragen wird ssDNA (Einzelstrang-DNA), die im Rezipienten zu dsDNA (Doppelstrang-DNA) komplettiert wird. Der Rezipient wird F+ und kann in weiteren Konjugationen als Donor agieren. Die Donorzelle behält ihre Kopie des F-Plasmids und bleibt F+. MPM 12 Mechanismus der Konjugation + © 2006 Pearson Studium / Abbildung aus: Madigan, Martinko: Brock Mikrobiologie, 11. Auflage / ISBN: 3-8273-7187-2 MPM 13 Mechanismus der Konjugation Die Tra-Gene kodieren für Faktoren, die für die Konjugation benötigt werden, z.B. für Faktoren die den Pilus aufbauen. MPM 14 F+ - und Hfr-Bakterien Bei der Standard-Konjugation werden nur die ≈ 100 000 Basenpaare des FPlasmids übertragen. Unter bestimmten Umständen kann jedoch praktisch das gesamte bakterielle Hauptchromosom mit übertragen werden. Dazu muss der Donor in Hfr-Form vorliegen (high frequency of recombination). Der Rezipient wird bei diesem Ereignis aber nicht F+ oder Hfr sondern bleibt F- MPM 15 F+ - und Hfr-Bakterien MPM 16 Hfr-Bakterien In Hfr-Bakterien ist das F-Plasmid in das Hauptchromosom integriert, das bei der Konjugation dann mit übertragen wird. Der gesamte Transfer dauert etwa 100 min. Die Gene des Hauptchromosoms werden "in geordneter Reihenfolge" transferiert und aus der Zeitabhängigkeit ihres Eintreffens im Rezipienten sind genaue Karten des bakteriellen Chromosoms erstellt worden. MPM 17 Genkartierung in E. coli © 2006 Pearson Studium / Abbildung aus: Madigan, Martinko: Brock Mikrobiologie, 11. Auflage / ISBN: 3-8273-7187-2 MPM 18 MPM 19 R- (Resistenz)-Plasmide R-Plasmide wurden erstmals in den 50-iger Jahren in Stämme des Ruhrerregers Shigella gefunden, die aus Antibiotika-behandelten Patienten isoliert worden waren. Auffallend war, daß diese Stämme eine Mehrfach-Resistenz aufwiesen (gegen Sulfonamide, Streptomycin, Chloramphenikol, Tetracyclin,...) und daß sich diese Resistenzen durch einfachen Zellkontakt auf andere Bakterien wie E.coli übertragen ließen. MPM 20 R- (Resistenz)-Plasmide Ein Beispiel für ein natürlich vorkommendes Plasmid, isoliert aus einem Antibiotika-resistenten Bakterienstamm. ampR kodiert β-Lactamase, die Resistenz gegen Ampicillin und andere Penicillinderivate vermittelt. kanR kodiert eine Kanamycin-Phospho-Transferase. tetR bezeichnet das Tet-Operon, das (mehrere) TetTransporter kodiert, die wiederum Tetrazyclin aus den Bakterien pumpen. OriV steht für den eigentlichen Replikations-Ursprung dieses Plasmids Die tra-Gene kodieren wie beim F-Plasmid für Faktoren, die für die Konjugation benötigt werden. MPM 21 Plasmid-Bakterium-Beziehung Die meisten natürlich vorkommenden Plasmide können nicht nur innerhalb einer Art, sondern auch zwischen (nicht zu entfernten) Spezies übertragen werden. Warum sollte ein Bakterium eine andere, konkurrierende Spezies mit u.U. lebenswichtiger genetischer Information versorgen? Man kann die Interaktion zwischen Plasmiden und Bakterien auch als eine Symbiose zwischen zwei genetischen Systemen verstehen, die sich beide in der Evolution behaupten müssen. Die Bakterien replizieren die Plasmide und übertragen sie an ihre Nachkommen bzw. durch Konjugation auf Vertreter der selben oder anderer Arten. Als "Gegenleistung" versorgen die Plasmide die Bakterien mit nützlicher genetischer Information. Ein Plasmid wird in der Regel um so "erfolgreicher" sein, von je mehr Bakterienstämmen es aufgenommen und repliziert werden kann, je größer der Selektionsvorteil für den Wirt ist und je geringer die Wahrscheinlichkeit ist, daß ein Wirt das Plasmid wieder verliert. MPM 22 Plasmidweitergabe an Tochterzellen Plasmide müssen bei der Zellteilung von der Mutter- auf die beiden Tochterzellen übertragen werden. Dabei kann es passieren, daß eine der Tochterzellen "leer ausgeht" und somit Plasmid-freie Nachkommen entstehen. Bei rein zufälliger Verteilung der Plasmide bei der Zellteilung hängt die Wahrscheinlichkeit, dass bei einer Zellteilung Plasmid-freie Nachkommen entstehen von der Zahl der Plasmide in der Mutterzelle ab: P = 21-n (n = Kopienzahl des Plasmids) Bei einer Kopie geht eine Tochterzelle mit Sicherheit leer aus, d.h. P=1 bei 2 Plasmide gibt es mögliche 4 Kombinationen der Verteilung, von denen 2 zu einer Plasmid-freien Tochterzelle führen, d.h. P=0,5;… Eine zufällige Plasmid-Verteilung (Engl. "Segregation") führt daher früher oder später zu einem spontanen Plasmidverlust (Eng. "curing"), sofern nicht auf Plasmid-haltige Bakterien selektiert wird (z.B. durch Antibiotika-Resistenz oder Auxotrophie-Marker). MPM 23 Mechanismen der Plasmidretension Einige Plasmide werden jedoch ohne äußeren Selektionsdruck sehr viel seltener verloren, als bei einer zufälligen Verteilung zu erwarten wäre. Zwei allgemeine Strategien werden genutzt, um die Stabilität eines Plasmids in einer Population (Engl: plasmid maintenance) zu erhöhen: 1. 2. aktive, d.h. nichtzufällige Verteilung (ähnlich wie Chromosomensegregation in der Mitose von Eukaryoten). Toxin-Antitoxin-Systeme, die Wirtszellen auch ohne äußeren Selektionsdruck töten, sobald sie das Plasmid verlieren. MPM 24 Mechanismen der Plasmidretension 1. Aktive Verteilung der Plasmide Actin ParM MreB TA0583 Segregations Proteine ParM & TA0583 sind Actin-Homologe und bilden in vitro und in vivo Filamente MPM 25 Mechanismen der Plasmidretension 1. Aktive Verteilung der Plasmide Carballido-López (2006) Microbiol. Molecular Biol. Reviews 70:888-909 MPM 26 Mechanismen der Plasmidretension 2. Toxin-Antitoxin System • Protease • • • • Antitoxin Toxin • • Plasmid codiert für ein Toxin und ein Antitoxin Das Antitoxin bindet das Toxin und hält es inaktiv Das Antitoxin ist instabil und wird von zellulären Proteasen abgebaut Das Toxin ist stabil Solange die Zelle das Plasmid enthält wird immer genügend Antitoxin nachgeliefert, um das Toxin inaktiv zu halten Wird bei der Zellteilung das Plasmid nur an eine Tochterzelle weitergegeben, verliert die Plasmidfreie Tochterzelle nach kurzer Zeit das Antitoxin und das Toxin tötet die Zelle ab Nur Zellen, die das Plasmid beibehalten können überleben F. Hayes Science 301, 1496 -1499 (2003) MPM 27 Plasmid codierte Toxin-Antitoxin Paare Plasmid Bacterium Toxin (aa) Antitoxin (aa) Toxin target F E. coli CcdB (101) CcdA (72) DNA gyrase P1 E. coli Doc (126) Phd (73) Translation? RK2 E. coli ParE (103) ParD (83) DNA gyrase R1 E. coli Kid (110) Kis (84) DnaB pTF-FC2 A. ferrooxidans PasB (90) PasA (74) ND pSM19035 S. pyogenes ζ(287) ε(90) ND Rts1 E. coli HigB (92) HigA (104) ND P307 E. coli RelE (95) RelB (83) ND pMYSH6000 S. flexneri MvpT (133) MvpA (75) ND pRUM E. faecium Txe (85) Axe (89) ND F. Hayes Science 301, 1496 -1499 (2003) MPM 28 Inkompatibilität von Plasmiden Viele Bakterien enthalten mehrere verschiedene Plasmide. Diese Co-Existenz besagt, dass diese Plasmide miteinander verträglich oder kompatibel sind. Zwei verwandte Plasmide können in einer Zelle nicht stabil co-existieren; sie sind unverträglich oder inkompatibel. Man teilt Plasmide in Inkompatibilitätsklassen ein, abgekürzt Inc. Zur gleichen Gruppe gehörende Plasmide sind nicht co-existent. Für E. coli wurden >30 Inkompatibilitätsgruppen definiert. Die Inkompatibilität ist mit der Kontrolle der Plasmid-Replikation verknüpft. MPM 29 Austausch genetischer Information zwischen Bakterien Transformation, Transduktion, Konjugation • Transformation: Aufnahme freier DNA aus der Umgebung (Bsp. Griffith, Avery) • Transduktion: Transfer genetischer Information durch einen Vektor z.B. Bakteriophagen • Konjugation: Direkte Übertragung von DNA durch Zell-ZellKontakte © 2006 Pearson Studium / Abbildung aus: Madigan, Martinko: Brock Mikrobiologie, 11. Auflage / ISBN: 3-8273-7187-2 MPM 30 Transformation Experiment von Griffith © 2006 Pearson Studium / Abbildung aus: Madigan, Martinko: Brock Mikrobiologie, 11. Auflage / ISBN: 3-8273-7187-2 MPM 31 Transformation Manche Bakterien können natürliche Kompetenz erwerben (Bsp. Bacillus) In diesem Zustand nehmen sie aktiv DNA aus der Umgebung auf Viele Bakterien können durch chemische oder physikalisch (elektrische Felder) Einwirkungen kompetent gemacht werden In diesem Zustand nehmen sie passiv DNA aus der Umgebung auf © 2006 Pearson Studium / Abbildung aus: Madigan, Martinko: Brock Mikrobiologie, 11. Auflage / ISBN: 3-8273-7187-2 MPM 32 Transduktion Bei der Vermehrung eines lytischen Bakteriophagen wird die Wirts-DNA endonukleolytisch in Fragmente zerlegt. Beim Zusammenbau der Phagennachkommen kann es passieren, dass Wirts-DNA in die Phagenhülle verpackt wird. Bei einer darauf folgenden Infektion wird dann DNA des vorherigen Wirtes anstelle der Phagen DNA in die neue Wirtszelle injiziert. Diese DNA kann durch homologe Rekombination in das Wirtsgenom integrieren. © 2006 Pearson Studium / Abbildung aus: Madigan, Martinko: Brock Mikrobiologie, 11. Auflage / ISBN: 3-8273-7187-2 MPM 33