Einführung in die Biochemie Wirkungsweise von Enzymen
Werbung

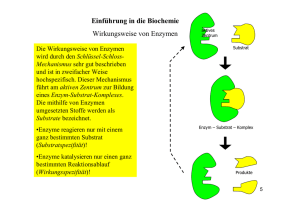
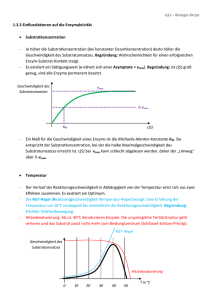
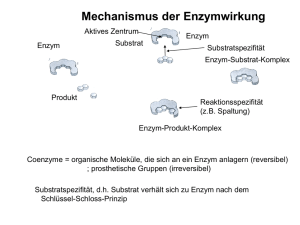
Einführung in die Biochemie Wirkungsweise von Enzymen Am Aktiven Zentrum kann ein Substrat nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der Substratspezifität von Enzymen. Dies resultiert aus dem chemischen Aufbau der Enzyme und der daraus hergehenden räumlichen Struktur. Enzyme sind Kettenmoleküle aus Aminosäuren deren Kettenglieder durch eine Vielzahl verschiedener Bindungen in einer charakteristischen Struktur (Konformation) stabilisiert werden. Als Bindungsarten treten kovalente Bindungen, H – Brückenbindungen und elektrostatische Wechselwirkungen zwischen geladenen Gruppen auf. Am aktiven Zentrum werden außerdem nur bestimmte Reaktionen katalysiert. Diese Eigenschaft wird Wirkungsspezifität genannt. Jede mögliche Reaktion eines Substrats benötigt einen anderen aktivierten Übergangszustand. Das aktive Zentrum eines Enzyms kann aber nur einen bestimmten Übergangszustand aktivieren. D. h. für jede Substratreaktion wird ein anderes Enzym benötigt. Ein Beispiel ist der Abbau von Glucose, in dessen Verlauf Brenztraubensäure enzymatisch entweder in Milchsäure oder in Essigsäure umgesetzt wird 6 Einführung in die Biochemie Nomenklatur von Enzymen Da bei Enzymen nicht immer der genaue Aufbau jedoch aber die Wirkung im Organismus bekannt sind, werden eindeutige Kennzeichen, wie die Substrat- und Wirkungsspezifität für die Benennung herangezogen. Der systematische Name ist dreiteilig: 1. Substratkennzeichnung 2. Wirkungskennzeichnung 3. Endung –ase Beispiele: Glukose │ oxid │ ase Lactat-Dehydrogen │ ase Pyruvat-Decarboxyl │ ase oxidiert Glucose oxidiert Milchsäure zu Brenztraubensäure spaltet CO2 von der Brenztraubensäure Teilweise wird aber auf die Wirkungskennzeichnung im Namen verzichtet: Ure │ ase Lip │ ase Amyl │ ase spaltet Harnstoff spaltet Fette unter Bildung freier Fettsäuren spaltet Stärke 8 Einführung in die Biochemie Enzymaktivität Die Aktivität eines Enzyms, d. h. die Wirksamkeit als Katalysator, wird durch die konkreten Bedingungen der biochemischen Reaktion beeinflusst. Da Enzyme bei Reaktionen nicht verbraucht werden, kann bei der Wirksamkeit von Enzymen nicht die Reaktionsgeschwindigkeit gemessen werden. Man bestimmt die Menge des pro Zeiteinheit umgesetzten Substrats. Einige Umgebungsbedingungen haben einen starken Einfluss auf die Effektivität der enzymatischen Wirkung. Dazu zählen Temperatur, pH-Wert und Substratkonzentration sowie Mineralstoffe und Spurenelemente. Temperatur: Steigende Temperaturen beeinflussen die Reaktionsgeschwindigkeit positiv, weil sich die Enzym- Substratmoleküle schneller bewegen. Bis ca. 30 °C folgt die Aktivitätszunahme der Reaktionsgeschwindigkeit-Temperatur-Regel (RGT-Regel) Dabei erreicht die Aktivität ein Maximum. Bei weiter zunehmender Temperatur denaturieren die Enzyme jedoch wie alle Proteine, so dass jedes Enzym ein Temperaturoptimum besitzt. Bei dieser Denaturierung (Gerinnung) werden die Sekundär- und Tertiärstrukturen der Proteine und somit auch der Funktionsmechanismus zerstört. 11 Einführung in die Biochemie Enzymaktivität pH - Wert: Jedes Enzym ist bei einem bestimmten pH – Wert am aktivsten. Bei den meisten liegt der optimale Wert im neutralen Bereich zwischen 6 und 8. Pepsin allerdings zeigt sein Optimum im sauren Bereich bei pH 2. Der räumliche Bau ist von der Aminosäuresequenz und den Wechselwirkungen zwischen den verschiedenen ionischen Gruppen der Aminosäuren vorgegeben. Aminosäuren haben auch in der Peptidverknüpfung saure und basische Reste. Die Veränderung des pH-Wertes führt zu einer Änderung der Raumstruktur – Substrate können nicht mehr oder nicht mehr optimal gebunden werden. Temperaturoptimum für ein thermophiles Bakterienenzym Temperaturoptimum für ein Enzym beim Menschen 0 20 pH-Wertoptimum von Pepsin und Trypsin Reaktionsgeschwindigkeit Reaktionsgeschwindigkeit Temperaturoptimum von Enzymen 40 60 80 100 Temperatur [°C] optimaler pH-Wert von Pepsinn 0 2 optimaler pH-Wert von Trypsin 4 6 8 pH 12 10 Einführung in die Biochemie Enzymaktivität Konzentration des Substrats: Jede Enzymreaktion kann durch Erhöhung der Konzentration des Substrates beschleunigt werden. Wenn alle Enzymmoleküle besetzt sind hat die Reaktionsgeschwindigkeit ihr Maximum erreicht und steigt nicht weiter an. Der Kurvenverlauf ist für jedes Enzym-SubstratPaar spezifisch; je nach Affinität des Enzyms zum Substrat strebt die Reaktionsgeschwindigkeit in den Sättigungsbereich. Als Maß für die Enzymaffinität verwendet man die maximale Reaktionsgeschwindigkeit Vmax und wählt den halbmaximalen Wert Vmax/2. Der dazu gehörende Konzentrationswert ist KM (Michaelis-Konzentration) 13 Einführung in die Biochemie Enzymaktivität Konzentration des Substrats: Jede Enzymreaktion kann durch Erhöhung der Konzentration des Substrates beschleunigt werden. Anfangs nimmt die Reaktionsgeschwindigkeit proportional zur Substratkonzentration zu und flacht dann ab. Wenn alle Enzymmoleküle besetzt sind hat die Reaktionsgeschwindigkeit ihr Maximum erreicht und steigt nicht weiter an. Vmax Reaktionsgeschwindigkeit Die Kinetik enzymkatalysierter Reaktionen kann durch die Michaelis-Menten-Gleichung beschrieben werden. Vmax/2 14 KM Konzentration des Substrats Einführung in die Biochemie Enzymaktivität Vmax Konzentration des Enzyms: Reaktionsgeschwindigkeit Ermittelt man Sättigungskurven für verschiedene Konzentrationen desselben Enzyms, so erhält man eine Schar von Kurven, deren Vmax zur Enzymkonzentration proportional ist. Dies bedeutet, dass die Michaelis-Konstante KM für alle Enzymkonzentrationen gleich ist. Mineralstoffe und Spurenelemente [E]C Vmax [E]B Vmax/2 Vmax/2 Vmax [E]A Vmax/2 KM Konzentration des Substrats Weitere Einflussgrößen aus der chemischen Umgebung auf die Enzymaktivität sind insbesondere anorganische Ionen, hauptsächlich Mg2+ und Ca2+. Für diese Mineralstoffe gibt es Optimumskurven der Konzentrationen, die denen des pHWertes im Prinzip vergleichbar sind. 15 Einführung in die Biochemie Hemmung der Enzymaktivität Die Enzymwirkung kann durch Hemmstoffe oder Inhibitoren herab gesetzt werden. Dies erfolgt auf zwei verschiedenen Wege: Kompetitive Hemmung Ein Hemmstoffmolekül besitzt eine Ähnlichkeit mit dem Substrat, lagert sich am aktiven Zentrum an und behindert den weiteren Substratabbau. Ist diese Bindung sehr fest wird das Enzym dauerhaft blockiert. Antibiotika blockieren so die Vermehrung von Bakterien. Schwermetallionen, wie Cd2+, Pb2+ und Hg2+ wirken als kompetitive Hemmstoffe in vielen Organismen giftig; sie passen chemisch oft ins aktive Zentrum. allosterisches Zentrum b Su a str t Enzym b u S a str t Enzym kompetitiver Hemmstoff kompetitiver Hemmstoff 16 Einführung in die Biochemie Hemmung der Enzymaktivität Allosterische Hemmung Enzyme haben nur ein aktives Zentrum. Aufgrund ihrer hochkomplexen Struktur können andere Moleküle als das Substrat Andockstationen finden. Diese allosterischen Zentren sind für das Substrat nicht geeignet. Dockt aber ein anderes Molekül dort an, kann die Raumstruktur des Enzyms so verändert werden, dass sich am aktiven Zentrum kein Enzym-Substrat mehr bilden kann. Allosterische Hemmstoffe können nur von außen, nicht durch das Substrat, beeinflusst werden. Sie sind aber nicht immer eine Bedrohung für die Zelle, sondern können auch zur Steuerung biochemischer Prozesse beitragen. allosterischer Hemmstoff allosterisches Zentrum enzymatische b Su str at Enzym Katalyse Enzym b Su ts ra t b Su a str t Enzym 17 Einführung in die Biochemie Koenzyme Bei Transferasen, Phosphotransferasen und anderen Enzymen beobachtet man, dass das Einsetzten der enzymatisch katalysierten Reaktion einen Reaktionspartner voraussetzt. Da ohne diese Reaktionspartner keine Enzymreaktionen zustande kommen können, hat man sie als notwendige Bestandteile der Enzyme aufgefasst und sie Koenzyme genannt. Substrat Koenzym Enzym-SubstratKomplex Enzym Produkt verändertes Koenzym 18