2.1 Stoffe und Stoffkreisläufe • Stoffe in der Umwelt Umweltchemie
Werbung
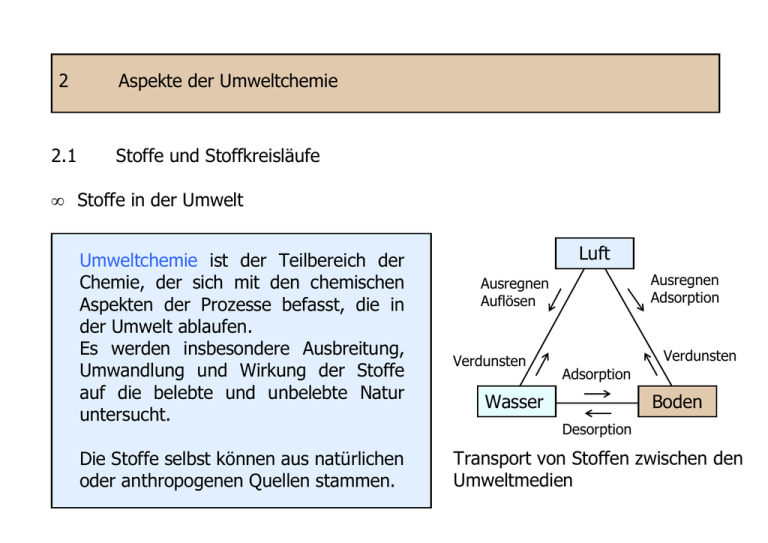
2 2.1 Aspekte der Umweltchemie Stoffe und Stoffkreisläufe • Stoffe in der Umwelt Umweltchemie ist der Teilbereich der Chemie, der sich mit den chemischen Aspekten der Prozesse befasst, die in der Umwelt ablaufen. Es werden insbesondere Ausbreitung, Umwandlung und Wirkung der Stoffe auf die belebte und unbelebte Natur untersucht. Die Stoffe selbst können aus natürlichen oder anthropogenen Quellen stammen. Luft Ausregnen Adsorption Ausregnen Auflösen Verdunsten Wasser e Verdunsten Adsorption Boden Desorption Transport von Stoffen zwischen den Umweltmedien Beispiele für lokale, regionale und globale Umweltbelastungen (Bliefert, 2002) lokal (100 km) Großstadtsmog (NOx, CO, O3, KW) Saurer Regen (SO2, NOx) Wasser Grundwasserverunreinigung (Pestizide, Nitrat) Ozeanverschmutzung (Chemie- und Kommunalabfälle) Boden Immobile Bodenverunreinigung (Schwermetalle) Luft 1) regional (1000 km) globale Destillation (Grashüpfereffekt) ---- global1) Stratosphärischer Ozonabbau, Treibhauseffekt (CO2 / FCKW, CH4) ---- Eigenschaften, Transport und Anreicherung von Stoffen Transport und Anreicherung von Stoffen hängen von ihren physikalischchemischen Eigenschaften ab. Dampfdruck - Druck des Dampfes, der bei gegebener Temperatur mit der Flüssigkeit im Gleichgewicht steht - nur von der Art des Stoffes und der Temperatur abhängig - Maß für die Flüchtigkeit einer Substanz - erhöht sich mit steigender Temperatur 0.023 bar 1,013 bar 15,55 bar 85,88 bar 210,4 bar Pkr 20 °C 100 °C 200 °C 300 °C 370 °C Tkr https://de.wikipedia.org/wiki/Dampfdruck Dampfdruck von Flüssigkeiten im offenen System (www.chemgapedia.de) Druck in bar 1,013 bar 1,00 0,75 Ethanol 0,50 Ether 0,25 Wasser e 0 20 40 34 60 80 78 100 Temperatur in °C Siedepunkt Temperatur, bei welcher der Dampfdruck der Flüssigkeit gleich groß dem äußeren Atmosphärendruck ist Einteilung von VOC (nach WHO) Verbindungen VVOC VOC Very Volatile Organic Compounds Volatile Organic Compounds SVOC Semi Volatile Organic Compounds POM Organic compound associated with particulate matter or particulate organic matter Schmelzpunkt Schmelztemperatur in Abhängigkeit des Druckes Siedebereich (°C) < 0 bis 50…100 50…100 - 240…260 240…260 - 380…400 > 380 Phasendiagramm des Wassers (Skizze nicht maßstabsgerecht) - Bedingungen, Wasser fest, gasförmig ist Siedepunktskurve Druck / bar 221 krP Schmelzkurve Druck-Temperatur-Zustandsdiagramm Wasser bei denen flüssig oder - Aggregatzustände werden durch Phasengrenzlinien begrenzt Tripelpunkt (Tp) Eis Smp 1,013 0,006 - Eis, Wasser und Wasserdampf liegen im Gleichgegewicht vor Sdp Wasserdampf Tp Kritischer Punkt (krP) - 273,15 0 0,01 Sublimationskurve 100 374 Temperatur / °C - Gas und Flüssigkeit besitzen die gleiche Dichte und sind nicht mehr unterscheidbar (überkritisches Fluid). Flüchtigkeit Einteilung der Flüchtigkeit von Lösungsmitteln anhand der Verdunstungszahl (VD) bei 23 °C, 50 % rel. Luftfeuchtigkeit, abhängig vom Dampfdruck VD = VDZ(LM) VDZ(LM) = VDZ(Ether ) 1 VDZ - Verdunstungszeit Flüchtigkeit VD leichtflüchtig VD bis 10 mittelflüchtig VD 10 bis 35 schwerflüchtig VD 35 bis 50 sehr schwerflüchtig VD über 50 Wasserlöslichkeit, Fettlöslichkeit Verteilungskoeffizient in 1-Octanol / Wasser als Maß, je größer POW, desto besser Fettlöslichkeit ist die Verbindung ( Anreicherung im Fettgewebe) POW = c1−Oc tan ol ( X ) c Wasser ( X ) Verbindung Formel POW Ethanol C2H5OH 0,5 Benzol C6H6 130 1,4-Dichlorbenzol C6H4Cl2 Hexachlorbenzol DDT C6Cl6 2500 1,6 ⋅ 106 1,6 ⋅ 106 Absorption (lat. absorbiere: verschlingen) - Eindringen von Gasen oder Gasgemischen in eine Flüssigkeit oder einen festen Stoff (Absorptionsmittel, Absorbens) - aufgenommenes Gas bildet mit dem Lösungsmittel homogene Lösungen Löslichkeit von Gasen s. 2.3 in Wasser in Wasser p(X) - Henry-Konstante Maß der Wasserlöslichkeit, z. B. K25(O2) = 1,26 ⋅ 10-3 mol/L ⋅ bar - Zusätzlich zur rein physikalischen Löslichkeit können chemische Folgereaktionen ablaufen, z. B. CO2 in Wasser: CO2 + H2O [H2CO3] c(X) H+ + HCO3c(X) = K · p(X) Sauerstoffkonzentration von luftgesättigtem Wasser (1013 mbar) Konzentration in mg/L 16 14 12 10 8 6 4 Minimum für Fische: 4 mg/L 2 0 0 5 10 15 20 25 Temperatur in °C 30 35 40 Adsorption (lat. adsorbere: an sich ziehen, ansaugen) - Adsorption als Anlagerung von Gasen, Flüssigkeiten oder gelösten Stoffen an Phasengrenzflächen, also an Oberflächen von Feststoffen oder Flüssigkeiten durch zwischenmolekulare Kräfte (Van-der-Waals-Wechselwirkungen, Wasserstoffbrücken Physisoption) oder chemische Bindungen ( Chemisorption)1). - Der zu adsorbierende Stoff wird als Adsorptiv, die adsorbierte Substanz als Adsorbat und das Adsorptionsmittel als Adsorbens bezeichnet. Aktivkohle als Adsorbens 1 cm Aaußen : Ainnen = 1 : >10.000 Hohe Effizienz auf Grund der großen inneren Oberfl. (300 - 2000 m2/g) 1) Bindungsenergie 4 - 40 bzw. 40 - 420 kJ/mol Wenige Gramm Aktivkohle besitzen die Oberfläche eines Fußballfeldes! Einflüsse auf die Adsorption an Oberflächen - Adsorptiv: Aggregatzustand, Teilchenform, Größe und Polarität - Adsorbens: Geometrie, Porosität, Zusammensetzung, Struktur der Oberfläche - Physikalisch-chemische "Affinität" zwischen Adsorbens und Adsorptiv Physisorption: Dispersionskräfte Dipol-Dipol-Kräfte Wasserstoffbrücken Chemisorption: Ion-Dipol-Kräfte hydrophil Adsorbentien hydrophob Ionenbindung kovalente Bindungen Kieselgel Al2O3 Zeolithe polare Adsorptive e Aktivkohle unpolare Adsorptive e - Temperatur und Druck, Darstellung als Adsorptionsisotherme für T = konst. N = f(p) (N = Anzahl der adsorbierten Teilchen, p = Druck) Anwendungen von Aktivkohle - Luft- und Gasreinigung - Wasserreinigung - Entfärbung und Reinigung von Flüssigkeiten - Träger für Katalysatoren - medizinische Anwendungen - Anreicherung von Metallen Oberflächenspannung, Benetzbarkeit Luft - stärkere zwischenmolekulare Kräfte in der Oberfläche einer Flüssigkeit, zeigt Verhalten einer gespannten, elastischen Membran Grenzfläche Wasser - Feststoffe mit hoher Oberflächenenergie werden durch Flüssigkeiten mit geringerer Oberflächenenergie bzw. Oberflächenspannung benetzt - Kontakt- oder Randwinkel α als Maß für die Benetzbarkeit einer Oberfläche α hydrophil Starke Kräfte innerhalb der Flüssigkeit Kräfte heben sich im Innern auf α hydrophob Lotus-Effekt … im Bauwesen Mikrostrukturierte, hydrophobe Oberfläche SI-Fassadenfarbe/Dachziegel Wassertropfen liegt auf äußersten Spitzen der Mikrostruktur auf, Kontaktwinkel ca. 160 °, Kontaktfläche 2 bis 3 % Selbstreinigungseffekt, weniger Wachstum von Mikroorganismen Partikel liegen ebenfalls lose auf, Benetzung und Haftung am Tropfen Wirkung hinterfragen! Umweltchemikalien Ferntransport von Schadstoffen Umweltchemikalien oder Xenobiotika (griech. xenos: Gast, Fremder; bios: Leben), fremd in biologischen Systemen - Stoffe, die durch menschliche Tätigkeit in die Umwelt gelangen oder als Folge davon dort entstehen oder in höherer Konzentration als naturgemäß üblich, auftreten - häufig Gefährdung von Lebewesen - Schwermetalle, Kunststoffe, Cl-KW … - POP´s (Persistant Organic Pollutants), schwer abbaubar bzw. persistent Organochlor-Insektizide (DDT u. a.) PCB aus Industrieanwendungen Dioxine aus Verbrennungsprozessen Umwelthormone oder Xenohormone Alpengletscher Freisetzung von DDT, PCB u. a. Kunststoffmüll in den Weltmeeren - Untersuchung durch UN-Umweltprogramm organisation Ocean Conservancy (Unep) und Meeresschutz- - Haus- und Industrieabfälle, gelangen über Flüsse ins Meer, Verschmutzung durch internationale Schifffahrt und Tourismus - Nach Schätzungen zirkulierten 2008 ca. 100 Mio t Kunststoffmüll in den Meeren, Eintrag pro Jahr 6,4 Mio t Müll - Ansammlung in zirkulierenden Meeresströmungen (Bildung gigantischer Müllstrudel) Nordpazifikwirbel "Great Pacific Garbage Patch" - Vollständiger Abbau von Kunststoffen im Meer dauert bis zu 450 Jahre1) 1) http://www.bundestag.de/ dokumente/analysen/2010/Plastikmuell.pdf Gefährdung des Ökosystems - Verwechslung mit Beutetieren, Zerfall durch Wellen und UV-Licht in immer kleinere Partikel, Aufnahme durch Meerestiere bis zum Plankton Nahrungskette - Freisetzung von Inhaltsstoffen (Weichmacher, Flammschutzmittel …), Bindung von Giftstoffen (DDT, PCB, Hg) - 13.000 Kunststoffteile/km2 Meeresoberfläche (UBA, 2014) OSPAR-Vertrag, HELCOM-Komission - Vertrag über den Schutz der Nordsee und des Nordostatlantik, Aktionsplan 2014 geordnete Abfallentsorgung an Land Anwendung effektiver Reinigungsmaßnahmen (Fishing-For-Litter-Initiative1)) Entsorgung von Schiffsabfällen in Häfen Reduktion des Einsatzes von Mikroplastik Erarbeitung von Bildungsmaterialien 1) Entsorgung aufgefangener Abfälle in Häfen - zwischenstaatliche Kommission zum Schutz der Ostsee Projekt "The Ocean Clean up" (Boyan Slat, TU Delft, 2012) - Crowdfunding - Studie 2012 - V-förmige Barrieren, bis zu 300 km Länge - Befestigung am Grund - Auffangstation mittig Ethinylestradiol - Antibabypille Umwelthormone Umwelthormone (endokrine Disruptoren, Xenohormone) sind Umweltschadstoffe, die wie Hormone wirken und so bereits in sehr geringen Konzentrationen zu Störungen des tierischen und menschlichen Hormonsystems führen können. - In Abwässern aus Wohngebieten und Industrieanlagen - Wirkung in sehr geringen Konzentrationen DDT - Insektizid PCB - Hydraulik- und Trafoöl, Weichmacher Bisphenol A - für PC, EP Nonylphenol - Tensid, Fungizid - Weichmacher - Hilfsstoff DEHP - Weichmacher Benzo-(a)-pyren - Verbrennung PFC - Imprägnierung, Tensid Terbutryn - Herbizid zinnorg. Verb. - Stabilisator - Biozid - Bioakkumulation - Schädigungen der Fortpflanzungsfähigkeit (Mensch!), des Wachstums und der Entwicklung Mögliche Auswirkungen von Umwelthormonen auf den Menschen1) - hormonabhängige Tumore (Prostata-, Hoden- und Brustkrebs) - Stoffwechselerkrankungen (Diabetes mellitus, Adipositas) - Verhaltensauffälligkeiten (Autismus, Aufmerksamkeitsdefizit-(Hyperaktivitäts-)Syndrom (AD(H)S)) - neurologische Erkrankungen (Alzheimer, Demenz) - früheres Einsetzen der Pubertätsentwicklung - Auftreten von Fehlbildungen der männlichen und weiblichen Geschlechtsorgane - abnehmende Fruchtbarkeit durch eine sinkende Spermienqualität 1) http://www.umweltbundesamt.de/themen/gesundheit/umwelteinfluesse-auf-den-menschen/chemische-stoffe/ umwelthormone Abbaubarkeit von Umweltchemikalien Biotischer Abbau: durch Mikroorganismen Aerober mikrobieller Abbau Anaerober mikrobieller Abbau Mineralisierung Fäulnis (Spezialisierung) Aerobe Bedingungen Anaerobe Bedingungen C, H CO2, H2O C, H CH4, H2 N NO3- N Amine, NH3, N2 S SO42- S H2S P PO43- P PH3 Abiotischer Abbau: Hydrolyse, Oxidation, photochemischer Abbau Reaktivität: biotische (biologische) Halbwertszeit nicht persistent: Stunden bis Wochen persistent: mehrere Jahre Anreicherung von Umweltchemikalien Anreicherung (Akkumulation) eines Schadstoffes in einem Teil des Ökosystems, abhängig von chemisch-physikalischen Eigenschaften CCl4 Bioakkumulation (Lösemittel) Luft (Verdunstung) Atrazin (Herbizid) Wasser (Absorption) DEHP (Weichmacher) feste Phase (Adsorption) Anreicherung von Schadstoffen durch Organismen direkte Anreicherung, aus dem umgebenden Medium (Wasserlebewesen) indirekte Anreicherung, über die Nahrungskette (Landlebewesen) Bioakkumulationsfaktor auch Bioconcentration Factor (BCF) BCF(Schadstoff) = c(Lebewesen) c(Medium) Bioakkumulation - Anreicherung von Schwermetallen aus dem Boden durch Pilze, Moose, Flechten und Wild- und Nutzpflanzen (Niederschlag, Klärschlamm …) 137 Cs (Tschernobyl) Rentierflechte Rentier Mensch - Anreicherung von Quecksilber und PCB aus dem Meerwasser, BCF für Hg bis 105 (∅ 0,03 µg/L Meerwasser), PCB bis 108 (∅ 0,002 µg/L Meerwasser) Anreicherung von fettlöslichem PCB in der Nordsee (Bliefert, 2002) c in mg/kg BCF Meerwasser 0,000 002 - Sediment 0,01 5 ⋅ 103 Wirbellose 7,8 3,9 ⋅ 106 Phytoplankton 8,4 4,2⋅ 106 Zooplankton 10,3 5,15 ⋅ 106 Fische 19 9,5 ⋅ 106 Seevögel 110 5,5 ⋅ 107 Meeressäuger 160 8 ⋅ 107 Schadwirkung durch (Umwelt)chemikalien Chemikaliengesetz (ChemG) Gefahrstoffverordnung GefStoffV Technische Regeln Gefahrstoffe TRGS darin Umsetzung von EU-Recht REACH-Verordnung Kennzeichnung von Gefahren für die menschliche Gesundheit und die Umwelt bei Herstellung, Transport und Verwendung von Chemikalien bzw. Gefahrstoffen durch normierte Markierung und Beschriftung entsprechend GefStoffV. GHS-System1) Gefahrensymbol, insgesamt 9 Symbole GHS 01 - 09 jeweilige Kodierung entsprechend Symbol Achtung/Gefahr Signalwort Art der Gefahr Gefahrenklasse, Gruppe von Chemikalien mit vergleichbaren Eigenschaften und Wirkungen, Unterteilung in Kategorien H H-Sätze, Gefährdungen P P-Sätze, Sicherheitshinweise Gefahrgutklasse für den Transport 1) Global Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien Alt Bedeutung entspr. Gefahrenklasse E explosionsgefährlich F+ hochentzündlich explosionsgefährlich entzündlich F leichtentzündlich O brandfördernd entzündend wirkend Gase unter Druck C ätzend T+ sehr giftig ätzend, korrosiv akut giftig T giftig Xn gesundheitsschädlich Xi reizend Gesundheitsgefahr1) Achtung N 1) umweltgefährlich außer giftig, augen- und hautreizend gewässergefährdend Neu Zeitpunkt der Schadwirkung1) akut innerhalb weniger Tage subakut bis nach 90 d chronisch nach mehr als 6 Monaten, auch mehrmalig kleinste Mengen Art der Schadwirkung reversibel irreversibel Organische Spurenstoffe im Wasser Angabe von Höchstwerten durch UBA, z. B. gesundh. Orientierungsw. (GOW), 0,01 - 3 µg/L Zulassung und Beschränkung besonders besorgniserregender Stoffe, SVHC2) - Stoffe mit cancerogener, mutagener und/oder reprotoxischer (teratogener) Wirkung CMR-Stoffe - persistente, bioakkumulierbare und toxische Stoffe - sehr persistente und sehr bioakkumulative Stoffe 1) PBT-Stoffe vPvB-Stoffe GHS-System vorrangig sinnvoll zur Charakterisierung von akuten/subakuten Wirkungen höherer Schadstoffkonzentrationen, Umweltchemikalien in der Regel mit chronischer Wirkung 2) Substances of Very High Concern; http://www.reach-info.de/svhc.htm • Globale Stoffkreisläufe Fast alle Stoffe sind an Kreisläufen (Zyklen) beteiligt: Sie bewegen sich in unterschiedlichem Ausmaß und mit verschiedenen Geschwindigkeiten zwischen den Kompartimenten Atmosphäre, Hydrosphäre, Lithosphäre und Biosphäre. Der Kohlenstoffkreislauf Transport: Flüsse Transport, Speicher: Atmosphäre Speicher: Boden, Ozeane Anreicherung von Stoffen - Senke Abreicherung von Stoffen - Quelle Aufenthaltsdauer bzw. Verweilzeit von Elementen und Verbindungen in den Der Kohlenstoffkreislauf Kompartimenten unterschiedlich lang Atmosphäre Boden Ozeane Flüsse Stoffkreislauf, z. B. C, N, S oder P Stoffkreisläufe und mittlere Verweilzeiten (Bliefert, 2002) Atmosphäre 1a Hydrosphäre 100 - 1000 a Pedosphäre 100 - 1000 a Lithosphäre 1.000.000 a Der Kohlenstoffkreislauf Wichtige Teilschritte - Aufnahme von CO2 bei der Photosynthese, Abgabe von CO2 bei der Atmung der lebenden Organismen und infolge Verbrennung - Bildung von organischen C-Speichern im Boden (fossile Brennstoffe) - Einlagerung von Carbonat und organischem Kohlenstoff in marine Sedimente - Umwandlung der verschiedenen Formen des sedimentären Kohlenstoffs in CO2 im oberen Erdmantel, Freisetzung bei vulkanischen Prozessen Atmosphäre 1 : 800 Gt C als CO2 Hydrosphäre 48 : 38.000 Gt C als CO2, HCO3-, CO32wirkt als CO2-Senke Lithosphäre 75 000 60.000.000 t C als CaCO3, CaMg(CO3)2 Kohlenstoffkreislauf (schematisch)