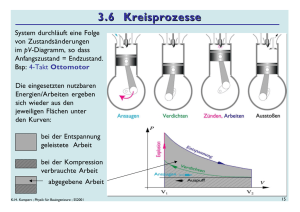
3.5 Zustandsänderung von Gasen
Werbung

3.5 Zustandsänderung von Gasen Ziel: Besprechung der thermodynamischen Grundlagen von Wärmekraftmaschinen und Wärmepumpen Zustand von Gasen wird durch • Druck p, • Volumen V, und • Temperatur T beschrieben Zustandsänderungen • isochor • isobar • isotherm • adiabatisch K-H. Kampert ; Physik für Bauingenieure ; SS2001 thermodyn. Zustandsgrößen sind auf vier verschiedene Arten möglich: (Volumen konstant) Energieaustausch (Druck konstant) mit Umgebung (Temperatur konstant) (kein Wärmeaustausch mit Umgebung) 1 pV-Diagramm p isochor isobar ~1/V V isotherm: p·V=const (Vgl. Boyle Mariotte) adiabatisch: p·V/ T=const (Abkühlung bei der Expansion bewirkt verstärkte Druckabnahme) Prinzip der Energieerhaltung bei Zustandsänderungen führt zum... K-H. Kampert ; Physik für Bauingenieure ; SS2001 2 1. Hauptsatz der Wärmelehre Bei Zufuhr von Wärme DQ kann Gas die innere Energie DU erhöhen und mechanische Arbeit DW leisten: DQ = DU + DW Vorzeichenkonvention: DQ > 0 : dem Gas zugeführte Wärme DQ < 0 : vom Gas abgegebene Wärme DW < 0 : dem Gas zugeführte mechanische Arbeit DW > 0 : vom Gas abgegebene mechanische Arbeit Bsp: Gas dehnt sich bei konstantem Druck p aus fl das Gas leistet mechanische Arbeit zur Vergrößerung des Volumens Arbeit = Kraft · Weg = F·Ds = (p·A) · Ds = (p·A) · DV/A = p · DV fl DW = p · DV K-H. Kampert ; Physik für Bauingenieure ; SS2001 fl W = ∫ p(V) · dV Vorzeichen lt. Konvention oben 3 Erläuterung der inneren Energie U: Isochore Zustandsänderung V sei konstant, während die Wärmemenge DQ zugeführt wird, d.h.: DV = 0 fl DW = 0 fl DQ = DU + DW = DU Die zugeführte Wärmemenge DQ wird also allein zur Erhöhung der inneren Energie des Gases verwendet Hierfür gilt: DQ = cv · m · DT fl DU = cv · m · DT Wichtiges Ergebnis: Die innere Energie eines idealen Gases wird allein von der Temperatur bestimmt. p p2 p1 DQ = Q1,2 = cv · m · (T2-T1) ; DW = 0 K-H. Kampert ; Physik für Bauingenieure ; SS2001 T2 T1 V 4 Isobare Zustandsänderung Wärmemenge DQ wird bei konstantem Druck zugeführt fl Volumenänderung p DQ = DU + DW T2 T1 DW V1 = p·DV = cv · m · DT = cp · m · DT V2 V ï DW=p·DV cp · m · DT = cv · m · DT + p·DV ‹ m · (cp - cv) · DT = p · DV bzw. m · (cp - cv) · T = p · V Vergleiche mit Zustandsgl.: m · R s · T = p · V ï K-H. Kampert ; Physik für Bauingenieure ; SS2001 R s = cp - cv Mayersche Gleichung 5 Isotherme Zustandsänderung Gastemperatur muss während der Zustandsänderung konstant gehalten werden fl Kontakt mit Wärmebad erforderlich DQ = DU + DW p DQ = p · DV = DW T1 DW V1 Weitere Auswertung erfordert Kenntnis p = p(V): V2 V verwende Zustandsgl.: p · V = m · R s · T Einsetzen: DW = p · DV = ( m · R s · T / V ) · DV V2 V p dV = m ⋅ Rs ⋅ T ⋅ ln 2 = m ⋅ Rs ⋅ T ⋅ ln 1 V1 p2 V V1 1 Beachte Vorzeichen: V2 > V1 fl Gas leistet Arbeit p∝ d.h. W1,2 > 0 V K-H. Kampert ; Physik für Bauingenieure ; SS2001 Integrieren: W1, 2 = m ⋅ Rs ⋅ T ⋅ ∫ 6 Wiederholung vom 10.5.01 Zustandsänderungen von Gasen: isobar, ischor, isotherm, adiabatisch Alle Prozesse werden durch den 1. Hauptsatz der Wärmelehre beschrieben: DQ = DU + DW mechanische Arbeit: DW=W12 = p · DV bzw. fl W = ∫ p(V) · dV isochor: DV = 0 fl DW = 0 fl DU = cv · m · DT p isobar: W12 = p ·DV DQ = cp · m · DT DU = cV · m · DT W12 p T2 T1 W12 V1 isotherm: DU = 0 V2 K-H. Kampert ; Physik für Bauingenieure ; SS2001 V W12 V1 V2 = m ⋅ Rs ⋅ T ⋅ ln V1 p = m ⋅ Rs ⋅ T ⋅ ln 1 p2 T1 V2 V 7 Adiabatische Zustandsänderung Während der Zustandsänderung wird das Gas thermisch isoliert fl DQ = 0 DQ = 0 = DU + DW p Isothermen Adiabate DQ T1=const Auswertung erfordert wieder Zustandsgleichung: =0 T2=const DW V1 ⇒ V2 V V2 ⇔ = cv · m· DT + W12 ‹ W12 = - cv · m · DT = ∫ p(V) · dV V2 ∫ V1 T 2 dV dT (c p − cv ) ⋅ ∫ = − cv ⋅ ∫ V T V1 T1 K-H. Kampert ; Physik für Bauingenieure ; SS2001 p(V) = m · R s · T / V m ⋅ Rs ⋅ T ⋅ dV = − cv ⋅ m ⋅ dT V V2 T2 dV dT ⇒ Rs ⋅ ∫ = − cv ⋅ ∫ V T V1 T1 ⇒ (c p − cv ) ⋅ ln V2 T = − cv ⋅ ln 2 V1 T1 8 Adiabatische Zustandsänderung (2) (c p − cv ) ⋅ ln ⇔ V2 T = − cv ⋅ ln 2 V1 T1 Mithilfe der Zustandsgleichung können wir auch T in Relation zu p, oder V in Relation zu p bringen: p1 ⋅ V1 p2 ⋅ V2 V p ⋅T = = const. ⇒ 2 = 1 2 T1 T2 V1 p2 ⋅ T1 c p − cv V T ⋅ ln 2 = + ln 1 cv V1 T2 V2 T1 ⇔ = T2 V1 c p − cv cv cp V2 cV = V1 mit cp Adiabatenkoeffizient κ = cV dann: V2 T1 = T2 V1 κ −1 ❶ −1 p1 ⋅ T2 T1 ⇒ = T2 p ⋅ T 2 1 p1 p2 T1 p1 ⇒ = ❶❷ ❸: T2 p2 Poissonsche Gleichungen K-H. Kampert ; Physik für Bauingenieure ; SS2001 κ −1 κ −1 T = 2 T1 p1 = p2 −1− (κ −1) κ −1 T2 ⋅ T1 T = 2 T1 −κ κ −1 T2 = T1 T = 1 T2 −1 κ ❶,❷ gleichsetzen: κ −1 κ ❷ ⇒ p1 V2 = p2 V1 κ ❸ 9 Aus Gl ❸ findet man unmittelbar: p1 V2κ = κ ⇔ p1 ⋅ V1κ = p2 ⋅ V2κ = p ⋅ V κ = const p2 V1 Poissonsches Gesetz ( Gleichung der Adiabaten des idealen Gases ) Bsp: Dieselmotor Berechnen Sie die Temperaturerhöhung der angesaugten Luft in einem Dieselmotor. Es handelt sich hierbei näherungsweise um eine adiabatische Kompression von Luft (T1 = 25°C, p1 = 1 bar, κ=1,4) von 1 bar auf 38 bar. T1 p1 Gleichung ❷ liefert Relation zwischen T und p: = T2 p2 p2 ⇒ T2 = T1 ⋅ p1 κ −1 κ 38 = 298 K ⋅ 1 1.4 −1 1.4 κ −1 κ ⇔ T2 p2 = T1 p1 κ −1 κ ≅ 843 K = 570 °C Welche mechanische Arbeit wird hierbei an dem Gas geleistet ? K-H. Kampert ; Physik für Bauingenieure ; SS2001 10 Volumenarbeit bei adiabatischer Kompression p W12 = ∫ p·dV = –DQ = - cv·m· DT < 0 ; am Gas wird Adiabate Arbeit DQ = + cv·m· (T1–T2) < 0 T2=const =0 geleitstet Isothermen T1=const W12 V2 V1 V p1 ⋅ V1 p2 ⋅ V2 p ⋅V = = const. ⇒ T2 = 2 2 ⋅ T1 T1 T2 p1 ⋅ V1 p V − p2V2 m ⋅ cv ⋅ T1 pV = W1, 2 = m ⋅ cv T1 − 2 2 T1 = m ⋅ cv ⋅ T1 1 1 ( p1V1 − p2V2 ) p1V1 p1V1 p1V1 ( ) Benutze p1V1 = m ⋅ Rs ⋅ T1 = m ⋅ c p − cv ⋅ T1 1 m ⋅ cv ⋅ T1 ⇒ W1, 2 = ( p1V1 − p2V2 ) = κ − 1 ( p1V1 − p2V2 ) m ⋅ c p − cv ⋅ T1 ( K-H. Kampert ; Physik für Bauingenieure ; SS2001 ) 11 Polytrope Zustandsänderungen Praxis: weder isotherme noch adiabatische Zustandsänderungen leicht realisierbar (es gibt weder eine ideale Kopplung mit einem Wärmebad noch eine ideale Isolation) Vergleicht man beide Prozesse: p1 V2 isotherm, z.B: = p2 V1 Isotherm entspricht adiabatisch für k=1 κ p1 V2 adiabatisch: = p2 V1 Führe daher zur Beschreibung von Mischformen den Polytropenkoeffizienten n ein, mit 1< n < k ⇒ K-H. Kampert ; Physik für Bauingenieure ; SS2001 p ⋅ V n = const Gleichung der Polytrope eines idealen Gases 12 Bsp: Entspannung von Druckluft Entspanne 1 kg Druckluft ( κ = 1.4) von p1 = 10 bar auf p2 = 1 bar. Die Anfangstemperatur T sei 20°C. Wie groß ist die Temperatur nach dem Vorgang, wenn dieser (a) adiabatisch und (b) polytrop (n = 1.2) abläuft ? 1 = 293 K ⋅ "# $% 10 " 1$ = 293 K ⋅ # % 10 1.4−1 1 .4 1.2−1 1 .2 = 152 K = -121 °C = 200 K = - 73 °C Wie groß ist die mechanische Arbeit in beiden Fällen (cv = 718 J/(kg·K) )? J adiabatisch: W12 = m · cV (T1 T2 ) = 718 ⇥ (293 152)K = 101kJ K 1 J 0.4 (T1 T2 ) = 718 · · (293 200)K = 132 kJ polytrop: W12 = m · cV · n 1 K 0.2 (Erklärung: die zusätzlichen 31 kJ werden der Umgebung als Wärme entzogen, daher kein „Gewinn“ gegenüber dem adiabatischen Fall!) K-H. Kampert ; Physik für Bauingenieure ; SS2001 13 Übersicht =adiabatisch K-H. Kampert ; Physik für Bauingenieure ; SS2001 14