Phagozytose, Rezeptoren der angeborenen Immunität, Komplement
Werbung
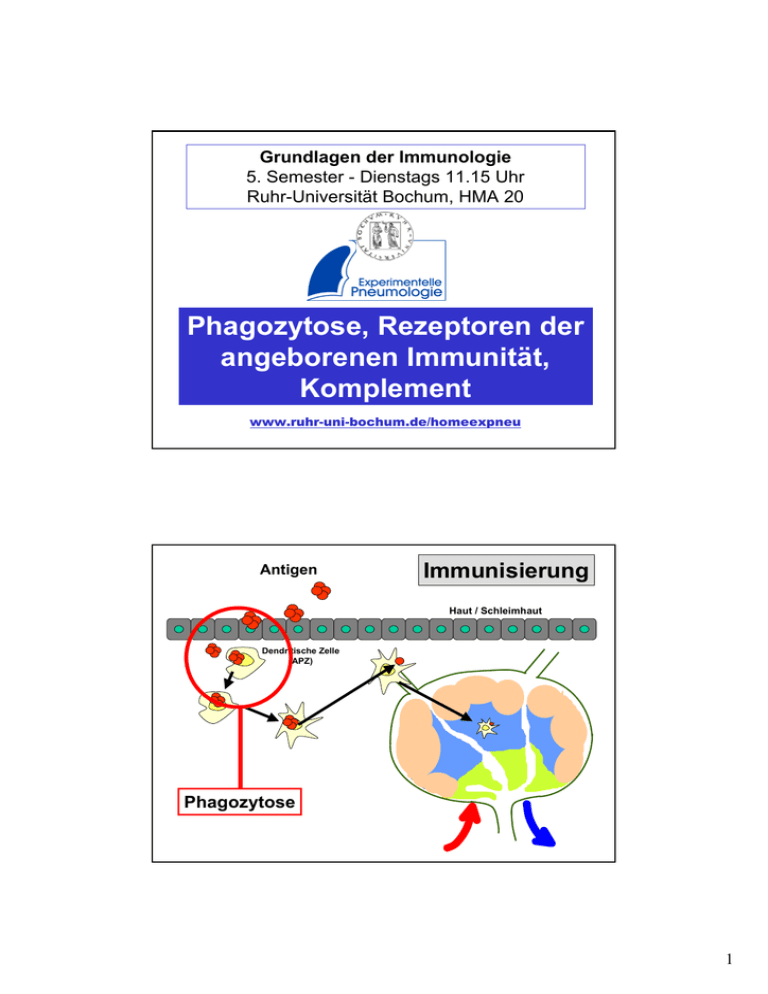
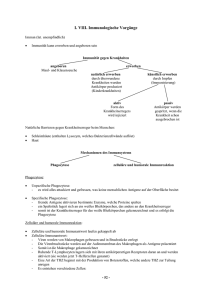
Grundlagen der Immunologie 5. Semester - Dienstags 11.15 Uhr Ruhr-Universität Bochum, HMA 20 Phagozytose, Rezeptoren der angeborenen Immunität, Komplement Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu Antigen Immunisierung Haut / Schleimhaut Dendritische Zelle (APZ) Phagozytose 1 Motto der heutigen Vorlesung Gefahr erkannt, durch Fressen gebannt. Phagozyten Makrophagen (im Gewebe (einkernig)) (Entwicklung) Monozyten (im Blut) • langlebig • bei Aktivierung werden Neutrophile Granulozyten = PMN=polymorphkernige neutrophile Leukozyten (nur im Blut, nicht im Gewebe) • kurzlebig Cytokine* und andere Mediatoren freigesetzt, die u.a. neutrophile Granulozyten anlocken *wichtig für lokale Entzündungsreaktionen und Vermittlung der induzierten, nichtadaptierten Reaktion 2 Monozyten-/ MakrophagenSystems Gehirn MikrogliaZellen Alveolarmakrophagen Leber KupfferStern- Zellen Milzmakrophagen Niere Mesangiale Phagozyten Blutmonozyten Lymphdrüse residente und umlaufende Makrophagen Synoviale A-Zellen Vorläufer im Knochenmark Osteoklasten Pro Tag 100 g Granulozyten (ca. 1011 Zellen) Pluripotente hämatopoetische Stammzelle KM Aktivierter Makrophage Blut Gewebe Myeloide Vorläuferzelle Monozyt Makrophage IFN-γ (aus T-Zellen: CD4 und CD8; NK-Zellen) Neutrophile Zelle CSF and G-CSF M-CSF (aus Fibroblasten, Endothel- und Epithelzellen) (aus Fibroblasten, Endothel- und Epithelzellen) 3 Phagozytose PAMPs eines bestimmten Bakteriums binden z. B. an den Mannose-Rezeptor. Dies löst eine Phagozytose aus. Mannose-Rezeptor 4 Umhüllung (Engulfment) des RezeptorBakteriumkomplexes Bildung eines Phagosomen Lysosom (enthält Lysozym) 5 Entstehen eines Phagolysosomen Lysosom (enthält Lysozym) Lysozym verdaut Bakterienwand und die übrigen Anteile der Bakterienzelle durch saure Hydrolyse 6 Intrazellulärer Verdau der Pathogene durch: Ansäuerung pH = 3,5-4, bakteriostatisch und bakterizid Toxische O2-Derivate O2-(Superoxid), H2O2(Wasserstoffperoxid), 02(Singletsauerstoff), OH(Hydroxylradikal), OCl- (Hypohalit) Toxische Stickoxide Stickstoffoxid NO Antimikrobielle Peptide Enzyme Defensine, kationische Proteine Lysozym - löst Zellwand einiger grampositiver Bakterien auf Saure Hydrolasen – zerkleinern Bakterien weiter Kompetitoren Laktoferrin – bindet Fe, Vitamin-B12-bindendes Protein Opsonisierung 7 Antikörper vermittelte Phagozytose Antikörper vermittelte Phagozytose 8 Aktivierung der Makrophagen PPR (pathogen pattern receptors) auf Makrophagen binden bakterielle und virale (Oberflächen)-Moleküle. (PAMPs = pathogen associated molecular pattern) Mannose-Rezeptor LPS-Rezeptor (CD14) CD11c/CD18 Toll-like-Rezeptoren Glykan-Rezeptor scavenger-Rezeptor Sialinsäure-Ligand 9 PAMPs sind: • Endotoxin (Lipopolysaccharid = LPS) auf gram-negativen Bakterien • Lipoteichonsäure auf gram-positiven Bakterien • Peptidoglykan in allen Zellwand tragenden Bakterien • Glykopeptan aus Mykobakterien • CpG-Nukleotide von bakterieller DNA • Doppelsträngige RNA (dsRNA) aus Viren Architektur der Gram-negativen Zellhülle Lipopolysaccharid OmpA [LPS; ´Endotoxin´] OmpF/C FhuA Kapselpolysaccharide [ Enterobacterial Common Antigen Polysaccharide Surface Layer + + + + + + + + + ´Lipoglycane´ Äußere Membran Phospholipid Periplasma Peptidoglycan Lipoprotein Innere Membran Phospholipid Proteine Cytoplasma Holst, O. et al. FZ-Borstel (2003) 10 Struktur des Respiratorischen Syncytial Virus (RSV) The Nobel Prize in Medicine Für ihre grundlegenden 1995 Erkenntnisse über die genetische Kontrolle der frühen Embryonalentwicklung. Christiane Nüsslein-Volhard Zusammen mit Edward B. Lewis und Eric F. Wieschaus Ursprünglich entdeckt wurden TLRs von der deutschen Forscherin Christiane Nüsslein-Volhard in der Fruchtfliege Drosophila in den 90er Jahren. Unter anderem für diese Erkenntnisse erhielt Nüsslein-Volhard 1995 den Nobelpreis für Medizin – zusammen mit ihrem Kollegen Eric Wieschaus und und dem bereits verstorbenen Amerikaner Edward Lewis. Seitdem sind jedes Jahr neue TLRVarianten in Menschen und Tieren entdeckt worden, sie finden sich sowohl bei Fischen und Reptilien, als auch bei einfacheren Organismen. Aus diesem Grund sind Forscher der Ansicht, dass es sich hierbei um ein evolutionär altes System handelt. 11 Receptor Agonist(s) (Pattern Recognition Receptors) (Pathogen-Associated Molecular Patterns) TLR1 Heterodimerizes with TLR2 TLR2 PGN, some LPS, some LTA, lipoproteins, AraLAM TLR3 dsRNA TLR4 Gram(-) LPS, Taxol, some LTA TLR5 Flagellin TLR6 Heterodimerizes with TLR2 TLR7 Imidazoquinoline TLR9 Bacterial DNA (CpG) TLR 8,10 Unknown Akira J.Biol.Chem. 2003 278:38105–38108 SPEZIFITÄT der TLRs TLR 1 BAKTERIELLE PRODUKTE MIT LPS (Mit TLR2 und 4) TLR 2 GRAM-POSITIVE BAKTERIEN; PEPTIDOGLYKAN; LIPOTEICHONSÄURE; MYKOBACTERIELLES LIPOARABINOMANNAN TLR 3 POLY I:C DOPPELSTRÄNGIGE VIRALE RNA TLR 4 LIPOPOLYSACCHARIDE (LPS) aus GRAM NEGATIVEN BAKTERIEN TLR 5 FLAGELLIN VON FLAGELLATEN TLR 6 LIPOPROTEIN (Mit TLR2); PEPTIDOGLYKAN aus GRAM POSITIVEN BACTERIEN; LIPOPEPTIDE TLR 9 CpG aus BACTERIELLER DNA 12 LPS LBP CD14 TLR4 LPS LBP CD14 TLR4 13 LPS LBP CD14 TLR4 LPS LBP CD14 TLR4 14 TRIF ZYTOPLASMA TRAM TLR4 LPS CD14 MD-2 Mal MyD88 TRAF6 IRAK TRAF6 TBK-1 IKKε TAB1 ECSIT TAK1 MEKK1 IKK2 STRESS-aktivierte Protein-Kinase (JNK, p38) P P IRF-3 MKK3/6 MKK4/7 p38 JNK P IκB p50 p65 P P IRF-3 p50 p65 P P P P P P CREB ATF-1 c-Jun ATF-2 c-Jun c-Fos CRE AP-1 AP-1 NUCLEUS IRSE NFκB LPS LBP CD14 TLR4 IL-1 IL-8 TNF-α IL-6 IL-12 Fieber, T-Zell und Makrophagenaktivierung Anlocken von Neutrophilen und T-Zellen Lokale Entzündung, Gefäßerweiterung, Adhäsion von Thrombozyten Akute Phase Proteine, Wachstum B- und T-Zellen Differenzierung T-Zellen; Aktivierung NK-Zellen 15 Komplementsystem klassischer Weg Lektin Weg alternativer Weg Antigen-Antikörper Komplex Lektin bindet Mannose auf der Pathogenoberfläche Pathogenoberfläche C1, C4, C2 MBL-MASP, C4, C2 C3, B, D C3-Konvertase C4a, C3a, C5a C3b Entzündungsvermittelnde Peptide, Anlocken von Phagozyten Bindet an Komplementrezeptoren auf Phagozyten Opsonierung von Pathogenen Terminale Komplementfaktoren: C5b, C6, C7, C8, C9 Membranangreifender Komplex (MAK) Lyse bestimmter Phagozyten und Zellen Entfernung von Immunkomplexen 16 Der Klassische Weg des Komplementsystems C1q C1s Der klassische Weg des Komplementsystems C2a C2 C1q C3a Spaltung C2b C4 C4a C3 C4b C1s Spaltung C4b C2b C3- Konvertase C3b 17 Der klassische Weg des Komplementsystems C2a C2 C1q C3a Spaltung C2b C4 C4a C3 C4b C1s Spaltung C4b C2b C3b C3- Konvertase Der alternative Weg des Komplementsystems C3a Faktor D Faktor B C3 Spaltung C3b Bb, C3b C3- Konvertase C3b 18 19 Anaphylatoxine • C3a • C4a • C5a Rezeptoren des Komplementsystems Erhöhung der Gefäßpermeabilität Kontraktion glatter Muskeln Erhöhung der Gefäßpermeabilität Kontraktion glatter Muskeln, Aktivierung von Mastzellen Erhöhung der Gefäßpermeabilität Kontraktion glatter Muskeln, Aktivierung von Mastzellen, Erhöhung der Adhärenz von Monozyten/Makrophagen an Gefäßwände und deren Migration ins Gewebe Rezeptor CR1 CR2 (CD21) Spezifität Funktionen Zelltypen C3b Zerfall von C3b und C4b, stimuliert Phagozytose Erytrocytentransport von Immunkomplexen Teil des B-Zell-Korezeptors Rezeptor für EBV Stimuliert Phagozytose Erytrocyten, Makrophagen Monocyten Leukozyten B-Zellen FDC C3b, EBV CR3 (CD11b/CD18) iC3bi CR4 (CD11b/CD18) iC3bi Stimuliert Phagozytose Cq1 C1q Bindung von Immunkomplexen an Phagozyten B-Zellen FDC Monocyten Makrophagen Leukozyten Monocyten Makrophagen Leukozyten B-Zellen Monocyten Makrophagen Blutplättchen Endothelzellen 20