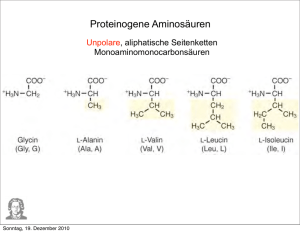
Proteinogene Aminosäuren
Werbung
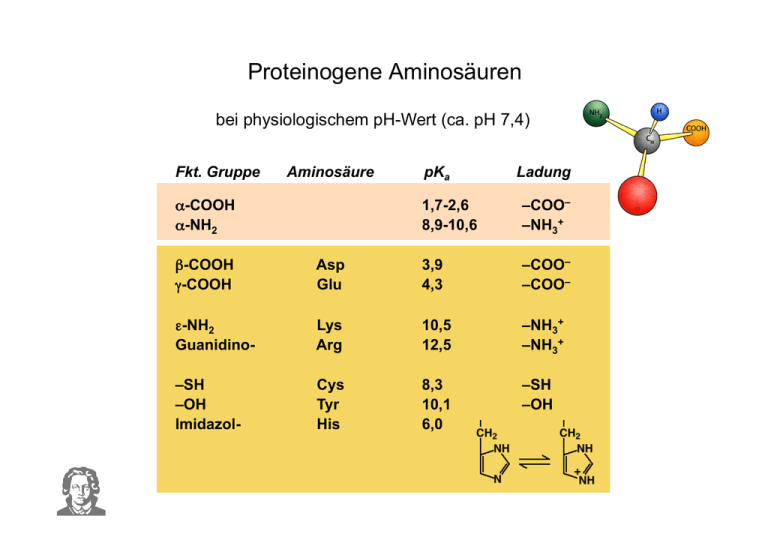
Proteinogene Aminosäuren bei physiologischem pH-Wert (ca. pH 7,4) Fkt. Gruppe Aminosäure α-COOH α-NH2 pKa Ladung 1,7-2,6 8,9-10,6 –COO– –NH3+ β-COOH γ-COOH Asp Glu 3,9 4,3 –COO– –COO– ε-NH2 Guanidino- Lys Arg 10,5 12,5 –NH3+ –NH3+ –SH –OH Imidazol- Cys Tyr His 8,3 10,1 6,0 –SH –OH Proteinogene Aminosäuren Metabolite bzw. Substrate im Stoffwechsel • Vorstufen für Neurotransmitter und Hormone • Vorstufen für Hormone • Vorstufen für Alkaloide (in Pflanzen) Proteinogene Aminosäuren Beispiel: Neurotransmitter "biogene Amine" Proteinogene Aminosäuren Beispiel: Gewebshormone "biogene Amine" Nichtproteinogene Aminosäuren Es gibt Aminoäsuren, die nie in Proteinen vorkommen ! Nichtproteinogene Aminosäuren sind • Metabolite bzw. Substrate im Stoffwechsel • Bestandteile bakterieller Zellwände (D-Aminosäuren) • Bestandteile von Antibiotika • Vorstufen für Neutrotransmitter • Vorstufen für Gewebshormone Nichtproteinogene Aminosäuren Beispiel: Neurotransmitter bzw. Hormone Nichtproteinogene Aminosäuren Beispiel: Neurotransmitter bzw. Hormone Nichtproteinogene Aminosäuren Beispiel: Neurotransmitter bzw. Hormone Nichtproteinogene Aminosäuren Beispiel: Neurotransmitter bzw. Hormone Nichtproteinogene Aminosäuren Beispiel: Neurotransmitter bzw. Hormone Nichtproteinogene Aminosäuren Beispiel: Neurotransmitter bzw. Hormone Nichtproteinogene Aminosäuren Beispiel: Metabolite im Primärstoffwechsel H 2O + Manche Aminosäuren sind für Tiere essentiell nicht essentiell essentiell Glycin Alanin Serin Cystein Valin Leucin Isoleucin Threonin abh. von Methionin-Zufuhr Glutaminsäure, Glutamin Asparaginsäure, Asparagin Prolin Arginin für Säuglinge essentiell Histidin für Säuglinge essentiell Tyrosin abh. von Phenylalanin-Zufuhr Phenylalanin Tryptophan Methionin Lysin Proteine Es ist alles eine Frage der richtigen Oberfläche Proteine sind Alleskönner: • • • • • • • sie sind Enzyme sie haben Transport- und Lagerfunktionen sie geben Gestalt sie vermitteln Bewegung sie vermitteln Immunität sie erlauben Kommunikation und vieles mehr ! Proteine • Proteine bestehen aus eindimensionalen Aminosäureketten • Primärstruktur • Reihenfolge der Aminosäuren ist festgelegt durch ein Gen • Verknüpfung der Aminosäuren erfolgt an Ribosomen • die Aminosäurekette faltet sich in übergeordnete Strukturen • Sekundärstruktur • Tertiärstruktur • Quartärstruktur Primärstruktur der Proteine Peptidbindung Primärstruktur der Proteine Peptidbindung Sekundärstruktur der Proteine α-Helix und β-Faltblatt Sekundärstruktur der Proteine Symbole α-Helix β-Faltblatt Sekundärstruktur der Proteine Beteiligte Bindungskräfte • Wasserstoffbrücken • Ionenbindungen • hydrophobe Wechselwirkungen • van-der-Waals-Kräfte • kovalente Bindungen (S–S) Tertiärstruktur der Proteine