doc - ChidS
Werbung

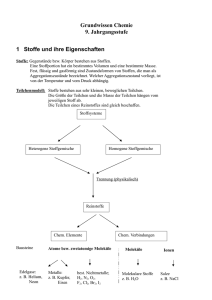
Experimentalvortrag Anorganische Chemie – Elektrochemie – Sara Metten Gliederung 1. Begriffsklärung 2. Grundlagen 3. Galvanische Zellen o Primärelement o Sekundärelement 4. Elektrolysezelle 5. Einsatz in Alltag und Technik 6. Lehrplan 7. Didaktische Aspekte 8. Literaturverzeichnis 9. Abbildungsverzeichnis Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html -1- 1. Einführung Die Anfänge der Elektrochemie Elektrische Erscheinungen, die auf Reibung beruhen, waren schon im Altertum bekannt. Auf Reibungselektrizität basierten auch die ersten ab 1610 gezielt durchgeführten Experimente zur Erzeugung von Elektrizität. Mit den damals konstruierten Maschinen ließ sich aber kein größerer kontinuierlicher Stromfluss erreichen. Die Geschichte der Elektrochemie begann mit den Experimenten des Mediziners Luigi Galvani. Er entdeckte, dass Froschschenkel gerade getöteter Tiere zuckten, wenn er sie der Elektrizität von Elektrisiermaschinen oder Blitzen aussetzte. 1786 machte er bei den Vorbereitungen für seine Versuche eine seltsame Beobachtung. Er befestigte einen frisch präparierten Froschschenkel mit einem Messinghaken an einem Eisendrahtgitter, wobei der Froschschenkel jedes Mal zuckte, wenn der Eisendraht den Messinghaken berührte. Weitere Experimente mit anderen Metallen ergaben, dass die Froschschenkel immer dann zuckten, wenn Nerv und Muskel von zwei unterschiedlichen, miteinander verbundenen Metalldrähten berührt wurden. Galvani nahm an, dass die Elektrizität im Muskel säße und bezeichnete sie als tierische Elektrizität. Aber ohne es zu wissen, konstruierte Galvani mit seinen Metalldrähten eine einfache Batterie. Heute nutzt man seine Entdeckungen bei der Anwendung von Herzschrittmachern zur Stimulierung von Herzmuskeln. Eine Erklärung für Galvanis Experimente fand erst der Physiker Alessandro Volta. Er wiederholte viele Experimente Galvanis, lenkte aber bald seinen Blick auf die verwendeten Metalldrähte und erinnerte sich an eine in diesem Zusammenhang passende ungeklärte Beobachtung. Berührte man mit der Zunge gleichzeitig ein Stück Blei und ein Stück Silber, die miteinander Kontakt hatten, bemerkte man einen unangenehmen, scharfen Geschmack. Trennte man die Metalle, blieb der Geschmack aus. Nach zweijähriger experimenteller Arbeit seine Theorie der metallischen Elektrizität vor. Er ordnete die Metalle der Reihe nach an, wobei zwei Metalle umso stärkere Elektrizität hervorrufen, je weiter sie auseinander stehen. Seine Anordnung war: Zink, Blei, Zinn, Eisen, Kupfer, Silber, Gold -2- Volta war nun in der Lage, ein Gerät zur Erzeugung kontinuierlicher Ströme zu bauen, in dem er mehrere Paare von Zink- und Kupferplatten übereinander schichtete. Zwischen den Platten lagen Filzscheiben, die mit getränkter Schwefelsäure getränkt waren. Mit dieser Voltaschen Säule stand den Chemikern ein neues Experimentiergerät zur Verfügung. Man entdeckte, dass an den Polen Wasser in Wasserstoff und Sauerstoff zerlegt wird und dass sich aus Salzlösungen am negativen Pol Metalle abscheiden. Größeres Aufsehen erregten 1807 die von Davy mit der Voltaschen Säule durchgeführten Versuche. Er kam auf die Idee, Salze wasserfrei flüssig zu machen und sie in geschmolzenem Zustand zu elektrolysieren. Durch Elektrolyse von Kaliumhydroxid und Natriumhydroxid konnte er beweisen, dass es sich bei diesen Stoffen nicht wie bisher angenommen um Elemente, sondern um Verbindungen handelte. Er entdeckte die Elemente Kalium und Natrium. Anfang des 19. Jahrhunderts entwickelte Berzelius eine elektrochemische Theorie, die größte Bedeutung erlangte. Er nahm an, dass bei chemischen Reaktionen Elektrizität ausgetauscht wird. Obwohl die Deutung elektrochemischer Vorgänge noch unklar blieb, wurde in der Zeit von 1835 bis 1880 viele wichtige Entdeckungen gemacht. So fallen in diese Zeit die Erfindungen der Brennstoffzelle und der Batterien. Die Elektrochemie ist streng genommen ein eigenes Teilgebiet der Chemie, im weiteren Sinne ordnet man sie jedoch der physikalischen Chemie zu. Sie beschäftigt sich mit der gegenseitigen Umwandlung von chemischer in elektrischer Energie, sie umfasst alle Vorgänge, bei denen es zur Wanderung von Elektronen und Ionen oder zur Bildung von elektrischen Potentialen kommt. Die Elektrochemie kann man einerseits organisch anderseits auch anorganisch beschreiben. In meinem Protokoll möchte ich ausschließlich auf die anorganischen Aspekte eingehen. 2. Grundlagen Zu den bedeutendsten Grundlagen der Elektrochemie gehört die elektrochemische Spannungsreihe. Dies ist die Einordnung der chemischen Elemente, insbesondere der Metalle, nach der Größe ihrer Potentialdifferenz, die sich an der Phasengrenze bei jedem der Elemente ergibt, wenn sie in einen Elektrolyten eintauchen. Das Element taucht hierbei als Elektrode in eine Lösung, die 1 Mol des Metallkations pro Liter enthält. Da man das elektrochemische Potential nur eines dieser Elemente gegen diesen Elektrolyten nicht messen kann, kennzeichnet man es durch die Spannung eines galvanischen Elements, dessen einer Pol das -3- einzuordnende Element und dessen anderer Pol die Normalwasserstoffelektrode ist. Die nun auftretende Spannung zwischen den beiden Elektroden nennt man das Normalpotential (Standardpotential) des Metalls. Die Einordnung der Normalpotentiale in eine Reihe, in der am Anfang die unedleren Metalle mit dem größten negativen und am Ende die edleren Metalle mit dem größten positiven Potential stehen, ergibt die Elektrochemische Spannungsreihe der Metalle. Demo 1: Spannungsreihe Geräte und Chemikalien: Bechergläser, geschmirgelter Eisennagel, geschmirgelter Kupfernagel (oder ein Kupferblech) Kupfersulfatlösung 0,1 mol/L, Silbernitratlösung 0,1 mol/L, Eisensulfatlösung 0,1 mol/L Durchführung: Man gibt in ein Becherglas die 0,1 molare Kupfersulfatlösung, in das andere Becherglas gibt man die 0,1 molare Silbernitratlösung. Nun hält man einen geschmirgelten Eisennagel in die Kupfersulfatlösung und wartet ca. 1 Minute ab, nun gibt man den beschichten Eisennagel in das Becherglas mit der Silbernitratlösung und wartet ebenfalls ca. 1 Minute ab. Den beschichteten Eisennagel hält man jedoch nicht so tief in die Silbernitratlösung, dass am Ende nur noch eine Schicht zu sehen ist, sondern, dass man zwei Schichten erkennen kann. In das Becherglas mit der 0,1 molaren Eisensulfatlösung hält man einen Kupfernagel und wartet ebenfalls ca. 1 Minute ab. Erklärung des Versuches: Taucht man einen Eisennagel in eine 0,1 molare Kupfersulfat Lösung, so scheidet sich am Eisen Kupfer ab und es bilden sich durch Oxidation Fe2+ Ionen. Bei dieser Reaktion handelt es sich um eine Redoxreaktion bei der Eisenatome Cu2+ Ionen zu Kupferatomen reduzieren. -4- Reduktion: Cu2+ + 2e- Cu Oxidation: Fe Fe2+ + 2e- Gibt man nun umgekehrt ein Stück Kupferblech in eine Eisensulfat Lösung, so ist keine Reaktion feststellbar. Die Eisenatome geben offensichtlich leichter Elektronen ab als Kupferatome. Eisen ist somit das stärkere Reduktionsmittel Von den beiden entsprechenden Metallkationen ist demnach das Cu2+ Ion das stärkere Oxidationsmittel. Nun tauche ich diesen verkupferten Eisennagel in eine 0,1 molare Silbernitratlösung. Man kann beobachten, dass sich eine silbrige Schicht an dem Nagel abscheidet. Hierbei werden nun die Ag2+ Ionen zu elementarem Silber von dem Kupferatomen reduziert. Es entsteht durch Oxidation aus Kupfer Cu2+ Ionen, die in Lösung gehen. Reduktion: 2 Ag+ + 2e- 2 Ag Oxidation: Cu Cu2+ + 2e- Nun kann man folgende Spannungsreihe von edel nach unedel aufstellen: Silber ist edler als Kupfer ist edler als Eisen. Da ich mich im weiteren Teil auch noch mit der Wanderung von Elektronen beschäftige, schließe ich nun schon die Erklärung der 2. Demonstration an. Hierbei geht es nicht um die Wanderung von Elektronen, sonder um die Wanderung von Ionen, dies mache ich anhand der 2. Demonstration sichtbar. Demonstration 2: Ionenwanderung Abb. 1 Geräte und Chemikalien: Petrischale, Overhead Projektor, nicht zu große Kaliumpermanganat Kristalle, verdünnte Natriumsulfat Lösung, 2 Graphit Elektroden, 2 Krokodilklemmen, 2 Kabel, Spannungsquelle -5- Durchführung: In der Petrischale befindet sich eine verdünnte Natriumsulfatlösung, die als Elektrolyt dient. Nun wird mit Hilfe einer Spannungsquelle eine Spannung von 10V angelegt. Als Elektroden werden 2 Graphit Elektroden verwendet. In die Mitte der Petrischale wird anschließend ein Kaliumpermanganat Kristall gegeben. Ergebnis: Die Permanganat Ionen wandern zum Pluspol. In metallischen Leitern sind Elektronen die Ladungsträger des elektrischen Stroms. Bei diesem Versuch kann man sehr gut erkennen, dass sich in einer Flüssigkeit bei Anlegen eines Stromes die Ionen im elektrischen Feld bewegen. Sie wandern gemäß ihrer formalen Ladung zur Kathode oder zur Anode. In flüssigen Lösungen sind also nicht Elektronen sondern positiv oder negativ geladene Ionen Ladungsträger des elektrischen Stroms. Im Fall des Kaliumpermanganats sind es die Permanganat Anionen die zur Anode wandern und die sichtbaren violetten Schlieren bildet. 3. Galvanische Zellen In der Elektrochemie geht es fast immer um elektrochemische Zellen, diese möchte ich nun näher erläutern. Elektrochemische Zellen bestehen im einfachsten Fall aus zwei metallischen Leitern (Elektroden) die mit einem elektrisch leitenden Medium, dem Elektrolyten, in Kontakt stehen. Es gibt zwei unterschiedliche Typen von elektrochemischen Zellen: 1. Galvanischen Zellen 2. Elektrolysezellen -6- Galvanische Zellen: Dies ist eine elektrochemische Zelle, bei der man eine spontane, chemische oder physikalische Reaktion zur Erzeugung des Stromes ausnutzt. Sie wurde nach den italienischen Physiologen und Mediziner Luigi Galvani benannt. Galvanische Elemente bestehen im einfachsten Fall aus zwei verschiednen Metallen, die miteinander sowohl elektrolytische, als auch metallisch leitend verbunden sind. Zwischen den Metallen tritt dabei eine Spannung auf, die eine Folge der zwischen Metallen und Flüssigkeiten entstehenden Berührungsspannung ist. Diese Berührungsspannungen werden elektrolytische Potentiale oder Galvani-Potentiale genannt. Da positive Ionen aus dem Metall in die Flüssigkeit treten, lädt sich das Metall jeweils gegen den Elektrolyten negativ auf. An der Grenze zwischen Metall und Flüssigkeit entsteht eine elektrische Doppelschicht, deren elektrisches Feld die Ionen wieder auf das Metall zurücktreibt. Das elektrische Feld ist umso größer, je höher die Ionendichte in der Flüssigkeit ist. Außerdem werden auch durch Diffusion befindlich Ionen an das Metall zurück getrieben und treten in dieses wieder ein. Ist die Anzahl der in der Zeiteinheit durch Rückdiffusion und durch die Wirkung des elektrischen Feldes und der Grenzschicht wieder in das Metall eintretenden Ionen gleich der in Lösung gehenden, so stellt sich ein Gleichgewichtszustand ein. Zwischen Metall und Flüssigkeit herrscht dann ein elektrolytisches Potential, das von der Art des Metalls und der Flüssigkeit abhängt. Werden die beiden Elektroden leitend miteinander verbunden, so fließt ein Strom. Dabei wandern im äußeren Leiter Elektronen von der positiven Elektrode zur negativen Elektrode; sie werden dort auf die Ionen des Metalls 1 übertragen, das abgeschieden wird. Zum Ausgleich gehen wieder Ionen von Metall 2 in Lösung; der Strom fließt so lange, bis sich entweder die positive Elektrode vollständig aufgelöst hat oder die Ionen von Metall 1 verbraucht sind. Es gibt auch galvanische Elemente, bei denen die Metalle zwar gleich der Elektrolyt jedoch aus Metallsalzlösungen unterschiedlicher Konzentrationen besteht (Konzentrationselemente). Die Lösungen müssen dabei aber durch ein Diaphragma oder einen Stromschlüssel voneinander getrennt sein, damit eine Durchmischung der Lösungen unterbleibt. Auf diese Weise entsehen trotz gleicher Metalle unterschiedlich Potentiale, die eine Spannung zwischen den Elektroden bewirken. Ein sehr bekanntes Galvanisches Element ist das Daniell Element auf das ich nun näher eingehen möchte: -7- Versuch 1: Daniell-Element Abb. 2 Dies wurde 1836 von dem britischen Chemiker und Physiker John Frederic Daniell erfunden. Das Daniell Element ist eine Kombination zweier Halbzellen aus Zink und Kupfer der Lösungen ihrer Sulfate, die durch ein Diaphragma voneinander getrennt sind. Geräte und Chemikalien: U-Rohr mit Diaphragma, Zinksulfat Lösung 0,1 mol/L, Kupfersulfat Lösung 0,1 mol/L, Zinkblech, Kupferblech, Voltmeter, 2 Krokodilklemmen, 2 Kabel, Stativmaterial Versuchsdurchführung: Ein Kupferblech wird in eine Kupfersulfatlösung, in diesem Fall eine 0,1 molare und einen Zinkstab in eine Zinksulfatlösung, ebenfalls eine 0,1 molare gegeben. Beide Halbzellen sind durch ein Diaphragma voneinander getrennt, das Diaphragma ist eine poröse Trennwand, die das Vermischen der Lösungen durch Diffusion verhindert, aber eine Ionenwanderung erlaubt. Anschließend werden beide Metalle an jeweils eine Krokodilklemme angeschlossen und sie durch Strippen mit dem Spannungsmessgerät verbunden. Ergebnis: Das Spannungsgerät zeigt eine Spannung von 1,1V an. Folgende Reaktionen laufen beim Daniell-Element ab: An der Zinkelektrode wird Zinkmetall zu Zink2+ Ionen oxidiert, es gehen Zinkionen in Lösung. Es verbleiben pro in Lösung gehendes Zinkatom 2 Elektronen in der Zinkanode, diese fließen über den äußeren Metalldraht zur Kathode. Dort reduzieren sie ein Cu2+ Ion der Lösung zu Cu0. Kupfer scheidet sich an dieser Elektrode ab. -8- Würde man nun das Spannungsmessgerät durch einen Verbraucher ersetzen, dann würden folgende Reaktion ablaufen: Innerhalb der Zelle erfolgt nun ein Stromfluss durch Ionenbewegung. Die Sulfatanionen müssen von der Kathode zur Anode und umgekehrt. Von der Kathode werden Zink 2+ Ionen an die Lösung abgegeben, Elektronen bleiben im Metall zurück. Zum Ausgleich der zusätzlichen positiven Ladungen im Bereich um die Anode müssen Sulfationen in Richtung Anode wandern, gleichzeitig wandern Zink2+ Ionen in Richtung Kathode. Abb. 3 Das Potential, dass sich bei einer elektrochemischen Zelle ausbildet, nennt man auch Elektromotorische Kraft (EMK). Auf Grund der bekannten Reduktionspotentiale der einzelnen Metalle kann man mit Hilfe der Nernst-Gleichung die EMK einer Zelle berechnen und sie somit vorher bestimmen. Die Nernst-Gleichung wurde von Walther Nernst im Jahr 1889 auf thermodynamischen Wege entwickelt. Er war Professor für physikalische Chemie in Göttingen und Berlin und erhielt 1920 den Nobelpreis für Chemie. Die Nernst Gleichung beschreibt den Zusammenhang zwischen dem Lösungsdruck von Metallen und ihren Reduktionspotentialen in folgender Formel beschreibt: E E0 R0 T c ln ox z F cred R0 allgemeine Gaskonstante mit dem Wert 8,3145 J/mol K T absolute Temperatur [K] z Zahl der bei einem Redoxsystem auftretenden Elektronen F Faraday-Konstante mit dem Wert 96487 C -9- E0 Normalpotential, das aus der Literatur zu entnehmen ist cox bzw. cred Massenwirkungsprodukte der Konzentrationen im oxidierten bzw. reduzierten Zustand, bei nicht idealen Lösungen muss statt der Konzentration die Aktivität eingesetzt werden Für T=298 K (25 °C) erhält man aus der obigen Gleichung durch Einsetzen der Zahlenwerte für die Konstanten und Berücksichtigung des Umwandlungsfaktors von ln in lg folgende Gleichung: E E0 c 0,059 (V ) lg ox z cred Sind die Lösungen, wie in unserem Falle, äquimolar so folgt aus obiger Gleichung E = E0 Während das erste Glied der Nernst Gleichung E0 eine für jedes System charakteristische Konstante ist, wird durch das zweite Glied die Konzentrationsabhängigkeit des Potentials eines Redoxsystems beschrieben. Wie im Massenwirkungsgesetz treten auch in der Nernst Gleichung die Konzentrationen reiner fester Phasen nicht auf. Die EMK des galvanischen Elements erhält man aus der Differenz der Redoxpotentiale der Halbelemente. Berechung der EMK für das Daniell Element: Zn(s)/Zn2+(aq) || Cu2+(aq)/Cu(s) Berechnung der Halbzelle Zn/Zn2+ E Zn/Zn 2 E 0Zn/Zn 2 R T 0,1 mol L ln z F 1 mol L Berechnung der Halbzelle Cu/Cu2+ E Cu/Cu 2 E 0Cu/Cu 2 R T 0,1 mol L ln z F 1 mol L - 10 - Nun vereinigt man beide Gleichungen zu einer. Man zieht bei der Berechnung der Spannung der beiden Potentiale das Kathodenpotential von dem Anodenpotential ab. E Zn/Zn 2 Cu 2 /Cu E Cu/Cu 2 E Zn/Zn 2 E Zn/Zn 2 Cu 2 /Cu E 0Cu/Cu 2 E 0Zn/Zn 2 Fasst man nun den Term ( in dem letzten Term ln R T 0,1 mol L ln z F 0,1 mol L RT ox ) mit dem ln aus beiden Formeln zusammen, so erhält man zF red RT 0,1 , dieses ergibt ausgerechnet 0 und wenn man 0 mit dem Term zF 0,1 multipliziert erhält man 0. Somit braucht man bei gleichen Konzentrationen der Lösungen bzw. bei äquimolaren Lösungen nur die beiden Standard Potentiale voneinander subtrahieren, um auf das Potential der beiden miteinander kombinierten Halbzellen zu schließen. E 0Cu/Cu 2 0,3370 V E Zn/Zn 2 Cu 2 /Cu E 0Cu/Cu 2 E 0Zn/Zn 2 E 0Zn/Zn 2 0,7628 V E Zn/Zn 2 Cu 2 /Cu 1,10 V Diese Spannung, die bei den galvanischen Zellen entsteht, kann man kommerziell nutzen und nennt sie dann Batterien. Die Bezeichnung der Batterie leitet sich von seiner seriellen Anordnung mehrerer galvanischer Zellen ab. Heute werden aber auch Monozellen als Batterien bezeichnet. Es gibt drei Arten von galvanischen Zellen: Primärelemente Bei diesen Elementen ist die Energie in Elektrodensubstanzen gespeichert, durch ihre Beteiligung an Redoxreaktionen wird Strom erzeugt. Die Reaktion kann jedoch nur für eine bestimmte Zeit ablaufen, sind alle Reaktionspartner verbraucht, so ist die Batterie entleert und sie ist nicht wiederaufladbar. Sekundärelemente (Akkumulatoren) - 11 - Dies sind galvanische Elemente, bei denen sich die bei der Stromentnahme (Entladen) ablaufenden chemischen Vorgänge durch Zufuhr elektrischer Energie (Laden) umkehren lassen. Brennstoffzellen Dies sind galvanische Zellen, bei denen die Edukte der zu Grunde liegenden Redoxreaktion an der Anode und Kathode kontinuierlich von außen zugeführt werden. Ein bekanntes Beispiel ist die Knallgas-Brennstoffzelle (H2/O2 Brennstoffzelle), in der an Platin Elektroden Wasserstoff oxidiert und Sauerstoff reduziert wird, es entsteht Wasser. Ein sehr bekanntes und auch schon sehr altes Primärelement ist das Leclanché-Element. Dieses wird nun genauer vorgestellt. Versuch 2: Leclanché Element Abb. 4 Geräte und Chemikalien: Zinkstab oder Zinkblech, Kupferstab oder Kupferblech, Kohlestab, Becherglas 100 mL, Soxhlethülse (aus Cellulose), Glasstab, Schmirgelpapier, Voltmeter, 2 Kabel, 2 Krokodilklemmen, durchbohrter Korkstopfen, Mehl, Graphitpulver oder gepulverte Aktivkohle, Mangan(IV)oxid gepulvert, Ammoniumchlorid Lösung (w = 0,2) Durchführung: Ein rechtwinkliges Zinkblech wird mit Schmirgelpapier gesäubert und zu einem Zylinder geformt, der an der Innenwand eines 100 mL Becherglases anliegt. Am oberen Rand des Zylinders befindet sich zwecks Anschluss einer Krokodilklemme eine nach außen gebogene Ecke des Zylinders. In das Becherglas füllt man eine Mischung von 30 g Mehl und 35 mL Ammoniumchlorid Lösung. 7 g Aktivkohle und 40 g Mangan(IV)oxid werden mit einem Glasstab in einem Becherglas vermengt. Durch Zugabe von 40 mL Ammoniumchloridlösung erhält man eine Paste, die in eine Extraktionshülse gefüllt wird. Die Hülse wird durch einen durchbohrten Stopfen, durch den eine Graphithülse geführt ist, verschlossen. Die so vorbe- 12 - reitete Extraktionshülse wird nun in das Becherglas mit dem Elektrolyten und dem Zinkzylinder gestellt und parallel zum Zylinder ausgerichtet. Die Zelle wird nun an das Voltmeter angeschlossen. Ergebnis: Es ist eine Spannung von 1,3 V abzulesen. An der Kohlekathode wird das Mangandioxid zu Manganoxidhydroxid reduziert. Hierbei wird das Mangan von der Oxidationszahl +4 auf die Oxidationszahl +3 reduziert. Es werden dabei 2 Protonen verbraucht, diese werden in der Reaktion an der Zinkanode durch die Oxidation von Zink zu Diamindichlorozink mit Hilfe des Elektrolyten Ammoniumchlorid gebildet. Das Zink hat nun eine Oxidationszahl von +2. Folgende Elektrodenreaktionen laufen dabei ab: Kathode: 2 MnO2 (s) + 2 H+(aq) + 2 e- 2 MnO(OH)(s) Anode: Zn(s) + 2 NH4Cl(aq) [Zn(NH3)2Cl2](aq)+ 2 H+ (aq) + 2 e- Gesamtreaktion: Zn(s) + 2 NH4Cl(aq) + 2 MnO2(s) [Zn(NH3)2Cl2](aq) + MnO(OH)(s) Hier noch einmal die Elektrodenreaktionen im Überblick: - 13 - Abb. 5 Im Detail wurden im Laufe der Zeit zahlreiche Verbesserungen an dem Leclanché Element vorgenommen und so entstand die heute überwiegend genutzte Alkali-Mangan-Batterie. Da als Elektrolyt Kalilauge anstatt Ammoniumchlorid Lösung verwendet wird nennt man eine solche Batterie Alkaline. Die Elektrodenreaktionen sind jedoch dieselben wie bei dem Leclanché Element. Es wird bei ihnen eine Nennspannung von 1,5 V ausgebildet. Das untere Bild zeigt den Querschnitt einer Alkali-Mangan Batterie Abb. 6 Sekundärelement Als Beispiel für einen Akkumulator wird nun der Bleiakkumulator näher erläutert. Dieser findet noch heute große Verwendung in Autos als Starterbatterie. Diese wurde 1859 von A. Planté entwickelt. Diese Art des galvanischen Elements zeichnet sich durch sorgfältig ausgewählte Elektroden aus. Sie müssen dem bis zu 1000-mal stattfindenden Lade- und Entladevorgang standhalten. Des weiteren müssen die Entladeprodukte schwer löslich sein, damit sie an den Elektroden haften bleiben und nicht durch Diffusion in den Elektrolyten verloren gehen. - 14 - Versuch 3: Bleiakkumulator Abb. 7 Geräte und Chemikalien: 2 Bleielektroden, Becherglas, 2 Krokodilklemmen, 2 Kabel, Spannungsquelle, Spielzeugmotor, Schwefelsäure 20 %ig Hinweis: Dieser Versuch muss unter dem Abzug durchgeführt werden, da bei der Reaktion Wasserstoff entsteht. Versuchsdurchführung: Formierung: Zu Beginn des Versuchs standen 2 Bleiplatten zur Verfügung, die noch keine Bleioxidschicht einer Elektrode besaßen, diese wurde erst durch die sogenannte Formierung hergestellt werden. Hierzu werden die beiden Bleiplatten in die 20% ige Schwefelsäure gestellt und bei ca. 4 V einige Minuten elektrolysiert. An der Kathode entstand Wasserstoff und an der Anode entstand Sauerstoff. Nach einiger Zeit entsteht an der Anode ein brauner Überzug von Blei(IV)oxid. Nun wurden die Stromrichtung umgekehrt und es entsteht an der Elektrode mit dem Blei(IV)oxid Wasserstoff und das Oxid wird zu fein verteiltem Blei reduziert. An der anderen Elektrode entsteht unter gleichzeitiger Entwicklung von Sauerstoff Blei(IV)oxid. Dies wird einige Male wiederholt. „Eigentliche“ Versuchsdurchführung: Zwei Bleielektroden werden in einem Becherglas befestigt. Es ist darauf zu achten, dass sich die beiden Bleielektroden nicht berühren, da es sonst einen Kurzschluss gibt. Das Becherglas wird nun mit der 20 %igen Schwefelsäure befüllt. Nun wird einige Minuten bei 4 V elektrolysiert. Die Spannung des Bleiakkus beträgt nun ca. 2V und der Spielzeugmotor kann nun damit betrieben werden. - 15 - Formierung: Kathode: 4 H3O+ + 4 e- 2 H2 + 4 H2O Anode: Pb(s) + 6 H2O(l) PbO2(s) + 4 e- + 4 H3O+ Entladenvorgang: Kathode: SO42-(aq) + PbO2(s) + 2 e- + 4 H3O+(aq) Anode: SO42-(aq) + Pb(s) PbSO4(s) + 6 H2O(l) PbSO4(s) + 2 e- Als Gesamtreaktion kann man folgendes festhalten: Laden 2 PbSO4(s) + 2 H2O Entladen Pb(s) + PbO2(s) + 2 H2SO4(aq) Beim Laden wird wegen der Überspannung des Wasserstoffs am Blei, keine Wasserstoffentwicklung beobachtet. Ist allerdings eine Verunreinigung des Elektrolyten vorhanden, wird die Überspannung aufgehoben und der Akku kann nicht mehr geladen werden. Bei der Stromentnahme wird Schwefelsäure verbraucht und Wasser gebildet, also wird die Schwefelsäure verdünnt. Der Ladungszustand kann daher durch Messung der Dichte der Schwefelsäure überprüft werden. In der nachfolgenden Abbildung ist eine typische Autobatterie einmal auseinandergebaut aufgezeigt. Abb. 8 - 16 - Der Aufbau ist folgendermaßen: Zwei Sätze von parallel geschalteten Gitterplatten bilden einen Plattenblock, dieser taucht in eine Schwefelsäurelösung (w = 0,38). In einer modernen wartungsfreien Starterbatterie bestehen die mit Blei(IV)oxid gefüllten Gitter des ersten Satzes aus einer Legierung aus Blei, Calcium und Silber, Zinn und Aluminium; die mit fein verteiltem Blei gefüllten zweiten Gitter des zweiten Satzes bestehen aus einer Legierung aus Blei und Calcium. Die Blei(IV)oxid Platten befinden sich in säurefesten Separatoren (mikroporöse Trennwände), welche in direktem Kontakt der Platten und damit einen Kurzschluss verhindern. In 12-V-Bleiakkumulatoren sind sechs solcher Plattenblöcke hintereinandergeschaltet. Brennstoffzellen Bei den bisher beschriebenen galvanischen Elementen liegen die an den Elektrodenvorgängen beteiligten Stoffe in der Zelle selbst vor. Durch die vorgegebenen Stoffportionen wird somit dem Element entnehmbare elektrische Energie begrenzt. Dies hat die Entwicklung von speziellen galvanischen Elementen zur Folge, den Brennstoffzellen. In Brennstoffzellen wird die Verbrennungsenergie von Brennstoffen wie Wasserstoff, Kohlenstoffmonoxid oder Methan direkt in elektrische Energie umgewandelt. Theoretisch sollten 100 % der freien Reaktionsenthalphie als elektrische Energie erhältlich sein, weshalb viel Forschungsarbeit für die Entwicklung wirksamer Brennstoffzellen aufgewandt wird. Bis jetzt sind erst Wirkungsgrade von 60-70 % erreicht worden, das ist aber bereits doppelt so viel wie bei Wärmekraftwerken. Am meisten fortgeschritten ist die Entwicklung von Brennstoffzellen, die mit Wasserstoff betrieben werden. An der einen Elektrode wird Wasser zu Protonen oxidiert, an der anderen Sauerstoff zu Oxidionen reduziert. Die Gasdiffusionselektronen sind durchlässig für die reagierenden Gase und durch einen ionenleitenden Elektrolyten voneinander getrennt, so dass sich die Gase nicht mischen können. Die Sauerstoffionen reagieren mit den Protonen, die durch den Elektrolyten wandern zu Wasser. Es wird also elektrochemisch Wasserstoff mit Sauerstoff zu Wasser umgesetzt. Die abgreifbare Zellspannung beträgt 0,5-0,7 V. Man unterscheidet Brennstoffzellen nach ihren Elektrolyten, aber auch nach ihrer Betriebstemperatur. Alle großen Automobilhersteller entwickeln Membranzellen als alternative Technik zum Verbrennungsmotor. Der Gesamtwirkungsgrad dieser Zellen ist ca. 10 % höher als der des Verbrennungsmotors und mit Wasserstoff betriebene Fahrzeuge sind abgasfrei. Die Probleme - 17 - bei wasserstoffbetriebenen Fahrzeugen ist die Wasserstoffspeicherung und die nötige Wasserstoffinfrastruktur. 4. Elektrolysezelle In galvanischen Elementen laufen Redoxprozesse freiwillig ab, galvanische Elemente können daher elektrische Arbeit leisten. Redoxvorgänge, die nicht freiwillig ablaufen, können durch Zuführung einer elektrischer Arbeit erzwungen werden. Dies geschieht bei der Elektrolyse. Es ist dabei darauf zu achten, dass man die angelegte Spannung den gewünschten Produkten anpasst. Den bei unterschiedlich angelegten Spannungen scheiden sich unterschiedliche Produkte ab. Versuch 4: Elektrolyse von Wasser Abb. 9 Geräte und Chemikalien: Hofmannscher Zersetzungsapparat, Schwefelsäure c=0,5 mol/L, 2 Platinelektroden, Spannungsquelle, 2 Kabel, Bunsenbrenner, Schaschlikspieß (oder ein sog. Glimmspan), 2 Reagenzgläser Versuchsdurchführung: Der Hofmannsche Zersetzungsapparat wird vollständig mit der 0,5 molare Schwerfelsäure gefüllt. Nun wird eine Spannung von ca. 5 V angelegt, so dass an beiden Elektroden eine sichtbare Gasentwicklung zu erkennen ist. Das Experiment wird so lange durchgeführt, bis ein Wasserstoffvolumen von 20 mL erreicht ist. Anschließend wird der Wasserstoff in ein Reagenzglas überführt und die Knallgasprobe durchgeführt. Weiter entnimmt man den entstandenen Sauerstoff und führt die Glimmspanprobe durch. - 18 - Elektrodenreaktionen: Anode: 2 OH-(aq) O2 (g) + 2 H2O (l) + 4 e- Kathode: 3 H3O+(aq) + 4 e- H2 (g) + 4 H2O (l) Auswertung des Ergebnisses: Hier wird nicht reines Wasser sondern 0,5 molare Schwefelsäure eingesetzt, die lediglich als Elektrolyt dient. Es wird nun eine Spannung von 10 V angelegt und man kann an beiden Platinelektroden eine Gasbildung erkennen. An der Kathode ist die Gasentwicklung etwas heftiger und es entsteht auch mehr Gas als an der Anode. An der Anode entsteht durch Oxidation aus Hydroxidionen, die aus dem Autoprotolyse Gleichgewicht des Wassers stammen, Disauerstoff. Bei der Reaktion werden 4 Elektronen frei, welche zur Kathode fließen und dort vier Hydroxoniumionen zu 2 Molekülen Diwasserstoff reduzieren. Als Gesamtreaktion kann man also zusammenfassen, dass aus 2 Wassermolekülen mit Hilfe einer angelegten Spannung, 2 Moleküle Diwasserstoff und 1 Molekül Disauerstoff entstehen. Anhand des Ergebnisses der Wasserelektrolyse kann man folgende Messungen vornehmen. Herleitung des ersten Faraday Gesetzes Bei konstanter Stromstärke werden die Gasvolumina in Zeitabständen von je 60 s bis zum Erreichen eines Wasserstoffvolumens von ca. 25 mL gemessen. Die Werte werden in eine Wertetabelle eingetragen und mit Hilfe eines Graphen ausgewertet. Hier ist nun die Stromstärke konstant bei 0,2 A. Enstandenes Volumen Diwasserstoff in Abhängigkeit der Zeit V H2 [mL] t [Min.] Volumen H2 [mL] 0 0 1 1,4 2 3,2 3 4,8 4 6,8 5 8,2 6 9,6 7 11,6 8 13,4 9 15,0 10 16,8 11 18,6 12 20,4 13 22,2 14 23,8 25 20 15 10 5 0 0 5 10 t [Min.] - 19 - 15 Den Graphen wurde eine Ausgleichsgerade hinzugefügt und nun ist erkennbar, dass eine lineare Abhängigkeit der Zeit mit dem entstandenen Volumen von Wasserstoff besteht. In einem weiteren Experiment wurde die Zeit als konstanter Faktor von 2 Minuten gesetzt und die Stromstärke wurde variiert. Entstandenes Volumen Diwasserstoff in Abhängigkeit der Stromstärke Volumen H2 [mL] 0 1,4 3,2 5,3 7,2 8,3 10 V H2 [mL] I [A] 0 0,1 0,2 0,3 0,4 0,45 8 6 4 2 0 0 0,1 0,2 0,3 0,4 0,5 I [A] Ebenfalls wurden die Messwerte in einem Diagramm gegeneinander aufgetragen und eine Ausgleichsgerade hinzugefügt. Es ist zu erkennen, dass auch die Stromstärke eine lineare Abhängigkeit mit dem entstandenen Volumen an entstandenem Wasserstoff ergibt. Somit kann man folgende Aussage gemacht werden: V~ t wenn I konstant ist und V ist ebenfalls proportional zu I, wenn t konstant ist. Die Volumina der abgeschiedenen Gase sind somit dem Produkt aus der Stromstärke und der Zeit proportional. Das Produkt aus Stromstärke und Zeit ist die elektrische Ladung Q. V ~ I · t bzw. V ~ Q Wird nun das molare Volumen Vm = V/n eingesetzt, erhält man die Beziehung, dass die Stoffmenge ebenfalls proportional zu Q ist. n ~ I · t bzw. n ~ Q Z bedeutet die Anzahl der Elektronen, die für die Abscheidung eines Teilchens an der Elektrode übertragen werden. So ergibt sich folgende Formel: Q=N·e·z·Q Q gibt die elektrische Ladung an, die für die Abscheidung von N Teilchen erforderlich ist. Die elektrische Elementarladung ist e. Mit N = n * NA folgt: - 20 - Q = n · NA · e · z Die Avogadro-Konstante fasst man mit der Elementarladung zusammen und erhält die Faraday-Konstante F, die einen Zahlenwert von 96485 hat. Die Einheit beträgt Coulomb pro mol. Somit wurde folgende Beziehung hergeleitet, um 1 Mol einfach geladener Ionen an einer Elektrode zu entladen braucht man 96485 Coulomb. Wenn man also 96485 Coulomb durch eine Elektrolysezelle leitet wird an jeder Elektrode die Stoffmenge von 1 mol umgesetzt. Daraus folgt: 1. Faraday-Gesetz: n Q zF Das zweite Faraday-Gesetz lässt sich nun im Anschluss mit wenigen Schritten noch herleiten. Hier zu werden noch einmal die Elektroden-Reaktionen benötigt: Anode: 2 OH-(aq) O2 (g) + 2 H2O (l) + 4 e- Kathode: 3 H3O+(aq) + 4 e- H2 (g) + 4 H2O (l) n1 = 2 mol Wasserstoff n2 = 1 mol Sauerstoff z1 = 2 Elektronen z2 = 4 Elektronen Das Verhältnis der Stoffmengen n1/n2 von verschiedenen Elektrolyseprodukten, die durch die gleiche elektrische Ladung Q abgeschieden werden, folgt aus dem 1. Faraday-Gesetz: Q= n1 · z1 · F = n2 · z2 · F nach Umformung der Gleichungen folgendes heraus: 2. Faraday-Gesetz: n1 z 2 n2 z1 Für die in Versuch 4 durchgeführte Wasserelektrolyse lässt sich somit folgendes Verhältnis aufstellen: es entstanden 2 mol Wasserstoff und 1 mol Sauerstoff, für 1 mol Wasserstoff wer- 21 - den 2 Elektronen benötigt, für 1 mol Sauerstoff werden 4 Elektronen benötigt. Man kommt dann auf ein Verhältnis von 2 4 1 2 Die Elektrolyse des Wassers ist nicht nur ein sehr anschaulicher Versuch, der eine hohe Erfolgsquote besitzt, er ist auch sehr gut geeignet um den Schülern mit einem Versuch gleich zwei wichtige Gesetze herzuleiten. Die Elektrolyse ist in der Industrie ein häufiges und sehr wichtiges Verfahren um Verbindungen zu trennen. Beispielsweise ist die Chloralkali-Elektrolyse eines der wirtschaftlich bedeutendsten Elektrolysen. Hier gibt es 2 Verfahren, die bei der Chloralkali-Elektrolyse zu nennen sind, das Diaphragmaverfahren und das Amalgamverfahren. Bei dem Diaphragmaverfahren wird eine Natriumchlorid Lösung mit einer Eisenkathode und einer Titananode elektrolysiert. Folgende Reaktionen laufen dabei ab: Kathode: 2 H2O (l) + 2 e- H2 (g) + 2 OH-(aq) Anode: 2 Cl-(aq) Cl2 (g) + 2 e- Gesamtreaktion: 2 Na+(aq) + 2 Cl-(aq) + 2 H2O (l) H2 (g) + Cl2 (g) + 2 Na+(aq) + 2 OH-(aq) Bei der Chloralkali-Elektrolyse entsteht also Natronlauge, Chlor und Wasserstoff. Um eine möglichst chloridfreie Natronlauge zu erhalten, wird der Anodenraum vom Kathodenraum getrennt. Da das Diaphragma für Ionen durchlässig ist, wandern Chloridionen in den Kathoderaum und Hydroxidionen in den Anodenraum. Da bei zu hoher Hydroxidionenkonzentration auch eine unerwünschte Hydroxidionen Abscheidung erfolgt, wird der Hydroxidionenwanderung dadurch entgegen gewirkt, dass nur eine verdünnte Lauge (bis zu 15%) erzeugt wird. Bei dem Amalgamverfahren erfolgt die Elektrolyse der Natriumchloridlösung ab einer Quecksilberanode und an Titankathoden. An der Anode erhält man Chlor und an der Kathode bildet sich wegen der hohen Überspannung kein Wasserstoff, sondern Natriumamalgam. Die Elektrolyse erfolgt bei etwa 70°C in Wannen aus Stahl, über deren Boden das Quecksilber in dünner Schicht fließt. Dicht über dem Quecksilber befinden sich die Anode aus Titan. Die Zersetzungsspannung beträgt ca. 4,5 V bei Stromstärken bis zu 450000 A. Das bei der Elektrolyse gebildete Natriumamalgam reagiert in einem nachgeschaltetem Zersetzer. - 22 - Der Vorteil bei diesem Verfahren ist die Gewinnung von nahezu chloridfreier Natronlauge (50-70%). Das Quecksilber wird wieder in die Elektrolysezelle gepumpt, so dass ein Quecksilberkreislauf entsteht. Trotz des Kreislaufs sind zur Entfernung von Quecksilberspuren aus den Produkten, aber auch aus der Abluft und dem Abwasser der Elektrolyseanlage, aufwändige Reinigungsmaßnahmen erforderlich, deshalb verliert das Verfahren zunehmend an Bedeutung. 5. Einsatz in Alltag und Technik Batterien und die Elektrochemie kommen weit häufiger zum Einsatz, als man es erwartet. Sie werden vor allem im Haushalt sehr häufig verwendet, einige Beispiele sind Taschenlampen, elektrisches Spielzeug, elektrische Küchengeräte ohne Netzstecker uvm. Aber auch in der Industrie hat die Elektrochemie einen großen Anwendungsbereich wie man am Beispiel der Elektrolyse schon erkennen konnte. Gerade auf dem Sektor der Brennstoffzellen wird zur Zeit noch intensiv geforscht. Geräuscharme und emissionsfreie Elektroautos werden als Alternative zu den Fahrzeugen mit Verbrennungsmotor entwickelt, insbesondere für den Einsatz in Städten. Aussichtsreich ist die Verwendung von Wasserstoff in Verbindung mit der Brennstoffzellentechnologie. In solchen Fahrzeugen kann der Wasserstoff z.B. durch Reformierung von Methanol erzeugt oder verflüssigt in speziellen Tanks mitgeführt werden. Den Vorteil der einfachen Handhabung verliert Methanol jedoch im Hinblick auf die Energiebilanz bei seiner Herstellung aus Erdgas und der Reformierung. Die noch vorhandene CO2 Emission ist sehr gering. Ohne Emission lässt sich flüssiger Wasserstoff nutzen, aber dessen Verflüssigung erfordert hohen Energieaufwand. Deshalb werden auch Speicher für gasförmigen Wasserstoff entwickelt. Wesentlich für die Nutzung der Brennstoffzellentechnologie in Fahrzeugen sind aber auch die Fragen zur Infrastruktur der Brennstoffversorgung. 6. Lehrplan Das Thema Elektrochemie kommt ganz konkret im neuen G8 Lehrplan vor. Als erstes ist dieses Thema in der 10.1 verankert unter dem großen Themenkomplex Redoxreaktionen. Zuerst werden Oxidation und Reduktion mit den Elektronenübergängen besprochen, im Anschluss folgen die Redoxreaktionen und nun kommt auch schon die Redoxreihe und schon ist man - 23 - mitten im Thema Elektrochemie gelandet. Es werden Standardpotentiale und die elektrochemische Spannungsreihe besprochen, weiter noch Leitfähigkeitstitrationen und Elektrolysen von wässrigen Lösungen. In der Oberstufe (12.2 LK) kann man das Thema Elektrochemie als Wahlpflichtfach vertiefen und hier beispielsweise auf die Herleitung der Nernstschen Gleichung weiter eingehen. 7. Didaktische Aspekte Elektrochemie ist ein meist nicht so beliebtes Thema bei den Schülern wie beispielsweise Farbstoffe oder Kunststoffe. Die Elektrochemie ist meiner Meinung nach jedoch ein sehr wichtiges Thema, denn sehr viele Dinge aus unserem Haushalt und der Umgebung funktionieren nur, weil es Batterien gibt. Das Notebook wäre kein Notebook, wenn man es nicht kabellos benutzen könne oder man stelle sich die Welt ohne Handys vor, die nicht portabel sind, da sie ohne Netzstecker nicht laufen würden. Den Schülern sollte man anhand solchen Beispielen klar machen, dass das ein wichtiger Bereich der Chemie ist. Um den Chemieunterricht interessant zu gestalten ist es mit 100%iger Sicherheit nötig, den Schülern genügend Zeit zu geben, um auch mal Versuche selbst durchzuführen. Wenn die Schüler mal ihre eigene Batterie zusammen gebaut haben und sehen, dass was sie vorher theoretisch errechnet haben ist wirklich so anwendbar ist. Zuvor muss jedoch einiges an Theorie bekannt sein, beispielsweise Redoxgleichungen und die dazugehörigen Oxidationszahlen. Zusammenfassend kann ich jedoch sagen, dass es sich auf jeden Fall lohnt, sich mit dem Thema Elektrochemie näher auseinander zu setzen, da es wirklich sehr spannend ist. 8. Literaturverzeichnis - Atkins, P. W.; Physikalische Chemie; 3. korr. Auflage, Wiley-VCH Verlag, Weinheim 2001 - Holleman, Wiberg; Lehrbuch der Anorganischen Chemie, 101. Auflage, Walter de Gruyter, Berlin 1995 - Riedel, E.; Anorganische Chemie, 6. Auflage, Walter de Gruyter, Berlin 2004 - 24 - - Mortimer, C. E.; Chemie - das Basiswissen der Chemie, 8. überarbeitete Auflage, Georg Thieme Verlag, Stuttgart 2003 - Eisener, W., Gietz, P., Elemente Chemie II, 1. Auflage, Ernst Klett Verlag, Stuttgart 2006 - Jäckel, M., Risch, K. T., Chemie heute Sekundarbereich II, Schroedel Schulbuchverlag, Hannover 1993 - Neumüller, B., Rickelt, E.; Lehrerfortbildung Elektrochemie - Unterricht Chemie 12/2001, Nr. 66, Themenheft: Elektrochemie - Janek J., Siebert A., Hofmann H.P., Schwertfeger H.; Von der Verbrennung zum Herzschlag, ChiuZ 2004, Nr. 38, S. 10-23 - http://www.univie.ac.at/chemiedidaktik/ - http://www.chemieunterricht.de/dc2/ 9. Abbildungsverzeichnis Abb. 1 www.hamm-chemie.de/images/k10/ionenwanderung3.jpg Abb. 2 www.reliefs.ch/chemie/daniellelement-Dateien/image002.jpg Abb. 3 Aus: Eisener, W., Gietz, P., Elemente Chemie II, 1. Auflage, Ernst Klett Verlag, Stuttgart 2006 Abb. 4 http://chestofbooks.com/food/household/The-Profession-Of-Home-Making/images/Fig28-A-Leclanche-Cell.jpg Abb. 5 www.chempage.de/lexi/lecl_small.jpg Abb. 6 - 25 - Aus: Eisener, W., Gietz, P., Elemente Chemie II, 1. Auflage, Ernst Klett Verlag, Stuttgart 2006 Abb. 7 http://img.stern.de/_content/32/55/325591/batterie400_250.jpg Abb. 8 Aus: Eisener, W., Gietz, P., Elemente Chemie II, 1. Auflage, Ernst Klett Verlag, Stuttgart 2006 Abb. 9 www.chemiedidaktik.uniwuppertal.de/alte_seite_du/material/virtklas/Projekt_1_Stromleitung_in_Wasser/Hofmann _klein_123.gif - 26 -