kurzfristige blutdruckregulation
Werbung

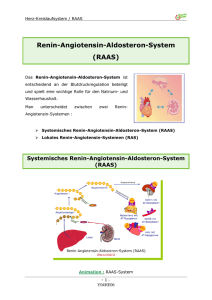
REGULATION des BLUTKREISLAUFS (Zusammenfassung Thews/Vaupel) regionale Regulationsmechanismen Durchblutung der einzelnen Organe auf den jeweiligen Bedarf überregionale Regulationsmechanismen Anpassung aller kardiovaskulären Funktionen an wechselnde Kreislaufsituationen Einstellung eines adäquaten Herzzeitvolumens Sicherstellung eines ausreichenden Perfusionsdrucks aller Organe Konstanthaltung des Blutvolumens (unter Beteiligung der Nieren) KURZFRISTIGE BLUTDRUCKREGULATION → Reaktion innerhalb weniger sec → Wirksamkeitseinschränkung resp. –verlust bei dauernder Beanspruchung innerhalb von wenigen Tagen 1.PRESSOREZEPTORENREFLEX (DEPRESSORREFLEX) Pressorezeptoren (Barorezeptoren) → Erregung durch Dehnung der Gefässwand Lokalisation: Media und Adventitia von Karotissinus → N. IX (R. sinus carotici, Karotissinusnerv) → Medulla oblongata Aortenbogen → N. X (Rr. cardiaci thoracici, linker Vagus) → ständig Informationen an die kreislaufregulierenden Neurone des „Kreislaufszentrums“ Blutdruck-Nervenimpuls-Charakteristik der Pressorezeptoren (isoliertes Karotissinuspräparat im Tierversuch) mit folgendem Ergebnis: akuter Druckanstieg → Frequenzzunahme in PR (und umgekehrt) auch bei stationären transmuralen Drücken im physiologischen Bereich → ständig mässige Erregung, ständig Impulse Frequenzabhängigkeit vom jeweiligen Mitteldruck → charakt. S-förmiger Verlauf mit einem linearen Bereich grösster Empfindlichkeit zwischen 80 und 180 mmHg pulssynchrones Impulsmuster → aufgrund rhythmischer Druckschwankungen im arteriellen System (PD-Rezeptoren) (Impulsfrequenz in der Anstiegsphase der Pulskurve überproportional zunehmend) Pressorezeptoren sind Proportional-Differential-Rezeptoren (PD-Rezeptoren) → signalisieren nicht nur mittlere Intensität, sondern auch die Änderungsgeschwindigkeit von Druckreizen → reagieren viel heftiger auf schnelle als auf langsame Blutdruckänderungen → somit ständig Informationen an die kreislaufregulierenden Neurone des „Kreislaufszentrums“ über: Höhe des arteriellen Mitteldrucks Anstiegssteilheit der Pulskurve Grösse der Blutdruckamplitude Herzfrequenz Antwort der kreislaufregulierenden Neurone via vegetativer Efferenzen: Bei arterieller Drucksenkung → Aktivität der PR → Herzaccelerationszentrum, Herzhemmungszentrum , Vasomotorenzentrum → allgemeine Sympathikusaktivierung und Hemmung Parasympathikus http://www.8ung.at/prionerl -1- DISCLAIMER ! Herzfrequenz → HZV Kontraktilität TPR (durch nerval vermittelte Vasokonstriktion, v. a. der Widerstandsgefässe ind Skelettmuskulatur und Bauchorganen; zusätzlich unterstützt durch Catecholamin Ausschüttung [allg. vasokonstriktorische Wirkung] aus dem symp. innervierten NNM) somit arteriellen Mitteldruck weiters Förderung des venösen Rückstroms zum Herzen → durch gleichzeitige Konstriktion der Kapazitätsgefässe Bei arterieller Druckerhöhung → depressorische (blutdrucksenkende) Gegenregulation → DEPRESSORREFLEX (Afferenzen via IX/X → Nucl. tractus solitarii, welcher im Normalfall hemmende Wirkung auf den Sympathikus hat) → bei Durchtrennung der afferenten Bahnen (Blutdruckzügler=N. depressor und Karotissinusnerv) → exzessiver Anstieg des Blutdrucks → ENTZÜGELUNGSHOCHDRUCK Regelkreis Regelgrösse Arterieller Mitteldruck Registrierung Pressorezeptoren Regler Kreislaufregulierende Neuronenverbände (Med. oblongata) Stellglieder HZV, TPR (bestimmen im wesentl. den art. Mitteldruck) 2.DEHNUNGSREZEPTORENREFLEXE Lokalisation der Dehnungs- resp. Volumen-Rezeptoren: → im intrathorakalen Niederdrucksystem (Herz, herznahe grosse Venen) → Kontrolle des Füllungszustands und damit des zirkulierenden Blutvolumens → Impulse via N.X → ständig Info an die kreislaufregulierenden Neurone in der Medulla oblongata, weiters Impulse zum hypothalamischen Regelzentrum für den Wasserhaushalt Von besonderer Bedeutung: A und B Rezeptoren (Mechanorezeptoren in der Wand beider Vorhöfe) [weiters Mechanorezeptoren in der linken Ventrikelwand] systolische A Rezeptoren → Reaktion auf aktive Spannungsentwicklung während der Vorhofkontraktion diastolische B Rezeptoren → Reaktion auf passive Dehnung bei der Vorhof-Füllung [Lang (S.43ff):] Volumenrezeptoren resp. B-Rezeptoren in den Vorhöfen und Pulmonalarterien lösen bei ihrer Erregung über die kreislaufregulierenden Neurone des Hirnstamms eine Stimulation des Vagus und eine Hemmung des Sympathicus aus. Dehnung des Vorhofs stimuliert ferner die Ausschüttung des ANF (atrialer natriuretischer Faktor), welcher die renale Durchblutung, glomeruläre Filtrationsrate und Na-Ausscheidung steigert und die peripheren Gefässe dilatiert. A-Rezeptoren der Vorhöfe bwirken bei Reizung eine Steigerung der Sympathikusaktivität und werden im Gegensatz zu den B-Rezeptoren während der aktiven Vorhofkontraktion erregt. Ferner git es Dehnungsrezeptoren in den Herzkammern, deren Reizung zur Hemmung des Sympathikus führt. Eine plötzliche, starke Reizung, z.B. durch Schlag gegen das Herz, kann wie beim Carotissinus einen Herstillstand provozieren oder zu einem starken Blutdruckabfall führen. Schliesslich führen Hypoglykämie sowie Erregung von Chemorezeptoren für CO2 und O2, die in erster Linie der Atemregulation dienen, zu einer Aktivierung des Sympathikus. Fasern ziehen zum Nucl. tractus solitarii und zum dorsalen Vaguskern in der Medulla oblongata und stellen die afferenten Leitungswege für die „Entlastungs- resp. Schonreflexe des Herzens“ dar: http://www.8ung.at/prionerl -2- DISCLAIMER ! Gauer-Henry-Reflex „Diuresereflex“ Bezold-Jarisch-Reflex (Vorhofdehnungsreflex ?) Bainbridge Reflex durch lokale Dehnung der Vorhöfe bei erhöhtem zirkulierenden Blutvolumen → verstärkte Erregung der Vorhofrezeptoren → nach ca. 10 – 20 min Hemmung der ADH-Freisetzung und somit Steigerung der renalen Flüssigkeitsausscheidung; umgekehrt bei vermindertem Blutvolumen → verstärkte ADH-Freisetzung; (Zusammenspiel von Adiuretinmechanismus u. natriuretischem Peptid entscheidend) bei vermehrter Dehnung des linken Ventrikels (z.B. bei Myokardhypoxie oder bei Verabreichung von Veratrin) via Reflexweg Verlangsamung der Schlagfrequenz und Vasodilatation der peripheren Blutgefässe Beschleunigung der Herzfrequenz u. Blutdruckanstieg infolge Druckerhöhung im re. Herzvorhof u. in den herznahen Venen bei ungenügendem HMV; Ausdruck einer reflektorischen Vagushemmung; möglicherweise aber kein Reflex, sondern eine durch Dehnungsreize bedingte Änderung der Autorhythmie des Sinusknotens. Eine isolierte Erregung der B-Rezeptoren führt – wie die Aktivierung der arteriellen Pressorezeptoren – zu einer Hemmung des Sympathikus und einer Aktivierung des Parasympathikus 3.CHEMOREZEPTORISCHE UND UNSPEZIFISCHE EINFLÜSSE Aktivierung der: peripheren Chemorezeptoren (z.B. durch Hypoxie [arter.pO2] ) [Exkurs:unterscheide Hypoxie u. Hypoxämie!] zentraler chemosensibler Strukturen resp. Chemorezeptoren (durch Hyperkapnie [pCO2], Azidose [H+] ) → direkt via kreislaufregulierender Neurone in der Medulla oblongata oder indirekt via Atemzentrum werden PRESSORISCHE (blutdrucksteigernde) REAKTIONEN ausgelöst Unspezifische Reize (wirken auf Rezeptoren ausserhalb des kardiovaskulären Systems): Schmerz- und Kältereize Lungendehnung Skelettmuskelkontraktionen periphere Chemorezeptoren (Chemosensoren) befinden sich in parasymphatischen Ganglien: Chemorezeptoren dienen in erster Linie der Atemregulation! anworten mit einer Aktivitätszunahmen, wenn der pO2 abnimmt pCO2 oder [H+] zunimmt Glomus caroticum: ist ein stark vaskularisiertes Gebilde (Kapillarknäuel), enthält Epitheloidzellen u. reichlich Nervenendigungen; spricht vorwiegend auf den O2-Gehalt, weniger auf CO2-Änderungen an; Typ-I-Zellen: über gap-junctions miteinander gekoppelt, sekundäre Sinneszellen, also kein Axon, jedoch synaptischen Kontakt mit afferenten Endigungen des N. sinus carotici → N.IX Reagieren auf Hypoxie, Hyperkapnie und Azidose; Hypoxie, Hyperkapnie und extrazelluläre pH (letzere beide bewirken eine intrazelluläre pH ) vermindert die Leitfähigkeit eines K+-Kanal in der Membran (auf noch nicht genau geklärte Weise)→ Membrandepolarisation → dadurch ein spannungsabängiger Ca²+-Kanal geöffnet und somit Ca²+-Influx → erhöhte intrazelluläre [Ca²+] bewirkt Ausschüttung von Dopamin → Auslösung von AP in afferenten Fasern des N. sinus carotici Gliaähnliche Typ-II-Zellen: umhüllen Typ-I-Zellen Glomera aortica: werden durch Blut aus der Aorta durchströmt, Innervation via Äste von N.X Schaltet man die peripheren Chemorezeptoren aus, führt auch sehr starke Hypoxie nicht mehr zur Atmungssteigerung, sondern eher zur Ventilationsabnahme (zentrale Depression), sprich O2-Wirkung ausschliesslich via Chemorezeptoren. http://www.8ung.at/prionerl -3- DISCLAIMER ! Zentrale Chemorezeptoren Erhöhung des arteriellen pCO2 und der arteriellen [H+] (Hyperkapnie, Azidose) bleiben hingegen als starker Atemreiz vorhanden! Dies ist auf die Wirkung von pCO2 und [H+] auf zentrale inspiratorische und exspiratorische Neurone resp. Chemorezeptoren in der oberflächlichen Ventralseite der Medulla oblongata und im Hirnstamm zurückzuführen, welche Chemosensibilität besitzen. MITTELFRISTIGE BLUTDRUCKREGULATION → Reaktion nach einigen min → volle Wirksamkeit allerdings erst nach einer gewissen Zeit Renin-Angiotensin-Mechanismus Transkapilläre Flüssigkeitsverschiebung, Regulation des intravasalen Volumens 1.RENIN-ANGIOTENSIN-MECHANISMUS Bei starkem Blutdruckabfall oder bei mechanisch ausgelöster Durchblutungsdrosselung → Einschränkung der Nierendurchblutung → Freisetzung des Gewebshormons RENIN aus dem juxtaglomerulären Apparat → vermehrte Bildung von Angiotensin II → starke Konstriktion der arteriellen Widerstandsgefässe → damit TPR und weiters Blutdruck Weitere Angiotensin II – Wirkungen: stimulierend auf zentrale kreislaufregulierende Neurone → Vasokonstriktion weiter verstärkt Hemmung der ADH- Freisetzung Steigerung des Durstgefühls Pathologisch: bei Nierenerkrankungen häufig verstärkter Reninproduktion → renale Hypertonie (sekundäre resp. symptomatische Hypertonie) mit besonders hohen Blutdruckwerten 2.TRANSKAPILLÄRE FLÜSSIGKEITSVERSCHIEBUNG Bei starker Blutdrucksteigerung → Zunahme des effektiven Filtrationsdrucks – vermehrte Filtration in den interstitiellen Raum → dadurch Abnahme des intravasalen Blutvolumens → und sekundär Abnahme des Blutdrucks Bei Blutdrucksenkung → gesteigerte kapilläre Reabsorption LANGFRISTIGE BLUTDRUCKREGULATION → durch Anpassung des Blutvolumens an die jeweilige Kreislaufsituation → Stellglied ist die Flüssigkeitsausscheidung durch die Nieren → Beteiligt sind hierbei: Änderung der renalen Flüssigkeitsausscheidung das Renin-Angiotensin-Aldosteron-System Adiuretin (ADH=Vasopressin) Natriuretische Peptide http://www.8ung.at/prionerl -4- DISCLAIMER ! 1.RENALES VOLUMENREGELSYSTEM → kontrollierte Flüssigkeitsausscheidung durch die Niere nicht nur zur Aufrechterhaltung des Wasser-/Elektrolythaushaltes sondern auch zur Aufrechterhaltung normaler Kreislauffunktionen wichtig bei Erhöhung des arteriellen Blutdrucks → renale Ausscheidung → extrazelluläres Flüssigkeitsvolumen und dadurch Blutvolumen → venöser Rückstrom → HZV → Blutdruck Urinausscheidungskurve: bereits bei sehr kleiner Veränderung des arteriellen Mitteldrucks → grosse Änderung der renalen Ausscheidung Ursache: u.a. durch die Druckabhängigkeit der Nierenmarkdurchblutung → DRUCKDIURESE wenn arterieller Blutdruck nicht autoregulierten Gefässe des Nierenmarks verstärkt durchblutet → vermehrter Abtransport gelöster Substanzen, sodass osmotischer Längsgradient reduziert wird damit auch osmotischer Antrieb für die H2O-Resorption aus dem Sammelrohr trotz ADH-Einwirkung → Urinausscheidung 2.RENIN - ANGIOTENSIN – ALDOSTERON – SYSTEM [Lang: S. 45 ff]: Eine herabgesetzte Durchblutung der Niere, wie sie z.B. durch die Vasokonstriktion bei vermindertem Vorhofdruck oder bei starkem Blutdruckabfall zustande kommt, stimuliert die renale Ausschüttung von Renin. Renin spaltet aus dem in der Leber gebildeten Angiotensinogen Angiotensin I ab, welches durch ein vor allem in der Lunge (Plasma!) vorkommendes CONVERTING ENZYME in Angiotensin II überfpührt wird. Angiotensin II wirkt stark vasokonstriktorisch, stimuliert die Ausschüttung von ADH, Aldosteron und NOR und löst Durst aus. ADH fördert die renale Wasser-, Aldosteron die renale Na-Resorption. Auf diese Weise wird dem Extrazellulärraum Volumen erhalten, das sich - wegen des Filtrationsgleichgewichtes in den peripheren Kapillaren - auch auf den intravaskulären Raum verteilt. Die Volumenzunahme erreicht über eine stärkere Herzfüllung einen Blutdruckanstieg, der durch die vasokonstriktorische Wirkung von Angiontensin II (direkt und über NOR) potenziert wird. Auch ohne Vermittlung ds Renin-Angiontensin-Aldosteron-Mechanismus ist die Niere in der Lage, auf Steigerung des Blutdruckes mit Natriurese und Diurese zu reagieren (→ Druckdiurese). Hier ANF und andere natriuretische Faktoren im Spiel. Druckabhängige und [NaCl]-abhängige Reninabgabe (in Macula densa des JGA gebildet, unter der Kontrolle des Sympathikus; Reizung von -Rezeptoren , von -Rezeptoren die Reninausschüttung) führt zur Bildung von → http://www.8ung.at/prionerl -5- DISCLAIMER ! Angiotensin II → stark vasokonstriktorisch (lokal Konstriktion des Vas afferens und damit Abnahme der glomerulären Filtrationsrate) → stimuliert die Aldosteronsekretion aus der NNR und ADH (Vasopressin) aus dem Hypothalamus → Durst → stimuliert weiters die intrarenale Freisetung von Gefäss-erweiternden Prostaglandinen → schliesslich fördert es via Aldosteron die Na-Resorption im proximalen Tubulus direkt (umgekehrt bei extrem hohen Konzentrationen hemmt es die Natriumresorption) → via ADH fördert es die Wasser Retention („zurückhalten“) → ausserhalb der Niere direkt oder via Freisetzung von NOR aus Nervenendigungen und NNM Vasokonstriktion Aldosteron: → Na-Rückresorption → H2O-Ausscheidung (osmotisch bedingt) bei Blutdruckabfall Erhöhnung des Blutvolumens bei Blutdruckanstieg Reduktion des Blutvolumens weitere Aldosteronwirkungen: Erhöhung der Erregbarkeit der Gefässmuskulatur gegenüber vasokonstriktorischen Einflüssen → durch TPR-Veränderung blutdruckregulierende Wirkung Vereinfachtes Schema zur Regulation von Blut- u. Flüssigkeitsvolumen über das Renin-Angiotensin-Aldosteron-System (RAAS) Vasopressin: Regelung der Osmolarität des Blutplasmas (u. der extrazellulären Flüssigkeit) über das ADH-System, mit den Blutvolumenregulierenden Prozessen über ADH (»ADH-Mechanismus«) u. Atriopeptin (»ANP-Mechanismus«); s.a. Renin-Angiotensin-System http://www.8ung.at/prionerl -6- DISCLAIMER ! 3.ADH (ADIURETIN) Afferente Impulse von Dehnungsrezeptoren der Vorhöfe → neben Kreislaufneuronen in der Medulla oblongata auch Beeinflussung bestimmter Regionen des Hypothalamus (ADH-Bildung) GAUER-HENRY-REFLEX (Volumenregulatorischer Mechanismus) bei Zunahme des zirkulierenden Blutvolumens → verstärkte Erregung der Vorhofrezeptoren → nach 10-20 min Hemmung der ADH-Sekretion → Anstieg der renalen Flüssigkeitsausscheidung umgekehrt bei Abnahme Blutvolumen → ADH-Freisetzung , Urinausscheidung ADH wirkt in hohen Plasmakonzentrationen blutdrucksteigernd (angelsächsisch: Vasopressin!) http://www.8ung.at/prionerl -7- DISCLAIMER ! 4.NATRIURETISCHE PEPTIDE ANP (Atriales Natriuretisches Peptid) und BNP (Zerebrales Natriuretisches Peptid) ANP bei verstärkter Vorhofdehnung aus der Granula der Vorhof-Kardiomyozyten freigesetzt (Blutvolumen u. Blutdruck ) → hemmt die Freisetzung von Renin und Aldosteron → fördert die renale Na+- und Flüssigkeitsausscheidung ANP und BNP antagonisieren die zentralen Effekte von Angiotensin II: ADH-Freisetzung Durst Stimulation blutdrucksteigender Neuronenpopulation Vasokonstriktion ZENTRALE KONTROLLE DES KREISLAUFS → Kreislauffunktionen werden von Neuronenpopulationen kontrolliert, die in der Medulla oblongate, im Hypothalamus, im Kleinhirn und in der Hirnrinde lokalisiert sind. → Zentrale Stelle nehmen die medullären Anteile ein, deshalb als KREISLAUFZENTREN bezeichnet. Skizze: 1.Medulläre Kreislaufkontrolle: Neuronengruppen der Formatio reticularis der Medulla oblongata Grundaktivität von Neuronen in der RVLM übt, vermittelt durch sympathische Efferenzen, einen fördernden Einfluss auf die Herztätigkeit und den Gefässtonus aus afferente Eingänge von den Presso- und Dehnungsrezeptoren projizieren zum Nucleus tractus solitarii. Von hier ausgehende Interneurone ziehen: → einerseits zum Nucleus ambiguus und Nucleus dorsalis nervi vagi (efferente Ausgänge der präganglionären parasympathischen Neuronen zum Herzen) → andererseits zur KVLM; von hier ausgehende Inerneurone hemmen Efferenzen der RVLM, die zu präganglionären sympathischen Neuronen im Rückenmark projizieren. 2.Hypothalamische Einflüsse → beeinflusst bereits unter Ruhebedingungen die Kreislaufregulation → von hier aus komplexe Allgemeinreaktionen gesteuert (vegetatives und hormonales System) → dadurch Anpassung an Belastungs- und Erholungssituationen Reizung der hinteren Hypothalamusregion führt zu Vasodilatation (symp. cholinerg) in der Skelettmuskulatur und zu Vasokonstriktion (symp. adrenerg) in vielen anderen Organen sowie zur Steigerung der Herztätigkeit. Wichtig ist diese hintere Hypothalamusregion für Leistungssteigerung des Organismus bei Alarmzuständen → „FIGHT and FLIGHT“, das vegetative NS wird dadurch in ergotrope Reaktionslage versetzt. Weiters werden vom Hypothalamus aus jene Kreislaufreaktionen ausgelöst, die der Thermoregulation dienen. http://www.8ung.at/prionerl -8- DISCLAIMER ! 3.Zerebellare Einflüsse Reizung der medianen Anteile werden ergotrope Reaktionen ausgelöst, die durch Projektionen von den Purkinje-Zellen auf die kreislaufsteuernden Neuronen der Medulla oblongata vermittelt werden. 4.Kortikale Einflüsse Neokortikale Strukturen, v.a. in den motorischen und prämotorischen Rindenfeldern. Besonders deutlich bei sog. Erwartungs- oder Startreaktionen, also die vegetative Umstellung bereits vor Beginn der körperlichen Arbeit. Unabhängig von der tatsächlich nachfolgenden Leistung kommt es zu einer Steigerung von Herzfrequenz und Blutdruck. Umschaltung der kortikalen Impulse auf das vegetative NS vor allem im Hypothalamus. Auch von palaeokortikalen (Palaeokortex=primitivster Typ der Hirnrinde, Teil des Allocortex) Strukturen können sowohl pressorische als auch depressorische Kreislaufreaktionen ausgelöst werden. Kreislaufumstellung=Orthostase (siehe S. 207 ff) ORGANDURCHBLUTUNG UND DURCHBLUTUNGSREGULATION Faktoren der Regulation der Organdurchblutung, haben in den verschiedenen Kreislauffaktoren einen unterschiedlichen Stellenwert: Veränderung des Basaltonus Aktivität des vegetativen NX myogene Autoregulation vasodilatatorische Metabolite zirkulierende Hormone Gewebehormone endotheliale Wirkstoffe 1.NEURONALE KONTROLLE DES GEFÄSSTONUS Ausgehend vom Ruhetonus (=basaler + neurogener Tonus) → Abnahme des Tonus → Vasodilatation (aufgrund Einwirkung des transmuralen Druckes) → Zunahme des Tonus → Vasokonstriktion http://www.8ung.at/prionerl -9- DISCLAIMER !