Kapitel 4: Chemisches Gleichgewicht
Werbung

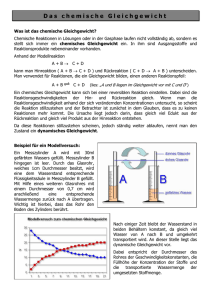
12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 1 Kapitel 4: Chemisches Gleichgewicht 1) Umkehrbare Reaktionen a) Versuch 1 Etwas Phosphorpentabromid PBr5(s) wird in einem ersten Reagenzglas (RG1) erhitzt Zusammenbringen von Brom und Phosphortribromid PBr3(l) in einem zweiten Reagenzglas (RG2) Umkehrbare Reaktion, also: b) Versuch 2 Bei niedriger Temperatur ist das Gas Distickstofftetraoxid N2O4 in einem ersten Rundkolben (RK1) farblos. Wird dieses Gas erwärmt, zerfällt es und es bildet sich braunes Stickstoffdioxidgas NO2: Wird braunes Stickstoffdioxidgas NO2 in einem zweiten Rundkolben (RK2) abgekühlt, so bildet sich farbloses N2O4. Umkehrbare Reaktion, also: siehe Buch “Umkehrbare Reaktionen” S. 86 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 2 2) Chemisches Gleichgewicht 2.1. Anschauungsbeispiele a) Werden die Reagenzgläser RG1 und RG2 von 1)a) in einem Wasserbad auf 80°C erhitzt, findet man in den beiden Reagenzgläsern GLEICHZEITIG sowohl PBr 5(s) wie PBr3(l) als auch Br2(g) an. Bemerkung: man spricht hier von einem HETEROGENEN Gleichgewicht (die an dem Gleichgewicht beteiligten Stoffe treten in unterschiedlichen Aggregatzuständen auf). b) Werden die beiden Rundkolben von Versuch 1b) bei Raumtemperatur aufbewahrt, so nimmt bei RK1 die Farbintensität zu, bei RK2 die Farbintensität ab. Bemerkung: man spricht hier von einem HOMOGENEN Gleichgewicht (alle an dem Gleichgewicht beteiligten Stoffe liegen unter dem gleichen Aggregatzustand vor) 2.2. Merkmale eines chemischen Gleichgewichtes Folgendes homogenes Gleichgewicht wurde sehr genau untersucht: Betrachten wir das sich einstellende Gleichgewicht unter zwei Aspekten. 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 3 a) Chemisches Gleichgewicht und Energetik (Kapitel 1) Sowohl Hin als auch Rückreaktion laufen bis zum Erreichen des Gleichgewichtes spontan ab, also: Darstellung b) Chemisches Gleichgewicht und Kinetik (Kapitel 3) Am Anfang der Reaktion: Während der Reaktion: Im Gleichgewicht: Darstellung: siehe Buch “Einstellung eines chemischen Gleichgewichtes” S.88 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 4 3) Das Massenwirkungsgesetz 3.1. Beispiel Experimentell wurde für folgendes homogenes Gleichgewicht: H2(g) + I2(g) 2HI(g) festgestellt dass: Im Gleichgewicht: Also: Bedeutung: 3.2. Allgemein Für jedes homogene chemische Gleichgewicht: aA + bB eE + dD lässt sich eine Gleichgewichtskonstante formulieren: Bemerkungen: Ist Kc << 1 c(Edukte) >> c(Produkte Ist Kc >> 1 c(Edukte) << c(Produkte) Ist Kc = 1 c(Edukte) = c(Produkte) Kc hängt nur von der Temperatur ab. Im Falle eines heterogenen Gleichgewichtes: alle Stoffe, welche unter festem oder flüssigem (aq) Aggregatzustand vorliegen, werden nicht in der Formulierung von Kc berücksichtigt (c dieser Stoffe werden als konstant bleibend angesehen). 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 5 Beispiel: 4A(s) + B(g) 3D(l) + 2E(g) Es liegt ein heterogenes Gleichgewicht vor: siehe Buch “Das Massenwirkungsgesetz” S. 88-89 und Aufgabe 1) Blatt 3.3. Ermittlung der Zusammensetzung eines Systems im Gleichgewicht Beispiel: In einem Gesamtvolumen von 0,5 Liter werden 2mol HI und 1mol I2 zusammengebracht. Wie lauten die Konzentrationen der Edukte und der Produkte beim Erreichen des Gleichgewichtes bei 393K? Bei 393K: Kc = 60 H2(g) + I2(g) 2HI(g) 12GE EPF Kapitel 4: Chemisches Gleichgewicht Aufgabe A2 S.89 und Aufgaben 2)-4) Blatt Seite 6 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 7 4) Einflüsse auf die Lage eines chemischen Gleichgewichtes 4.1. Volumenveränderung a) siehe V4 S.93 Ausgangsbemerkungen: i) ii) folgendermassen wurde der Kolben zusammengedrückt je heller der Grünton des Indikators, umso grösser c(H3O+) iii) Bild 1 b) Das verbleibende CO2 in der Spritze zusammengedrückt (Verringerung des Volumens): Bild 3 Bild 2 wird während längerer Zeit 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 8 c) Der Kolben wird zurückgezogen (Vergrösserung des Volumens): Bild 4 d) Allgemein Eine Volumenverringerung verschiebt das Gleichgewicht in die Richtung, welche das kleinstmögliche Gasvolumen aufweist. Eine Volumenvergrösserung verschiebt das Gleichgewicht in die Richtung, welche das grösstmögliche Gasvolumen aufweist. siehe Buch “Volumenveränderung” S.92-93 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 9 4.2. Zufuhr/Entzug von Wärme a) Etwas farbloses Distickstofftetraoxid wird erwärmt: b) Etwas braunes Stickstoffdioxid wird abgekühlt c) Allgemein Eine exotherme Reaktion wird durch Wärmeentzug, eine endotherme Reaktion durch Wärmezufuhr begünstigt. siehe Buch “Zufuhr bzw. Entzug von Wärme” S.91 und A3 S.93 4.3. Stoffmengenveränderung a) Zu einer gelben Kaliumchromat/Kaliumdichromat-Lösung wird etwas Salzsäure gegeben. 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 10 b) Zu der unter a) erhaltenen orang-farbenen Lösung werden einige ml einer Baselösung gegeben c) Allgemein Eine Erhöhung der Konzentration einer der am Gleichgewicht beteiligten Stoffe verschiebt das Gleichgewicht in die Richtung, welche einen Teil des zugeführten Stoffes wieder verbraucht. Die Entnahme eines der am Gleichgewicht beteiligten Stoffe verschiebt das Gleichgewicht in die Richtung, welche einen Teil des entnommenen Stoffes wieder bildet. siehe Buch “Stoffmengenänderung” S.90-91, A2-A3 S.93 und Aufgaben Blatt 5)-7) 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 11 5) Löslichkeitsprodukt 5.1. Lösungsvorgang: ein umkehrbarer Vorgang Was passiert während eines Lösungsvorganges? a) Anlagerung der Wassermoleküle an Ionen des Kristalls hydratisierte Ionen b) Führung hydratisierter Ionen in flüssige Phase (Lösung) Schreibweise: Bemerkung: Hydratisierte Ionen können aber auch wierderum in den Kristall eingebaut werden. Schreibweise: Also: siehe Buch S. 96 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 12 5.2. Gleichgewicht bei schwer löslichen Salzen a) Versuch: Zu ganz genau 20ml einer 1molaren Calciumchloridlösung werden ganz genau 25ml einer 1molaren Natriumsulfatlösung gegeben. b) Auswertung Die Calciumchloridlösung enthält Die Natriumsulfatlösung enthält 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 13 Werden die beiden Lösungen miteinander vermischt, reagieren die Calciumionen (Ca2+) mit den Sulfationen (SO42-) zu unlöslichem Calciumsulfat: Obschon SO42- Ionen im Überfluss (0,025mol für 0,02mol Ca2+ Ionen) enthält überstehende Lösung immer noch Ca2+-Ionen (nachweisbar durch einen bestimmten Ca2+ Indikator). Also: Es stellt sich also ein Gleichgewicht zwischen Auflösen (hier: Hinreaktion) und Ausfällen (hier: Rückreaktion) ein. Nur ein sehr geringer Teil von CaSO4 ist in Wasser löslich. Die maximale Menge an CaSO4 welches sich in einem bestimmten Volumen lösen kann wird Sättigungskonzentration cs genannt. Eine gesättigte Lösung ist eine Lösung, welche keinen weiteren Stoff (hier: CaSO4) mehr auflösen kann. Sie enthält die höchstmögliche Menge des gelösten Stoffes. c) Formulierung des MWG KL wird LÖSLICHKEITSPRODUKT genannt (gilt nur bei schwerlöslichen Salzen). KL ist nur abhängig von der Temperatur. Bemerkung: wenn ca(Ab+)cb(Ba-) < KL kein Niederschlag wenn ca(Ab+)cb(Ba-) > KL Niederschlag siehe auch Buch S. 96-97 und Aufgaben Blatt 8) 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 14 d) Berechnung einer Sättigungskonzentration Beispiel: KL für Fe(OH)3 beträgt (Tabelle): KL = 410-40 mol4L-4. Welche Masse an gelöstem Eisen(III)-hydroxid weist 1 Liter einer gesättigten Lösung auf? siehe auch Beispiele B3 und B4 S.97, A2-A3 S.97 und Aufgaben Blatt 9)-12) 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 15 6) Aufgaben 1) Entscheide, ob es sich jeweils um ein homogenes oder um ein heterogenes Gleichgewicht handelt. Formuliere für jede Gleichung das Massenwirkungsgesetz. Gib jeweils die Einheit der Gleichgewichtskonstante Kc an. a) N2(g) + 3H2(g) 2NH3(g) b) CH4(g) C(s) + 2H2(g) c) 2O3(g) 3O2(g) d) C(s) + 2S(g) CS2(g) e) 4HCl(g) + O2(g) 2H2O(g) + 2Cl2(g) f) PCl3(g) + Cl2(g) PCl5(g) g) H2O(l) + HCl(g) H3O+(aq) + Cl-(aq) 2) Man gibt in 1Liter-Gefäss 2mol Phosphorpentachlorid. Dieses zersetzt sich beim erwärmen in Phosphortrichlorid und in Chlor. PCl5(g) PCl3(g ) + Cl2(g) a) Formulieren Kc. b) Berechne die Konzentrationen der einzelnen am Gleichgewicht beteiligten Stoffe bei 250°C. Bei 250°C: Kc = 1,8 mol/L 3) In einem Gesamtvolumen von 500mL werden 2mol Essigsäure CH3COOH und 1mol Ethanol C2H5OH zusammengebracht. Wie lauten die Konzentrationen der Edukte und der Produkte beim Erreichen des Gleichgewichtes bei 298K? Bei 298K: Kc = 4 CH3COOH(l) + C2H5OH(l) CH3COOC2H5(l) + H2O(l) 4) Phosgen (COCl2) ist ein sehr giftiges Gas, welches beim Erwärmen unvollständig in Kohlenmonoxidgas und in Chlorgas zerfällt. a) Stelle die Reaktionsgleichung auf (Gleichgewicht). b) In ein 250mL-Gefäss gibt man 0,5mol Phosgen. Bei Erreichen des Gleichgewichtes bei 527°C findet man nur noch 0,046mol Phosgen im Gefäss an. Berechne die Konzentrationen der Stoffe Kophlenmonoxid und Chlor bei 527°C. c) Wie lautet also die Gleichgewichtskonstante Kc bei 527°C? 5) Wie reagieren folgende Systeme im Gleichgewicht durch Volumenerhöhung? In welche Richtung wird das Gleichgewicht jeweils verschoben? a) 2NOCl(g) b) CH4(g) + H2O(g) c) 2SO2(g) + O2(g) d) H2(g) + Br2(g) e) Ni(s) + 4CO(g) 2NO(g) + Cl2(g) CO(g) + 3H2(g) 2SO3(g) 2HBr(g) Ni(CO)4(g) 12GE EPF Kapitel 4: Chemisches Gleichgewicht Seite 16 6) Wie können folgende Systeme im Gleichgewicht durch Temperaturveränderungen jeweils nach rechts verschoben werden? a) N2(g) + 3H2(g) 2NH3(g) b) 4HCl(g) + O2(g 2H2O(g) + 2Cl2(g) Hr = -114kJ c) C(s) + 2S(g) CS2(g) Hr = +117kJ d) 2O3(g) 3O2(g) Hr = -284kJ e) CH4(g) C(s) + 2H2(g) Hr = +75kJ f) H2O(l) + HCl(g) H3O+(aq) + Cl-(aq) 7) Welchen Einfluss haben folgende Veränderungen auf folgendes System im Gleichgewicht ? HCOOH(l) + CH3CH2OH(l) Methansäure + Ethanol HCOOCH2CH3(l) + H2O(l) Methansäureethylester + Wasser a) Zugabe von Wasser. b) Erhöhung der Temperatur auf 65°C. c) Zugabe einer Base. d) Zugabe von Ethanol. Siedetemperaturen: Methansäure: 100°C; Ethanol: 78°C; Ester: 56°C 8) Schreibe jeweils Ionenverbindungen an: die Lösungsgleichung folgender schwerlöslicher Calciumcarbonat, Bariumdichromat, Silber(I)-sulfid, Aluminiumsulfat, Mangan(II)hydroxid, Eisen(II)-hydroxid 9) Man gibt festes Magnesiumhydroxid in destilliertes Wasser. Man stellt fest, dass c(Mg2+) = 1,4·10-4mol/l beträgt. Berechne das Löslichkeitsprodukt. 10) Die Löslichkeit von Blei(II)-sulfat in destilliertem Wasser beträgt 0,038g/l. Berechne das Löslichkeitsprodukt von Blei(II)-sulfat. 11) Welche Masse an Silber(I)-chromat kann man in 100ml destilliertem Wasser auflösen? KL(Ag2CrO4) = 8,8·10-12. 12) Man vermischt 100ml einer 0,25molaren Natriumfluroidlösung mit 100ml einer 0,3molaren Bariumnitratlösung. Bildet sich ein Bariumfluoridniederschlag?