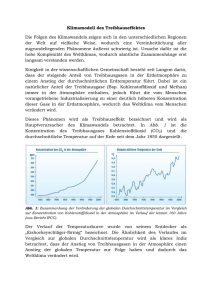
Beeinflussung des chemischen Gleichgewichts Stoffmengenänderung Eisen(III)-Ionen reagieren mit Thiocyanationen in einer Gleichgewichtsreaktion zu Eisen(III)-thiocyanat. Aus der Farbe der Lösung lassen sich Aussagen zu den Konzentrationen der Reaktionspartner der Gleichgewichtsreaktion folgern. Fe3+ (aq) + 3 SCN- (aq) ⇌ Fe(SCN)3 (aq) Versuch: Mischen Sie 2 ml verd. Eisen(III)chlorid-Lösung mit 2 ml verd. Kaliumthiocyanat-Lösung. Verdünnen Sie die blutrote Lösung so weit, dass sie nur noch rosa erscheint. Verteilen Sie diese Lösung auf zwei Reagenzgläser und geben Sie in das eine festes Eisen(III)-chlorid, in das andere festes Kaliumthiocyanat. Aufgaben: 1. Notieren Sie ihre Beobachtungen. 2. Formulieren Sie das Massenwirkungsgesetz (S. 106 u. 107) und deuten Sie ihre Beobachtungen anhand dieses Gesetzes. Zusätzliche Informationen finden Sie im Buch auf den Seiten 100 – 102. 3. Erläutern Sie das Prinzip von LE CHATELIER (Buch S.102) mithilfe des von Ihnen durchgeführten Versuches. 1 Beeinflussung des chemischen Gleichgewichts Änderung von Druck und Volumen Wird eine Coladose oder eine Limonadenflasche geöffnet, bildet sich über der Öffnung ein feiner, weißer Nebel, gleichzeitig bilden sich Gasblasen. Woher rühren diese Phänomene? Das Getränk wird unter Druck von 2000 bis 3000 hPa verschlossen, in der Dose oder Flasche stellt sich ein Gleichgewicht zwischen dem gelösten und dem gasförmigen Kohlenstoffdioxid ein: CO2 (g) ⇌ CO2 (aq) Wird der Verschluss geöffnet, fällt der Druck schlagartig auf den Atmosphärendruck ab, etwa 1013 hPa, Versuch: Lassen Sie in einen Kolbenprober mit Hahn 80 ml Kohlenstoffdioxid strömen. Saugen Sie anschließend noch 20 ml Wasser ein, das mit Universalindikator versetzt worden ist, und schließen Sie den Hahn. Schütteln Sie gut durch. Pressen Sie das Gasvolumen kräftig zusammen und halten Sie den Stempel einige Minuten fest. Lassen Sie den Stempel wieder los und ziehen Sie ihn noch ein wenig heraus. Halten sie den Stempel wieder einige Minuten fest. und das Gas dehnt sich aus, da ihm jetzt ein größerer Raum zur Verfügung steht. Die Temperatur des Kohlenstoffdioxids und der Umgebung sinkt dadurch sehr stark, Wasserdampf kondensiert und bildet den feinen Nebel. Das Entweichen des Kohlendioxids aus der Flasche führt dazu, dass sich das Gleichgewicht zugunsten des ungelösten Kohlenstoffdioxids verschiebt. In der Lösung bilden viele Kohlenstoffdioxidmoleküle Mikrobläschen, diese vereinigen sich zu größeren Blasen die nach oben steigen. Wird die Flasche oder Dose geschlossen, stellt sich erneut das Gleichgewicht zwischen gelöstem und gasförmigem Kohlenstoffdioxid ein. Aufgaben: 1. Notieren Sie ihre Beobachtungen. 2. Formulieren Sie das Massenwirkungsgesetz (S. 106 u. 107) und deuten Sie ihre Beobachtungen anhand dieses Gesetzes. Berücksichtigen Sie dabei auch die Reaktion von Kohlenstoffdioxid mit Wasser. Erstellen Sie hierzu eine Reaktionsgleichung. Zusätzliche Informationen finden Sie im Buch auf den Seiten 100 – 102. 3. Erläutern Sie das Prinzip von LE CHATELIER (Buch S. 102) mithilfe des von Ihnen durchgeführten Versuches. Sachinformationen: Füllt man in einen Kolbenprober Wasser und Kohlenstoffdioxid, so löst sich ein wenig Kohlenstoffdioxid im Wasser. Ein Teil des gelösten Kohlenstoffdioxids reagiert mit Wasser zu Oxonium- und Hydrogencarbonationen weiter. Es stellen sich zwei Gleichgewichte ein: CO2(g) ⇌ CO2(aq) CO2(aq) + 2 H2O(l) ⇌ H3O+(aq) + HCO3–(aq) Drückt man den Kolben in den Zylinder und erhöht dadurch den Druck, so löst sich ein Teil des gasförmigen Kohlenstoffdioxids in der Flüssigkeit. Ein Teil dieses gelösten Kohlenstoffdioxids reagiert wiederum mit dem Wasser. Durch das Lösen des Kohlenstoffdioxids sinkt die Anzahl der Moleküle im Gasraum. Die von außen bewirkte Druckerhöhung wird also durch das Gleichgewichtssystem teilweise kompensiert. Eine Druckerhöhung verschiebt das Gleichgewicht einer Gasreaktion zu der Seite mit der geringeren Anzahl von Gasteilchen; eine Druckerniedrigung zu der Seite mit der größeren Anzahl von Gasteilchen. 2 Beeinflussung des chemischen Gleichgewichts Änderung der Temperatur Das braune Gas Stickstoffdioxid steht bei 27 °C mit dem farblosen Gas Distickstofftetraoxid in einem Gleichgewicht. Bei dieser Temperatur besteht das zugehörige Gemisch zu = 20 % aus Stickstoffoxid und zu = 80 % aus Distickstofftetraoxid. Die Bildung des farblosen Distickstofftetraoxids ist exotherm, seine Spaltung endotherm. 2 NO2 (g) ⇌ N2O4 (g) Versuch: Drei Waschflaschen werden wie in der unteren Abbildung mit einem Stickstoffdioxid-Distickstofftetraoxid-Gemisch gefüllt. Anschließend wird die eine Waschflasche mit Eiswasser gekühlt und die andere mit heißem Wasser erwärmt. Aufgaben: 1. Formulieren Sie die oben dargestellten Beobachtungen. 2. Formulieren Sie das Massenwirkungsgesetz (S. 106 u. 107) für diese Gelichgewichtsreaktion und deuten Sie die Beobachtungen anhand dieses Gesetzes. Zusätzliche Informationen finden Sie im Buch auf den Seiten 100 – 102. 3. Erläutern Sie das Prinzip von LE CHATELIER (Buch S.102) mithilfe des oben dargestellten Versuches. Sachinformationen: : Symbol für Volumenanteil 5 °C 30 °C 70 °C Bei der Temperatur von 27 °C besteht das Gemisch zu = 20 % aus Stickstoffdioxid und zu = 80 % aus Distickstofftetraoxid. Die Bildung des farblosen Distickstofftetraoxids ist exotherm, seine Spaltung ist endotherm. Kühlt man das sich im Gleichgewicht befindliche Gemisch der beiden Gase ab, so nimmt der Anteil des energieärmeren Distickstofftetraoxids im Gemisch zu (Bild links). Die Abkühlung, der Wärmeentzug, begünstigt also die wärmeliefernde (exotherme) Hinreaktion. Die dabei frei werdende Wärme bewirkt, dass sich die Temperatur des Gasgemisches nicht so stark erniedrigt, wie dies bei gleichem Wärmeentzug ohne Gleichgewichtsverschiebung eintreten würde. Erwärmt man das sich im Gleichgewicht befindliche Gemisch, so steigt der Anteil des Stickstoffdioxids (Bild rechts). Die Temperaturerhöhung, die Wärmezufuhr, begünstigt die wärmeverbrauchende (endotherme) Teilreaktion. Bei 100 °C beträgt der Volumenanteil des Distickstofftetraoxids nur noch 11 %. Die Zunahme des Anteils des Stoffes mit der höheren Energie bewirkt, dass die Temperatur sich nicht so stark erhöht, wie dies bei gleicher Wärmezufuhr ohne Gleichgewichtsverschiebung erfolgen würde. Eine Gleichgewichtsverschiebung durch eine Temperaturänderung tritt bei allen Gleichgewichtsreaktionen auf. (Eine Ausnahme sind Reaktionen, die weder exotherm noch endotherm sind.) Temperaturerniedrigung begünstigt die exotherme Reaktion. Temperaturerhöhung begünstigt die endotherme Reaktion. 3