Verbrennung in offenem vs.
Werbung

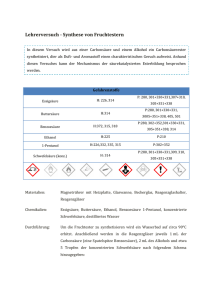
Fachdidaktik Chemie, Amadeus Bärtsch Experimentierkurs Verbrennung in offenem vs. geschlossenem System Mögliche Ziele (in Gelb die Ziele, die ich weiterverfolgt habe): - - - Leitidee: Prinzip der Massenerhaltung erklären o SuS sollen verstehen, dass sich Sachen umwandeln, aber nie verschwinden! o Verstehen, dass Ausgangsstoffe auch aus der Umgebung kommen und nicht nur in den gestellten Stoffen sind Dispositionsziel: SuS sollen immer schauen, ob an beiden Seiten der Reaktionsgleichung die gleichen Dinge enthalten sind. Sie müssen verstehen, dass nichts verloren gehen darf und sonst die Aufgabe wohl falsch gelöst ist. Operationalisiertes Ziel: Da man ein Prinzip erklärt, eher schwierig (oder sehr einfach). o Warum kann ein geschlossenes System keine Masse verlieren? Anderes mögliches Ziel, oder Anknüpfung - Leitidee: SuS sollen ein Gefühl dafür bekommen, welche Massen bei Verbrennungen umgesetzt werden Dispositionsziel: Verstehen, welche Mengen Treibstoff ein Auto verbraucht und zu welchen Mengen CO2 dies führt. CO2 Emission fassbar machen. Operationalisiertes Ziel: Errechnen, wieviel CO2 aus einer bestimmten Masse eines Kohlenwasserstoffs entsteht. (ich finde es selber beeindruckend, wenn man ausrechnet, dass man 100 Grillanzünder-würfel braucht um ca. 10 km mit dem Auto zu fahren). Aufgabe 5 in den Übungen nur machen, wenn dieses Lernziel auch verfolgt wird. Voraussetzungen: Für das Arbeitsblatt müssen die SuS Reaktionsgleichungen aufstellen können und Verbrennung kennen. Ist aber nicht zwingend für die Erklärung der Massenerhaltung Zeitbedarf: 15 min; ja nach Arbeitsblatt länger 1 Fachdidaktik Chemie, Amadeus Bärtsch Experimentierkurs Skizze: Materialien: Grillanzünder (Migros), Porzellanschale, Reagenzglas, Kristallisierschale, Gummistopfen, Klebstreifen, Holzklammer, Streichhölzer, Brenner, 2 Waagen 2 Fachdidaktik Chemie, Amadeus Bärtsch Experimentierkurs Durchführung: 1. Paraffinwürfel a. Porzellanschale auf einer Kristallisierschale (Isolation der Waage) auf eine Waage stellen; Waage auf „0“ stellen b. Würfel in das Becherglas legen c. Wiegen und Gewicht notieren d. Würfel anzünden e. Man kann den Massenverlust des Würfels direkt sehen f. Schüler Gewicht notieren lassen (ist nicht möglich, da es permanent abnimmt) 2. Streichholz im Reagenzglas a. Abgebrochens Streichholz mit Zündkopf in Reagenzglas geben b. Dieses mit einem Gummistopfen verschliessen und mit 2 Streifen Klebefilm sichern c. Reagenzglasständer auf Waage stellen und auf „0“ stellen d. Reagenzglas wiegen und Wert notieren e. Reagenzglas mit Bunsenbrenner erhitzen bis Streichholz zündet (dauert ca. 10 sec) f. Reagenzglas wieder wiegen; Gewicht ist unverändert Reaktionsgleichung (Paraffin): C31H64 + 47 O2 31 CO2 + 32 H20 Auswertung / Ablauf: 1. 2. 3. 4. Versuch Teil A der Skizze Arbeitsblatt Teil B der Skizze mit genauer Erklärung der Abläufe Der Massenverlust bei Paraffin kommt dadurch zustande, dass die Produkte in die Luft entweichen. Das verschlossene Reagenzglas ist ein geschlossenes System; Masse kann weder rein noch raus und bleibt entsprechend konstant. Entsorgung: Alle Produkte sind ungiftig und können im Hausmüll entsorgt werden Literatur: K. Häusler, H. Rampf, R. Reichelt. 1995 Experimente für den Chemieunterricht, mit einer Einführung in die Labortechnik, Oldenburg Schulbuchverlag, München, 2. Auflage, S67-68 Kommentar: In dieser Literaturstelle ist nur der Versuch mit dem Streichholz im Reagenzglas beschreiben. Die Massenänderung beim Streichholz ist minimal und kann mit den normalen Waagen kaum gemessen werden. Daher der Zusatz mit dem Paraffinwürfel. Dies ist zwar kein Kontrollversuch, aber man kann sehr schön den permanenten Masseverlust sehen. Autor: Georg Lambert 3 Fachdidaktik Chemie, Amadeus Bärtsch Experimentierkurs Arbeitsblatt Lösungen zum Arbeitsblatt: 1. Warum verliert der Paraffinwürfel Masse und nicht das Reagenzglas? Wo ist die „fehlende Masse“ des Paraffinwürfels? Beim offenen System können die Reaktionsprodukte als Gas entweichen. Im geschlossenen System kann nichts abgegeben werden, die Masse muss gleich bleiben. Im offenen System wird die fehlende Masse als Gas an die Luft abgegeben. 2. Skizzieren Sie die Situation nach dem Verbrennen in einer ähnlichen Skizze, wie der an der Tafel dargestellten. Geben Sie in der Skizze die Reaktion von Paraffin mit Luft an (Nur Edukte und Produkte, nicht ausgeglichen). Paraffin: C31H64 Siehe Skizze oben 4 Fachdidaktik Chemie, Amadeus Bärtsch Experimentierkurs 3. Wenn Sie einen Eisennagel statt des Paraffinwürfels in die Schale geben würden und so lange warten, bis dieser vollständig verrostet ist (ziemlich lange…): Was für eine Änderung der Masse erwarten Sie? Begründen Sie Ihre Antwort Der Nagel rostet. Das reine Eisen verbindet sich also mit etwas aus der Luft (Sauerstoff) zu „Eisen + etwas anderem“ (Eisen und Sauerstoff, Eisenoxid). Da das Eisen noch da ist und etwas dazu kommt, muss die Masse zunehmen. Die zusätzliche Masse kommt als Sauerstoff aus der Luft. 4. (nur mit Lernziel 2) Der Paraffinwürfel wog am Anfang 12 g. Wenn der Paraffinwürfel vollständig verbrannt ist; wieviel Gramm H2O und CO2 sind dann entstanden? C31H64 mit 436 u entsprechen 12 g 47 O2 mit 1504 u entsprechen 41.4 g 31 CO2 + 32 H20 müssen also 53.4 g entsprechen. 31 CO2 mit 1364 u entsprechen also 37.5 g 32 H20 mit 576 u entsprechen also 15.8 g Ein Paraffinwürfel setzt also bei der Verbrennung ca. 38 g CO2 frei. (ein schöner SUV pro KM durchaus mal 300g oder mehr) 5