ppt
Werbung

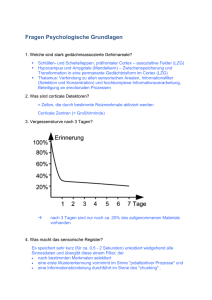
Informationsübertragung im Nervensystem Informationsübertragung im Nervensystem 1. 2. 3. 4. 5. 6. 7. Aufbau des Nervensystems Aufbau einer Nervenzelle Ruhemembranpotential Aktionspotential Erregungsleitung Erregungsübertragung Erregungsausbreitung im Neuronenverband Informationsübertragung im Nervensystem 1. Aufbau des Nervensystems 1. Aufbau des Nervensystems Das menschliche Nervensystem 1. Aufbau des Nervensystems Das menschliche Nervensystem das zentrale Nervensystem (ZNS) 1. Aufbau des Nervensystems Das menschliche Nervensystem das zentrale Nervensystem (ZNS) das periphere Nervensystem (PNS) 1. Aufbau des Nervensystems 1.1 Das zentrale Nervensystem (ZNS) Das ZNS umfasst das Gehirn und das Rückenmark. Die Aufgaben des ZNS sind: • Integration aller „sensiblen“ Reize, die ihm – afferent – von innerhalb oder außerhalb des Organismus zugeleitet werden • Koordination sämtlicher motorischer Eigenleistungen des Gesamtorganismus • Regulation aller dabei ablaufenden innerorganischen Abstimmungsvorgänge, zwischen den organischen Subsystemen oder Organen, einschließlich solcher hormoneller Art 1. Aufbau des Nervensystems 1.1 Das zentrale Nervensystem (ZNS) • Das ZNS wird eingeteilt in graue und weiße Substanz • Die graue Substanz liegt im Gehirn außen und im Rückenmark innen. Sie besteht hauptsächlich aus den Nervenzellkörpern. • Die weiße Substanz liegt im Gehirn innen und im Rückenmark außen. Sie besteht hauptsächlich aus den Nervenfasern, also Axonen und Dendriten. • Das ZNS ist durch den Schädel, den Wirbel – Spinal – Kanal und die Blut – Hirn – Schranke geschützt. 1. Aufbau des Nervensystems 1.2 Das periphere Nervensystem (PNS) Das periphere Nervensystem umfasst alle Nervenzellen, die nicht zum ZNS gehören. Eine starre Abgrenzung ist allerdings nicht sinnvoll. • Motorische und vegetative Neuronen haben ihre Zellkörper im ZNS, die Fortsätze reichen aber ins PNS. • Die sensiblen Neurone dagegen haben ihre Zellkörper fast ausnahmslos in Ganglien (Nervenknoten) außerhalb des ZNS, ihre Fortsätze ziehen aber fast alle ins ZNS. • Nur bei intramuralen Nerven (Nerven in der Wand von inneren Organen) findet die Informationsverarbeitung teilweise unabhängig vom ZNS statt. 1. Aufbau des Nervensystems 1.2 Das periphere Nervensystem (PNS) • Das PNS wird in das somatische und das autonome Nervensystem weiter unterteilt. • Das somatische Nervensystem regelt die Funktionen, die der Beziehung zur Außenwelt dienen, also der willkürlichen und reflektorischen Motorik und der Oberflächen- und Tiefensensibilität. • Das autonome (auch: vegetative) Nervensystem kontrolliert die „Vitalfunktionen“, wie Herzschlag, Atmung, Blutdruck, Verdauung und Stoffwechsel. Außerdem werden Sexualorgane und das Blutgefäßsystem vom autonomen Nervensystem beeinflusst. Informationsübertragung im Nervensystem 2. Aufbau einer Nervenzelle 2. Aufbau einer Nervenzelle Eine Nervenzelle besteht aus folgenden (Haupt-) Bestandteilen: • Zellkörper (Soma) • Dendriten • Axon • Synapsen 2. Aufbau einer Nervenzelle Soma: • enthält den Zellkern und einige Zellorganellen • ist etwa 0,25mm groß • in ihm werden alle für die Funktion der Nervenzelle wichtigen Stoffe produziert, wie z.B. Neurotransmitter Dendriten: • nehmen Signale von anderen Neuronen oder Sinneszellen auf und leiten sie zum Soma weiter • Dendritenbaum einer einzigen (menschlichen) Zelle kann mit bis zu 200.000 Fasern anderer Neuronen in Kontakt stehen 2. Aufbau einer Nervenzelle Axon: • leitet die Signale vom Soma weg hin zu den Synapsen • im Soma produzierte Neurotransmitter werden durch das Axon zu den Synapsen transportiert • kann je nach Typ der Nervenzelle von 1µm bis über einen Meter lang sein • wird von aufeinanderfolgenden Myelinscheiden umhüllt, die von sog. Ranvier‘schen Schnürringen unterbrochen werden Synapsen: • Verbindungspunkt zwischen zwei Nervenzellen an dem Reizübertragung meist chemisch erfolgt • ein Neuron hat bis zu 10.000 Synapsen, das menschliche Gehirn etwa 1 Billiarde 2. Aufbau einer Nervenzelle Charakteristische Anordnung der Dendritischen Fortsätze verschiedener Neurone im ZNS Kleinhirnrinde Rückenmark Großhirnrinde Informationsübertragung im Nervensystem 3. Ruhemembranpotential 3. Ruhemembranpotential Wie die Membranen von anderen Zellen besteht die Membran einer Nervenzelle aus einer Doppellipidschicht in die Proteine eingelagert sind. Zu beiden Seiten der Membran sind unter anderem Salze in wässriger Lösung. Wichtig sind hier NaCl und KCl. 3. Ruhemembranpotential Die Natrium – Kalium – Pumpe Eigentlich würden sich die Konzentrationen im Intra- und Extrazellulärraum ausgleichen, aber die sog. Natrium – Kalium – Pumpe pumpt Natriumionen aus der Zelle herraus und Kaliumionen in die Zelle hinein. Die dafür benötigte Energie wird aus dem Zellstoffwechsel durch die Umwandlung von ATP bereitgestellt. Stöchiometrisch bedeutet die Umwandlung von einem ATP – Molekül das 3 Natriumionen aus der Zelle herausgepumpt werden und 2 Kaliumionen in die Zelle hineingepumpt werden. Die Aktivität der Natrium – Kalium – Pumpe hängt von der Ionenkonzentration zu beiden Seiten der Membran ab. 3. Ruhemembranpotential Die erste treibende Kraft: Ionenkonzentrationsgradienten Durch die Natrium – Kalium – Pumpe ist die Konzentration von Natrium außerhalb der Zelle sehr viel höher als innerhalb. Für die Konzentration von Kalium ist es umgekehrt. Auch für die Konzentration von Chlorionen bildet sich infolge eines aktiven Transports durch die Membran ein Konzentrationsungleichgewicht aus. Es bildet sich also über der Membran ein Konzentrationsgradient aus. intrazellulär extrazellulär Kalium (mmol/l) 120 – 150 4–5 Natrium (mmol/l) 5 – 15 140 – 150 Chlor (mmol/l) 4–5 120 – 150 Die zweite treibende Kraft: Potentialdifferenz Da die Natrium – Kalium – Pumpe elektrogen arbeitet, bildet sich über der Membran außerdem eine Potentialdifferenz aus. 3. Ruhemembranpotential Die zwei treibenden Kräfte des Ruhemembranpotentials 3. Ruhemembranpotential • Diese Treibenden Kräfte können nur in Bewegung umgesetzt werden, wenn die Membran für die verschiedenen Ionen durchlässig ist. • Für Kaliumionen ist die Membran relativ gut durchlässig. • Für Natriumionen ist die Membran so gut wie gar nicht durchlässig. • Verantwortlich für die selektive Permeabilität sind Kanalproteine in der Membran, die jeweils für eine bestimmte Ionensorte durchlässig sind. 3. Ruhemembranpotential Durch das Zusammenspiel der Natrium – Kalium – Pumpe und den zwei treibenden Kräften baut sich entlang der Membran ein elektrisches Feld auf, dessen negativer Pol im Zellinneren liegt. Diese Potentialdifferenz wird Ruhemembranpotential genannt und ist gleich dem Kalium Gleichgewichtspotential. 3. Ruhemembranpotential Registrierung von Ionenströmen durch Membrankanäle Die Ionenströme die durch Membrankanäle fließen können mit der sog. Spannungsklemme gemessen werden. Dabei wird über der Membran eine bestimmte Spannung eingestellt und konstant gehalten. Damit diese Spannung konstant bleibt muss der Ionenstrom durch die Kanäle genau kompensiert werden. Mit der Patch – Clamp Methode kann der Strom durch einzelne Kanäle erfasst werden. Mit einer Kapilare wird ein kleiner Membranfleck angesaugt, der möglichst wenige Kanäle enthält. Dann wird das Potential auf einen konstanten Wert eingestellt und der benötigte Kompensationsstrom gemessen. 3. Ruhemembranpotential Potentialregistrierung Zur Messung des Membranpotentials wird eine Mikroelektrode in die Zelle eingeführt. Das ist eine Glaskapilare mit einem Spitzendurchmesser von 0,1 bis 1µm. Diese wird mit einer Elektrolytlösung gefüllt, und so eine elektrisch leitende Verbindung zum Intrazellulärraum hergestellt. Mit einem Spannungsmessgerät kann die Potentialdifferenz zwischen dem Zellinneren und der Referenzelektrode im Extrazellularraum gemessen werden. 3. Ruhemembranpotential • Das Kaliumgleichgewichtspotential liegt bei den meisten Warmblütern zwischen –80 und –90mV. • Es kann mit der Nernst – Gleichung berechnet werden: E = RT/(zF)*ln(c(intrazellulär)/c(extrazellulär)) • Es kann an natürlichen Membranen vom Ruhemembranpotential abweichen, da natürliche Membranen nicht völlig undurchlässig für Natrium- und Chlorionen sind. Das Verhältnis der Permeabilitäten ist: P(K):P(Na):P(Cl) = 1:0,04:0,45 • Das Ruhemembranpotential kann durch Änderung der Ionenkonzentrationsgradienten oder durch Änderung der Permeabilitäten geändert werden 3. Ruhemembranpotential Um die Änderung des Membranpotentials zu untersuchen werden zwei Mikroelektroden in die Zelle eingeführt, eine zur Ableitung des Membranpotentials (ME1), eine zur Veränderung des Membranpotentials (ME2). Der Ausgangswert für das Membranpotential wird variiert und dann die Permeabilität für die Kaliumionen selektiv erhöht. 3. Ruhemembranpotential Membranpotential vor Erhöhung der P(K) Potentialdifferenz im Vergleich zur Normopolarisation Nettokraft im Vergleich zur Normopolarisation Membranpotential bei Erhöhung der P(K) depolarisiert (positiver als normopolarisiert) kleiner größer, auswärts stark hyperpolarisiert normopolarisiert - - schwach hyperpolarisiert polarisiert am Kalium – Gleichgewichtspotential größer kleiner, d.h. keine keine Änderung hyperpolarisiert (negativer also normopolarisiert) deutlich größer etwa gleich, einwärts depolarisiert Informationsübertragung im Nervensystem 4. Aktionspotential 4. Aktionspotential 4.1 Aufbau und Funktion spannungsgesteuerter Ionenkanäle • In der Membran von Nervenzellen gibt es ein zweites Kanalsystem, das seine Permeabilität für kurze Zeit ändern kann. • Weil die Permeabilitätsänderung durch Spannungsänderungen hervorgerufen wird, nennt man diese spannungsgesteuerte Ionenkanäle. • Es gibt drei Sorten von spannungsgesteuerten Ionenkanälen: Kaliumkanäle, Natriumkanäle und Calciumkanäle. 4. Aktionspotential Aufbau spannungsgesteuerter Ionenkanäle am Beispiel eines Kaliumkanals: • Bestehen aus 4 Untereinheiten • Untereinheiten bestehen aus 6 Segmenten (Proteine in - Helix – Struktur) • Untereinheiten sind durch Aminosäureketten untereinander verbunden 4. Aktionspotential Spannungsgesteuerte Ionenkanäle können drei Funktionszustände einnehmen: 1. Die Ionenkanäle können geschlossen sein. 2. Die Ionenkanäle können durch Depolarisation geöffnet sein. Dabei wird das Kanalmolekül umgelagert. Die auftretenden Ladungsverschiebungen sind als sog. Torströme messbar. 3. Währen der Depolarisation können die Kanäle inaktiviert werden. Der inaktivierte Zustand („sekundäre Geschlossenheit“) kann nur durch eine Repolarisation der Membran wieder aufgehoben werden. 4. Aktionspotential 4.2 Ablauf des Aktionspotentials • Wenn die Depolarisation des Membranpotentials einen kritischen Wert erreicht, die sog. Membranschwelle, öffnen sich die spannungsgesteuerten Ionenkanäle. • Zunächst öffnen sich die Natriumkanäle und Natrium strömt in die Zelle ein. Die Membran wird also weiter depolarisiert. Im Sinne einer positiven Rückkopplung werden mehr Natriumkanäle geöffnet und mehr Natrium strömt ein. • Das Membranpotential nähert sich dem Natrium – Gleichgewichtspotential. Das Membranpotential wird positiv und die treibende Kraft für Natrium ist wieder nach außen gerichtet. • Die Natriumkanäle inaktivieren sich selbstständig. • Kurz nach dem Öffnen der Natriumkanäle öffnen sich die Kaliumkanäle, so dass Kalium aus der Zelle ausströmen kann. Der Kaliumausstrom wächst aber wesentlich langsamer, als der Natriumeinstrom, und erreicht sein Maximum erst während der Schließung der Natriumkanäle. • Auch die Kaliumkanäle inaktivieren sich selbstständig wenn sich das Potential wieder dem Kaliumgleichgewichtspotential nähert. • Nach Beendigung des Aktionspotentials kann ein sog. Nachpotential auftreten, das entweder hyperpolarisierend oder depolarisierend ist. 4. Aktionspotential Zeitlicher Verlauf von Ionenein- und -ausstrom Typischer Verlauf eines Aktionspotentials 4. Aktionspotential 4.3 Charakteristika des Aktionspotentials • Die Depolarisation erfolgt innerhalb von weniger als 1ms mit einer maximalen Depolarisationsgeschwindigkeit von 1000V/s. • Die Repolarisation hat bei unterschiedlichen Zelltypen einen unterschiedlichen Zeitverlauf. • Bei Nervenzellen stellt sich das Ruhemembranpotential in 1ms wieder ein. • Bei Muskelzellen erfolgt zunächst auch eine schnelle Repolarisation, die sich aber bei –60 bis –70mV stark verlangsamt. Das Ruhemembranpotential wird erst nach ca. 10ms wieder erreicht. • Beim Herzmuskel verläuft die Repolarisation im positiven Bereich sehr langsam. Erst nach 200 bis 300ms hat sich das Ruhepotential wieder eingestellt 4. Aktionspotential 4.3 Charakteristika des Aktionspotentials • Die Amplitude des Aktionspotentials ist unabhängig von der Höhe der Depolarisation. Wird die Membranschwelle erreicht, wird ein Aktionspotential ausgelöst, andernfalls nicht. Diese Reaktionsweise wird als „Alles – oder – Nichts – Regel“ bezeichnet. • Die Amplitude des Aktionspotentials ist nicht konstant, sondern hängt vom Ausgangsmembranpotential ab. • Die Erregbarkeit der Membran hängt vom extrazellulären Ionenmillieu ab. Bei geringerer Calciumkonzentration als normal, genügen wesentlich geringere Depolarisationen um ein Aktionspotential auszulösen und umgekehrt. • Während eines Aktionspotentials kann auch mit hohen Depolarisationen kein weiteres Aktionspotential ausgelöst werden, da der Natriumeinstrom vom Ausgangspotential abhängt. Erst in der späten Repolarisationsphase sind die Natriumkanäle zunehmend wieder aktivierbar. Die Depolarisation muss aber umso höher sein, je früher sie an das vorangegangene Aktionspotential anschließt. Dieses Phänomen heißt Refraktärität. Aktivierbarkeit der Natriumkanäle in Abhängigkeit vom Ruhemembran-potential Aktivierung der Natriumkanäle in Abhängigkeit vom Ausmaß einer raschen Depolarisation bei unterschiedlichen extrazellulären Calciumkonzentrationen 4. Aktionspotential Die Refraktärität kommt dadurch zustande, das die Membranschwelle kurz nach einem Aktionspotential sehr weit vom Ruhemembranpotential entfernt ist und sich nur langsam auf ihren normalen Wert einstellt. Sie lässt sich in zwei Phasen unterteilen: 1. Während der absoluten Refraktärphase kann kein neues Aktionspotential ausgelöst werden, egal wie hoch die Depolarisation ist. 2. Während der relativen Refraktärphase können zwar Aktionspotentiale ausgelöst werden, jedoch sind dazu höhere Depolarisationsamplituden notwendig, als zur Auslösung des vorangegangenen Aktionspotentials. Die Wiederholungsfrequenz für neuronale Erregungen ist also durch die Refraktärzeit begrenzt. Informationsübertragung im Nervensystem 5. Erregungsleitung 5. Erregungsleitung Erregungsleitung 5. Erregungsleitung Erregungsleitung kontinuierliche Erregungsleitung • kommt hauptsächlich bei wirbellosen Tieren vor 5. Erregungsleitung Erregungsleitung kontinuierliche Erregungsleitung saltatorische Erregungsleitung • kommt hauptsächlich bei wirbellosen Tieren vor • alle Nerven beim Menschen und anderen Säugetieren leiten Informationen saltatorisch weiter 5. Erregungsleitung 5.1 Zwei Arten der Erregungsleitung Die kontinuierliche Erregungsleitung Ist an einer Stelle der Nervenfaser ein Aktionspotential ausgebildet, so liegt an dieser Stelle der positive Pol der Potentialdifferenz im Inneren der Zelle und der negative Pol im Extrazellulärraum. Beim Rest der Zelle ist es umgekehrt. Es bildet sich also zusätzlich zur Potentialdifferenz über der Membran eine Potentialdifferenz entlang der Membran aus. Der dadurch entstehende Kationenstrom depolarisiert die Membran in den Nachbarbereichen. Dadurch wird an diesen Stellen wieder ein Aktionspotential ausgelöst. Das Aktionspotential hat sich also entlang der Membran „bewegt“. Die saltatorische Erregungsleitung Myelinisierte oder markhaltige Nervenfasern werden von aufeinanderfolgenden Myelinscheiden umwickelt. Diese isolieren die Nervenfaser elektrisch vom Extrazellulärraum. Je dicker die Myelinscheide ist, umso stärker ist die Nervenfaser isoliert, und umso geringer ist der Ionenaustausch zwischen Inter- und Extrazellularraum. Die Ionenströme die sich zu beiden Seiten der Membran bei einem Aktionspotential bilden und für die Weiterleitung des Aktionspotentials verantwortlich sind müssen also bis zum nächsten Ranvier‘schen Schnürring fließen um das nächste Aktionspotential auszulösen. Der Weg den das Aktionspotential in einer markhaltigen Nervenfaser zurücklegt ist in der gleichen Zeit viel größer als in der marklosen Nervenfaser. 5. Erregungsleitung Sprunghafte (saltatorische) Erregungsleitung in einer Nervenfaser mit Markscheide 5. Erregungsleitung 5. Erregungsleitung Ausschnitt aus einem peripheren Nerv der Maus (20900fach, Einschaltbild 87200fach). Im linken Bildteil eine rasch leitende Nervenfaser von einer Markscheide (Schwannschen Scheide) umgeben. Im Einschaltbild wird der lamellenartige Aufbau dieser Scheide deutlich. Im rechten Bildteil langsam leitende Nervenfasern (NF) von einer Schwannschen Zelle umgeben. 5. Erregungsleitung Bild einer Myelinscheide 5. Erregungsleitung Bei multipler Sklerose werden vom körpereigenen Immunsystem die Myelinscheiden im ZNS zerstört. Die Ursachen dafür sind noch nicht vollständig geklärt, es wird jedoch ein Virus als Auslöser angenommen. Durch den Myelinscheidenzerfall wird die Erregungsleitung verzögert und zum Teil sogar unterbrochen. Folgen können u.a. Lähmungen, Inkontinenz und Demenz sein. Einen gegenteiligen Effekt kann man mit Sport erreichen. Eine Gruppe von Forschern um Henner Ertel, Professor für Neuropsychologie am G.R.P. Institut für Rationelle Psychologie, hat herausgefunden, dass „durch eine Kombination von aerobem Bewegungstraining und Lernen“ die Anzahl der Neuronen im Gehirn zunimmt, es zu neuen synaptischen Verbindungen kommt und die Myelinisierung der Nervenzellen sich verbessert. Eine Studie mit über 30.000 Probanden bestätigt ohne Ausnahme, dass es durch ein solches Training zu einer „besseren Informationsaufnahme und –verarbeitung sowie zu mehr Kreativität und Intelligenz“ kommt. 5. Erregungsleitung 5.2 Leitungsgeschwindigkeit von Nervenfasern Die Ausbreitungsgeschwindigkeit eines Aktionspotentials entlang einer Nervenfaser hängt von mehreren Faktoren ab. Grob kann man sagen: • je größer der Natrium – Einstrom, also je größer der Strom zur Depolarisation benachbarter Membranabschnitte • je größer der Faserdurchmesser, also je geringer der intrazelluläre Widerstand • je höher der Membranwiderstand desto größer ist die Leitungsgeschwindigkeit. 5. Erregungsleitung 5.2 Leitungsgeschwindigkeit von Nervenfasern Nervenfasern können nach Leitungsgeschwindigkeit und funktioneller Einbindung in verschiedene Gruppen eingeteilt werden. Einteilung der Nervenfasern nach Lloyd und Hunt: Faserdurchmesser Fasergruppe Leitungsgeschwindigkeit (etwa) Funktion 13µm I 80 – 120m/s Ia: afferente Impulse von Muskelspindeln Ib: afferente Impulse von Sehnenorganen 9µm II 60m/s Berührungsimpulse der Haut 3µm III 15m/s afferente Impulse von tiefen Mechanorezeptoren des Muskels 1µm (marklos) IV 1m/s langsame Schmerzfasern 5. Erregungsleitung Einteilung der Nervenfasern nach Erlanger und Gasser: Faserdurchmesser Fasergruppe Leitungsgeschwindigkeit Funktion 3 – 20µm A 80 – 120m/s motorische Impulse, afferente Impulse von Muskelspindeln und Sehnenorganen 60m/s Berührungsimpulse der Haut 40m/s efferente Impulse zu den kontraktilen Abschnitten der intrafusalen Muskelfasern 20m/s Impulse von Mechanorezeptoren, Kalt-, Warm- und Schmerzrezeptoren der Haut (rasche Schmerzfasern) 1 – 3µm B 10m/s präganglionäre vegetative Fasern 1µm (marklos) C 1m/s postganglionäre vegetative Fasern und afferente Fasern des Grenzstrangs, Impulse von Mechano-, Kaltund Warmrezeptoren, langsame Schmerzfasern 5. Erregungsleitung 5.3 Stofftransport in Nervenfasern Durch die Röhrenform eignet sich das Axon einer Nervenzelle auch für den Transport von Molekülen. Die drei wichtigsten Stofftransporte sind: 1. Der schnelle, vom Zellkörper zur Synapse gerichtete Transport erreicht eine Geschwindigkeit von bis zu 40cm pro Tag. Transportiert werden im Zellkörper produzierte Stoffe wie Neurotransmitter. Als Transportmedium dienen Vesikel und Ribosomen, die unter ATP – Verbrauch an Tubuli und Filamenten entlangtransportiert werden. 2. Der langsame Transport vom Zellkörper zur Synapse erreicht Geschwindigkeiten von 0,1 – 0,5cm pro Tag und transportiert Elemente des Zellskeletts und Enzyme. 3. Der Transport von der Synapse zum Zellkörper erreicht bis zu 20cm pro Tag und ist für die Aufrechterhaltung der Eiweißsynthese im Zellkörper verantwortlich, allerdings ist noch nicht geklärt in welcher Weise. Außerdem können Viren intraaxonal durch den Körper transportiert werden, z.B. das Herpes – Simplex – Virus. Informationsübertragung im Nervensystem 6. Erregungsübertragung 6. Erregungsübertragung 6.1 Formen der Erregungsübertragung Synapsen 6. Erregungsübertragung 6.1 Formen der Erregungsübertragung Synapsen elektrische Synapsen 6. Erregungsübertragung 6.1 Formen der Erregungsübertragung Synapsen elektrische Synapsen chemische Synapsen 6. Erregungsübertragung Elektrische Synapse (gap junction): • Prä- und Postsynapse sind über Proteine, sog. Connexine, miteinander verbunden • Connexine bilden einen Tunnel über den Ionen aus dem einen Neuron in das andere gelangen können • Erregungsübertragung läuft prinzipiell ab wie Erregungsleitung entlang der Zellmembran eines einzigen Neurons 6. Erregungsübertragung Chemische Synapse • präsynaptischer Endknopf und postsynaptische Membran sind durch den Synaptischen Spalt voneinander getrennt • Erregungsübertragung geschieht mittels chemischer Botenstoffe, den sog. Neurotransmittern 6. Erregungsübertragung 6.2 Transmitter und Transmitter – Rezeptor – Komplex • Neurotransmitter werden in der präsynaptischen Endigung synthetisiert und normalerweise in Vesikeln gespeichert • Wird die präsynaptische Endigung durch ein ankommendes Aktionspotential depolarisiert steigt die Konzentration von Calciumionen in der Zelle an • Die Transmitter werden in den synaptischen Spalt freigesetzt • Die Transmitter docken nach einem „Schlüssel – Schloss – Prinzip“ an Proteine, sog. Membranrezeptoren, an • Membranrezeptoren sind an Membrankanäle (sog. ligandengesteuerte Kanäle) gekoppelt, die durch die Transmitter – Rezeptor – Bindung aktiviert werden • Nach der Rezeptorbindung werden die Transmitter entweder durch enzymatische Spaltung, oder durch herausdiffundieren aus dem Synapsenbereich, deaktiviert • Die Transmitter bzw. ihre Abbauprodukte werden i.d.R. wieder in die präsynaptische Struktur zurücktransportiert • Die Synapsen sind von Gliazellen umgeben, die die räumliche Ausbreitung der Transmitter verhindern. Außerdem sind in der Membran der Gliazellen teilweise Transportmechanismen ausgebildet, damit die Transmitter zurück zur Präsynapse transportiert werden können. 6. Erregungsübertragung Schematische Darstellung einer Synapse 6. Erregungsübertragung Querschnitt durch eine motorische Endplatte eines Frosches. Präsynaptische Membran und postsynaptische Membran begrenzen den synaptischen Spalt. 6. Erregungsübertragung Motorische Innervierung der Muskulatur. Die Nervenfasern spalten sich auf und bilden am Ende die Endknöpfe der motorischen Endplatten (Vergrößerung 800fach) 6. Erregungsübertragung Aufbau ligandengesteuerter Kanäle am Beispiel einer nikoninergen Acetylcholinsynapse • Rezeptor – Kanal – Molekül besteht aus fünf Untereinheiten • jede Untereinheit besteht aus vier Segmenten, die durch Aminosäureketten verbunden sind 6. Erregungsübertragung Ligandengesteuerte Kanäle können drei Funktionszustände einnehmen: 1. Die Kanäle können geschlossen und durch Transmitter aktivierbar sein, 2. Sie können geöffnet sein, 3. Sie können während der Bindung eines Transmitters wieder geschlossen und nicht aktivierbar, also dem Transmitter gegenüber unempfindlich sein. 6. Erregungsübertragung • Ligandengesteuerte Känäle weisen eine hohe Spezifität für Transmitter sowie durch sie hindurchtretende Ionen auf • Der Kanälöffnung liegen zwei verschiedene Prinzipien zugrunde: 1. Ionotrope Rezeptoren: Der Rezeptor ist Teil des Kanalproteins und die Bindung eines Transmitters an das Rezeptormolekül verursacht eine unmittelbare Öffung, so wie eine Ablösung des Transmitters zur sofortigen Schließung des Kanals führt. 2. Metabotrope Rezeptoren: Durch die Bindung eines Transmittermoleküls an den Rezeptor wird ein guanosintriphosphatbindendes Protein aktiviert. Über sog. second Messenger, das sind intrazelluläre Botenstoffe werden Phosphorisierungsvorgänge stimuliert, wodurch schließlich der Kanal geöffnet wird. 6. Erregungsübertragung 6.3 Postsynaptische Potentiale • Durch die geöffneten Kanäle entstehen Ionenströme, die in der postsynaptischen Struktur eine Polarisationsänderung hervorrufen • Das entstehende postsynaptische Potential lässt sich, je nach Richtung und Zusammensetzung der Ströme, in zwei Typen einteilen: 1. exzitatorische (erregende) postsynaptische Potentiale (EPSP) 2. inhibitorische (hemmende) postsynaptische Potentiale (IPSP) 6. Erregungsübertragung Exzitatorische Synapsen • haben Kanalmoleküle, die im aktivierten Zustand für Natrium- und Kaliumionen durchlässig sind • durch die treibenden Kräfte strömt Natrium schnell in die Zelle ein und Kalium langsam aus der Zelle aus • das Potential wird depolarisiert und nähert sich der Membranschwelle • wird die Membranschwelle überschritten wird ein Aktionspotential ausgelöst Inhibitorische Synapsen • haben Kanalmoleküle, die im aktivierten Zustand für Kalium- und Chlorionen durchlässig sind • durch den Kaliumausstrom bzw. den Chloreinstrom wird die Membran hyperpolarisiert • das Membranpotential entfernt sich von der Membranschwelle und die Auslösung eines Aktionspotentials wird unwahrscheinlicher 6. Erregungsübertragung Ob ein Transmitter ein IPSP oder ein EPSP auslöst, ist durch die Art des Rezeptors bestimmt, aber nicht durch den Transmitter selbst. Man kann allerdings sagen das einige Transmitter vorwiegend exzitatorisch bzw. vorwiegend inhibitorisch wirken: • vorwiegend exzitatorisch: Acetylcholin und Glutaminsäure • vorwiegend inhibitorisch: GABA (Gamma – Aminobuttersäure), Glycin, Serotonin und Dopamin 6. Erregungsübertragung Die synaptischen Kontakte sind über der gesamten Oberfläche der Nervenzelle verteilt. Man unterscheidet • axodendritische Synapsen • axosomatische Synapsen • axoaxonische Synapsen Da im Bereich des Somas mehr Membrankanäle zu finden sind, haben somanahe Synapsen die größte Effizienz im Hinblick auf die Auslösung eines Aktionspotentials. 6. Erregungsübertragung Axoaxonische Synapsen können eine präsynaptische Hemmung hervorrufen. 6. Erregungsübertragung 6.4 Zeitliche und Räumliche Summation von EPSP und IPSP • Wird in einer postsynaptischen Membran ein EPSP ausgelöst, das aber die Membranschwelle nicht erreicht, wird die „Information“ nicht weitergeleitet. • Kommt aber in der präsynaptischen Faser ein zweites Aktionspotial an, bevor das erste EPSP beendet ist, addieren sich die synaptischen Potentiale, so das das gesamte EPSP die Membranschwelle erreichen kann und ein Aktionspotential ausgelöst wird. Die Summation hängt hier vom Zeitintervall zwischen den ankommenden Aktionspotentialen ab. Daher spricht man hier von „zeitlicher Summation“. • Kommen an zwei Synapsen gleichzeitig oder mit nur kurzer Zeitverzögerung zwei Aktionspotentiale an, können sich die ausgelösten EPSPs ebenfalls addieren und ein Aktionspotential auslösen. Dabei spricht man von „räumlicher Summation“. • Es können außerdem postsynaptische Potentiale entgegengesetzter Polarität „verrechnet“ werden. Gleichzeitig ankommende IPSPs und EPSPs können sich also in ihrer Wirkung aufheben. 6. Erregungsübertragung Informationsübertragung im Nervensystem 7. Erregungsausbreitung im Neuronenverband 7. Erregungsausbreitung im Neuronenverband Vorrausgesetzt es entsteht immer ein überschwelliges EPSP, wird in einer Neuronenkette ein Aktionspotential vom Startneuron bis zum Zielneuron weitergeleitet. 7. Erregungsausbreitung im Neuronenverband Häufig sind Neurone nicht in langen Ketten hintereinandergeschaltet, sondern durch Axonkollaterale zu Netzwerken verknüpft. Ist das ausgelöste EPSP groß genug, kann das Aktionspotential von einem Startneuron auf viele Zielneurone übertragen werden. Diesen Vorgang nennt man Divergenz. 7. Erregungsausbreitung im Neuronenverband Ist das ausgelöste EPSP nicht groß genug ein Aktionspotential weiterzuleiten, kann ein Aktionspotential von vielen Startneuronen aber auf ein einziges Zielneuron durch räumliche Summation übertragen werden. Diesen Vorgang nennt man Konvergenz. 7. Erregungsausbreitung im Neuronenverband Wird von einem exzitatorischen Startneuron ein Aktionspotential über eine Axonkollaterale auf ein inhibitorisches Neuron übertragen, und das inhibitorische Neuron sendet das Aktionspotential über das Axon zum Startneuron zurück, wird das Startneuron für eine gewisse Zeit unerregbar. Dadurch wird die Wiederholungsfrequenz des Startneurons begrenzt. Man spricht hier von Rückwärtshemmung. Ist das inhibitorische Neuron über das Axon mit einer parallelen Neuronenkette verbunden, so kann ein durch diese Kette laufendes Aktionspotential nicht weitergeleitet werden. In diesem Fall spricht man von Vorwärtshemmung. 7. Erregungsausbreitung im Neuronenverband Aktionspotentiale können außerdem in kreisförmigen exzitatorischen Netzwerkstrukturen „gespeichert“ werden, vorrausgesetzt die erzeugten EPSP‘s sind groß genung. Solche Neuronale Schaltungen, in denen Aktionspotentiale einzeln, oder zu Mustern zusammengefasst, gespeichert werden können, bilden offensichtlich die strukturelle Grundlage des Kurzzeitgedächnisses. Informationsübertragung im Nervensystem Quellenangaben: „Physiologie“, Deetjen, Speckmann, Henschler, Elsevier (Urban & Fischer), 4. Auflage „Biophysik“, Hoppe, Lohmann, Markl, Ziegler, Springer Verlag, 2. Auflage „Linder Biologie“, Bayrhuber, Kull, Metzler, 20. Auflage „PM Magazin“ Ausgabe 1/2005 www.wikipedia.de