ppt - ChidS
Werbung

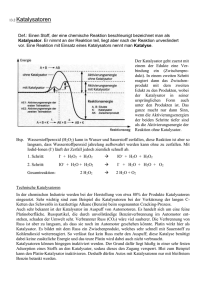
Eigenschaften der Übergangsmetalle Gliederung 1. Einführung 2. Eigenschaften der Übergangsmetalle - 2.1 Oxidationsstufen - 2.2 Komplexe - 2.3 Farbige Salze - 2.4 Katalysatoren 3. Schulische Relevanz 1.Einführung Definition: Elemente, die in ihren häufigsten Oxidationsstufen teilweise gefüllte d- bzw. f- Orbitale besitzen. Innere Übergangselemente Äußere Übergangselemente 1.Einführung Unterscheidung zwischen Übergangsmetallen und Hauptgruppen- Elementen: • Hauptgruppenelemente: s- und p- Orbitale werden mit Elektronen besetzt • Übergangsmetalle: d- bzw. f- Orbitale werden mit Elektronen besetzt innere Orbital bestimmen Chemie dieser Elemente 1.Einführung Elektronenkonfiguration der Übergangsmetalle Sc Ti V Cr Mn 4s23d1 4s23d2 4s23d3 4s13d5 4s23d5 Fe Co Ni Cu Zn 4s23d6 4s23d7 4s23d8 4s13d10 4s23d10 1.Einführung Physikalische Eigenschaften • Hohe Wärme- und Stromleitfähigkeit • Hohe Duktilität • Zum Teil extrem hohe Schmelz- und Siedepunkte (W: Smp. 3380°C, Sdp. 5500°C) • Hohe Dichten • Zum Teil hohe Beständigkeit der Metalle gegen Sauerstoff, Säuren und Basen 2.1 Oxidationsstufen 2.1 Oxidationsstufenstufen Die Oxidationsstufen der Übergangsmetalle • Hauptgruppenmetalle bilden nur in einer Oxidationsstufe stabile Ionen Beispiel: Na+, Mg2+, Al3+ Oktettregel oder in sich um zwei Einheiten unterscheidender Oxidationsstufen stabile Ionen Beispiel: Pb2+, Pb4+ Inert-Pair-Effekt • Übergangsmetalle bilden in mehreren verschiedenen Oxidationsstufen stabile Ionen Versuch 1: Oxidationsstufen des Mangans 2.1 Oxidationsstufen Versuch 1: Oxidationsstufen des Mangans +7 -1 2 MnO4(aq) + H2O2(aq) violett +6 -1 grün -1 2 MnO43(aq) + H2O2(aq) blau 0 2 MnO42-(aq) + O2(g) ↑ + 2 H+(aq) grün 2 MnO42(aq) + H2O2(aq) +5 +6 +5 0 2 MnO43-(aq) + O2(g)↑ + 2 H+(aq) blau +4 0 2 MnO44-(aq) + O2(g)↑ + 2 H+(aq) braun- gelb 2.1 Oxidationsstufen Die Ligandenfeldtheorie • Mangan-Ionen besitzen im isolierten Zustand 5 entartete d-Orbitale z z y y x dz² z y x dx²-y² x dxy • für die verschiedenen d- Orbitale ist die Größe der Abstoßung durch das tetraedrische Ligandenfeld unterschiedlich groß Entartung wird aufgehoben 2.1 Oxidationsstufen Die Ligandenfeldtheorie Energie t2g-Orbitale dxy dxz dyz 2 5 ΔT 5 ΔT Entartete d-Orbitale 3 eg-Orbitale dz² dx²-y² T 2.1 Oxidationsstufen Verteilung der d- Elektronen d0 im d1 im +7 MnO4 +6 - d2 im +5 MnO43- MnO42- d3 im +4 MnO44- 2.1 Oxidationsstufen Farbigkeit der Manganat- Ionen Charge-Transfer-Übergänge bei MnO4• durch Absorption eines Lichtquants wird Elektronenladung innerhalb des Moleküls übertragen O O Mn O O e- - 2.1 Oxidationsstufen Farbigkeit der Manganat- Ionen d → d-Übergänge d1 im ΔE=h∙ν MnO 24 d2 im ΔE=h∙ν MnO 34 d3 im ΔE=h∙ν MnO44- • durch Lichtabsorption wird ein Elektron aus dem e- Niveau in das t2- Niveau angeregt Demo 1: Unedel vs. Edel 2.1 Oxidationsstufen Demo 1: Edel vs. Unedel 2 Zn( s) 2H(aq) Zn ( aq ) H2( g) Cu(s) H (aq) / 2.1 Oxidationsstufen Spannungsreihe • durch die Spannungsreihe lässt sich voraussagen, welche Redoxreaktionen möglich sind • Elemente mit einem niedrigeren Reduktionspotential (E°) geben Elektronen an die Elemente mit einem höheren Standardpotential ab E° in V Zn Zn2+ + 2e- - 0,76 H2 2H+ + 2e- 0,00 Cu Cu2+ + 2e- + 0,34 2.1 Oxidationsstufen Standartwasserstoffelektrode H 2 + 2 H 2O 2 H3O+ + 2 e- 2.2 Komplexe 2.2 Komplexe Komplexe • die räumliche Struktur wird bestimmt von dem Zentralteilchen; die Koordinationszahl spielt hierbei eine wichtige Rolle • an das Zentralteilchen binden die Liganden; hierbei spielt die Zähnigkeit eine wichtige Rolle Beispiel: Struktur von [Cu(NH3)4(H2O)2]: Cu2+ NH3 H2O 2.2 Komplexe Koordinationszahl Beispiele Koordinationsgeometrie • KZ 4 → tetraedrisch → quadratisch planar • KZ 5 → trigonale bipyramidal • KZ 6 → oktaedrisch [CoCl4]2- [PtCl4]2- [Ni(CN)5]3- [Fe(H2O)6]3- 2.2 Komplexe Liganden Beispiele • 1- zähnig: Halogenide • 2- zähnig: Ethyldiamin (en) • 6- zähnig: Ethylendiamintetraacetat (EDTA) Liganden mit einer höheren Zähnigkeit bilden stabilere Komplexe Versuch 2: Gleichgewicht in Kupferkomplexen 2.2 Komplexe Versuch 2: Gleichgewicht in Kupferkomplexen 2 CuCl2 H2 O2 (aq) 2H2 O(l) Cu H O 2Cl ( aq ) ( aq ) 2 4 blaugrün himmelblau 2 CuCl2 H2O2 (aq) 2Cl(aq) CuCl ( aq ) 2H2O( l ) 4 blaugrün hellgrün 2 CuCl2 H2O (aq ) 4NH3(aq ) Cu NH 2 H O 2 Cl ( aq ) ( aq ) 3 2 ( l ) 4 2 blaugrün dunkelblau 2.2 Komplexe Ligandenaustausch 2 CuCl2 H2 O2 (aq) 2H2 O(l) Cu H O 2Cl ( aq ) ( aq ) 2 4 2 CuCl2 H2O2 (aq) 2Cl(aq) CuCl ( aq ) 2H2O( l ) 4 Ligandenaustausch durch das Prinzip des kleinsten Zwangs 2 CuCl2 H2O( aq ) 4NH3( aq ) Cu NH 2 H O 2 Cl ( aq ) ( aq ) 3 2 ( l ) 4 NH3 stärkerer Ligand als ClSpektrochemische Reihe I- < Cl- < F- < OH- < H2O < NH3 < en < CN- ≈ CO schwaches Feld mittleres Feld starkes Feld Versuch 3: Magnetismus 2.2 Komplexe Magnetismus • magnetische Momente werden durch den Spin ungepaarter Elektronen erzeugt mag ~ I · F μmag = magnetisches Moment I = Stromstärke F = Fläche Paramagnetismus • alle Stoffe, die abgeschlossene Schalen besitzen, weisen ein diamagnetisches Moment auf diamagnetisch paramagnetisch 2.2 Komplexe Die Valence-Bond-Theorie • Grundlage ist die Anwendung des Hybridisierungsmodells auf Komplexe • Bindung von Zentralteilchen zu Ligand ist kovalent z y Mischung x tetraedrisch 2.2 Komplexe Die 3 wichtigsten Hybridisierungstypen: quadratisch- planar dsp2 oktaedrisch d2sp3 tetraedrisch sp3 2.2 Komplexe Magnetismus 3d Fe2+ im [Fe(H2O)6]2+ 4s 4p 4d Hybridisierung Besetzung der Hybridorbitale durch Ligandenelektronen 2.2 Komplexe Magnetismus 3d Fe2+ im [Fe(CN)6]4- 4s 4p Spinpaarung und Hybridisierung Besetzung der Hybridorbitale durch Ligandenelektronen Vergleich: Versuch 4: Jahn- Teller- Verzerrung 2.2 Komplexe Versuch 4: Jahn- Teller- Verzerrung 2 Ti (s) 6 H3O (aq) 12 H2O 6Cl(aq) 2 Ti H2O6 3 (aq) 3 H2(g) 6 Cl(aq) 6 H2O violett Energie z dx2-y2 eg- Orbitale dz2 dx2- 3 t2g- Orbitale 2/ 2 y /5ΔO dz2 x y Entartete d- Orbitale 5ΔO dxy dxy dxz dyz dyz dxz Versuch 5: 2+ Ni - Nachweis 2.2 Komplexe Versuch 5: Ni2+- Nachweis OH H 3C C N gepuffert 2+ Ni + 2 ([Ni(H2O)6])2+ NH3 C H 3C N NiL2(s) + H2O + 2 H+(aq) OH _ OH O H 3C C C H 3C N 2+ N C lackrot ↓ Ni N O_ HO CH3 N C CH3 d8 dsp2 2.2 Komplexe Quadratisch planare Komplexe Energie dx2-y2 Entartete d-Orbitale dxy dyz dxz dz2 2.2 Komplexe Mit welcher Theorie lässt sich nun das Aussehen von Komplexe besser beschreiben Valence-BondTheorie LigandenfeldTheorie Bindung Kovalente Bindung Elektrostatische WW Struktur Automatisch Beruht auf Annahme Magnetismus Richtig erklärt, aber nicht vorhersagbar ? Ja Farbigkeit Ja 2.3 Farbige Salze 2.3 Farbige Salze Farbige Verbindungen • die meisten Verbindungen der Hauptgruppenmetalle sind farblos bzw. weiß • Verbindungen der Übergangselemente sind dagegen oft intensiv farbig Grund: 1. d d-Übergänge 2. Charge-Transfer Demo 2: Chrom- Salze 2.3 Farbige Salze Demo 2: Chrom- Salze +6 2CrO 4 +6 Cr2 O 7 2 (aq) 2 (aq) 2H +6 (aq) Cr2O7 4H2 O 2(aq) 2H 2 (aq) H2O +6 (aq) 2CrO(O 2 )2(aq) 5H2 O 0 0 0 Cr 0 0 2.4 Katalysatoren 2.4 Katalysatoren Katalysatoren • • • • griech. katalysis = Auflösung beeinflusst die Geschwindigkeit chemischer Reaktionen ohne dabei verbraucht zu werden Veränderung der Aktivierungsenergie - positive Katalysatoren setzen sie herab - negative setzen diese herauf ändern die Kinetik aber nicht die Thermodynamik aber verändern nicht das Gleichgewicht einer Reaktion 2.4 Katalysatoren Geschichte des Katalysators • schon in der Antike genutzt • erst Jöns Jakob Berzelius erkannte 1835 die Kraft der Katalysatoren und gab ihnen den Namen • Wilhelm Ostwald erforschte den Mechanismus und bekam Anfang das 20. Jahrhunderts den Nobelpreis für Chemie 2.4 Katalysatoren Definition eines Katalysators noch W. Ostwald „Ein Katalysator ist ein Stoff, der die Geschwindigkeit einer chemischen Reaktion erhöht, ohne selbst dabei verbracht zu werden und ohne die endgültige Lage des thermodynamischen Gleichgewichts dieser Reaktion zu verändern.“ 2.4 Katalysatoren Bedeutung von Katalysatoren Lebewesen: • fast alle lebensnotwendigen Prozesse laufen katalysiert ab Autoabgaskatalysator: • unvermeidbare, giftige Gase werden in weniger gefährliche umgesetzt 2.4 Katalysatoren Wichtige katalytische Verfahren in der Industrie Verfahren Produkt Katalysator Bedingung AmmoniakSynthese NH3 α- Eisen/Al2O3 T = 450-500°C p = 25-40 MPa MethanolSynthese CH3OH CuO/Cr2O3, ZnO/Cr2O3 oder CuO/ZnO T = 210-280°C p = 6 MPa Schwefelsäureherstellung H2SO4 V2O5 T = 400-500°C Salpetersäureherstellung HNO3 Platin/Rhodium T = 800°C Versuch 6: Beschleunigung des Zerfalls von H2O2 durch MnO2 2.4 Katalysatoren Versuch 6: Zerfall von Wasserstoffperoxid durch Mangan (IV)- oxid +4 +6 MnO 2( s ) H2 O 2(l) " MnO 3( s ) "H2 O(l) +6 +4 " MnO 3( s ) "H2 O 2(l) MnO 2( s ) H2 O(l) O 2( g) Schulische Relevanz • Jahrgangsstufe 11: Redoxreaktionen - Oxidationsstufen - Standartwasserstoffelektrode • Jahrgangsstufe 13.1 Prinzip vom Zwang - Ligandenaustausch Geschwindigkeit chem. Reaktionen - Katalysator • Jahrgangsstufe 13.2 Wahlthema „Komplexchemie“ - Kupferkomplexe - Jahn-Teller-Verzerrung - Ni-Nachweis Vielen Dank für Ihre Aufmerksamkeit