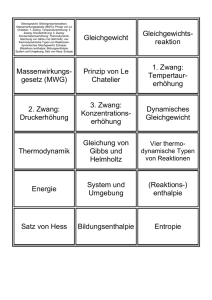
Die Natur - Ein System der Gleichgewichte
Werbung

Die Natur Ein System der Gleichgewichte Experimentalvortrag (OC) Tobias Rocksloh SoSe 2011 1 „Wahre Ruhe ist nicht Mangel an Bewegung. Sie ist Gleichgewicht der Bewegung.“ Ernst Freiherr von Feuchtersleben, 1840 2 Vortragsziele Das Aufzeigen von Gleichgewichten als eine zentrale Eigenschaft der belebten und unbelebten Natur Darstellung der Schul- und Lehrplanrelevanz des Themas 3 Ablauf 1. Einführung 2. Phasengleichgewichte 3. Lösungsgleichgewichte 4. Das chemische Gleichgewicht 5. Steuerung der Gleichgewichte 6. Die Lehrplanrelevanz des Themas 4 1. Einführung Statisches Gleichgewicht: Ein System im Ruhezustand Dynamisches Gleichgewicht: Zwei gegenläufige Prozesse gleichen sich aus 5 Ablauf 1. Einführung 2. Phasengleichgewichte 3. Lösungsgleichgewichte 4. Das chemische Gleichgewicht 5. Steuerung der Gleichgewichte 6. Die Lehrplanrelevanz des Themas 6 2. Phasengleichgewichte Der Aggregatzustand 7 2. Phasengleichgewichte Der Phasenbegriff Phase: Räumlicher Bereich, den eine Substanz ohne erkennbare Grenzflächen in seinem Inneren einnimmt. 8 2. Phasengleichgewichte Ein-Komponenten-System: Wasser/Wasserdampf 0.023 bar 20° C Beobachtung: Der freie Raum über der Flüssigkeit reichert sich bis zu einer bestimmten Konzentration mit dem Dampf der Flüssigkeit an. 9 2. Phasengleichgewichte Maxwell-Boltzmann-Verteilung Maxwell-Boltzmann-Verteilung: Die kinetische Energie und damit die Geschwindigkeit der Flüssigkeitsteilchen schwanken um einen Mittelwert. 10 2. Phasengleichgewichte Maxwell-Boltzmann-Verteilung Maxwell-Boltzmann-Verteilung: Die kinetische Energie und damit die Geschwindigkeit der Flüssigkeitsteilchen schwanken um einen Mittelwert. 11 2. Phasengleichgewichte Ein-Komponenten-System: Wasser/Wasserdampf 0.023 bar 1.013 bar 85.88 bar 20° C 100° C 300° C Dynamisches Gleichgewicht: Anzahl der Teilchen, die in Gasphase übergehen ≙ Anzahl der Teilchen, die flüssige Phase verlassen. 12 2. Phasengleichgewichte Dampfdruck 13 2. Phasengleichgewichte Zustandsdiagramm des Wassers 0.023 bar 20°C 14 2. Phasengleichgewichte Demonstration 1: Dampfdruck Demonstration 1 15 2. Phasengleichgewichte Demonstration 1: Dampfdruck 16 Ablauf 1. Einführung 2. Phasengleichgewichte 3. Lösungsgleichgewichte 4. Das chemische Gleichgewicht 5. Steuerung der Gleichgewichte 6. Die Lehrplanrelevanz des Themas 17 3. Lösungsgleichgewichte Definition: Lösung Lösung: Eine Mischung von Verbindungen, die eine einheitliche Zusammensetzung (eine Phase) hat. 18 3. Lösungsgleichgewichte Der Lösungsprozess Solvatation: Umhüllung von gelösten Teilchen durch Lösungsmittelmoleküle aufgrund von anziehenden Kräften (Hydratation: Solvatation in Wasser). 19 3. Lösungsgleichgewichte Definition: Löslichkeit Die Löslichkeit eines Stoffes ist u.a. abhängig von: 1. Art und Stärke der Anziehungskräfte zwischen: a) den Lösungsmittelteilchen b) den Lösungsmittelteilchen und den gelösten Teilchen c) den gelösten Teilchen 2. Verhältnis von Lösungsmittel und gelösten Teilchen (≙ Konzentration) 3. Temperatur Löslichkeit: Die Eigenschaft eines Stoffes, sich unter homogener Verteilung der Teilchen dieses Stoffes im Lösungsmittel zu vermischen. 20 3. Lösungsgleichgewichte Einfluss der Molekülstruktur auf die Löslichkeit Polar Unpolar Polarität: Getrennte Ladungsschwerpunkte aufgrund einer ungleichen Verteilung der Elektronendichte im Molekül. 21 3. Lösungsgleichgewichte Einfluss der Molekülstruktur auf die Löslichkeit Prinzip: Similia similibus solvuntur (Lat.: Ähnliches wird von Ähnlichem gelöst.). 22 3. Lösungsgleichgewichte Definition: Lösungsgleichgewicht Phase β Phase α Lösungsgleichgewicht: Gleichgewicht, das sich bei der Verteilung eines Stoffes zwischen zwei Phasen einstellt. 23 3. Lösungsgleichgewichte Kombinationen von Lösungsgleichgewichten Kombinationen: a) Verteilung des Stoffes zwischen zwei nicht mischbaren Flüssigkeiten b) Verteilung des Stoffes zwischen einer Gasphase und der Lösung c) Verteilung des Stoffes zwischen einer festen Phase und der Lösung 24 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Versuch 1 25 26 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Zeit nach Zugabe von Rhodamin: 0 h 27 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Zeit nach Zugabe von Rhodamin: 24 h 28 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Zeit nach Zugabe von Rhodamin: 48 h 29 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Zeit nach Zugabe von Rhodamin: 96 h 30 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz 31 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz ṽButanol → Wasser = k1 • cButanol (Rhodamin b) [1] ṽWasser → Butanol = k2 • cWasser (Rhodamin b) [2] Im Gleichgewicht: ṽButanol → Wasser = ṽWasser → Butanol [3] k1 • cButanol (Rhodamin b) = k2 • cWasser (Rhodamin b) [4] Verteilungskoeffizient 32 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Löslichkeitsgradient Rhodamin b in Butanol Rhodamin b in Wasser Rhodamin b in Butanol Konzentrationsgradient Prozess: Kronzentrationsgradient vs. Löslichkeitsgradient 33 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Zugabe Farbstoff 34 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Konzentrationsgradient überwiegt Löslichkeitsgradient. 35 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Konzentrationsgradient überwiegt Löslichkeitsgradient. 36 3. Verteilungsgleichgewichte Versuch 1: Nernstsches Verteilungsgesetz Im Gleichgewicht: Löslichkeitsgradient überwiegt Konzentrationsgradient. 37 3. Lösungsgleichgewichte Kombinationen von Lösungsgleichgewichten Kombinationen: a) Verteilung des Stoffes zwischen zwei nicht mischbaren Flüssigkeiten b) Verteilung des Stoffes zwischen einer Gasphase und der Lösung c) Verteilung des Stoffes zwischen einer festen Phase und der Lösung 38 3. Lösungsgleichgewichte Henry-Dalton-Gesetz Gas A in Lösung Gas A im Gasgemisch über der Lösung Prinzip: Die Konzentration eines Gases in einer Lösung ist proportional zu dem Dampfdruck des Gases über der Lösung. 39 3. Lösungsgleichgewichte Kombinationen von Lösungsgleichgewichten Kombinationen: a) Verteilung des Stoffes zwischen zwei nicht mischbaren Flüssigkeiten b) Verteilung des Stoffes zwischen einer Gasphase und der Lösung c) Verteilung des Stoffes zwischen einer festen Phase und der Lösung 40 3. Verteilungsgleichgewichte Demonstration 2: Chromatographie Demonstration 2 41 3. Verteilungsgleichgewichte Demonstration 2: Chromatographie Prinzip: Freisetzung der Blattfarbstoff durch mechanische Zerstörung der Zellwand und Zellmembranen. 42 3. Verteilungsgleichgewichte Demonstration 2: Chromatographie H3C CH3 CH3 Carotin CH3 CH3 CH3 H H3C CH3 → α-Carotin H3C O O CH3 CH3 CH3 N N H3C CH3 CH3 2+ Mg H3C N CO 2 N CH3 CH3 H2C CH3 H3C O O CH3 Chlorophyll a N HOC Chlorophyll b CH3 CH3 N CH3 2+ Mg N H2C CH3 N CO 2 CH3 CH3 43 3. Verteilungsgleichgewichte Demonstration 2: Chromatographie Unpolar Unpolares Lösungsmittel S chwach pol ar P ol ar Polare, stationäre Phase 44 3. Verteilungsgleichgewichte Demonstration 2: Chromatographie Chlorophyll a/b an stationärer Phase (Kreide) Chlorophyll a/b an mobiler Phase (Ethanol) Carotin Carotin an stationärer Phase (Kreide) an mobiler Phase (Ethanol) Prinzip: Trennung der Stoffe aufgrund unterschiedlicher Lösungsgleichgewichte zwischen stationärer Phase und mobiler Phase. 45 Ablauf 1. Einführung 2. Phasengleichgewichte 3. Lösungsgleichgewichte 4. Das chemische Gleichgewicht 5. Steuerung der Gleichgewichte 6. Die Lehrplanrelevanz des Themas 46 4. Das chemische Gleichgewicht Chemische Reaktionen Chemische Reaktion: Vorgang, bei dem eine oder mehrere Verbindungen in andere umgewandelt werden. 47 4. Das chemische Gleichgewicht Versuch 2: Iod-Stärke Reaktion Versuch 2 48 4. Das chemische Gleichgewicht Versuch 2: Iod-Stärke Reaktion Prinzip: Umkehrbare Einlagerung der Polyiodidketten in das Stärkepolymer. 49 4. Das chemische Gleichgewicht Reversible Reaktionen Das chemische Gleichgewicht: Zwei entgegengesetzte Reaktionen (Hin- bzw. Rückreaktion) laufen gleichschnell ab. 50 4. Das chemische Gleichgewicht Reversible Reaktionen Das chemische Gleichgewicht: Zwei entgegengesetzte Reaktionen laufen gleichschnell ab. 51 4. Das chemische Gleichgewicht Reversible Reaktionen Das chemische Gleichgewicht: Zwei entgegengesetzte Reaktionen laufen gleichschnell ab. 52 4. Das chemische Gleichgewicht Das Massenwirkungsgesetz αA + εE xX + zZ Das chemische Gleichgewicht: Zwei entgegengesetzte Reaktionen laufen gleichschnell ab. 53 Ablauf 1. Einführung 2. Phasengleichgewichte 3. Lösungsgleichgewichte 4. Das chemische Gleichgewicht 5. Steuerung der Gleichgewichte 6. Die Lehrplanrelevanz des Themas 54 5. Steuerung der Gleichgewichte Das Prinzip von Le Chatelier Prinzip des kleinsten Zwanges: „Übt man auf ein System, das im Gleichgewicht ist, durch Druck,- Temperatur-, oder Konzentrationsänderungen einen Zwang aus, so verschiebt sich das Gleichgewicht. Es Henry Louis Le Chatelier (1850 – 1936) stellt sich ein neues Gleichgewicht ein, bei dem der Zwang vermindert ist“ 55 5. Steuerung der Gleichgewichte Parameter zur Steuerung des Gleichgewichts Gleichgewicht Paramter Phasengleichgewicht Druck, Temperatur Lösungsgleichgewicht Druck, Temperatur, Konzentration Chemisches Gleichgewicht Druck, Temperatur, Konzentration Beispiel 56 5. Steuerung der Gleichgewichte Versuch 3: Steuerung von Lösungsgleichgewichten Versuch 3 57 5. Steuerung der Gleichgewichte Versuch 3: Steuerung von Lösungsgleichgewichten CO 2 (g) CO2 (aq) Prinzip: Die Konzentration eines Gases in einer Lösung ist proportional zu dem Dampfdruck des Gases über der Lösung. 58 5. Steuerung der Gleichgewichte Versuch 4: Steuerung des chemischen Gleichgewichts Versuch 4 59 5. Steuerung der Gleichgewichte Versuch 4: Steuerung des chemischen Gleichgewichts OH OH + O 2N O 2N NO 2 NO 2 e-Akzeptor e-Donor NO 2 NO 2 Anthracen Pikrinsäure Anthracenpikrat Prinzip: Ein Überschuss an Anthracen bewirkt ein Ausweichen des Systems in Richtung des kleineren Zwanges, die Seite des Produkts. 60 5. Steuerung der Gleichgewichte Versuch 5: Katalyse Versuch 5 61 5. Steuerung der Gleichgewichte Versuch 5: Katalyse H O H2N O H O H2N NH2 O - O + NH2 H2N + NH 4 NH3 alkalisch spontan CO 2 H2O + H H NH 3(aq) OH + (aq) + OH + NH3 (aq) Mechanismus: Nucleophiler Angriff des Wassers am elektrophilen Carbonylkohlenstoff und anschließender Zerfall der tetraedrischen Zwischenstufe. 62 5. Steuerung der Gleichgewichte Versuch 5: Katalyse Prinzip: Der Harnstoff-Urease-Komplex besitzt eine geringere potentielle Energie als Harnstoff. Die Aktivierungsenergie sinkt, die Reaktion verläuft schneller. 63 5. Steuerung der Gleichgewichte Wirkung von Katalysatoren H O H2N O H O H2N NH2 OH + NH3 Urease → Erhöhen die Geschwindigkeit der Reaktion, ohne selbst verbraucht zu werden. → Katalysieren Hin- und Rückreaktion, d.h. es wird die Einstellung des Gleichgewichts beschleunigt, jedoch nicht dessen Lage. 64 Ablauf 1. Einführung 2. Phasengleichgewichte 3. Lösungsgleichgewichte 4. Das chemische Gleichgewicht 5. Steuerung der Gleichgewichte 6. Die Lehrplanrelevanz des Themas 65 4. Die Lehrplanrelevanz des Themas Versuch: Lehrplanrelevanz Verteilung von Rhodamin zwischen Butanol 9 G1: Wassermolekül als Dipol und Wasser Q4 LK/GK: Angewandte Chemie: Farbstoffe Iod-Stärke-Reaktion Q3 GK: Das chemische Gleichgewicht Q3 LK: Antrieb und Steuerung chemischer Reaktionen Fächerübergreifender Unterricht mit der Biologie Kohlensäure im Mineralwasser: Q3 GK: Das chemische Gleichgewicht Das Prinzip von Le Chatelier Q3 LK: Antrieb und Steuerung chemischer Reaktionen Darstellung von Anthracenpikrat Q3 GK: Das chemische Gleichgewicht Q3 LK: Antrieb und Steuerung chemischer Reaktionen Q4 LK/GK: Angewandte Chemie: Farbstoffe 66 4. Die Lehrplanrelevanz des Themas Versuch Lehrplanrelevanz Katalyse: Zersetzung von Harnstoff durch Q3 GK: Das chemische Gleichgewicht Urease Q3 LK: Antrieb und Steuerung chemischer Reaktionen Fächerübergreifender Unterricht mit der Biologie Demonstration Lehrplanrelevanz Dampfmaschine 7 G1: Stoffe unterscheiden und isolieren: Der Aggregatzustand Fächerübergreifender Unterricht mit der Physik Säulenchromatographie: Q4 LK/GK: Angewandte Chemie: Farbstoffe Auftrennung der Blattfarbstoffe Fächerübergreifender Unterricht mit der Biologie 67 Vielen Dank für die Aufmerksamkeit ! 68 Literatur- und Quellenverzeichnis Hessisches Kultusministerium. Lehrplan Chemie für die Jahrgangsstufen G7 bis G12 http://www.kultusministerium.hessen.de/irj/HKM_Internet?uid=3b43019a8cc6-1811-f3ef-ef91921321b2 (Zugriff 10.11.2011) Hollemann, A. F., Wiberg, E., Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie. 102. Auflage. Berlin, New York: de Gruyter. Jander, Blasius (2006). Lehrbuch der analytischen und präparativen anorganischen Chemie. 16. Auflage. Stuttgart: S. Hirzel Verlag. 69 Literatur- und Quellenverzeichnis Mortimer, C. E. (2001). Chemie – Das Basiswissen der Chemie. 7. Auflage. Stuttgart, New York: Georg Thieme Verlag. Unfallkasse Hessen, Hessisches Kultusministerium. Hessisches Gefahrstoffinformationssystem Schule - HessGISS. Version 11. 2006/2007. http://www.mineralienatlas.de/VIEW.php?param=1113766097.max (8.10.2011) http://de.wikipedia.org/w/index.php?title=Datei:Waldhaus_Gasterntal_Plan5.JPG&filetime stamp=20100828092422 (8.10.2011) 70 Literatur- und Quellenverzeichnis http://www.mineralienatlas.de/VIEW.php?param=1113766097.max (8.10.2011) http://de.wikipedia.org/w/index.php?title=Datei:Waldhaus_Gasterntal_Plan5.JPG&filetime stamp=20100828092422 (8.10.2011) http://www.axel-schunk.de/experiment/edm0909.html (11.11.2011) http://www.chemie-master.de/FrameHandler.php?loc=http://www.chemiemaster.de/lex/begriffe/h04.html (29.9.2011) http://www.dampfspeck.de/attachments/Image/Skizze.jpg (9.9.2011) http://www.chemgapedia.de/vsengine/media/vsc/de/ch/4/cm/kinetik/bilder/profil2.gif (1.9.20111) http://www.itusozluk.com/gorseller/le+chatelier/271065 (7.9.2011) 71 Literatur- und Quellenverzeichnis http://www.mineralienatlas.de/VIEW.php?param=1113766097.max (8.10.2011) http://www.cornelsen.de/fm/649/ideal_gas.gif (25.11.2011) http://www.hamm-chemie.de/images/k10/dipol.jpg (8.11.2011) 72

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)