ppt - Joerg Enderlein
Werbung

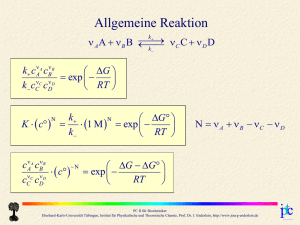
Paradigmenwechsel: Von Molekülen zu Systemen Energien sind die möglichen Energien eines Moleküls Energien sind die möglichen Energien eines Gesamtsystems Jede Kugel symbolisiert ein Moleküls Jede Kugel symbolisiert einen Systemzustand PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Paradigmenwechsel: Von Molekülen zu Systemen System kann Energie mit Umgebung austauschen! N ist jetzt Gesamtzahl von Snapshots von Systemzuständen Nj gibt an, wie oft das System bei N Snapshots im jten Zustand gefunden wird Energien sind die möglichen Energien eines Gesamtsystems Jede Kugel symbolisiert einen Systemzustand PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Paradigmenwechsel: Von Molekülen zu Systemen Ausgangspunkt war: maximiere N ln N N j ln N j j Nj Nj ln N j ln N N j ln N j N N j j N j Äquivalent: maximiere W p j ln p j j 1. Randbedingung: N j N N j j j 1 j j 2. Randbedingung: p Ej E p E j j U j PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Paradigmenwechsel: Von Molekülen zu Systemen maximiere W p j ln p j j 1. Randbedingung: N j N N j j j 1 j j 2. Randbedingung: p Ej E p E j j U j Lösung wiederum: Gibbs-Boltzmann-Verteilung! Ej 1 1 p j exp E j exp Z Z k T B PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Energie Visualisierung der Gibbs-Boltzmann-Verteilung W p j ln p j j p 1 j j U p E j j U j Ej 1 1 p j exp E j exp Z Z k T B PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 0. Hauptsatz der Thermodynamik Zwei Systeme im thermischen Gleichgewicht haben dieselbe Temperatur. PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Änderung der inneren Energie U pj Ej j dU dp j E j p j dE j j 1 p j exp E j Z dU 1 ln Z ln p dp j j j j 1 E j ln p j ln Z dp p dE j j j j j d p j 0 dp j j j PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Änderung der inneren Energie 1 ln Z dU ln p j dp j j dp p dE j j j j j d p j 0 dp j j j 1 dU d p j ln p j p j dE j j j d p j ln p j dp j ln p j dp j j j j PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Änderung der inneren Energie 1 dU d p j ln p j p j dE j j j Änderung der Besetzungswahrscheinlichkeiten Definition: Änderung der Zustandsenergien S k B p j ln p j j Entropie PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de S k B p j ln p j j Entropie ist Maß für die Verteilung über Energien Energie Entropie U Ej U S kB p j ln p j kB p j ln Z kB ln Z kBT T j j Entropie ist additiv, also extensive Zustandsgröße PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Änderung der inneren Energie dU TdS p dE j j j Änderung der Besetzungswahrscheinlichkeiten p dE j j Änderung der Zustandsenergien pdV sonstige nichtthermische Energiezufuhr j TdS dQ thermische Energiezufuhr PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 1. Hauptsatz der Thermodynamik Energieerhaltung: Unter reversiblen Bedingungen: dU dQ pdV dU TdS pdV Wärme → Entropieänderung: dQ TdS Statistische Entropiedefinition: S k B p j ln p j j PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 2. Hauptsatz der Thermodynamik Bei Herleitung Gibbs-Boltzmann: maximiere W p j ln p j j Statistische Entropiedefinition: S k B p j ln p j j Im thermodynamischen Gleichgewicht: S = max Bei beliebigen Änderungen: dS ≥ 0 Bei irreversiblen Prozessen: dS > đQ/T PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 3. Hauptsatz der Thermodynamik Am absoluten Nullpunkt der Temperatur sind alle Freiheitsgrade eines Systems eingefroren: System befindet sich in einem einzigen Zustand Statistische Entropiedefinition: S k B p j ln p j j p1 1 und p j 1 0 Am absoluten Nullpunkt T = 0 ist S = 0 (für ideale Kristalle) PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de