*************E
Werbung

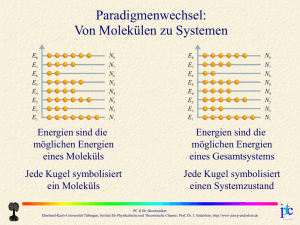
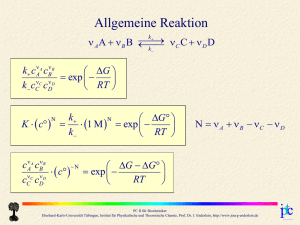
Grundgleichungen der Wellenfunktion 2 2 2 2 2 U 2 2 2 U i t 2m x y z 2m Laplace-Operator Schrödingergleichung Energieoperator E i t Hamiltonoperator Hˆ Impulsoperator 2 2m i grad p U PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Der quantenmechanische harmonische Oszillator Gesucht: Eigenzustände des Hamiltonoperators Teilchen im harmonischen Potential (U = k∙x2/2): Ĥ x E x Gesamte Wellenfunktion: i x, t x exp Et 2 d2 k 2 x x E x 2 2m dx 2 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Grundzustand des harmonischen Oszillators 2 2 x d x ˆ A0 x exp exp 0 x 0 2 dx 2 x 2 0 x C exp 2 mx 2 m 0 x exp 2 14 ĥ0 x 0 x E (J) = 100 mm m = 12 D E0 x 2 x (nm) PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 1. angeregter Zustand des harmonischen Oszillators Aˆ Aˆ hˆ ˆ ˆ hˆ AA ˆ 0 A 0 ˆ ˆ x ? Was ergibt hA 0 ˆ ˆ x Aˆ Aˆ Aˆ x Aˆ AA ˆ ˆ x Aˆ x hA 0 0 0 0 ˆ ˆ Aˆ Aˆ 2 AA ˆ ˆ x Aˆ Aˆ Aˆ 2 x Aˆ x 3Aˆ x hA 0 0 0 0 ist neue Eigenfunktion d ˆ 1 x ~ A 0 x 0 x von ĥ mit Eigenwert 3! dx 3 E1 2 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 1. angeregter Zustand des harmonischen Oszillators Aˆ Aˆ hˆ Normierung ˆ ˆ hˆ AA d ˆ 1 x ~ A 0 x 0 x dx dx Aˆ 0 x Aˆ 0 x ˆ ˆ x 2 dx 0 x AA 0 partielle Integration x 2 d x 2 1 ˆ 1 1 x A 0 x exp exp 0 2 2 2 dx 2 1 x 14 x 2 d 2 exp exp x 2 2 dx m PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Höhere Zustände des harmonischen Oszillators Aˆ Aˆ hˆ ˆ ˆ hˆ AA ˆ ˆ Aˆ Aˆ 2 Aˆ , Aˆ AA ˆ ˆ x ~ Aˆ Aˆ Aˆ x Aˆ hˆ 2 x 2k 1 Aˆ x hA ˆ ˆ x ~ Aˆ Aˆ Aˆ x Aˆ hˆ 2 x 2k 1 Aˆ x hA ˆ ˆ x ~ Aˆ Aˆ Aˆ x Aˆ hˆ 2 x 5Aˆ x hA 1 1 1 1 k k k k k k k k Â+ und  sind sogenannte Leiteroperatoren: Â+ transformiert Zustand in energetisch nächsthöheren,  transformiert Zustand in energetisch nächsttieferen Zustand PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Alle Zustände des harmonischen Oszillators k x ~ Aˆ k k x d x 0 x 1 exp exp 0 x 2 dx 2 2 k 2 14 x 2 d k 2 k x 1 exp exp x k 2 k n ! k 2 dx k 14 x 2 k x exp Hk k k 2 k ! 2 x k d 2 H x z 1 exp z 2 exp z k dz Hermitesche Polynome k 1 Ek k 2 m PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Die untersten Zustände des harmonischen Oszillators 3 x  2 x  1 x  14 x 2 2 3 3 exp 12 x 8 x 3 48 2 14 8 2 x 2 2 2 exp 4 x 2 2 14 x 2 exp 2x 2 2 0 x 14  x 2 exp 2 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de   Die untersten Zustände des harmonischen Oszillators 2c 1.99 1020 J ||2 x (nm) x (nm) Energie (J) m = 12 D = 100 mm Zahl der Nullstellen von (nodes) = k PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom Potentielle Energie eines Elektrons im elektrischen Feld eines positiv geladenen Protons: q2 U r 40 r r Klassische Bewegungsgleichungen r r r r r r mp d 2 rp dt 2 eˆ r dU r dr e p e dU r d 2re me 2 eˆ r dt dr reduzierte Masse: 1 1 1 m me m p 1 d 2r 1 dU r eˆ r 2 dt me m p dr dU r d 2r m 2 eˆ r dt dr PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de p Wasserstoffatom q2 Potentielle Energie U r 40 r r Reduzierte Masse 1 1 m me m p Zeitunabhängige Wellenfunktion 1 f r f r Ef r 2m r 2 Laplace-Operator in Kugelkoordinaten: 1 2 1 f rf 2 2 r r r 1 f 1 2 f sin 2 2 sin sin PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Intermezzo: Kugelkoordinaten z x r sin cos y r sin sin z r cos y x eˆ eˆ grad eˆ r r r r sin eˆ eˆ div eˆ r sin r r sin r sin PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Drehimpuls Wellenfunktion bei Bewegung um eine fixe Achse (z.B. z): f ~ eim Beschränkung: f r, , f r, , 2 m muß ganze Zahl sein! Quantisierung des Drehimpulses: Lz m Drehimpuls: Impuls mal Radius Quantisierung des Drehimpulses gilt für jede Achse!! PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Drehimpuls um verschiedene Achsen 90° 90° f ~ e i f ~ ei 2 ei f ~ e i f ~ e2i f ~ e2i 3ei 6 3ei e2i f ~ e2i PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: Trennung der Variablenabhängigkeiten 2 2 rf 2 2mr r 2mr 2 2 1 f 1 2 f sin 2 2 sin sin f Ef r f ~ eim 2 2 rf 2 2mr r 2mr 2 2 Quadrat des gesamten Drehimpulses L K 1 f m2 sin 2 sin sin f f Ef r 1 f m2 sin 2 f Kf sin sin 2 2 K rf f f Ef 2 2 2mr r 2mr r 2 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: -Abhängigkeit 1 f m2 sin 2 f Kf sin sin 2 sin 2 sin K 2 cos 2 sin m2 sin 2 1 1 sin m2 sin m Ansatz: f ~ sin 2 K sin 2 K sin Gesamtdrehimpuls ~ Drehimpuls um z Generelle Lösung: f ~ Pm cos Assoziierte Legendre-Polynome PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Assoziierte Legendre-Polynome Pm x 1 m 2 ! 1 x2 m2 d m 2 x 1 m dx Pm cos m=0 m=1 ℓ=0 ℓ=1 P0 P00 1 P1 P10 cos P11 sin ℓ=2 P2 P20 3cos 2 1 2 P21 3cos sin P22 3sin 2 m=2 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: -Abhängigkeit m = -2 m = -1 m=0 m=1 m=2 ℓ=0 s ℓ=1 p ℓ=2 d PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: r-Abhängigkeit 1 f m2 sin 2 f sin sin f ~ Pm cos eim 2 2 rf 2m r 2 2 1 r2 2m Im Limes r → 0 r 2 ~ 1 r 2 1 f rf rf E rf r 2 2 rf Im Limes großer ~ E rf 2 Werte von r: 2m r 2 rf rf 2mE rf ~ exp i r 2 2mE rf ~ r exp i r 2 1 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: r-Abhängigkeit 2 2 rf 2m r 2 2 2m Ansatz: rf ~ r 2m 2 i m 1 2mE 1 2 2i 2 r 2mE E 1 1 r2 1 rf rf E rf r 2mE exp i r 2 1 2mE 2 r m 2 2 2 1 2 2 1 1 E 2 2m r r mq 4 32202 2 1 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 2 Wasserstoffatom: Grundzustand f1,0,0 mq 2 exp 2 4 0 mq 4 E1 322 02 r r exp a0 Bohr-Radius: a0 = 0.529 Å 2 E1 13.6 eV Elektronenvolt: Energie, die ein Elektron bei Durchlaufen einer Spannungsdifferenz von einem Volt erhält 1 eV 1.6022 1019 C 1 V 1.6022 1019 J PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: Allgemeine Lösung f n, ,m 2r 2r 2 1 2r m im N exp L P cos e n 1 na0 na0 na0 Assoziierte Laguerre-Polynome m , n x k p e x d x pk Lkp x e x p p ! dx mq 4 En 322 02 2 n 2 ℓ=0 n=2 L10 1 L11 2 x 1 n=3 L12 6 6 x x 2 n=1 ℓ=1 ℓ=2 L30 1 2 L13 4 x L50 1 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: Radialfunktion n=1 ℓ=0 n=2 ℓ = 0,1 n=3 | f |2 normalisierte Funktionen f ℓ = 0,1,2 r (a0) r (a0) PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Wasserstoffatom: Energieschema - log |E| - 0.14 eV - 0.17 eV - 0.21 eV - 0.28 eV - 0.38 eV - 0.54 eV - 0.85 eV - 1.5 eV Entartung des nten Energieniveaus: - 3.4 eV n 1 2 1 n 2 0 - 13.6 eV ℓ Orbital 0 s 1 p 2 d 3 f 4 5 6 7 8 PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de 9 Spin Wie ändert sich die Wellenfunktion eines Teilchens, wenn es um eine Achse rotiert wird? R ? Volle Rotation: R 2 ! Beide Vorzeichen sind möglich, 2 2 R 2 da nur gelten muß Fermionen R 2 Bosonen R 2 R eis Spin-Quantenzahl s PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de Pauli-Prinzip Angenommen, zwei Teilchen befinden sich im identischen Zustand. r1 , r2 r1 r2 Dann ist die Wellenfunktion, bei der beide Teilchen vertauscht sind, identisch mit der ursprünglichen Wellenfunktion. r1 r2 r2 r1 Vertauschung kann aber auch durch Drehung um ein Achse erreicht werden. Für Fermionen haben wir demnach: r2 r1 R r1 r2 R r1 R r2 r1 r2 Zwei Fermionen können niemals im gleichen Zustand sein! PC II für Biochemiker Eberhard-Karls-Universität Tübingen, Institut für Physikalische und Theoretische Chemie, Prof. Dr. J. Enderlein, http://www.joerg-enderlein.de