Vorlesungs
Werbung

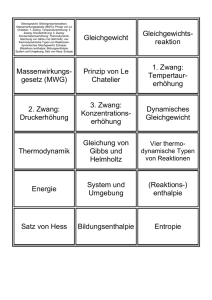
270150 VO Allgemeine Chemie Bernhard Keppler, Vladimir Arion, Herbert Ipser, Regina Krachler Vorlesungsversuche: Norbert Kandler Dienstag, 9.30 – 11.00 Uhr Mittwoch, 11.00 - 12.00 Uhr Donnerstag, 9.30 – 11.00 Uhr ------------------------------------------ http://homepage.univie.ac.at/regina.krachler/ Prüfungen • Vorlesungs-Prüfung: schriftlich, 15 Fragen/ 100 Punkte maximal erreichbar. Für diese Prüfung erhält man ein Zeugnis. • Termine der Vorlesungs-Prüfung: 1. Anfang Februar, 2. Ende Februar, 3. Anfang März, 4. nach den Osterferien, 5. Ende Juni, 6.Ende September, 7. Mitte November. • Zwischenprüfung: 1. Dezember. Die Teilnahme an der Zwischenprüfung ist freiwillig, sie kann nicht wiederholt werden. Falls man die Vorlesungs-Prüfung zum 1., 2. oder 3. Termin absolviert, ist das (positive) Ergebnis der Zwischenprüfung anrechenbar, und es sind dann statt 15 nur 6 Fragen zu beantworten. Ab dem 4. Termin ist das Ergebnis der Zwischenprüfung nicht mehr anrechenbar. Literatur C. MORTIMER, U. MÜLLER CHEMIE – DAS BASISWISSEN DER CHEMIE 9. Aufl., 2007 (Paperback) Georg Thieme Verlag E. RIEDEL ALLGEMEINE UND ANORGANISCHE CHEMIE 9. Aufl., 2008 (Paperback) de Gruyter E. RIEDEL/C. JANIAK ÜBUNGSBUCH ALLGEMEINE UND ANORGANISCHE CHEMIE 1. Aufl., 2009 (Paperback) de Gruyter Die chemische Reaktion Definitionen über die an der Reaktion beteiligten Stoffportionen: Stoffmengenkonzentration Stoffmengenanteil (Molenbruch) SI-Einheit mol·m-3 übliche Einheit mol·L-1 x( X ) n( X ) n Reaktion unter Zufuhr mechanischer Energie (mechanochemische Reaktion) Reiben HgBr2(S) + 2KI(S) HgI2(S) rot + 2KBr(s) Endotherme Reaktion Exotherme Reaktion Phen=Phenanthrolin Redox-Indikator rot blau Vorlesungsversuche 18 Teilreaktionen mit 21 beteiligten Species !! Ein mechanisches System kann um seine Gleichgewichtslage schwingen. Ein chemisches System kann das nicht tun. Schwingende chemische Systeme befinden sich stets fernab vom Gleichgewicht. Sie streben dem Gleichgewicht zu, wobei die Konzentrationen von Zwischenverbindungen oszillieren. + Reaktionskinetik = Lehre von der Geschwindigkeit chemischer Reaktionen • Altgriechisch kinetikos = die Bewegung betreffend, zur Bewegung gehörend • Während einer Reaktion werden Ausgangsstoffe (Edukte) verbraucht, ihre Konzentrationen im Reaktionsgemisch nehmen daher mit der Zeit ab, während gleichzeitig Reaktionsprodukte entstehen, d.h. die Konzentrationen der Produkte nehmen mit der Zeit zu. • Definition der Reaktionsgeschwindigkeit v: z.B. für die Reaktion aA bB cC P 1 d A 1 d B 1 d C d P v a dt b dt c dt dt Faktoren, die die Reaktionsgeschwindigkeit beeinflussen Konzentration der Reaktanden Temperatur, bei der die Reaktion stattfindet Ist die Reaktion homogen? Dann erfolgt sie im Raum in drei Dimensionen. Befinden sich die Reaktanden in unterschiedlichen Phasen, so ist die Reaktion auf deren Grenzfläche beschränkt. Dann hängt die Reaktionsgeschwindigkeit von der Größe der Grenzfläche ab (z.B. chemische Verwitterung, Staubexplosion) Anwesenheit eines Katalysators Reaktionsgeschwindigkeitsgesetz v k A B C x y z • beschreibt die Abhängigkeit der Reaktionsgeschwindigkeit von den Konzentrationen der Reaktanden (bei konstanter Temperatur). • Es handelt sich um eine Differentialgleichung, in der eine gesuchte Funktion (Konzentration als Funktion der Zeit) und deren 1. Ableitung auftritt. • Reaktionsordnung (Gesamtreaktionsordnung) = Summe der Hochzahlen x+y+z • Konstante k = Reaktionsgeschwindigkeitskonstante (für eine bestimmte Reaktion eine charakteristische Größe) Reaktionsordnung • Das Geschwindigkeitsgesetz (und damit auch die Reaktionsordnung) muss experimentell bestimmt werden. • Man kann die Reaktionsordnung nicht aus der Brutto-Reaktionsgleichung ableiten, außer es handelt sich um eine Elementarreaktion (Reaktion, die nur aus einem Reaktionsschritt besteht). • Die Reaktionsordnung muss nicht ganzzahlig sein. Reaktionen nullter Ordnung A B Pr odukte d A d B v k dt dt Beispiel: Die Reaktion wird durch ein Enzym katalysiert, welches pro Zeiteinheit nur eine ganz bestimmte Menge an Reaktionsumsatz katalysieren kann. Die Reaktanden A und B stehen hierzu in einem sehr großen Überschuss. Daraus folgt: Die Reaktionsgeschwindigkeit ist unabhängig von den Konzentrationen der Reaktanden. Reaktionen erster Ordnung A Pr odukte d A v k A dt d A k dt A ln A k t ln At 0 At At 0 e k t k Beispiel: N2O ½ O2 + N2 Die Halbwertszeit einer Reaktion 1. Ordnung Bei einer Reaktion 1. Ordnung ist die Halbwertszeit konstant. Aus: Mortimer, Müller. Chemie. Thieme Reaktionen zweiter Ordnung A A Pr odukte d A 2 v k A dt 1 1 k t A At 0 Beispiele: 2 HI (g) 2 NO2 (g) A B Pr odukte d A d B v k A B dt dt H2 (g) + I2 (g) 2 NO (g) + O2 (g) 2 NO2 (g) 2 NO (g) + O2 (g) Die Daten wurden bei 300°C erfasst. Aus: Brown, LeMay, Bursten: Chemie – die zentrale Wissenschaft. Pearson Einstufige Reaktionen (Elementarreaktionen) und mehrstufige Reaktionen • Aus der stöchiometrischen Reaktionsgleichung ist nicht zu erkennen, ob die Reaktion in einer Stufe (einem Schritt, einem molekularen Prozess) abläuft (Elementarreaktion), • oder ob eine Kaskade von Elementarreaktionen vorliegt, die zeitlich hintereinander mit unterschiedlicher Geschwindigkeit ablaufen. • Erfolgt die Reaktion über zwei oder mehrere Stufen, so treten kurzlebige Zwischenprodukte auf, die in der Reaktionsgleichung nicht aufscheinen. • Der geschwindigkeitsbestimmende Schritt für die Gesamtreaktion ist immer die am langsamsten verlaufende Teilreaktion. Geschwindigkeitsbestimmender Schritt A+B+C Produkte Langsam: A+B Zwischenstufe X Schnell: X+C Produkte v k A B Reaktion 2. Ordnung Aus der Stöchiometrie einer Reaktionsgleichung kann nie unmittelbar auf die Reaktionsordnung geschlossen werden, man muss die geschwindigkeitsbestimmenden Schritte kennen. Molekularität einer Elementarreaktion: Wie viele Teilchen treten zum Übergangszustand (aktivierten Komplex) zusammen? • Beispiel: Einer der beiden monomolekularen Schritte muss also der langsamste und damit derjenige sein, der die Reaktionsgeschwindigkeit und damit die Reaktionsordnung der Gesamtreaktion bestimmt. Reaktionsordnung und Molekularität von Elementarreaktionen A Produkte v = k [A] Monomolekulare Reaktion, Reaktion 1. Ordnung A+B Produkte v= k [A] [B] Bimolekulare Reaktion, Reaktion 2. Ordnung 2A+B Produkte v = k [A]2 [B] Trimolekulare Reaktion, Reaktion 3. Ordnung (sehr selten) Beispiel einer monomolekularen Reaktion Aus: E. Riedel, Allgemeine und Anorganische Chemie Zwischenmolekulare Zusammenstöße Zahl der Kolloisionen in einem Gasvolumen von 1 L bei 25°C und 101325 Pa: 1031 Kollosionen pro Sekunde Bei allen chemischen Reaktionen nimmt die Reaktionsgeschwindigkeit mit steigender Temperatur zu Dies gilt für exotherme wie für endotherme Reaktionen Faustregel: Eine Temperaturerhöhung um 10°C bewirkt eine Erhöhung der RG auf das Doppelte Eine Temperaturerhöhung von 25°C auf 35°C bewirkt eine Erhöhung der Zahl der Kollisionen um 2% ?? Aktivierungsenergie Damit zwei Teilchen zum aktivierten Komplex zusammentreten und zu den Produkten reagieren, müssen sie zunächst kollidieren. Im Allgemeinen führt nur ein kleiner Bruchteil der stattfindenden Kollisionen tatsächlich zur Reaktion. Für eine effektive Kollision muss die Summe der kinetischen Energien der zusammentreffenden Moleküle einen Mindestwert übersteigen. Dieser Mindestwert heißt Aktivierungsenergie. Temperaturabhängigkeit der Reaktionsgeschwindigkeit Die Geschwindigkeitskonstante k ändert sich mit der Temperatur gemäß der Arrhenius-Gleichung (Svante Arrhenius 1889) ------------------------------------------------------Ea Arrhenius‘sche Aktivierungsenergie R Ideale Gaskonstante T absolute Temperatur A Faktor, berücksichtigt die geometrische Ausrichtung der Moleküle beim Zusammenstoß Maxwell-Verteilung k Ae Ea RT Übergangszustand (Aktivierter Komplex) • Irgendwo auf dem Weg der Reaktion zwischen A und B gibt es eine Anordnung der Kerne der beteiligten Atome, die maximale potentielle Energie besitzt, • und ausgehend von der die Reaktion spontan weiterläuft – entweder zu den Produkten oder zurück zu den Reaktanden A und B. • Diese Kernanordnung bezeichnet man als Übergangszustand der Reaktion. Energieprofil einer chemischen Reaktion Isomerisierung von Methylisonitril. Produkt: Acetonitril Energieprofil einer chemischen Reaktion, die über zwei Übergangszustände und eine Zwischenstufe abläuft, wobei der 1. Reaktionsschritt geschwindigkeitsbestimmend ist. Wilhelm Ostwald 1853-1932 Foto aus Wikipedia Der Autoabgas-Katalysator CH 4 2 NO2 CO2 N 2 2 H 2O 4 CO 2 NO2 4 CO2 N 2 2 CO 2 NO 2 CO2 N 2 2 CO O2 2 CO2 2 C2 H 6 7 O2 4 CO2 6 H 2O Aus: Brown, LeMay, Bursten: Chemie – die zentrale Wissenschaft. Pearson Eugene Houdry erfand 1950 den Autoabgaskatalysator Anlass: Photochemischer Smog in Los Angeles durch Autoabgase Patent 1956 Wurde zunächst nicht eingesetzt, da der Katalysator durch das Antiklopfmittel Bleitetraethyl vergiftet wurde. Heute tert-Buyl-Methyl-Ether und Benzol als Antiklopfmittel Katalysatorpflicht ab 1989 Eugene Houdry in 1953, holding a small catalytic converter. Courtesy Sunoco, Inc. Pionier der Katalyse in der Erdölindustrie: katalytisches Cracken langkettiger Kohlenwasserstoffe Gleichgewicht im Apfelkrieg, aus: Dickerson/Geis, Chemie eine lebendige und anschauliche Einführung, Verlag Chemie, Basel 1983. Chemisches Gleichgewicht Es findet (wenn die Reaktionsprodukte nicht entfernt werden) im Reaktionsgemisch stets eine Hinreaktion und eine Rückreaktion statt. Nach einer gewissen Zeit hat sich ein Gleichgewicht ausgebildet, bei dem Hin und Rückreaktion gleich schnell ablaufen. Die Gesamtreaktionsgeschwindigkeit ist dann gleich Null. Für diesen Fall gilt das Massenwirkungsgesetz (MWG). Das MWG wurde 1867 von Cato Maximilian Guldberg und Peter Waage (Norwegen) experimentell entdeckt und kinetisch abgeleitet. Eine chemische Reaktion kommt bei gegebener Temperatur dann zum Stillstand, wenn der Massenwirkungsquotient Q einen für die Reaktion charakteristischen Zahlenwert K erreicht hat. Foto: Wikpedia C D Q a b A B c aA bB cC dD d Allgemeine Reaktion aA + bB cC + dD Im Gleichgewicht gilt: Q=K Massenwirkungsquotient =Gleichgewichtskonstante C D K a b A B c d Es gibt unendlich viele mögliche Gemische der Reaktanden, die dem MWG genügen und daher nach außen hin nicht reagieren!! Gekoppelte Reaktionen im Gleichgewicht Es können z.B. zwei Reaktionen über einen gemeinsamen Reaktanden D miteinander gekoppelt sein: aA bB cC D D eE fF gG K1 C c D Aa B b K2 F G D E e f g Die Gleichgewichtskonstante der Gesamtreaktion ist gleich dem Produkt der Gleichgewichtskonstanten der Einzelreaktionen: aA bB eE cC fF gG c f g c f g C D F G C F G K K1 K 2 a b e a b e A B D E A B E Kinetische Ableitung des MWG aA bB cC dD vhin k hin A B a Das MWG lässt sich aus der stöchiometrischen Reaktionsgleichung kinetisch ableiten, auch dann, wenn die Reaktion aus mehreren Reaktionsschritten (Elementarreaktionen) besteht, weil sich für alle beteiligten Reaktionsschritte Gleichgewicht einstellt. b vrück k rück C D c d vhin vrück k hin C D K a b k rück A B c d Haber-Bosch Verfahren Katalysator: α-Eisen/Al2O3 Temperaturabhängigkeit der Gleichgewichtskonstante braun farblos Chemische Thermodynamik Befasst sich mit den quantitativen Beziehungen zwischen der Wärmeenergie und anderen Energieformen Geht von - aus Experimenten abgeleiteten - Axiomen aus, den Hauptsätzen der Thermodynamik Ermöglicht die Voraussage, ob eine bestimmte chemische Reaktion unter gegebenen Bedingungen ablaufen kann Systemarten der Thermodynamik System = Abgegrenzter Teil der physikalischen Welt, welcher den Gegenstand der Untersuchung bildet. Abgeschlossene Systeme Geschlossene Systeme Offene Systeme Robert Mayer und James Joule entdeckten Mitte des 19. Jh. die Äquivalenz von Wärme und mechanischer Energie Joule‘sches Experiment • Im Jahre 1847 formulierte Hermann Helmholtz den 1. Hauptsatz der Thermodynamik: • In einem abgeschlossenen System (d.h. in einem System, dem von außen weder Energie zugeführt noch entzogen wird) in dem sich beliebige (mechanische, thermische, elektrische, chemische) Vorgänge abspielen, bleibt die vorhandene Gesamtenergie erhalten. • Nach diesem Satz ist es klar, dass es kein Perpetuum Mobile geben kann. Der 2. Hauptsatz der Thermodynamik: • Formulierung von Clausius: es ist unmöglich, dass Wärme von selbst aus einem kälteren auf einen wärmeren Körper übergeht. • Formulierung von Thomson: es ist unmöglich, eine periodisch wirkende Maschine zu konstruieren, die nichts weiter bewirkt als Abkühlung eines Wärmereservoirs und Leistung mechanischer Arbeit (Prinzip der Unmöglichkeit eines Perpetuum Mobile 2. Art). In einem abgeschlossenen System strebt die Entropie S irreversibel einem Maximalwert zu. Ist thermodynamisches Gleichgewicht schließlich erreicht, so bleibt die Entropie S konstant.