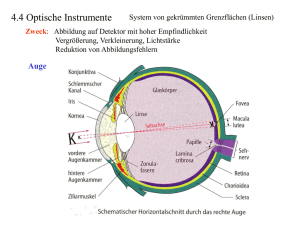
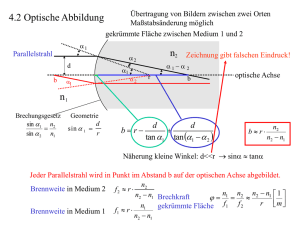
Betrachtung sphärischer Aberrationen nach Implantation einer
Werbung

Aus der Klinik für Augenheilkunde des Knappschaftskrankenhauses Bochum-Langendreer – Universitätsklinik – der Ruhr-Universität Bochum Direktor: Prof. Dr. med. Burkhard Dick Betrachtung sphärischer Aberrationen nach Implantation einer asphärischen Linse Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Daniel Pinto dos Santos aus Frankfurt a.M. 2009 Dekan: Prof. Dr. med. G. Muhr Referent: Prof. Dr. med. B. Dick Koreferent: PD Dr. med. M. Holzer Tag der Mündlichen Prüfung: 02.02.2010 Inhaltsverzeichnis 1 Einleitung........................................................................................................................7 1.1 Anatomie und Physiologie der Linse......................................................................8 1.2 Die Katarakt..........................................................................................................10 1.3 Kataraktchirurgie..................................................................................................13 1.4 Intraokularlinsen...................................................................................................14 1.5 Optische Abbildung..............................................................................................16 2 Ziel und Fragestellung..................................................................................................19 3 Patienten, Material, Methodik......................................................................................20 3.1 Patientenkollektiv.................................................................................................20 3.2 Intraokularlinse.....................................................................................................21 3.3 Ablauf und Untersuchungsmethoden....................................................................22 3.3.1 Berechnung der IOL-Brechkraft und IOL-Auswahl.....................................23 3.3.2 Refraktionsbestimmung und Sehschärfeprüfung..........................................24 3.3.3 Bestimmung der Vorderkammertiefe............................................................25 3.3.4 Messung der Aberrationen............................................................................26 3.4 Statistische Auswertung........................................................................................28 4 Ergebnisse.....................................................................................................................29 4.1 Präoperative Ergebnisse........................................................................................29 4.1.1 Allgemeine und patientenbezogene Daten....................................................29 4.1.2 Morphologische Größen................................................................................31 4.1.3 Funktionelle Ergebnisse................................................................................32 4.1.4 Sphärische Aberrationen...............................................................................33 4.1.5 Zusammenhänge präoperativer Größen........................................................35 Morphologische Größen....................................................................................35 Brechwerte der IOL...........................................................................................36 Sphärische Aberrationen....................................................................................37 4.2 Postoperative Ergebnisse......................................................................................38 4.2.1 Morphologische Größen................................................................................38 4.2.2 Funktionelle Ergebnisse................................................................................39 4.2.3 Sphärische Aberrationen...............................................................................41 1 4.2.4 Zusammenhänge postoperativer Größen.......................................................42 Abweichungen von der Zielrefraktion...............................................................42 Sphärische Aberrationen....................................................................................43 5 Diskussion....................................................................................................................47 5.1 Kritische Würdigung.............................................................................................52 6 Zusammenfassung........................................................................................................54 7 Literaturverzeichnis......................................................................................................55 2 Abkürzungsverzeichnis % Prozent nm, mm, µm, m Nano-, Milli-, Mikro-, Meter mg Milligramm µl Mikroliter Abb. Abbildung AO Advanced Optics AQP Aquaporin B&L Bausch&Lomb c.c. cum correctione CCD Charge Coupled Device d. h. das heißt DIN Deutsches Institut für Normung dpt Dioptrie et al. et alii IOL Intraokularlinse Jhdt. Jahrhundert s.c. sine correctione Tab. Tabelle UV Ultraviolett v. Chr. vor Christus VK Vorderkammer 3 Tabellenverzeichnis Tab. 1: Technische Details Akreos Adapt AO.............................................................21 Quelle: Bausch & Lomb GmbH Akreos Adapt AO Datenblatt Tab. 2: Visusstufe nach DIN 58224 und Sehschärfe...................................................25 Tab. 3: Altersverteilung...............................................................................................29 Tab. 4: IOL-Brechkraft...............................................................................................30 Tab. 5: Zielrefraktion..................................................................................................30 Tab. 6: präoperative Vorderkammertiefe und Achslänge............................................31 Tab. 7: Hornhauthauptschnittradien............................................................................31 Tab. 8: präoperativer Visus.........................................................................................32 Tab. 9: präoperative Fehlsichtigkeit............................................................................33 Tab. 10: präoperative sphärische Aberrationen...........................................................33 Tab. 11: postoperative Vorderkammertiefe.................................................................39 Tab. 12: postoperativer Visus......................................................................................39 Tab. 13: postoperative Fehlsichtigkeit und Abweichung von Zielrefraktion..............40 Tab. 14: postoperative sphärische Aberrationen.........................................................41 4 Abbildungsverzeichnis Abb. 1: Bau der menschlichen Linse............................................................................9 Benninghoff, A., Drenckhahn, D. (Hrsg.) Anatomie Band 2 Urban & Fischer Verlag, München Abb. 2: Bau des Auges nach Celsus............................................................................10 Feugère, M., Künzel, E., Weisser, U. (1985). Die Starnadeln von Montbellet (Saône-et-Loire). Sonderdruck aus: Jahrbuch des Römisch-Germanischen Zentralmuseums (32. Jahrgang) Abb. 3: Sicht eines gesunden Auges...........................................................................12 http://de.wikipedia.org/wiki/Bild:Grauerstar-1.jpg (Zugriff vom 12.07.2007) Abb. 4: Sicht eines kranken Auges ............................................................................12 http://de.wikipedia.org/wiki/Bild:Grauerstar-2.jpg (Zugriff vom 12.07.2007) Abb. 5: Airy- oder Beugungsscheibchen....................................................................16 http://de.wikipedia.org/wiki/Bild:Diffraction_disc_calculated.png (Zugriff vom 12.07.2007) Abb. 6: Zernike-Polynome..........................................................................................17 Kampik, A. (Hrsg.) Augenärztliche Rehabilitation, Georg Thieme Verlag, Stuttgart Abb. 7: B&L Akreos Adapt AO..................................................................................21 Bausch & Lomb GmbH Akreos Adapt AO Datenblatt Abb. 8: Untersuchungszimmer...................................................................................25 Abb. 9: Oculus Pentacam............................................................................................26 Abb. 10: Carl Zeiss WASCA......................................................................................26 Abb. 11: Shack-Hartmann-Sensor..............................................................................27 Eigene Bearbeitung von http://de.wikipedia.org/wiki/Bild:SHACK01.png (Zugriff vom 12.07.2007) Abb. 12: Geschlechtsverteilung..................................................................................29 Abb. 13: Verteilung der Augen...................................................................................29 Abb. 14: präoperativer Visus......................................................................................32 Abb. 15: präoperative sphärische Aberrationen..........................................................34 Abb. 16: Korrelation: Achslänge zu Vorderkammertiefe............................................35 Abb. 17: Korrelation: Achslänge zu Hornhauthauptschnitt........................................35 5 Abb. 18: Korrelation: Hornhauthauptschnitte.............................................................35 Abb. 19: Korrelation: Vorderkammertiefe zu Hornhauthauptschnitt..........................36 Abb. 20: Korrelation: Achslänge zu IOL-Stärke........................................................36 Abb. 21: Korrelation: Vorderkammertiefe zu IOL-Stärke..........................................36 Abb. 22: Korrelation: Hornhauthauptschnitt zu IOL-Stärke......................................37 Abb. 23: Korrelation: Hornhauthauptschnitt zu sphärischen Aberrationen................37 Abb. 24: postoperativer Visus.....................................................................................39 Abb. 25: Refraktive Ergebnisse..................................................................................40 Abb. 26: postoperative sphärische Aberrationen........................................................41 Abb. 27: Korrelation: Achslänge zu Abweichung von Zielrefraktion........................42 Abb. 28: Korrelation: Zielrefraktion zu Abweichung von Zielrefraktion...................42 Abb. 29: Korrelation: IOL-Stärke zu Abweichung von Zielrefraktion.......................42 Abb. 30: Korrelation: Vorderkammertiefe zu Abweichung von Zielrefraktion..........43 Abb. 31: Korrelation: Hornhauthauptschnitt zu Abweichung von Zielrefraktion......43 Abb. 32: Korrelation: Vorderkammertiefe zu sphärischen Aberrationen...................44 Abb. 33: Korrelation: Achslänge zu sphärischen Aberrationen..................................44 Abb. 34: Korrelation: IOL-Stärke zu sphärischen Aberrationen................................44 Abb. 35: Korrelation: Horizontaler Hornhauthauptschnitt zu sphärischen Aberrationen...........................................................................................................45 Abb. 36: Korrelation: Senkrechter Hornhauthauptschnitt zu sphärischen Aberrationen...........................................................................................................45 Abb. 37: Korrelation: Senkrechter Hornhauthauptschnitt zu sphärischen Aberrationen...........................................................................................................46 Abb. 38: Korrelation: Senkrechter Hornhauthauptschnitt zu sphärischen Aberrationen...........................................................................................................46 6 1 Einleitung Katarakt oder „Grauer Star“ sind Bezeichnungen für jede Trübung der Linsenkapsel oder -substanz, unabhängig von deren Auswirkung auf das Sehen und davon ob es sich um eine angeborene oder erworbene Trübung handelt (Grehn, 2006). Die mit einem Anteil von etwa 90% häufigste Form der Katarakt ist die altersabhängige Katarakt (Cataracta senilis), die einen überwältigenden Anteil der über 65-jährigen betrifft. Weltweit sind etwas weniger als 40 Millionen Menschen blind, davon fast die Hälfte aufgrund einer Katarakt. In Industrieländern liegt die Quote, mit etwa fünf Prozent, erwartungsgemäß sehr viel tiefer, was sich vor allem darauf zurückführen lässt, dass hier die chirurgische Entfernung der Linse mit anschließender Implantation einer Kunstlinse ein relativ einfaches und daher häufig angewandtes Verfahren ist, die Sehfähigkeit wiederherzustellen (Resnikoff et al., 2004). Die Kataraktoperation ist der wohl am häufigsten durchgeführte und am weitesten perfektionierte chirurgische Eingriff überhaupt. Allein in Deutschland wurden im Jahr 2004 etwa 480.000 Kataraktoperationen durchgeführt. (Ober et al., 2005) Die derzeit bevorzugte Operationsmethode ist die Phakoemulsifikation nach Kapsulorhexis, bei der zunächst die Linsenkapsel eröffnet und die trübe Linse anschließend mithilfe eines vibrierenden piezoelektrischen Kristalls emulgiert und abgesaugt wird. In den verbleibenden Kapselsack wird dann die künstliche Linse implantiert (Grehn, 2006). Bei Design und Material der künstlichen Linsen findet eine stetige Weiterentwicklung statt, so dass inzwischen eine große Vielfalt implantierbarer Intraokularlinsen zur Auswahl steht. 7 Eine der jüngsten Entwicklungen auf diesem Gebiet ist die Betrachtung sogenannter sphärischer Aberrationen, durch deren Berücksichtigung die Sehleistung bei Patienten mit Kunstlinsen weiter verbessert werden soll (Applegate, 2000). Mit diesem Aspekt soll sich die vorliegende Arbeit beschäftigen. 1.1 Anatomie und Physiologie der Linse Die Entwicklung der Linse beginnt in der vierten Entwicklungswoche mit der Anlage des Augenbechers und der Bildung des Linsenbläschens aus dem Ektoderm. Die Zellen des hinteren Anteils beginnen Linsenfasern zu bilden, die das Innere der Blase ausfüllen, während die vordere Wand das Linsenepithel bildet. Durch die am Äquator stetig zuwachsenden Linsenfasern plattet sich die anfangs runde Linse ab. Die erwachsene menschliche Linse (Lens, gr. phakos) ist ein bikonvexer, ellipsoider, transparenter Körper, dessen Vorderfläche den Pupillenrand berührt und über die Zonulafasern am Ziliarkörper aufgehängt ist. Sie besitzt weder Blutgefäße noch Nerven und ist vorne schwächer als hinten gekrümmt. Der äquatoriale Durchmesser beträgt durchschnittlich 9 mm, der axiale im Mittel 3,5 mm, bei maximaler Abrundung bis zu 4,7 mm. Dank ihrer Elastizität kann die Linse ihre Brechkraft durch Verformung verändern. Die durchschnittliche Brechkraft der menschlichen Augenlinse beträgt 17 dpt und kann bei Jugendlichen durch maximale Akkomodation um bis zu 12 dpt gesteigert werden. Der Brechungsindex der Linse gegenüber dem Kammerwasser beträgt 1,4. 8 Von außen nach innen lassen sich drei Komponenten abgrenzen (siehe Abb. 1): Linsenkapsel, Linsenepithel und Linsensubstanz, wobei letztere aus Linsenfasern besteht und Linsenrinde und Linsenkern bildet. Die Linsenkapsel ist eine von den Linsenepithelzellen produzierte Basal- Abbildung 1: Bau der menschlichen Linse membran und umschließt die Linse als eine elastische Hülle, deren Dicke zwischen etwa 8 μm an der dünnsten Stelle und etwa 20 μm an der dicksten Stelle beträgt. In ihrem Äquatorbereich inserieren die Zonulafasern. Unmittelbar unterhalb der Linsenkapsel liegt das Linsenepithel, das nur auf der vorderen Seite der Linse vorhanden ist und sich in der Äquatorregion zu Linsenfasern elongiert. Hier liegen auch in der adulten Linse noch teilungsaktive Stammzellen, so dass die Linse im Laufe des Lebens ihr Gewicht fast verdoppelt (etwa 145 mg beim Kind und 280 mg beim 80-jährigen) und auch entsprechend an Volumen zunimmt (etwa von 140 μl auf 240 μl), wobei sich die Zahl der Zellen annähernd verdoppelt. Bei den Linsenfasern der Linsensubstanz handelt es sich um flache sechseckige und relativ lange Zellen. In oberflächlichen Schichten besitzen sie noch einen Zellkern, während Zellen in tieferen Schichten diesen verlieren und zellkernlos verbleiben. Ebenso verlieren sie durch partielle Apoptose alle membranumhüllten Organellen. Der Proteingehalt der Linsenfasern beträgt ca. 35%, der Rest ist Wasser. Der Proteinanteil scheint in erheblichem Maße zu den refraktiven Eigenschaften der Linse beizutragen, während der Wasseranteil für die Transparenz wichtig ist. (Benninghoff, Drenckhahn, 2004) 9 Die Ernährung der Linse erfolgt über das Kammerwasser. Eine zentrale Rolle nehmen hierbei die Aktivität der Na+-K+-ATPase und Aquaporine AQP-0 und AQP-1 ein, gerade auch bei der Regulation des Wassergehaltes, dessen Verminderung als eine der Ursachen einer Katarakt gilt. (Verkman et al., 2008) 1.2 Die Katarakt Erste Erwähnungen trüber Augenlinsen und ihrer Behandlung findet man bereits in babylonischer Zeit im Codex Hammurapi (um 1700 v. Chr.), in dem in §215 der Lohn für einen gelungenen bzw. in §218 die Strafe für einen misslungenen Starstich geregelt wird. (Johns, 1904) In Antike und Mittelalter existierten bereits detaillierte Vorstellungen von der Entstehung einer Katarakt. Man ging davon aus, dass sich hinter der Pupille ein freier Raum befände (siehe Abb. 2), in dem sich feuchte pathologische Ausdünstungen sammelten und dann unter Ausbildung einer umhüllenden Membran zu einer festen Masse erstarrten. Die menschliche Linse wird je nach Quelle als hinter der Katarakt liegend angesehen oder als eigentliches Sehorgan Abbildung 2: Bau des Auges nach Celsus beschrieben. 10 Diese Vorstellung der Ätiologie einer Katarakt zeigt sich bis heute in der Etymologie des Wortes Katarakt. Die Griechen nannten es zunächst einen Erguss, ύποχύμα, was im Lateinischen mit suffusio und im Arabischen mit nuzūl al-mā', was wörtlich „Herabfließendes Wasser“ bedeutet, übersetzt wurde. Bei der späteren Übersetzung der arabischen Medizintexte ins Lateinische entstand durch die Unkenntnis des eigentlichen griechischen Äquivalents das heute gebräuchliche Wort Katarakt, vom griechischen κατρράκτης (Wasserfall), bzw. lateinisch cataracta (Wasserfall). Die deutsche Bezeichnung Star leitet sich ebenfalls von diesem Erklärungsmodell ab und bezieht sich auf das Erstarren der Flüssigkeiten, aber auch auf den starren Blick den Patienten mit weit fortgeschrittenen Staren entwickeln. (Feugère et al., 1985) Erst 1705 wurde dieses Modell der Entstehung einer Katarakt durch Brisseau widerlegt, der heraus fand, dass es sich um eine Trübung der menschlichen Augenlinse selbst handelt. Indem er bei einem gestorbenen Soldaten einen Starstich durchführte und anschließend das Auge obduzierte, konnte Brisseau zeigen, dass die niedergedrückte getrübte Linse im unteren Bereich des Augapfels zu Liegen gekommen war. (Henning, 1994) Heute sind Katarakte relativ gut erforscht. Man kann sie nach verschiedenen Kriterien einteilen, z.B. Morphologie oder Ätiologie. Allen gemein ist der klinische Symptomkomplex, von langsamem progredientem Sehverlust mit reduziertem Kontrast, bedingt durch die Trübung der Linse und Blendung durch eine diffuse Lichtbrechung (siehe Abb. 3 und Abb. 4). Interessanterweise berichten einige Patienten mit Katarakt von einer Verbesserung der Sehfähigkeit im Nah- oder Fernbereich, was sich durch die veränderten refraktiven Eigenschaften des degenerierten Linsenkerns erklären lässt. (Grehn, 2006) 11 Abbildung 3: Sicht eines gesunden Auges Abbildung 4: Sicht eines kranken Auges Die häufigste Form der Katarakt ist die altersabhängige Katarakt (Cataracta senilis), die fast als physiologisch im Rahmen der Alterung der Linse angesehen werden kann, und sich entsprechend ihrer Morphologie und ihres Reifungsstadiums weiter differenzieren lässt. Daneben gibt es noch traumatische, medikamenten-induzierte, kongenitale oder im Zusammenhang mit anderen Erkrankungen erworbene Katarakte. (Grehn, 2006) Obwohl die Pathogenese der Cataracta senilis wohl noch nicht im Detail geklärt ist, scheint sich die Entstehung der Katarakt vor allem auf Störungen des Linsenstoffwechsels und Enzym- oder Kanaldefekte zurückführen zu lassen. (RuizEderra, Verkman, 2006) Die Therapie einer Katarakt ist in den meisten Fällen eine Operation mit Implantation einer künstlichen Linse, da eine medikamentöse Therapie nur für Katarakte im Rahmen einer anderer Krankheit, z.B. Diabetes oder Galaktosämie, in Frage kommt. (Grehn, 2006) 12 1.3 Kataraktchirurgie Wie bereits oben erwähnt finden sich schon in babylonischer Zeit (um 1700 v. Chr.) erste Aufzeichnungen über die antike Form der Kataraktchirurgie, den Starstich. Im Mittelalter sind zwei Operationstechniken etabliert. Die ältere Form ist die des klassischen Starstiches. Hierbei führte der Operateur eine Nadel in das Auge ein und drückte mit ihr die trübe Linse in den Glaskörperraum. Eine erst etwas später auftauchende Operationsmethode sah die Entfernung der trüben Linse nicht nur aus dem Strahlengang des einfallenden Lichtes sondern gänzlich aus dem Auge vor. Islamische Augenärzte nutzten dazu um 1000 n. Chr. hohle Metallnadeln, durch die sich nach dem Einführen in das Auge die Linse absaugen ließ. Bei dieser Methode wurde allerdings oft auch einiges an Kammerwasser und Glaskörpermasse aspiriert, wodurch das Auge teils beträchtlich schrumpfte. Dies führte dazu, dass diese Operationsmethode sich bei den meisten mittelalterlichen Augenärzten nicht durchsetzte. (Feugère et al., 1985) Da die Patienten nach einer solchen Operation ganz ohne Linse verblieben, war die Sehschärfe erheblich gemindert. Die schwerwiegendste Komplikation allerdings stellte die Infektion des Auges durch die verwendete Nadel dar. Man muss davon ausgehen, dass ein erheblicher Anteil der in Antike und Mittelalter behandelten Patienten als Folge dieser Komplikation schließlich doch das Augenlicht verlor, oder gar daran starb. Auf die Erkenntnis Brisseaus vom Jahre 1705 gestützt, der die Trübung der Linse als Ursache für die Katarakt erkannte, fand Anfang des 18. Jhdt. eine rasante Entwicklung neuer Kataraktoperationsmethoden statt. Diese mündete 1750 in der ersten gezielten extrakapsulären Kataraktextraktion durch Jacques Daviel, die als Grundstein der heutigen Operationstechnik angesehen werden darf. (Henning, 1994) Die heutige Operationsmethode der Wahl ist die Phakoemulsifikation. Hierbei wird zunächst eine selbstschließende Tunnelinzision in die Vorderkammer angelegt. Nach der Injektion eines Viskoelastikums wird im rechten Winkel zur ersten Inzision eine zweite Stichinzision angelegt. Nun beginnt mit der Kapsulorhexis der eigentlich wichtige Teil der Operation. Nachdem der vordere Teil der Linsenkapsel eröffnet ist, wird der 13 Linsenkern durch die Hydrodissektion mobilisiert, d. h. durch Einbringen einer Flüssigkeit zwischen Kapsel und Kern wird dieser von der Kapsel getrennt. Anschließend kann der Linsenkern mittels des Phakostiftes, an dessen Ende ein piezoelektrischer Kristall mit Ultraschallfrequenzen vibriert, fragmentiert, emulgiert und abgesaugt werden. In den dann verbleibenden Kapselsack wird ein Viskoelastikum injiziert und die zu implantierende Linse inseriert (Grehn, 2006). Da die meisten Linsen heutzutage faltbar sind, kann auf das Erweitern der Inzisionen verzichtet werden. Die Linse entfaltet sich dann im Auge und kann vom Operateur an der richtigen Stelle positioniert werden. Die Haptik der Linse, meist aus zwei oder vier elastischen Bügeln bestehend, ermöglicht es den optischen Teil zentriert zu halten. 1.4 Intraokularlinsen Etwa zur selben Zeit als Jacques Daviel seine erste extrakapsuläre Kataraktextraktion vornahm, tauchten auch die ersten Versuche auf, nach der Operation eine künstliche Linse einzusetzen. Erste Versuche sind vom sächsischen Hofokulisten Casaamata überliefert, der wohl 1795 versuchte eine Linse aus geschliffenem Bergkristall einzusetzen. Der Versuch glückte allerdings nicht, da die Linse zu schwer war und nach unten sank. Erst im Jahre 1949 konnte durch Zufall ein geeignetes Material gefunden werden, als Harold Ridley bemerkte, dass bei abgeschossenen englischen Piloten Plexiglasstücke reizlos im Auge verbleiben konnten. (Henning 1994) Seitdem sind Intraokularlinsen stark weiterentwickelt und verbessert worden. Nicht nur Material, Implantationsmöglichkeiten und Architektur der Linse sind Gegenstand aktueller Forschung. Seit einigen Jahre richtet man nun vermehrt das Augenmerk auch 14 auf das Design der optischen Eigenschaften, nachdem mit der Einführung der objektiven Wellenfrontmessung 1994 auch ein geeignetes Verfahren zur Darstellung von Aberrationen höherer Ordnung zur Verfügung steht (Maeda 2009). Es tat sich die Frage auf, ob die üblichen sphärischen Intraokularlinsen eine optimale optische Rehabilitation nach einer Kataraktoperation ermöglichen, da sich herausstellte, dass durch linseneigene Abbildungsfehler vor allem die Kontrastempfindlichkeit reduziert und die Blendempfindlichkeit erhöht wird. Dies nimmt zum Teil solche Ausmaße an, dass Patienten mit sphärischen Intraokularlinsen als nicht mehr nachtfahrtauglich einzustufen sind. (Großkopf et al., 1998) Wie Applegate zeigen konnte, würde die Korrektion der Aberrationen höherer Ordnung zu einer Verbesserung der Kontrastempfindlichkeit und der Sehschärfe führen (Applegate, 2000). Erste Ansätze in diese Richtung führten zur Entwicklung asphärischer Linsen, die durch ihr optisches Design die kornealen Aberrationen kompensieren sollten (Holladay et al., 2002). Da diese negative sphärische Aberrationen aufweisen müssen, um die positiven Aberrationen eines standardisierten Auges zu kompensieren, wird die Qualität der Abbildung allerdings schon durch leichte Verkippung der Linse beeinträchtigt. (Altmann et al., 2005) Solche korrigierende asphärischen Linsen zeigten daher uneinheitliche Ergebnisse in Bezug auf reproduzierbare Vorteile, was neben Anfälligkeit für Verkippung vor allem auch auf die fehlende Berücksichtigung der individuellen kornealen Aberrationen zurückgeführt wurde (Montés-Micó et al., 2009). Eine der aktuelleren Entwicklungen ist daher die Fertigung von Linsen, die aberrationsfrei sind und deren Abbildungsqualität daher durch Dezentrierung kaum mehr beeinträchtigt wird (Altmann et al., 2005). Hinzu kommt, dass korneale Aberrationen belassen werden, was bei pseudophaken Augen der Tiefenschärfe zugute kommt und dementsprechend eine Pseudoakkommodation ermöglicht. (Nio et al., 2002) Neuste Entwicklungen zielen auf individuell anpassbare Intraokularlinsen ab, die unter Berücksichtigung der präoperativen Hornhauttopographie eine Auswahl der postoperativen sphärischen Aberrationen zulassen (Kohnen, Klaproth, 2008). 15 1.5 Optische Abbildung Betrachtet man die Physik der Optik so kann gesagt werden, dass die optische Abbildung die Projektion eines realen Objektes durch ein optisches System auf eine Bildebene ist. Zum optischen System gehört jede Materie zwischen Objekt und Bild, die mit dem zur Abbildung genutzten Licht wechselwirkt. Verschiedene mathematische Modelle beschreiben die Transformation des von einem Objekt ausgehenden Lichtes zu einer Abbildung. Diese wirken prinzipiell bei jeder Form von elektromagnetischer Strahlung, doch soll im Folgenden nur auf den Teil des Spektrums eingegangen werden, der für das menschliche Auge sichtbar ist. Neben den Gesetzen der einfachen geometrischen Optik, wie dem snelliusschen Brechungsgesetz, müssen zur vollständigen Erfassung der Vorgänge der optischen Abbildung auch die Prinzipien der Wellenoptik berücksichtigt werden. (Gerthsen, 2006) Da eine ideale Abbildung im optischen System nur für Bereiche sehr nah der optischen Achse möglich ist, entstehen im Auge unter natürlichen Bedingungen eine Reihe von Abbildungsfehlern, geometrische wie Unschärfe und Asymmetrie aber auch wellenoptische wie Beugungs- oder Wellenfrontfehler. Licht eines Bildpunktes, das durch eine enge Öffnung wie die Pupille fällt, erhält an deren Rand durch Beugung eine gewisse Unschärfe, so dass die Abbildung dieses Punktes zu einer konzentrischen Ringstruktur wird, Airy-Scheibchen genannt (siehe Abb. 5). Eine solche Abbildung, ohne weitere optische Abbildungsfehler, nennt man beugungsbegrenzt. Da die meisten im Auge vorkommenden Abbildung 5: Airy- oder Beugungsscheibchen optisch aktiven Strukturen allerdings eine annähernd sphärische Gestalt haben, d. h. rotationssymmetrischen Kugelschnitten ähneln, besitzt die Abbildung oben genannte Abbildungsfehler. Hinzu kommt die 16 Tatsache, dass das menschliche Auge nicht absolut perfekt und symmetrisch gebaut ist, sondern in jeder Oberfläche auch kleinere Ungleichmäßigkeiten aufweist. Dadurch wird die Wellenfront des durchtretenden Lichtes auf komplexe Weise deformiert. Um alle möglichen Abbildungsfehler auf eine einfache Weise zu beschreiben, entwickelte der Mathematiker und Physiker Fritz Zernike die nach ihm benannten Zernike-Polynome, nach denen sich alle Abbildungsfehler, einschließlich der Wellenfrontfehler höherer Ordnung, in ihre mathematischen Grundbausteine zerlegen lassen (siehe Abb. 6). Im Gegensatz zur Angabe reiner Wellenfrontfehler, z.B. mittels Wellenfrontkarten, lassen sich so die jeweiligen Abbildungsfehler als Zahlenwert oder Grafik getrennt darstellen. So beschreibt der Zernike-Koeffizient Z(4, 0) beispielsweise die sphärischen Aberrationen. (Kohnen, 2005) Die sphärische Kugelgestalts- Aberration, oder auch Öffnungsfehler, beschreibt den Umstand, dass Strahlen die weiter von der optischen Achse entfernt verlaufen eine andere Schnittweite haben als Strahlen die näher an der optischen Achse verlaufen. Die Abbildung erscheint dadurch zwar scharf, aber etwas weicher Abbildung 6: Zernike-Polynome und mit weniger Kontrast. Aus dem Zusammenhang zur Entfernung des jeweiligen Strahls zur optischen Achse wird klar, dass die sphärische Aberration im Auge mit steigendem Pupillendurchmesser ebenfalls größer wird. (Seiler, Mrochen, 2003) Sowohl die Hornhaut als auch die menschliche Linse besitzen eine etwas prolate Form, d. h. ihre Krümmung wird zum Rand hin etwas flacher, was eine Reduktion der sphärischen Aberrationen bewirkt (Kiely et al., 1982). Es konnte gezeigt werden, dass die Höhe der sphärischen Aberrationen bei einem großen Kollektiv im gesunden Auge nicht signifikant von Null abweichen. Die große Standardabweichung weist allerdings auf eine große individuelle Variabilität hin (Mrochen et al., 2004). Da aber ebenfalls 17 gezeigt wurde, dass die Hornhautvorderfläche allein, bei einem Betrachtungsradius von 6 mm, sphärische Aberrationen in Höhe von etwa 0,280 μm erzeugt, muss die menschliche Linse entgegengesetzte sphärische Aberrationen beisteuern, um die oben genannten von Null nicht signifikant abweichenden Werte zu erhalten (Wang et al., 2003). Am jungen Auge gelingt diese Kompensation noch gut, die natürliche menschliche Linse verändert sich mit dem Alter jedoch zu positiveren sphärischen Aberrationen, so dass die Höhe der sphärischen Aberrationen des Gesamtsystems Auge zunehmend relevant wird (Kohnen, Klaproth, 2008). Obwohl trotz mehrerer Studien der letzten Jahre der Zusammenhang zwischen Aberrationen höherer Ordnung und dem funktionellen Sehen noch nicht eindeutig geklärt werden konnte, legen die obigen Überlegungen nahe, dass eine Betrachtung der Aberrationen höherer Ordnung bei der Entwicklung implantierbarer Linsen nicht vernachlässigt werden sollte. 18 2 Ziel und Fragestellung In letzter Zeit sind bereits einige Studien und Untersuchungen durchgeführt worden, in denen die Designs mehrerer asphärischer Linsen kritisch diskutiert wurden. In der vorliegenden Arbeit soll im Rahmen einer Anwendungsbeobachtung die Intraokularlinse Akreos Adapt AO der Firma Bausch&Lomb untersucht werden. Das Hauptaugenmerk der Arbeit soll vor allem darauf gerichtet sein, ob und inwiefern bei Implantation einer aberrationsfreien Intraokularlinse die sphärischen Aberrationen von den Radien der Hornhauthauptschnitte, als Maß für den kornealen Anteil der sphärischen Aberrationen, beeinflusst werden. Zusätzlich soll untersucht werden, ob sich weitere Einflussfaktoren auf die sphärischen Aberration finden lassen und die funktionellen Ergebnisse der Linse in klinischer Anwendung bewertet werden. Gegenstand aktueller Forschung ist die Frage, ob eine individuell angepasste Intraokularlinse möglich bzw. sinnvoll ist und inwiefern sphärische Aberrationen das funktionelle Sehen beeinflussen. Diese Frage kann letztlich in der vorliegenden Arbeit nicht geklärt werden, allerdings soll in der Diskussion der Ergebnisse ein Überblick über den aktuellen Stand der Forschung gegeben werden. 19 3 Patienten, Material, Methodik 3.1 Patientenkollektiv In der vorliegenden Anwendungsbeobachtung wurden 36 Augen von 36 Patienten eingeschlossen. Aufgrund fehlender Compliance von fünf Patienten (fünf Augen) und dem Ausfall eines weiteren Patienten (ein Auge) im Rahmen einer Nachuntersuchung, konnten 30 Augen in die Auswertung aufgenommen werden. Alle Patienten wiesen eine operationswürdige Katarakt auf und gaben nach entsprechender Aufklärung ihr Einverständnis zur Teilnahme an der Anwendungsbeobachtung. An allen Augen wurde im Zeitraum von Januar bis März 2006 unter standardisierten Bedingungen und stets durch den gleichen Operateur eine extrakapsuläre Kataraktextraktion mit anschließender IOL-Implantation vorgenommen. Die Untersuchungen wurden im Juni 2006 abgeschlossen. Es galten folgende Ein- und Ausschlusskriterien: Es wurden nur Patienten aufgenommen, die zwischen 50 und 95 Jahre alt waren, eine operationswürdige Katarakt aufwiesen und keine wesentlichen anderen Augenerkrankungen hatten, insbesondere pathologische Hornhautbefunde, fortgeschrittene altersbedingte Makuladegeneration oder Amblyopien. Des Weiteren wurden nur Patienten in die Anwendungsbeobachtung eingeschlossen, die ausreichende kognitive Fähigkeiten aufwiesen, um bei den Untersuchungen zu kooperieren. Die Nachuntersuchungen wurden ausschließlich an Patienten mit komplikationslosem operativem und postoperativem Verlauf vorgenommen. Im Falle einer nicht mit der Implantation der Linse in Zusammenhang stehenden neu aufgetretenen Pathologie war der nachträgliche Ausschluss aus der Anwendungsbeobachtung vorgesehen, so dass ein 20 Patient (ein Auge) aufgrund einer neu aufgetretenen deutlichen Pigmentepithelverschiebung mit Pigmentepitheldefekten nachträglich ausgeschlossen werden musste. 3.2 Intraokularlinse Alle Patienten wurden im Rahmen der Anwendungsbeobachtung mit Linsen des Typs Akreos Adapt AO der Firma Bausch&Lomb versorgt (siehe Abb. 7 und Tab. 1). Die Linse besitzt eine monofokale Optik, d. h. sie besitzt nur einen umschriebenen Entfernungsbereich innerhalb dessen eine scharfe Abbildung möglich ist. Um Objekte außerhalb dieses Bereiches scharf darzustellen benötigt der Patient eine zusätzliche Brillenkorrektur. Abbildung 7: B&L Akreos Adapt AO Tabelle 1: Technische Details Akreos Adapt AO Bausch&Lomb IOL-Parameter Akreos Adapt AO Material Hydrophiles Acrylat mit UV-Absorber Brechungsindex 1,458 Optik Bikonvex, Durchmesser: 6,0 mm Haptiken Haptikanwinkelung 0° Verfügbare Dioptrien 10,0 – 30,0 dpt in 0,5 Schritten Gesamtdruchmesser 10,5 – 11,0 mm je nach Dioptrien A-Konstante 118,0 VK-Tiefe 4,96 mm 21 3.3 Ablauf und Untersuchungsmethoden Alle Patienten wurden einige Tage vor der Operation im ambulanten Operationszentrum der Augenklinik Mainz vorstellig und einer standardisierten Voruntersuchung unterzogen. Neben einer ausführlichen Anamnese, Sehschärfenbestimmung und Aufklärung des Patienten, wurde auch eine genaue Vermessung des Auges mit dem IOL Master der Firma Carl Zeiss, sowie eine eingehende ophthalmologische Untersuchung vorgenommen. Im Rahmen dieser Voruntersuchung wurde die Eignung des Patienten zur Aufnahme in die Anwendungsbeobachtung eingeschätzt. Waren die Einschlusskriterien erfüllt, wurde dem Patienten die Teilnahme an der Anwendungsbeobachtung vorgeschlagen und auf die eventuellen Fragen des Patienten dazu eingegangen. War das Einverständnis des Patienten gegeben, wurde im Anschluss an die Voruntersuchung eine Vermessung des vorderen Augenabschnittes und eine Wellenfrontmessung durchgeführt. Alle Patienten wurden unter standardisierten Bedingungen vom stets selben Operateur (Prof. B. Dick) nach der heute üblichen und unter 1.3 beschrieben Methode operiert. Alle Operationen verliefen ohne Komplikationen. Vier Wochen nach der Operation wurde eine erste Nachkontrolle vorgenommen, um den postoperativen Verlauf des Patienten zu beurteilen. Dazu wurde eine ausführliche ophthalmologische Untersuchung des operierten Auges durchgeführt, im Rahmen derer wie oben beschrieben, ein Patient nachträglich von der Anwendungsbeobachtung ausgeschlossen werden musste. Die für die Auswertung relevanten Nachuntersuchungen fanden frühestens zwei Monate nach Operation statt, da zu diesem Zeitpunkt mit einem stabilen Refraktionsergebnis und einer abgeschlossenen Kapselsackschrumpfung zu rechnen ist. Im Rahmen dieser Nachuntersuchung wurde eine Sehschärfen- und Refraktionsbestimmung durchgeführt, 22 sowie eine Vermessung des vorderen Augenabschnittes und eine Messung der Aberrationen des Auges. Die einzelnen Untersuchungsmethoden werden im folgenden genauer dargestellt. 3.3.1 Berechnung der IOL-Brechkraft und IOL-Auswahl Die Auswahl des Brechwertes der IOL erfolgte mit dem Gerät IOL Master der Firma Carl Zeiss. Es misst die Achslänge des Auges, sowie die Vorderkammertiefe und die beiden Hauptschnitte der Hornhaut. Im Gegensatz zur Vermessung des Auges per Ultraschall bietet die berührungslose Messung mit dem IOL Master einige Vorteile, da die Messung wesentlich genauer und darüber hinaus für den Patienten sehr viel angenehmer ist. (Hitzenberger et al., 1993, Goyal et al., 2003) Zur Messung der Achslänge wird das Prinzip der Teilkohärenz-Interferometrie angewandt. Bei diesem Verfahren wird von einer Laserdiode Infrarotlicht mit einer Wellenlänge von 780 nm und einer Kohärenzlänge von etwa 160 µm ausgesandt. In einem Michelson-Interferometer wird dieses in zwei parallele koaxiale Teilstrahlen unterschiedlicher Weglänge gespalten, die dann jeweils von Hornhautvorderfläche und Retina reflektiert werden. Ist die Weglänge der reflektierten Strahlen gleich, resultiert daraus eine messbare Interferenz. Während der Messung wird ein Spiegel des Interferometers mit konstanter Geschwindigkeit bewegt und das gemessene Signal als Funktion der Spiegelposition festgehalten, woraus sich dann die Achslänge des Auges berechnen lässt. Dieses Verfahren ist in Abhängigkeit der verwendeten Kohärenzlänge äußerst genau. Die Messung der Radien der Hornhauthauptschnitte sowie der Vorderkammertiefe basiert auf digitaler Bildauswertung. Im Falle der Hornhauthauptschnitte wird die Berechnung anhand der Reflektion von sechs Messpunkten auf der Hornhaut durchgeführt, während die Vorderkammertiefe aus einem Spaltlampenbild berechnet wird, als der Abstand zwischen der Linsenvorderfläche und der Hornhautvorderfläche. Auch diese Messungen sind äußerst genau. (Vogel et al., 2001) 23 Unter Zuhilfenahme der ermittelten Daten und der A-Konstante der vorgesehenen Intraokularlinse, kann dann mittels der SRK/T-Formel die IOL-Brechkraft berechnet werden, die nötig wäre um Emmetropie zu erreichen. In der Praxis wird allerdings meist eine IOL ausgewählt, die postoperativ eine leichte Myopie von etwa -0,5 dpt erzeugt, da so die Sehschärfe in den Nahbereich verlegt wird, und der Patient im Alltag meist auf eine Brille verzichten kann. Ist bei einem Patienten bereits ein Auge mit einer Intraokularlinse versorgt, wird dessen Refraktionsergebnis bei der Auswahl der einzusetzenden IOL berücksichtigt. Ebenso kann der Wunsch des Patienten berücksichtigt werden für den Nahbereich eine Brille zu tragen und dafür mehr Sehschärfe in der Ferne zu haben. 3.3.2 Refraktionsbestimmung und Sehschärfeprüfung Zur Ermittlung der funktionellen Sehleistung vor und nach der OP wurde unter standardisierten Bedingungen die Refraktion des Auges gemessen, sowie eine Sehschärfeprüfung zur Bestimmung des Fernvisus durchgeführt. Die Messung der Refraktion erfolgte zunächst mit dem Autorefraktometer der Firma Humphrey Instruments. Das Ergebnis dieser Messung wurde dann mittels einer subjektiven Prüfung mit Messbrille verifiziert oder zugunsten eines subjektiv besseren Wertes korrigiert. Die Bestimmung des Fernvisus erfolgte monokular und lediglich für das operierte Auge. Die Sehtafel wurde in 5 m Entfernung angeboten. Zunächst wurde der unkorrigierte Fernvisus ermittelt, im Anschluss daran der korrigierte Fernvisus, wobei als Korrektur die zuvor ermittelte subjektiv beste Brille benutzt wurde. Zur besseren Vergleichbarkeit wurden in der Auswertung die Refraktionsergebnisse als sphärisches Äquivalent dargestellt und die Messwerte der Sehschärfeprüfung gemäß DIN 58224 in Visusstufen umkodiert (siehe Tab. 2). 24 Tabelle 2: Visusstufe nach DIN 58224 und Sehschärfe Visusstufe 21 Sehschärfe 1,25 20 19 18 17 16 1 0,8 0,63 0,5 0,4 15 14 0,32 0,25 13 0,2 12 11 10 0,16 0,125 0,1 Abbildung 8: Untersuchungszimmer 3.3.3 Bestimmung der Vorderkammertiefe Die prä- und postoperative Messung der Vorderkammertiefe, sowie die Beurteilung des vorderen Augenabschnittes erfolgte mit der Scheimpflug-Kamera Pentacam der Firma Oculus (siehe Abb. 9). In einer rotierenden Messung wird dabei eine Serie von Scheimpflugbildern aufgenommen, mittels derer durch digitale Bildauswertung ein 3D-Modell des vorderen Augenabschnittes erstellt werden kann. Die Scheimpflugbilder entstehen durch die Spaltlichtbeleuchtung einer Schnittfläche von der Hornhautvorderfläche bis zur Rückfläche der Linse. Da diese Beleuchtung in einem Winkel von 45° erfolgt, muss die Aufnahme der Scheimpflug'schen Regel folgend ebenso mit einer um 45° gekippten Bildebene erfolgen, um ein 25 verzerrungsfreies Bild zu erhalten. (Konstantopoulos et al., 2007) Hierdurch wird eine Analyse des vorderen Augenabschnittes und der Vorderkammer ermöglicht. Die Vorderkammertiefe kann berechnet werden durch den Abstand zwischen dem Apex der Hornhaut und Vorderfläche der natürlichen bzw. künstlichen Linse. Die Bestimmung der postoperativen Vorderkammertiefe ermöglicht eine Aussage über die Linsenposition im Kapselsack. Abbildung 9: Oculus Pentacam 3.3.4 Messung der Aberrationen Die Bestimmung der sphärischen Aberrationen erfolgte mit dem WASCA Wavefront Analyzer der Firma Carl Zeiss Meditec (Jena). Die Messung erfolgt nach dem Prinzip von Shack-Hartmann, wobei mittels eines Lasers der Wellenlänge 835 nm eine Punktlichtquelle auf der Retina erzeugt wird. Das davon ausgesandte Licht wird auf dem Weg aus dem Auge zur Messeinheit, von allen im optischen System des Auges vorhandenen Aberrationen be- Abbildung 10: Carl Zeiss WASCA einflusst. 26 Diese verzerrte Wellenfront wird im Mikrolinsenarray des Shack-Hartmann-Sensors in viele Teilstrahlen zerlegt und als Punktmuster auf einem Detektor-CCD-Chip abgebildet (siehe Abb. 11) (Seiler, Mrochen, 2003). Während bei einem ideal emmetropen Auge alle Punkte des Punktmusters äquidistant liegen, führt die deformierte Wellenfront zu einer unregelmäßigen Verteilung der Punkte, aus der dann die Form der Wellenfront über der Pupille berechnet werden kann (Dick, Kaiser, 2002). Die Messungen erfolgten in medikamentöser Mydriasis, wobei die Messwerte zur besseren Vergleichbarkeit mit der Software des Geräts auf definierte Pupillendurchmesser umgerechnet wurden. Für die Höhe der Aberrationen besteht kein Unterschied zwischen natürlicher und medikamentöser Mydriasis. (Yang, Wu, 2007) Abbildung 11: Aberrometrie nach Shack-Hartmann Da die Höhe der gemessenen Aberrationen durch eine Vielzahl verschiedener Faktoren verfälscht werden kann, wurden von jeden Patienten mehrere Aufnahmen angefertigt und offensichtlich unplausible Ergebnisse verworfen. Im Gegensatz zu subjektiven Verfahren wie der Ermittlung der Kontrastempfindlichkeitskurve bietet die Aberrometrie den Vorteil, ausschließlich die optische Abbildungsgüte des Gesamtsystems Auge zu vermessen, ohne Störung durch die nachfolgende neuronale Verarbeitung. 27 3.4 Statistische Auswertung Die statistische Auswertung erfolgte unter Zuhilfenahme des Programms SPSS 17.0 für Windows lizenziert für die Johannes Gutenberg Universität Mainz. Verschiedene andere Berechnungen und Diagramme entstanden mit OpenOffice.org Calc 3.0.1. Die Deskription stetiger Größen erfolgte über nichtparametrische Lagemaße (Median, 1. und 3. Quartil, Minimum und Maximum), die entsprechende graphische Darstellung basiert auf nicht-parametrischen Boxplots. Die explorative Signifikanzanalyse der in der Arbeit bewerteten Zusammenhänge erfolgte mittels linearer Regression. Ein Zusammenhang mit einem p-Wert < 0,05 wurde als statistisch signifikant angesehen. Zur besseren Veranschaulichung wurden die möglichen Zusammenhänge zusätzlich mittels Streudiagrammen dargestellt. 28 4 Ergebnisse 4.1 Präoperative Ergebnisse 4.1.1 Allgemeine und patientenbezogene Daten Das in die Auswertung aufgenommene Patientenkollektiv umfasste 30 Patienten. Bei keinem der in die Auswertung aufgenommenen Patienten waren postoperative Komplikationen aufgetreten, alle wiesen eine gute Zentrierung der Linse auf und bei keinem Patienten wurde eine Hinterkapselfibrose festgestellt. Tabelle 3: Altersverteilung Anzahl [n] 30 Alter [Jahre] Median Minimum/Maximum Quartile 74 54/91 71/78 Geschlechtsverteilung Verteilung der Augen 70% 80% 60% 70% 60% 50% 50% 40% 40% 30% 30% 20% 20% 10% 10% 0% 0% männlich weiblich Abbildung 12: Geschlechtsverteilung rechts links Abbildung 13: Verteilung der Augen 29 Das Patientengut wies eine für Kataraktpatienten charakteristische Verteilung auf. Der jüngste Teilnehmer war 54 Jahre alt, der älteste 91, der Altersmedian lag bei 74 (siehe Tab. 3). Etwa 63% der teilnehmenden Patienten waren weiblich, 70% der eingeschlossenen Augen waren rechte Augen. (siehe Abb. 12 und Abb. 13) Die Brechkraft der implantierten Linsen lag im Median bei 21,5 dpt. Die geringste Brechkraft einer implantierten Linse betrug 17 dpt, die größte 25,5 dpt. (siehe Tab. 4) Tabelle 4: IOL-Brechkraft Anzahl [n] Brechkraft der IOL [dpt] 30 Median Quartile Minimum/Maximum 21,5 17,0/25,5 20,0/22,6 Wie oben beschrieben wurde bei den meisten Patienten eine leichte Myopie angestrebt. Lediglich bei drei Patienten (vier Augen) wurde eine stärkere Myopie gewählt, in zwei Fällen um im Vergleich zu einem bereits vorbehandelten Auge keine zu große Anisometropie zu erzeugen, im anderen Fall weil bei dem Patienten bereits präoperativ eine extreme Myopie bestand. Daraus folgt für die angestrebte, mittels SRK/T-Formel und einer A-Konstante von 118,0 berechnete, Zielrefraktion im Median ein sphärisches Äquivalent von -0,7 dpt, mit einem Minimum von -2,78 dpt und einem Maximum von 0,73 dpt. Tabelle 5: Zielrefraktion Anzahl [n] Zielrefraktion (sphärisches Äquivalent) [dpt] 30 Median Quartile -0,7 -0,92/-0,56 Minimum/Maximum -2,78/0,73 30 4.1.2 Morphologische Größen Die präoperative Vorderkammertiefe aller eingeschlossenen Augen lag zwischen 2,11 mm und 4,06 mm, der Median lag bei 3,05 mm. Die Achslänge der eingeschlossenen Auge betrug im Median 23,27 mm, bei etwa 66,7% der Augen wurde eine Achslänge zwischen 22,5 mm und 24,5 mm gemessen, was als normal angesehen werden kann. Kürzere Augen sind in Abhängigkeit vom Brechwert des dioptrischen Systems mit der Hornhaut als Hauptbestandteil meist hyperop, längere meist myop. (siehe Tab. 6) Tabelle 6: präoperative Vorderkammertiefe und Achslänge Anzahl [n] Vorderkammertiefe [mm] 30 Achslänge [mm] 30 Die mittels des IOL Masters Median Minimum/Maximum Quartile 3,05 2,11/4,06 2,88/3,29 23,27 22,75/23,69 gemessenen 21,89/26,04 präoperativen Radien der Hornhauthauptschnitte betrugen für den senkrechten im Median 7,80 mm, mit Werten im Bereich von 7,27 mm bis 8,58 mm, und für den horizontalen im Median 7,65 mm, mit Werten im Bereich von 7,04 mm bis 8,38 mm. (siehe Tab. 7) Tabelle 7: Hornhauthauptschnittradien Anzahl [n] Senkrechter Hornhauthauptschnitt [mm] Horizontaler Hornhauthauptschnitt [mm] 30 30 Median Quartile 7,80 7,68/7,94 7,65 7,55/7,79 Minimum/Maximum 7,27/8,58 7,04/8,38 31 4.1.3 Funktionelle Ergebnisse Bedingt durch den mit der Trübung der Linse einhergehenden Visusverlust, lag der nach DIN 58224 umkodierte unkorrigierte Visus aller Patienten im Median bei 15 (entsprechend einer Sehschärfe von 0,32), der beste Visus ohne Korrektur lag bei 18, der schlechteste bei 11 (entsprechend einer Sehschärfe von 0,125). Der präoperative korrigierte Visus wurde entweder mit der Brille des Patienten oder der stenopäischen Lücke beurteilt. Im Median lag der korrigierte Visus bei 17 nach DIN 58224 (entsprechend einer Sehschärfe von 0,5). Der beste korrigierte Visus betrug 20, der schlechteste 13. (siehe Abbildung 14: präoperativer Visus Abb. 14 und Tab. 8) Tabelle 8: präoperativer Visus Anzahl [n] Visus s.c. 30 Visus c.c. 30 Median Quartile 15 13/17 17 15/18 Minimum/Maximum 11/18 13/20 Obwohl durch die Katarakt sicherlich etwas verfälscht, wurde bei allen Patienten die präoperative Fehlsichtigkeit ermittelt. Im Median waren die Patienten mit 1,250 dpt leicht hyperop, die Extreme lagen bei etwa 3,6 dpt maximal und etwa -13,38 dpt als kleinstem Wert, wobei es sich bei letzterem um den bereits oben erwähnten sehr myopen Patienten handelt. (siehe Tab. 9) 32 Tabelle 9: präoperative Fehlsichtigkeit Anzahl [n] präoperative Fehlsichtigkeit (sphärisches Äquivalent) [dpt] 30 Median Quartile 1,250 -0,98/2,53 Minimum/Maximum -13,38/3,63 4.1.4 Sphärische Aberrationen Im Rahmen der präoperativen Voruntersuchung wurde bei allen Patienten eine Wellenfrontmessung durchgeführt. Aufgrund einer sehr fortgeschrittenen Katarakt konnten präoperativ lediglich bei 18 Patienten Messwerte erhoben werden. Tabelle 10: präoperative sphärische Aberrationen Anzahl [n] Pupillendurchmesser [mm] 18 Z(4,0) bei 5mm [µm] 15 Z(4,0) bei 4mm [µm] 15 Z(4,0) bei 3mm [µm] 16 Median Quartile 5,91 4,76/6,73 0,251 -0,088/0,409 0,164 0,081/0,212 0,092 0,030/0,125 Minimum/Maximum 2,66/6,97 -0,437/0,693 -0,112/0,289 -0,055/0,206 Die Messung wurde in medikamentöser Mydriasis durchgeführt, die Pupillenweite lag bei Messung im Median bei 5,91 mm. Zur besseren Vergleichbarkeit wurden dann die Messwerte wie oben beschrieben auf definierte Pupillendurchmesser umgerechnet. Bei drei Patienten konnte keine ausreichende Mydriasis erreicht werden, so dass nur die erfassbaren Werte berücksichtigt wurden oder sie aus der Auswertung ganz ausgeschlossen werden mussten. 33 Der Median für Z(4,0) lag für 5 mm Pupillendurchmesser bei 0,251 µm, für 4 mm bei 0,164 µm und für 3 mm bei 0,092 µm (siehe Abb. 15 und Tab. 10) Auffällig ist hierbei die teils enorme Streuung der Werte. Vor allem bei 5 mm Pupillendurchmesser liegen die Abbildung 15: präoperative sphärische Aberrationen Extremwerte sehr weit auseinander (0,693 µm und -0,437 µm), dies lässt sich sicherlich auch auf die durch die Katarakt veränderten Refraktionseigenschaften der Linse zurückführen. 34 4.1.5 Zusammenhänge präoperativer Größen Morphologische Größen Zwischen der mittels des IOL Masters gemessenen Achslänge des Auges und Vorderkammertiefe konnte eine positive Korrelation gezeigt werden. Unabhängig vom Stadium der Katarakt wurden mit zunehmender Achslänge eine größere Vorderkammertiefe gemessen. Der Korrelationskoeffizient betrug 0,551, und kann mit p=0,002 als signifikant angesehen werden (siehe Abb. 16). Ebenso konnte sowohl zwischen der Achslänge des Auges und Hornhauthauptschnittradien als auch zwischen den Radien der Abbildung 16: Korrelation: Achslänge zu Vorderkammertiefe Hauptschnitte untereinander eine enge Korrelation gezeigt werden. Mit zunehmender Achslänge wurden auch größere Radien, also flachere Hornhäute gemessen. Abbildung 17: Korrelation: Achslänge zu Hornhauthauptschnitt Abbildung 18: Korrelation: Hornhauthauptschnitte 35 Hierbei zeigte sich erwartungsgemäß, dass insbesondere die Radien der Hornhauthauptschnitte untereinander sehr eng korreliert sind (r=0,885, p<0,001). Die Korrelation der Achslänge mit dem senkrechten Hauptschnittradius zeigte sich weniger eng (r=0,382) aber weiterhin signifikant (p=0,037). (siehe Abb. 17 und Abb. 18) Im Gegensatz dazu zeigte sich zwischen der präoperativen Vorderkammertiefe und dem senkrechten Hornhauthauptschnittradius keine Korrelation (r=0,040, p=0,834) (siehe Abb. 19). Abbildung 19: Korrelation: Vorderkammertiefe zu Hornhauthauptschnitt Brechwerte der IOL Entsprechend der in die Formel zur Auswahl der IOL einfließenden Daten konnte eine enge und höchst signifikante Korrelation sowohl zwischen Achslänge des Auges und Brechwert der einzusetzenden IOL als auch zwischen präoperativer Vorderkammertiefe und IOL-Brechwert gezeigt werden. Abbildung 20: Korrelation: Achslänge zu IOLStärke Abbildung 21: Korrelation: Vorderkammertiefe zu IOL-Stärke 36 Längeren Augen wurden dabei mit Linsen kleinerer Brechkraft versorgt (r=0,863, p<0,001) (siehe Abb. 20). Der Zusammenhang der präoperativen Vorderkammertiefe mit der Brechkraft der IOL ist hingegen kein direkter, sondern muss vielmehr über die Korrelation der Achslänge des Auges mit der präoperativen Vorderkammertiefe erklärt werden. Dementsprechend war diese Korrelation nicht ganz so eng, aber weiterhin signifikant (r=0,577, p=0,001) (siehe Abb. 21). Zwischen den Hornhauthaupt- schnitten und der Brechkraft bestand hingegen keinerlei Korrelation (r=0,018, p=0,924) (siehe Abb. 22). Abbildung 22: Korrelation: Hornhauthauptschnitt zu IOL-Stärke Sphärische Aberrationen Entsprechend der großen Streuung der präoperativen sphärischen Aberrationen und der unterschiedlich fortgeschrittenen Stadien der Katarakte bestand präoperativ keine Korrelation zwischen der Höhe der sphärischen Aberrationen und den Radien der Hornhauthauptschnitte (r=0,151, p=0,591) (siehe Abb. 23). Die Radien der Hornhauthaupt- schnitte können als stellvertretend für die Brechkraft der Hornhaut und die Steilheit am Rande der Hornhaut und somit als der wesentlichste Einflussfaktoren auf die sphärischen Aberrationen angesehen werden. Abbildung 23: Korrelation: Hornhauthauptschnitt zu sphärischen Aberrationen 37 Da sphärische Aberrationen vor allem im Randbereich der Hornhaut zum Tragen kommen, ist zu erwarten, dass eventuelle Korrelationen bei Betrachtung größerer Pupillendurchmesser am deutlichsten zu sehen sind. Aus diesem Grund kann hier eine fehlende Korrelation des senkrechten Hornhauthauptschnittes mit der Höhe sphärischer Aberrationen bei 5 mm Pupillendurchmesser als ausreichend angesehen werden. 4.2 Postoperative Ergebnisse 4.2.1 Morphologische Größen Aufgrund der heute sehr fortschrittlichen und atraumatischen Operationstechnik kann angenommen werden, dass sich durch die Operation weder die Achslänge des Auges noch die Radien der Hornhauthauptschnitte ändern. Da die Operation bei allen Patienten ohne nennenswerte Komplikationen verlief und es bei keinem Patienten in den Nachuntersuchungen Anlass zur Vermutung gab, dass sich an der Morphologie des Auges etwas geändert haben könnte, werden im Folgenden die präoperativ für Achslänge und Hornhauthauptschnittradien gemessenen Werte ohne Einschränkung als weiterhin gültig angesehen. Einzig die Vorderkammertiefe änderte sich bedingt durch die Linsenextraktion und anschließende Implantation der Kunstlinse. Hierbei spielt die postoperative Vorderkammertiefe eine wichtige Rolle zur Beurteilung der regelrechten Lage der IOL im Kapselsack. Die optimale postoperative Vorderkammertiefe wird vom Hersteller mit 4,96 mm angegeben. Im Median lag die postoperative Vorderkammertiefe im untersuchten Patientenkollektiv bei 4,94 mm und somit nicht relevant von der Zielvorgabe des Herstellers entfernt. Nur sehr wenige Patienten wiesen größere Abweichungen auf. (siehe Tab. 11) 38 Tabelle 11: postoperative Vorderkammertiefe Anzahl [n] Vorderkammertiefe [mm] 30 Median Quartile 4,94 4,86/5,04 Minimum/Maximum 4,36/5,44 4.2.2 Funktionelle Ergebnisse Entsprechend der durch die Entfernung der trüben Linse zurückgewonnenen unbehinderten Sehkraft zeigte sich bei allen Patienten postoperativ eine erhebliche Verbesserung des Visus. Der Median für den unkorrigierten Visus lag bei 18,5 nach DIN 58224 (ungefähr einer Sehschärfe von 0,63 entsprechend) und für den bestmöglich korrigierten Visus bei 20 (entsprechend einer Sehschärfe von 1) (siehe Abb. 24 und Tab. 12). Der vergleichsweise niedrige unkorrigierte Visus lässt sich dadurch erklären, dass fast alle Patienten postoperativ myop waren. Abbildung 24: postoperativer Visus Tabelle 12: postoperativer Visus Anzahl [n] Visus s.c. 30 Visus c.c. 30 Median Quartile 18,5 18/20 20 19/20 Minimum/Maximum 13/20 16/22 39 Wie oben beschrieben lag die angestrebte, mittels SRK/T-Formel mit einer A-Konstante von 118,0 berechnete, Zielrefraktion im Median bei -0,7 dpt. Die tatsächlichen postoperativen Refraktionsergebnisse wichen leicht davon ab, so dass der Median der Refraktion postoperativ bei -0,375 dpt lag mit einem Minimum von -3,50 dpt und einem Maximum von 0,50 dpt (siehe Abb. 25). Damit betrug die Abweichung von der Zielrefraktion im Median 0,252 dpt mit Extremwerten von 1,01 dpt als Abbildung 25: Refraktive Ergebnisse Maximum und -0,94 dpt als Minimum (siehe Tab. 13). Diese Abweichungen sind allerdings so gering, dass ihnen keine klinische Relevanz zukommt. Tabelle 13: postoperative Fehlsichtigkeit und Abweichung von Zielrefraktion Anzahl [n] postoperative Fehlsichtigkeit (sphärisches Äquivalent) [dpt] 30 Abweichung von der Zielrefraktion (sphärisches Äquivalent) [dpt] 30 Median Quartile -0,375 -0,75/-0,22 0,252 0,05/0,40 Minimum/Maximum -3,50/0,50 -0,94/1,01 40 4.2.3 Sphärische Aberrationen Im Gegensatz zur präoperativ beobachteten großen Streuung der sphärischen Aberrationen lagen die Werte postoperativ sehr eng beieinander. Auch bei den postoperativen Messungen konnte bei einem Patienten keine ausreichende Mydriasis erreicht werden, so dass dieser aus der Auswertung ausgeschlossen werden musste. Der Abbildung 26: postoperative sphärische Aberrationen Median für die Pupillendurchmesser lag bei diesen Messungen bei 5,57 mm. Der Median der sphärischen Aberrationen lag postoperativ für 5 mm bei 0,356 µm, für 4 mm bei 0,145 µm und für 3 mm bei 0,015 µm (siehe Abb. 26 und Tab. 14). Tabelle 14: postoperative sphärische Aberrationen Anzahl [n] Pupillendurchmesser [mm] 30 Z(4,0) bei 5mm [µm] 29 Z(4,0) bei 4mm [µm] 29 Z(4,0) bei 3mm [µm] 29 Median Quartile 5,57 5,44/5,80 0,356 0,316/0,417 0,145 0,108/0,175 0,015 -0,009/0,041 Minimum/Maximum 2,92/6,04 0,082/0,614 -0,022/0,276 -0,138/0,075 41 4.2.4 Zusammenhänge postoperativer Größen Abweichungen von der Zielrefraktion In Bezug auf die Abweichungen der postoperativen refraktiven Ergebnisse der Patienten im Vergleich zur Zielrefraktion konnte zu keiner der untersuchten Größen ein signifikanter Zusammenhang gezeigt werden. Für die Korrelation der Zielrefraktion mit der Abweichung davon galt r=0,253 mit p=0,177 und für die Korrelation der Achslänge mit der Abweichung von der Zielrefraktion r=0,205 mit p=0,276 (siehe Abb. 27 und Abb. 28). Abbildung 27: Korrelation: Achslänge zu Abweichung von Zielrefraktion Abbildung 28: Korrelation: Zielrefraktion zu Abweichung von Zielrefraktion Alle weiteren Zusammenhänge waren ebenso wenig signifikant, so galt für die Korrelation der IOL-Brechkraft mit der Abweichung von der Zielrefraktion r=0,178 mit p=0,348, für die Korrelation der postoperativen Vorderkammertiefe weichung von der mit der Ab- Zielrefraktion Abbildung 29: Korrelation: IOL-Stärke zu Abweichung von Zielrefraktion r=0,042 mit p=0,824. 42 Ebenso wenig korreliert zeigte sich der Zusammenhang zwischen dem senkrechten Hornhauthauptschnittradius und der Abweichung von der Zielrefraktion, hier galt r=0,072 mit p=0,704. (siehe Abb. 29, Abb. 30 und Abb. 31) Abbildung 30: Korrelation: Vorderkammer-tiefe zu Abweichung von Zielrefraktion Abbildung 31: Korrelation: Hornhauthauptschnitt zu Abweichung von Zielrefraktion Sphärische Aberrationen Da das besondere Augenmerk der vorliegenden Arbeit vor allem auf der Suche nach Korrelationen zu den postoperativen sphärischen Aberrationen lag, wurden diese mittels linearer Regressionen mit allen in Frage kommenden Einflussfaktoren verglichen. Dabei zeigten sich keine signifikanten Korrelationen außer mit den Radien der Hornhauthauptschnitte. Für den Zusammenhang der sphärischen Aberrationen mit der postoperativen Vorderkammertiefe betrug der Korrelationskoeffizient 0,232 bei einem p-Wert von 0,226, für die Korrelation der Achslänge des Auges mit der Höhe der postoperativen sphärischen Aberrationen lag r bei 0,051 mit einem p-Wert von 0,791 (siehe Abb. 32 und Abb. 33). 43 Abbildung 32: Korrelation: Vorderkammer-tiefe zu sphärischen Aberrationen Abbildung 33: Korrelation: Achslänge zu sphärischen Aberrationen Ebenso wenig konnte eine Korrelation der Höhe der sphärischen Aberrationen mit der Brechkraft der gewählten IOL gezeigt werden, hier betrug r 0,151 mit einem p-Wert von 0,434 (siehe Abb. 34). Im Gegensatz dazu zeigte sich ein relativ enger und signifikanter Zusammenhang zwischen den Radien der Hornhauthauptschnitte und der Höhe der postoperativen sphärischen Aberrationen, wobei der senkrechte Hauptschnitt noch etwas enger korrelierte als der horizontale. Diese Korrelation lag sowohl bei fünf als auch bei vier Millimetern Pupillen- Abbildung 34: Korrelation: IOL-Stärke zu sphärischen Aberrationen durchmesser vor, wohingegen eine signifikante Korrelation bei 3 mm Pupillendurchmesser nicht mehr vorhanden war. 44 Für den Zusammenhang zwischen horizontalem und der Hornhauthauptschnitt Höhe der sphärischen Aberrationen bei 5 mm Pupillendurchmesser ergab sich eine Korrelation mit r=0,404 und p=0,030, die somit als signifikant gelten kann (siehe Abb. 35). Abbildung 35: Korrelation: Horizontaler Hornhauthauptschnitt zu sphärischen Aberrationen Die engsten Zusammenhänge zeigten sich zwischen der Höhe der sphärischen Aberrationen und dem senkrechten Hornhauthauptschnitt. Dabei war die Korrelation je nach betrachtetem virtuellem Pupillendurchmesser unterschiedlich eng und signifikant. Alle Korrelationen zeigten, dass bei kleineren Hornhauthauptschnittradien vom Betrag her größere, das heißt negativere, sphärische Aberrationen gemessen betrachteten wurden. Bei größeren Pupillendurchmessern waren die Korrelationen sowohl enger als auch deutlicher signifikant. Abbildung 36: Korrelation: Senkrechter Hornhauthauptschnitt zu sphärischen Aberrationen Wie schon für den Zusammenhang zwischen dem waagrechten Hornhauthauptschnitt und der Höhe der sphärischen Aberrationen bei 5 mm betrachtetem Pupillendurchmesser, konnte auch für den senkrechten Hornhauthauptschnitt eine signifikante Korrelation mit einem Korrelationskoeffizienten von r=0,515 und p=0,004 gezeigt werden (siehe Abb. 36). 45 Für 4 mm betrachtetem Pupillendurchmesser war die Korrelation fast ebenso eng und signifikant. Hier lag r bei 0,470 mit einem p-Wert von p=0,010. (siehe Abb. 37) Im Gegensatz dazu war bei einem betrachteten Pupillendurchmesser von 3 mm bereits keine ausreichende Signifikanz mehr zu zeigen. Hier lag der Korrelationskoeffizient bei 0,344 mit p=0,067 (siehe Abb. 38). Abbildung 37: Korrelation: Senkrechter Hornhauthauptschnitt zu sphärischen Aberrationen Abbildung 38: Korrelation: Senkrechter Hornhauthauptschnitt zu sphärischen Aberrationen 46 5 Diskussion Im Sinne einer für den Patienten bestmöglichen optischen Rehabilitation nach erfolgreicher Kataraktoperation sind mehrere Faktoren von entscheidender Relevanz. Das sicherlich wichtigste Ziel ist die Wiederherstellung einer optimalen Sehschärfe, um den alltäglichen Anforderungen gerecht zu werden. Dieses Ziel konnte bereits früh erreicht werden, und die Ergebnisse herkömmlicher sphärischer Linsen unterscheiden sich in in Bezug auf diese Fragestellung in keinster Weise von den Ergebnissen neuerer Generationen von Linsen. Auch die in der vorliegenden Arbeit untersuchte Linse zeigte exzellente funktionelle Ergebnisse. Erreichten die Patienten präoperativ im Median lediglich eine bestmöglich korrigierte Sehschärfe von 0,5, konnten sie nach der Entfernung der Katarakt und Implantation der Linse im Median einen korrigierten Visus von 1,0 erreichen, ein Patient erreichte sogar eine Sehschärfe darüber. Für die refraktiven Ergebnisse kann gesagt werden, dass, trotz einer Abweichung von im Median 0,252 dpt von der Zielrefraktion, die Berechnungen ausreichend exakt waren und keine statistisch signifikante Fehlerquelle gefunden werden konnte. Insbesondere war die Abweichung von der Zielrefraktion nicht mit der postoperativen Vorderkammertiefe korreliert, die bis auf wenige Ausnahmen sehr genau mit der vom Hersteller angegebenen Zielvorderkammertiefe übereinstimmte. Diese Abweichungen von der Zielrefraktion stellen allerdings keine nennenswerte Beeinträchtigung für den Patienten dar, da die postoperative Fehlsichtigkeit in der Praxis durch das Tragen einer Brille einfach kompensiert werden kann. In den meisten Fällen wird ohnehin eine leichte postoperative Myopie geplant, für die der Patient postoperativ eine Brille benötigt. 47 Trotz der nach einer Kataraktoperation wiederhergestellten Sehfähigkeit zeigte sich im Laufe der Zeit, dass Patienten, die mit herkömmlichen sphärischen Linsen versorgt worden waren, vermehrt über Blendungserscheinungen und herabgesetzte Kontrastempfindlichkeit bei schwachen Lichtverhältnissen klagten. (Casprini et al., 2005) Durch die Entwicklung asphärischer Linsen konnten diese Probleme zum Teil bereits mit gutem Erfolg beseitigt werden (Ohtani et al., 2009). Auch für die in der vorliegenden Arbeit untersuchte Linse konnten bereits andere Studien in Bezug auf die Blendungsproblematik exzellente Ergebnisse zeigen. So wurde in einer großen Studie gezeigt, dass Patienten, die mit der hier untersuchten Linse versorgt wurden, signifikant weniger über Blendungserscheinungen klagten als Patienten bei denen eine herkömmliche sphärische IOL implantiert worden war (Radford et al., 2007). Dies ist allerdings nur bedingt im Zusammenhang mit den sphärischen Aberrationen zu sehen, da hierfür nicht nur die optischen Eigenschaften der Linse verantwortlich sind, sondern auch Materialeigenschaften eine Rolle spielen. (Tester et al., 2000) Allerdings warf die Entwicklung asphärischer Linsen, die die sphärischen Aberrationen der Hornhaut ausgleichen sollten, ein neues Problem auf. Patienten mit stark vom Durchschnitt abweichenden Hornhäuten erfuhren durch die Implantation einer asphärischen Linse mehr Nach- als Vorteile, da bei der Entwicklung der Linsen ein auf Durchschnittswerten eines bestimmten Patientenkollektives basierendes Hornhautmodell gewählt wurde. (Holladay et al., 2002, Piers et al., 2004, Atchison, 1991) Die in der vorliegenden Arbeit untersuchte Linse verfolgt also ein anderes Prinzip im Umgang mit den sphärischen Aberrationen. Sie belässt den kornealen Anteil der sphärischen Aberration unkorrigiert, und beschränkt sich darauf, im Gegensatz zu den herkömmlichen sphärischen Linsen, keine neuen Aberrationen hinzuzufügen. Dies könnte sich auch insofern als sinnvoll erweisen, als gezeigt werden konnte, dass optische Aberrationen nur am Ort ihres Entstehens sinnvoll korrigiert werden können. So werden dem Gesamtsystem des Auges durch eine Korrektur der kornealen sphärischen Aberrationen mittels einer implantierbaren Linse andere neue Aberrationen hinzugefügt. (Preußner, 2004) 48 Es sollte also in der vorliegenden Arbeit gezeigt werden, dass die vorliegende Linse tatsächlich vom Patientenprofil unabhängig den kornealen Anteil der sphärischen Aberrationen belässt und keine zusätzlichen sphärischen Aberrationen induziert. Hierzu sollten die sphärischen Aberrationen auf statistische Zusammenhänge mit der Morphologie des Auges untersucht werden. Um eine zuverlässige Aussage zu ermöglichen, müssen zunächst die präoperativ ermittelten Daten bewertet werden. Für alle ermittelten morphologischen Größen zeigt sich eine gute Übereinstimmung des Medians mit in der Literatur angegebenen Werten. Sowohl für die Achslänge als auch für die präoperative Vorderkammertiefe wurden einige wenige Extremwerte gemessen, denen allerdings insofern keine gesonderte Aufmerksamkeit zukommt, als die Achslänge bei der Betrachtung der sphärischen Aberrationen keinen eigenen Einflussfaktor darstellt, sondern vielmehr über die in 4.1.5 dargestellten Zusammenhänge indirekt zum Tragen kommt. Die Extremwerte der präoperativen Vorderkammertiefe finden nur insofern Eingang in die Bewertung, als Patienten mit einer großen präoperativen Vorderkammertiefe auch postoperativ meist eine große Vorderkammertiefe besaßen. Die Höhe der präoperativen sphärischen Aberrationen selbst zeigte erwartungsgemäß eine hohe Streuung, was vor allem durch die unterschiedlichen Ausprägung der Katarakt erklärt werden kann (Lee et al. 2008). Für die Radien der Hornhauthauptschnitte konnte ebenso eine gute Übereinstimmung der Mediane mit Literaturwerten gezeigt werden. In der Literatur wird als mittlerer Hornhautradius 7,72 ± 0,27 mm angegeben, was sich sehr gut mit dem Median des senkrechten Hornhauthauptschnittes deckt, der hier bei 7,80 ± 0,13 mm lag. (Kiely et al., 1982) Diese Messungen wurden lediglich präoperativ vorgenommen, können aber auch für die postoperative Situation als gültig angesehen werden, da die heutzutage verwendete Operationstechnik, keine größeren Veränderungen der Hornhaut verursacht. (Merriam et al., 2003, Guirao et al., 2004) Auch die in 4.1.5 gezeigten Zusammenhänge zwischen Achslänge, Vorderkammertiefe und Hornhauthauptschnittradien decken sich mit den Angaben in der Literatur. (Llorente et al., 2004) 49 Im Folgenden werden die Radien der Hornhauthauptschnitte als Maß der durch die Hornhaut induzierten sphärischen Aberrationen angesehen. Es kann angenommen werden, dass eine Hornhaut mit größerem Hauptschnittradius zum Randbereich hin flacher ausläuft als eine Hornhaut mit kleinerem Hauptschnittradius. Da die Höhe der sphärische Aberrationen maßgeblich von der Steilheit im Randbereich eines optischen Elementes bestimmt wird, kann der Zusammenhang zwischen Hornhauthauptschnittradien und kornealen sphärischen Aberrationen als gültig angesehen werden. Ähnliches lässt sich ebenfalls in der Literatur finden. (Gatinel et al., 2002) Betrachtet man nun die sphärischen Aberrationen zeigt sich deutlich, dass die untersuchte IOL, im Gegensatz zu anderen Linsen, den Anteil der durch die Hornhaut induzierten sphärischen Aberrationen in keinster Weise korrigiert. Für korrigierende asphärische Linsen konnte am Beispiel der Tecnis Z9000 gezeigt werden, dass für dem Durchschnitt entsprechenden Augen die sphärischen Aberrationen fast eliminiert werden können (Mester et al., 2003). Herkömmliche sphärische IOL hingegen gleichen die sphärischen Aberrationen nicht aus, so dass postoperativ im Median Werte um die 0,25 μm für 4 mm Pupillendurchmesser und 0,37 μm für 6 mm Pupillendurchmesser gemessen wurden (Padmanabhan et al., 2006, Rocha et al., 2006). In der vorliegenden Arbeit konnten für die untersuchte Linse etwas niedrigere Werte gemessen werden, vor allem für 4mm Pupillendurchmesser wird der Unterschied deutlich. So beträgt die Höhe der sphärischen Aberrationen hier im Median mit 0,142 μm und somit lediglich knapp 60% im Vergleich mit einer sphärischen Linse. Besonders hervorgehoben werden soll aber eine andere Auffälligkeit der vorliegenden Arbeit. Während sowohl bei herkömmlichen sphärischen Linsen als auch bei korrigierenden asphärischen Linsen die Höhe der sphärischen Aberrationen in großem Maße von der Brechkraft der implantierten Linse abhängt, zeigte sich dieser Zusammenhang für die hier untersuchte Linse nicht (Rocha et al., 2006). In der vorliegenden Arbeit zeigte sich die Höhe der sphärischen Aberrationen als allein von den Radien der Hornhauthauptschnitte abhängig. Zwar sind die Radien der Hornhauthauptschnitte mit der Achslänge des Auges und diese wiederum mit der Stärke 50 der implantierten Linse korreliert, doch zeigten sich wie bereits beschrieben lediglich die oben genannten Korrelationen als signifikant. Daraus kann geschlossen werden, dass die postoperative Höhe der sphärischen Aberrationen nach Implantation einer B&L Akreos Adapt einzig von der Höhe der durch die Hornhaut induzierten sphärischen Aberrationen abhängt. Dies stellt einen wesentlichen Vorteil gegenüber anderen Linsen dar, da so auch bei Patienten mit vom Durchschnitt abweichenden Hornhäuten ein relativ gutes Ergebnis erzielt werden kann. Ein weiterer Vorteil besteht darin, dass die durch die Linse induzierten Aberrationen minimiert sind, und somit eine weitere Interaktion zwischen Aberrationen der Linse und Aberrationen der Hornhaut vermieden werden kann. So konnte beispielsweise gezeigt werden, dass insbesondere die sphärischen Aberrationen im Zusammenspiel mit anderen Aberrationen einen erheblichen verschlechternden Einfluss auf die Sehschärfe nehmen können. (Applegate et al., 2003) Die genauen Zusammenhänge zwischen Aberrationen höherer Ordnung und dem funktionellen Sehen sind noch nicht bis ins letzte Detail eindeutig geklärt. Man kann jedoch voraussetzen, dass eine höhere optische Qualität zu einer besseren Abbildung auf der Retina und somit zu einer besseren Sehleistung führt. Während die sphärischen Aberrationen der jugendlichen Linse fast vollständig durch die sphärischen Aberrationen der Hornhaut kompensiert werden, ändern sich die sphärischen Aberrationen der Linse im Alter, wodurch diese nicht mehr durch die Kornea ausgeglichen werden können. Ebenso nimmt die Kontrastempfindlichkeit im Alter ab, so dass man hieraus einen Zusammenhang ableitete. (McLellan et al., 2001) Da sich jedoch in optischen Systemen stets alle Aberrationen überlagern, kann man annehmen, dass die alleinige Betrachtung der sphärischen Aberrationen nicht ausreicht. Vielmehr müssten in weiteren Arbeiten, wie oben bereits angesprochen, sämtliche Aberrationen und deren Interaktionen betrachtet werden. Zusammenfassend lässt sich sagen, dass der von der in der vorliegenden Arbeit untersuchten Linse verfolgte Ansatz eine sinnvolle Alternative zu den korrigierenden 51 asphärischen Linsen darstellt. Durch eine Minimierung der durch die Linse induzierten Aberrationen können Über- bzw. Unterkorrekturen sphärischer Aberrationen bei Patienten mit vom Durchschnitt abweichenden Hornhäuten vermieden werden. Ein weiterer Vorteil besteht in der, im Gegensatz zu Linsen mit korrigierenden sphärischen Aberrationen, weitestgehenden Unempfindlichkeit gegen Dezentrierung und einer gewissen Tiefenschärfe durch Belassen der kornealen sphärischen Aberrationen. Hinzu kommt, dass Aberrationen am besten an der Stelle des Entstehens korrigiert werden können, da sonst neue Aberrationen induziert werden. Es könnte sich also als sinnvoll erweisen, möglichst aberrationsfreie Linsen herzustellen und eventuelle korneale Aberrationen an der Hornhaut selbst zu korrigieren, wofür heute bereits die Möglichkeit besteht (Awwad, McCulley, 2006). 5.1 Kritische Würdigung Abschließend muss die Frage gestellt werden, welche Nachteile durch die Implantation einer B&L Adapt AO entstehen. Prinzipiell zeigten sich in der vorliegenden Arbeit und im Vergleich mit der Literatur keine wesentlichen Nachteile für die Patienten. Hinsichtlich der Vorteile im Vergleich zu einer herkömmlichen sphärischen Linse, oder einer korrigierenden asphärischen Linse, legt die vorliegende Arbeit zwar tendenziell eine Überlegenheit nahe, diese sollte jedoch durch weitere Studien überprüft werden, da in der vorliegenden Arbeit die Zahl der eingeschlossenen Patienten relativ gering war und die Ergebnisse daher lediglich als Tendenz zu werten sind. Ebenso sollte bei weiteren Studien das Augenmerk auch auf andere Aberrationen höherer Ordnung gerichtet werden, da die funktionelle Sehleistung, wenn auch durch die sphärischen Aberrationen wohl mit am wesentlichsten, auch von anderen Aberrationen beeinflusst werden kann. 52 Ein weiterer Kritikpunkt ist, dass in der vorliegenden Arbeit die Hornhauthauptschnittradien als Maß für den kornealen Beitrag der sphärischen Aberrationen betrachtet wurden, was sicherlich lediglich als Näherung zutrifft. Ebenso war die Zahl der Patienten mit deutlich außerhalb des Durchschnitts liegenden Messwerten hinsichtlich der bewerteten Parameter zu klein, um dazu eine deutliche Aussage treffen zu können. Ein weiterer, wenn auch aus medizinischer Sicht untergeordneter Punkt, der diskutiert werden sollte, sind die Kosten der Linse, deren Preis zum Zeitpunkt der Untersuchung in etwa das Dreifache des Preises einer herkömmlichen Linse betrug, so dass eine Implantation nur bei solchen Patienten in Betracht zu ziehen ist, die dadurch eine relevant bessere Sehleistung zu erwarten haben. Zuletzt soll erwähnt werden, dass die untersuchte Linse einen interessanten Weg in der aktuellen Debatte um individuell angepasste Linsen aufzeigen könnte. Statt der aufwendigen Fertigung individueller Linsen, oder z.B. der nachträglichen Anpassung einer lichtempfindlichen Linse per Beleuchtung, stellt die Fertigung möglichst absolut aberrationsfreier Linsen und der nachträglichen Korrektur kornealer Aberrationen an der Kornea selbst möglicherweise eine gute Alternative dar. 53 6 Zusammenfassung Die Suche nach einer für möglichst viele Patienten optimalen Intraokularlinse hat mit der Entwicklung nicht-korrigierend asphärischer Linsen eine neue interessante Richtung eingeschlagen. Bereits seit längerer Zeit ist bekannt, dass sich der im Laufe des Lebens zunehmende Betrag sphärischer Aberrationen verschlechternd auf das Sehen auswirken kann. Seitdem gewinnen die optischen Aberrationen höherer Ordnung zunehmend an Beachtung. Die bisherigen Entwicklungen zielten vor allem darauf ab mit der implantierten Linse die kornealen sphärischen Aberrationen zu korrigieren, was trotz der offensichtlichen Vorteile auch einige Nachteile birgt. Ziel der vorliegenden Untersuchung war es zu überprüfen ob durch ein nichtkorrigierend asphärisches Design tatsächlich keine zusätzlichen sphärischen Aberrationen induziert werden und Zusammenhänge zwischen morphologischen Größen und der postoperativen Höhe der sphärischen Aberrationen zu überprüfen. Dabei zeigte sich, dass bei Implantation einer nicht-korrigierend asphärischen Linse, wie der untersuchten, die Höhe der postoperativen sphärischen Aberrationen stark negativ mit den Hornhauthauptschnittradien korreliert ist, während für alle anderen Parameter kein Zusammenhang existiert. Im Gegensatz zu korrigierenden asphärischen Linsen, belassen aberrationsfreie nichtkorrigierend asphärische Linsen den kornealen Anteil der sphärischen Aberrationen unverändert und induzieren keine zusätzlichen Aberrationen. Dies gewährt ein weitestgehend vom Patient unabhängig gleich bleibendes Ergebnis, eine höhere Toleranz gegen Verkippungen und eine relativ gute Pseudoakkommodation. 54 7 Literaturverzeichnis Altmann, G. E., Nichamin, L. D., Lane, S. S., Pepose, J. S. (2005). Optical performance of 3 intraocular lens designs in the presence of decentration. J Cataract Refract Surg. 31(3), 574-585 Applegate, R. A. (2000). Limits to vision: can we do better than nature? J Refract Surg. 16(5), 547-551 Applegate, R. A., Marsack, J. D., Ramos, R., Sarver, E. J. (2003). Interaction between aberrations to improve or reduce visual performance. J Cataract Refract Surg. 29(8), 1487-1495 Atchison, D. A. (1991). Design of aspheric intraocular lenses. Ophthalmic Physiol Opt. 11(2), 137-146 Awwad, S. T., McCulley, J. P. (2006). Wavefront-guided LASIK: recent developments and results. Int Ophthalmol Clin. 46(3), 27-38 Casprini, F., Balestrazzi, A., Tosi, G. M., Miracco, F., Martone, G., Cevenini, G., Caporossi, A. (2005). Glare disability and spherical aberration with five foldable intraocular lenses: a prospective randomized study. Acta Ophthalmol Scand. 83(1), 2025 Dick, H. B., Kaiser, S. (2002). Dynamische Aberrometrie während der Akkommodation phaker Augen sowie Augen mit potenziell akkommodativer Intraokularlinse. Ophthalmologe. 99(11), 825-834 Drenckhahn, D., Rager, G. (2004). Visuelles System. In Benninghoff, A., Drenckhahn, D. (Hrsg.) Anatomie Band 2 Urban & Fischer Verlag, München, 680-683 55 Feugère, M., Künzel, E., Weisser, U. (1985). Die Starnadeln von Montbellet (Saône-etLoire). Sonderdruck aus: Jahrbuch des Römisch-Germanischen Zentralmuseums (32. Jahrgang) Gatinel, D., Haouat, M., Hoang-Xuan, T. (2002). Étude des paramètres permettant la description mathématique de l’asphéricite cornéenne. J Fr Ophtalmol. 25(1), 81-90 Gerthsen, C. (2006). Geometrische Optik. In Gerthsen. C., Meschede, D. (Hrsg.) Gerthsen Physik Springer Verlag, Berlin, 483-513 Goyal, R., North, R. V., Morgan, J. E. (2003). Comparison of laser interferometry and ultrasound A-scan in the measurement of axial length. Acta Ophthalmol Scand. 81(4), 331-335 Grehn, F. (2006). Linse In Grehn, F. Augenheilkunde Springer Verlag, Heidelberg, 158-180 Großkopf, U., Wagner, R., Jacobi, F. K., Krzizok, T. (1998). Dämmerungssehvermögen und Blendempfindlichkeit bei monofokaler und multifokaler Pseudophakie. Ophthalmologe. 95(6), 432-437 Guirao, A., Tejedor, J., Artal, P. (2004). Corneal aberrations before and after smallincision cataract surgery. Invest Ophthalmol Vis Sci. 45(12), 4312-4319 Henning, A. (1994). Zum Paradigmenwechsel bei der operativen Starbehandlung um 1750. In Tost, M. (Hrsg.) Vom Augendienst zur modernen Ophthalmologie, Symposium an der Augenklinik der Martin-Luther-Universität Halle-Wittenberg, Julius Hirschberg Gesellschaft 56 Hitzenberger, C. K., Drexler, W., Dolezal, C., Skorpik, F., Juchem, M., Fercher, A. F., Gnad, H. D. (1993). Measurement of the axial length of cataract eyes by laser Doppler interferometry.Invest Ophthalmol Vis Sci. 34(6), 1886-1893 Holladay, J. T., Piers, P. A., Koranyi, G., van der Mooren, M., Norrby, N. E. (2002). A new intraocular lens design to reduce spherical aberration of pseudophakic eyes. J Refract Surg. 18(6), 683-691 Johns, C. H. W. (1904). Code of Hammurabi. (Zugriff vom 11.05.2007) http://www.commonlaw.com/Hammurabi.html Kiely, P. M., Smith, G., Carney, L. G. (1982). The mean shape of the human cornea. Opt Acta. 29(8), 1027-1040 Kohnen, T. (2005). Laserchirurgie zur Refraktionsänderung. In Kampik, A. (Hrsg.) Augenärztliche Rehabilitation Georg Thieme Verlag, Stuttgart, 10-24 Kohnen, T., Klaproth, O. K. (2008). Asphärische Intraokularlinsen. Ophthalmologe 105(3), 234-240 Konstantopoulos, A., Hossain, P., Anderson, D. F. (2007). Recent advances in ophthalmic anterior segment imaging: a new era for ophthalmic diagnosis? Br J Ophthalmol. 91(4), 551-557 Lee, J., Kim, M. J., Tchah, H. (2008). Higher-order aberrations induced by nuclear cataract. J Cataract Refract Surg. 34(12), 2104–2109 Llorente, L., Barbero, S., Cano, D., Dorronsoro, C., Marcos, S. (2004). Myopic versus hyperopic eyes: axial length, corneal shape and optical aberrations. J Vis. 4(4), 288-298 57 Maeda, N. (2009). Clinical applications of wavefront aberrometry – a review. Clin Experiment Ophthalmol. 37(1), 118-129 McLellan, J. S., Marcos, S., Burns, S. A. (2001). Age-related changes in monochromatic wave aberrations of the human eye. Invest Ophthalmol Vis Sci. 42(6), 1390-1395 Merriam, J. C., Zheng, L., Merriam, J. E., Zaider, M., Lindström, B. (2003). The effect of incisions for cataract on corneal curvature. Ophthalmology. 110(9), 1807-1813 Mester U, Dillinger P, Anterist N. (2003). Impact of a modified optic design on visual function: clinical comparative study. J Cataract Refract Surg. 29(4), 652-660 Montés-Micó, R., Ferrer-Blasco, T., Cerviño, A. (2009). Analysis of the possible benefits of aspheric intraocular lenses: Review of the literature. J Cataract Refract Surg. 35(1), 172-181 Mrochen, M., Iseli, H. P., Kaemmerer, M., Mierdel, P., Krinke, H. E., Seiler, T. (2004). Relevance of wavefront aberrations of the human eye in corneal laser surgery. Med Laser Appl. 19(3), 126-135 Nio, Y. K., Jansonius, N. M., Fidler, V., Geraghty, E., Norrby, S., Kooijman, A. C. (2002). Spherical and irregular aberrations are important for the optimal performance of the human eye. Ophthalmic Physiol Opt. 22(2), 103-112 Ober, S., Reuscher, A., Scharrer, A., Wenzel, M. (2005). Zum derzeitigen Stand der Katarakt- und refraktiven Chirurgie. Ophthalmo-Chirurgie 17, 311-316 Ohtani, S., Miyata, K., Samejima, T., Honbou, M., Oshika, T. (2009). Intraindividual comparison of aspherical and spherical intraocular lenses of same material and platform. Ophthalmology. 116(5), 896-901 Padmanabhan, P., Yoon, G., Porter, J., Rao, S. K., Roy, J., Choudhury, M. (2006). Wavefront aberrations in eyes with Acrysof monofocal intraocular lenses. J Refract Surg. 22(3), 237-242 58 Piers, P. A., Norrby, N. E., Mester, U. (2004). Eye models for the prediction of contrast vision in patients with new intraocular lens design. Opt Lett. 29(7), 733-735 Preußner, P. R. (2004). Die Anwendbarkeit der Wellenfrontkorrektur in der Augenheilkunde. Klin Monatsbl Augenheilkd. 221(6), 456-463 Radford, S. W., Carlsson, A. M., Barrett, G. D. (2007). Comparison of pseudophakic dysphotopsia with Akreos Adapt and SN60-AT intraocular lenses. J Cataract Refract Surg. 33(1), 88-93 Resnikoff, S., Pascolini, D., Etya'ale, D., Kocur, I., Pararajasegaram, R., Pokharel, G. P., Mariotti, S. P. (2004). Global data on visual impairment in the year 2002. Bulletin of the WHO 82(11), 844-851 Rocha, K. M., Soriano, E. S., Chalita, M. R., Yamada, A. C., Bottós, K., Bottós, J., Morimoto, L., Nosé, W. (2006). Wavefront analysis and contrast sensitivity of aspheric and spherical intraocular lenses: a randomized prospective study. Am J Ophthalmol. 142(5), 750-756 Seiler, T., Mrochen, M. (2003). Wellenfrontanalyse (Aberrometrie) in der physiologischen Optik. In Kampik, A. (Hrsg.) Augenärztliche Diagnostik Georg Thieme Verlag, Stuttgart, 55-62 Tester, R., Pace, N. L., Samore, M., Olson, R. J.. (2000) Dysphotopsia in phakic and pseudophakic patients: incidence and relation to intraocular lens type. J Cataract Refract Surg. 26(6), 810-816 Verkman, A. S., Ruiz-Ederra, J., Levin, M. H. (2008). Functions of aquaporins in the eye. Prog Retin Eye Res. 27, 420-433 Vogel, A., Dick, H. B., Krummenauer, F. (2001). Reproducibility of optical biometry using partial coherence interferometry. J Cataract Refract Surg. 27(12), 1961-1968 59 Wang, L., Dai, E., Koch, D. D., Nathoo, A. (2003). Optical aberrations of the human anterior cornea. J Cataract Refract Surg. 29(8), 1514-1521 Yang, Y., Wu, F. (2007). Technical note: Comparison of the wavefront aberrations between natural and pharmacological pupil dilations. Ophthalmic Physiol Opt. 27(2), 220-223 60 Danksagung An allererster Stelle gilt mein besonderer Dank Herrn Professor Dr. Burkhard Dick für die Überlassung des Themas, die zahlreichen Ideen, die stets gute und zuverlässige Betreuung und das entgegengebrachte Vertrauen. Ebenso danke ich Frau Sabine Buchner für die besondere Unterstützung bei der Einführung in die apparativen Messverfahren und die zuverlässige Beratung bei fachlichen Fragen aller Art. Vielen Dank auch an alle Mitarbeiter und Ärzte der Universitäts-Augenklinik Mainz, die sich immer Zeit für meine Fragen genommen haben und mich in jeder Hinsicht unterstützten. Desweiteren möchte ich Herrn Professor Dr. Manfred Berres und Frau Dipl.-Stat. Renate Klaaßen-Mielke für die gute Beratung und Hilfe hinsichtlich der statistischen Auswertung danken. Weiterhin gilt mein herzlichster Dank meinen Eltern, die mir dieses Studium ermöglichen und mir stets jede mögliche Unterstützung zukommen lassen, sowie Sarah Dörr für ihre liebevolle fortwährende moralische Unterstützung und Motivation. Ferner möchte ich besonders meinem Kommilitonen Georg Dultz danken für die stets konstruktive Kritik, das Korrekturlesen und kleinen Hilfen aller Art, auf die ich mich stets verlassen konnte. Ebenso möchte ich allen danken, die mich stets auf ihre Art unterstützt und motiviert haben und deren Aufzählung hier den Rahmen sprengen würde. Lebenslauf Persönliche Daten Name Pinto dos Santos Vorname Daniel Geburtsdatum 02.05.1984 Geburtsort Frankfurt a.M. Nationalität portugiesisch Schulbildung 1990 – 1994 Robert-Blum-Schule, Grundschule, Frankfurt a.M. 1994 – 2000 Helene-Lange-Schule, Gymnasium, Frankfurt a.M. 2000 – 2003 Friedrich-Dessauer-Gymnasium, Frankfurt a.M. Abitur: Gesamtnote 1,2 Studium seit 10/2003 Studium der Medizin Johannes-Gutenberg-Universität, Mainz 09/2005 Physikum: Gesamtnote 2,5 08/2008 – 12/2008 Praktisches Jahr Wellington School of Medicine, Neuseeland Chirurgie-Tertial 12/2008 – 07/2009 Praktisches Jahr Krankenhaus der Barmherzigen Brüder, Trier Wahlfach: Radiologie